慢性骨髓炎是一种慢性炎症性骨病,常由开放性骨折或术后植入物感染引起,目前临床上多采用手术清创联合抗感染治疗[1]。金黄色葡萄球菌是慢性骨髓炎最常见的病原体之一,通过生物膜形成、毒力因子分泌、代谢模式改变等多种机制干扰免疫应答,降低抗生素和手术清创治疗骨髓炎的有效性[2-3]。慢性骨髓炎的特点是低度感染、致病菌长期存在、迁延不愈、形成死骨和窦道,病程时间可以持续数个月甚至数年,且反复发作[4]。彻底清创是控制感染的关键,清创范围应包括炎性肉芽组织、窦道和内固定钉道、死骨及血供无法重建的缺血硬化骨。因治疗效果不理想,患者常常需要进行多次手术和长期使用抗生素,部分患者因治疗失败需行截肢手术,这给患者身心带来很大的创伤,也给个人和家庭带来很大的经济负担[5]。因此,寻找减少慢性骨髓炎复发、缩短治疗疗程的有效方法至关重要。
慢性骨髓炎动物模型是进行慢性骨髓炎实验研究的重要基础,建立稳定、有效、成功率高的慢性骨髓炎标准化动物模型是慢性骨髓炎实验研究的有力保证。然而,如何选择一个既能控制影响不同临床表现的多个变量、又能准确概括人类慢性骨髓炎病理学特征的慢性骨髓炎动物模型目前仍是一个重大挑战[6]。SD大鼠具有饲养周期短、成本低、繁殖量大、可控性好等优势,以其作为实验对象的股骨骨髓炎模型应用较为广泛[6]。基于以上考虑,本研究采用在SD大鼠股骨髁间沟钻孔开窗、向股骨髓腔注入金黄色葡萄球菌、再用无菌骨蜡填塞骨窗的方法,制备了SD大鼠股骨慢性骨髓炎模型,现报告如下。
1 材料和方法 1.1 实验动物48只SPF级6~8周龄、体重286~324 g的雄性SD大鼠购自上海吉辉实验动物饲养有限公司[实验动物生产许可证号:SCXK(沪)2017-0012]。在实验前1周于海军军医大学(第二军医大学)SPF级动物房[实验动物使用许可证号:SYXK(沪)2020-0033]进行适应性饲养,6只/笼,12 h光照、12 h黑暗交替,自由进食饮水,室温为(22±2)℃,相对湿度为(45±5)%,每周更换2次垫料及笼盒。实验操作严格按照实验动物管理条例及伦理委员会相关规定执行。
1.2 实验仪器、菌株与试剂显微手术器械购自上海医疗器械有限公司,小动物CT机为比利时Brucker公司产品,正置光学显微镜为日本Nikon公司产品。金黄色葡萄球菌(ATCC25923)由美国模式菌种收集中心提供。3%戊巴比妥钠购自上海新亚药业有限公司,H-E染液(货号G1003)、中性PBS(货号C0221A)、4%多聚甲醛溶液(货号P0099)购自上海碧云天生物技术有限公司。
1.3 动物模型制备SD大鼠称重后,随机分为模型组(24只)和对照组(24只)。用3%戊巴比妥钠溶液按0.1 mL/100 g剂量腹腔注射麻醉大鼠,麻醉显效后右后肢备皮,用碘伏消毒术区,铺无菌一次性治疗巾。取膝关节内侧1 cm纵行切口,切开皮肤、显露股骨髁间沟,用电钻于股骨髁间沟处钻1个直径0.5 mm小孔直通股骨髓腔。之后向模型组大鼠髓腔内注射50 μL细菌密度为1×106/mL的金黄色葡萄球菌悬液,对照组大鼠髓腔内注射50 μL生理盐水,孔洞用无菌骨蜡密封。逐层缝合皮肤软组织,用无菌敷料覆盖包扎,按统一标准饲养。
1.4 行为学观察与评估术后每天观察大鼠的活动能力,通过敲击震动鼠笼对大鼠的反应能力及活动范围进行综合评估。将大鼠依次置于安静房间的鼠笼中,待其适应环境1 h后以木棒轻敲鼠笼体一侧产生震动与声响,同时运行Sound Meter噪声测试软件进行声响的简易标准化限定,控制声音响度在55~70 dB。活动能力评分标准如下:大鼠可快速完成从鼠笼一侧活动至另一侧或活动同等距离,且活动期间无跛行,右后肢无勾悬,计5分;可在较短时间内从鼠笼一侧活动至另一侧或活动同等距离,但活动期间出现跛行,右后肢无勾悬,计4分;可从鼠笼一侧活动至另一侧或活动,同等距离,但所需时间较长且活动期间有右后肢勾悬,计3分;无法从鼠笼一侧活动至另一侧或活动同等距离,但可完成同等距离一半以上的活动,且活动期间有右后肢勾悬,计2分;有部分位移活动,但无法完成从鼠笼一侧至另一侧一半的活动或不足同等距离的一半,计1分;无明显位移活动,计0分。以上计分由3名研究者在同一时间点独立完成,以平均值作为分析数据。
1.5 体温和体重测量术后每天用电子体温计测量大鼠肛门温度,将电子体温计插入肛门,深度为2.0 cm,待体温计发出“嘀嘀嘀”声之后再测30 s,记录读数。术前及术后第1、2、4周,分别测量大鼠体重。
1.6 感染部位局部症状观察和细菌培养术后每天观察感染部位局部红肿、包块等症状。术后2、4、8周,从模型组和对照组分别随机抽取8只大鼠,过量麻醉处死后,取造模周围软组织做细菌培养,取模型组大鼠右股骨标本放入液氮中保存待测。将造模周围软组织放入无菌研磨器中研磨后,置入15 mL离心管中,加入10 mL无菌PBS混匀,以800×g的离心加速度离心3 min;取上清液10 μL用无菌PBS稀释100倍后在胰蛋白胨大豆琼脂平板上涂板,然后放入恒温孵育箱,37 ℃培养24 h,拍照并进行细菌菌落计数。
1.7 影像学观察及组织病理学检测术后2、4、8周,取模型组大鼠右股骨标本进行小动物CT观察。术后2、8周,取模型组大鼠右股骨标本制成组织病理学切片,进行H-E染色、Masson染色及吉姆萨染色分析。
1.8 统计学处理应用Excel 2016软件进行统计学分析,应用ImageJ 5.0软件进行图像分析。服从正态分布且方差齐的计量资料以x±s或x表示,两组间比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 两组大鼠行为学变化两组大鼠术后行为学改变包括舔舐右后肢及手术切口、右后肢勾悬、跛行、活动减少等。随着时间推移,对照组大鼠逐渐恢复如常,手术切口逐渐愈合,在第7天时所有大鼠伤口均愈合,右后肢行走状态逐步恢复,第8天恢复正常活动水平;模型组大鼠右后肢勾悬,不能负重,手术切口逐渐愈合,术后第10天左右手术切口完全愈合;术后第12天恢复正常活动水平,第15天以后活动水平稍有下降。两组大鼠术后的活动能力评分见图 1。
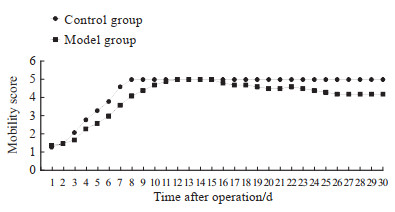
|
图 1 对照组和股骨慢性骨髓炎模型组大鼠活动能力评分 Fig 1 Mobility scores of rats in control and chronic femur osteomyelitis model groups n=24 in control group; n=24, 16, and 8 in model group 1-14 d, 15-28 d, and 29-30 d after operation, respectively. x. |
2.2 两组大鼠体温和体重变化
如图 2所示,模型组大鼠接种细菌后体温逐渐升高,10 d时达高峰;随后体温逐渐下降,至2周后体温基本平稳,但仍高于正常体温。造模前,模型组和对照组大鼠体重分别为(353.95±6.97)、(355.49±5.88)g,差异无统计学意义(P=0.420);术后1周,模型组和对照组大鼠体重分别为(361.58±7.71)、(365.91±7.75)g,差异无统计学意义(P=0.981);术后2周,模型组和对照组大鼠体重分别为(341.00±5.50)、(370.95±6.87)g,模型组低于对照组(P<0.001);术后4周,模型组和对照组大鼠体重分别为(341.33±7.94)、(371.04±8.52)g,模型组低于对照组(P<0.001)。
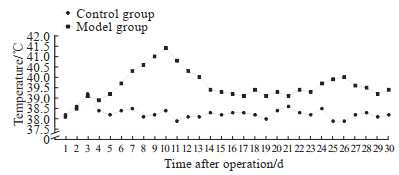
|
图 2 对照组和股骨慢性骨髓炎模型组大鼠体温变化 Fig 2 Changes of body temperature in rats of control and chronic femur osteomyelitis model groups n=24 in control group; n=24, 16, and 8 in model group 1-14 d, 15-28 d, and 29-30 d after operation, respectively. x. |
2.3 模型组大鼠感染症状及细菌培养结果
模型组大鼠接种细菌1周后可见感染局部红肿,2周后部分大鼠右膝关节处可触及一包块、包块内有波动感,4周后所有大鼠均有局部红肿和包块。切开大鼠右后肢皮肤后,右膝内侧可见一脓肿,脓肿与周围组织边界较为清晰,局限于造模钻孔处。剥离股骨周围软组织可见股骨外形基本完整,髓腔内可见大量脓性分泌物,在股骨髁间沟处与外界软组织相通。见图 3。取造模周围软组织做细菌培养,结果如图 4所示,细菌培养皿上可见均匀分布的金黄色葡萄球菌菌落,且随时间延长而增多。
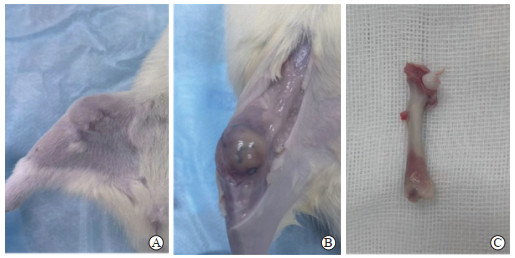
|
图 3 股骨慢性骨髓炎模型大鼠股骨及周围组织大体观察 Fig 3 Gross findings of femur and perifemur tissue in chronic femur osteomyelitis model rats A: An obvious mass was observed in the knee joint of rats; B: Abscess and surrounding tissue boundaries were clear; C: The soft tissue around the femur was stripped and the femur was basically intact. |
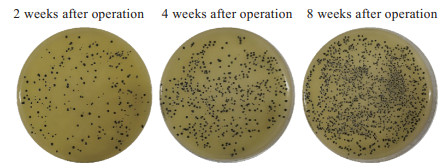
|
图 4 股骨慢性骨髓炎模型大鼠股骨周围软组织细菌培养结果 Fig 4 Results of bacterial culture of soft tissue around femur of chronic femur osteomyelitis model rats |
2.4 模型组大鼠股骨影像学检查结果
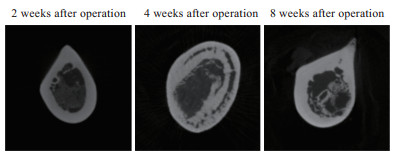
小动物CT机检查结果(图 5)显示,术后2周,模型组大鼠骨髓腔内可见炎症改变,局部皮质破环,未累及皮质全层,仅局限于骨髓腔表面骨质;术后4周,大鼠股骨髓腔内炎症反应加重,骨皮质破环累及全层,皮质骨中散发脓肿形成;术后8周,大鼠股骨髓腔内炎症反应进一步加重,骨质破环累及骨皮质全层,死骨形成并伴有新骨生成。
|
图 5 股骨慢性骨髓炎模型大鼠小动物CT机检查结果 Fig 5 Micro-CT results of chronic femur osteomyelitis model rats CT: Computed tomography. |
2.5 模型组大鼠股骨组织病理学变化
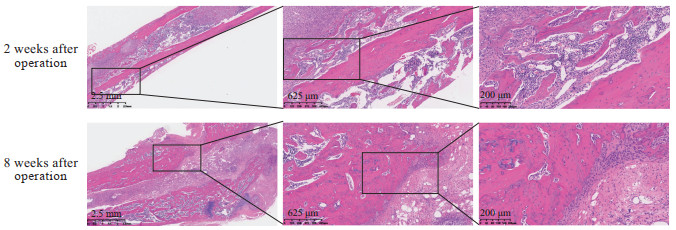
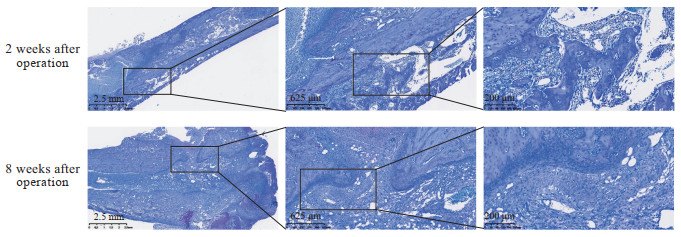
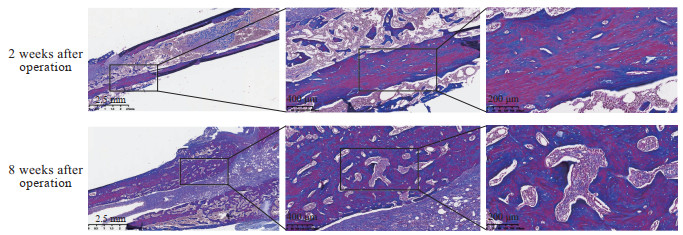
H-E染色结果(图 6)显示,术后2周,模型组大鼠股骨髓腔内有大量炎症细胞浸润,炎症局限于骨髓腔内,炎症细胞以淋巴细胞、中性粒细胞为主,成纤维细胞数量少,几乎没有肉芽组织,有少量骨质破坏;术后8周,股骨组织可见大量炎症细胞浸润,炎症细胞以中性粒细胞为主,骨髓腔内充满淋巴细胞,伴有肉芽组织形成,有新生的小血管、新生的成纤维细胞,局部有含铁血黄素的沉积。吉姆萨染色结果(图 7)显示,术后2周,模型组大鼠股骨髓腔内有大量炎症细胞浸润,炎症局限于骨髓腔内,组织内含有大量的金黄色葡萄球菌;术后8周,炎症迁延,皮质骨中有窦道与外界相连,组织内含有大量金黄色葡萄球菌。Masson染色结果(图 8)显示,术后2周,模型组大鼠股骨皮质骨中胶原纤维连续排列,皮质骨破坏尚不明显;术后8周,皮质骨中胶原纤维大量断裂,皮质骨被大量破坏,胶原纤维间隙有感染灶。
|
图 6 股骨慢性骨髓炎模型大鼠股骨组织切片H-E染色结果 Fig 6 H-E staining results of femur tissue sections of chronic femur osteomyelitis model rats |
|
图 7 股骨慢性骨髓炎模型大鼠股骨组织切片吉姆萨染色结果 Fig 7 Giemsa staining results of femur tissue sections of chronic femur osteomyelitis model rats |
|
图 8 股骨慢性骨髓炎模型大鼠股骨组织切片Masson染色结果 Fig 8 Masson staining results of femur tissue sections of chronic femur osteomyelitis model rats |
3 讨论
慢性骨髓炎是骨科常见的难治性疾病之一,其发病机制复杂,具有不同的病理生理学表现。各种炎症因子和白细胞会导致组织坏死及骨小梁和骨基质的破坏,临床上可见窦道形成、局部的持续溃烂和流脓等特征性表现,实验室检查一般表现为白细胞计数、中性粒细胞计数、红细胞沉降率、CRP、降钙素原、IL-6、TNF-α等感染指标不同程度的增高[7-8]。一些影像学检查有助于慢性骨髓炎的定性及诊断,包括X线、CT、PET-CT、MRI、放射性核素扫描等[9]。慢性骨髓炎重在预防,创伤后的彻底清创至关重要,一定要遵循彻底清创、有效抗感染、消灭死腔的治疗原则[10]。
慢性骨髓炎动物模型研究经历了长期的发展。1941年,Scheman等[11]通过将金黄色葡萄球菌和5%鱼肝油酸钠注射进兔胫骨近干骺端,成功建立了可复制的慢性骨髓炎动物模型。在此基础上,后来的研究者创建了多种慢性骨髓炎动物模型。慢性骨髓炎动物模型常使用的动物有大鼠、小鼠、兔、犬、羊及禽类,模型的构建与菌株接种方式、菌液中菌株的密度、植入部位、骨缺损等因素密切相关,即使消除了大多数混杂因素也难以统一量化,近年来研究者们不断进行改进并逐渐量化感染过程[6, 12]。
本实验用电钻于SD大鼠股骨髁间沟处钻1个直径0.5 mm小孔直通股骨髓腔,向髓腔内注入50 μL细菌密度为1×106/mL的金黄色葡萄球菌(ATCC25923)悬液,孔洞用无菌骨蜡密封,制作了SD大鼠股骨慢性骨髓炎模型。通过行为学观察、体重及体温测量、影像学检查与组织病理学分析评估造模效果,结果表明,此种造模方式所造成的股骨慢性骨髓炎模型具有高度可复制性,病理生理学表现与人体病理生理学改变相似。
| [1] |
CHEN Y, LIU Z, LIN Z, et al. The effect of Staphylococcus aureus on innate and adaptive immunity and potential immunotherapy for S. aureus-induced osteomyelitis[J]. Front Immunol, 2023, 14: 1219895. DOI:10.3389/fimmu.2023.1219895 |
| [2] |
GUERRA F E, BORGOGNA T R, PATEL D M, et al. Epic immune battles of history: neutrophils vs. Staphylococcus aureus[J]. Front Cell Infect Microbiol, 2017, 7: 286. DOI:10.3389/fcimb.2017.00286 |
| [3] |
GIMZA B D, CASSAT J E. Mechanisms of antibiotic failure during Staphylococcus aureus osteomyelitis[J]. Front Immunol, 2021, 12: 638085. DOI:10.3389/fimmu.2021.638085 |
| [4] |
WU H, JIA C, WANG X, et al. The impact of methicillin resistance on clinical outcome among patients with Staphylococcus aureus osteomyelitis: a retrospective cohort study of 482 cases[J]. Sci Rep, 2023, 13(1): 7990. DOI:10.1038/s41598-023-35111-w |
| [5] |
PANTELI M, GIANNOUDIS P V. Chronic osteomyelitis: what the surgeon needs to know[J]. EFORT Open Rev, 2016, 1(5): 128-135. DOI:10.1302/2058-5241.1.000017 |
| [6] |
HUANG S, WEN J, ZHANG Y, et al. Choosing the right animal model for osteomyelitis research: considerations and challenges[J]. J Orthop Transl, 2023, 43: 47-65. DOI:10.1016/j.jot.2023.10.001 |
| [7] |
BERNARD L, DINH A, GHOUT I, et al. Antibiotic treatment for 6 weeks versus 12 weeks in patients with pyogenic vertebral osteomyelitis: an open-label, non-inferiority, randomised, controlled trial[J]. Lancet, 2015, 385(9971): 875-882. DOI:10.1016/s0140-6736(14)61233-2 |
| [8] |
HWANG J, KELHAM S A. Osteomyelitis[J]. JAAPA, 2022, 35(9): 57-58. DOI:10.1097/01.jaa.0000854520.27186.dd |
| [9] |
LEE Y J, SADIGH S, MANKAD K, et al. The imaging of osteomyelitis[J]. Quant Imaging Med Surg, 2016, 6(2): 184-198. DOI:10.21037/qims.2016.04.01 |
| [10] |
JERZY K, FRANCIS H. Chronic osteomyelitis— bacterial flora, antibiotic sensitivity and treatment challenges[J]. Open Orthop J, 2018, 12(1): 153-163. DOI:10.2174/1874325001812010153 |
| [11] |
SCHEMAN L, JANOTA M, LEWIN P. The production of experimental osteomyllitis: preliminary report[J]. J Am Med Assoc, 1941, 117(18): 1525-1529. DOI:10.1001/jama.1941.02820440033008 |
| [12] |
刘金月, 章猛奇, 卿明松, 等. 金黄色葡萄球菌性骨髓炎动物模型构建的研究与进展[J]. 中国组织工程研究, 2020, 24(14): 2256-2262. DOI:10.3969/j.issn.2095-4344.2600 |
 2024, Vol. 45
2024, Vol. 45


