急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是临床常见的危重症,病死率高达46%[1]。ARDS临床表现为进行性呼吸窘迫和顽固性低氧血症,其本质是各种病因诱导机体产生免疫应答及炎症反应,进而损伤肺实质细胞。ARDS发病机制以复杂和失调的炎症为特征,涉及一系列免疫细胞(包括巨噬细胞、淋巴细胞亚群、树突状细胞)及细胞因子网络[2]。尽管炎症是一种重要的防御反应,可以消除有害物质,但过度炎症反应可能导致细胞、组织和器官损伤。因此,调控原发病导致的机体免疫应答和炎症反应是ARDS治疗中渴望突破的重点。辅助性T细胞17(T helper cell 17,Th17)和调节性T细胞(regulatory T cell,Treg)是一对重要的免疫调节细胞,是初始CD4+ T细胞在相应转录因子和不同细胞因子作用下分化成的不同亚群,在炎症反应发展过程中,Th17的过度生成和激活可归因于高炎症损伤,而Treg是具有抗炎功能的炎症抑制细胞,两者不仅参与ARDS的炎症病理过程,其介导的免疫应答还影响ARDS的炎症反应程度[3-4]。Th17/Treg平衡的走向预示了疾病发展的程度,在ARDS中Th17/Treg比值升高代表更高的死亡率和更差的预后[5-6]。
近年来,迷走神经介导的抗炎机制受到关注。迷走神经是最长的脑神经,支配包括肺、脾在内的大部分外周器官。迷走神经刺激(vagus nerve stimulation,VNS)是一种新型的物理治疗方法,通过在颈迷走神经周围放置电极或经皮刺激颈迷走神经分支发挥抗炎和镇痛等治疗作用[7]。研究发现,VNS可通过激活胆碱能抗炎通路(cholinergic anti-inflammatory pathway,CAIP)来调控促炎细胞因子释放,促进巨噬细胞向抗炎表型M2型转化,从而减轻ARDS的肺损伤[8]。Th17可以通过正反馈调控细胞因子释放[9-10],有趣的是,这些细胞因子与CAIP调控的细胞因子有很大部分重叠。因此,我们猜测VNS可以调控ARDS中Th17及Treg相关蛋白和炎症因子的表达。本研究通过脂多糖(lipopolysaccharide,LPS)诱导ARDS大鼠模型,选取肺和脾两个靶器官,探究VNS对Th17及Treg相关蛋白表达及炎症因子水平的影响,揭示VNS减轻肺损伤的作用机制,为临床防治ARDS提供参考。
1 材料和方法 1.1 实验动物和主要试剂30只SPF级雄性SD大鼠(6~8周龄)购于重庆医科大学实验动物中心[动物生产许可证号:SCXK(渝)2022-0016]。大鼠自由进水、摄食,饲养环境温度为22~24 ℃、相对湿度为40%~60%、明暗周期12 h/12 h。本研究通过重庆医科大学实验动物伦理委员会批准。
LPS购于美国MCE公司,叉头框蛋白P3(forkhead box protein P3,Foxp3)抗体、GAPDH抗体购于武汉三鹰生物技术有限公司,维甲酸受体相关孤儿受体γt(retinoic acid-related orphan receptor γt,Rorγt)抗体购于沈阳万类生物科技有限公司,HRP标记的羊抗兔二抗购于北京中杉金桥生物技术有限公司,所有ELISA检测试剂盒均购于武汉博士德生物工程有限公司,BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶制备试剂盒、RIPA强效细胞裂解液、SDS-PAGE上样缓冲液、无蛋白快速封闭液购于上海雅酶生物医药科技有限公司,ECL发光液购于上海碧云天生物技术有限公司,PVDF膜购于美国Millipore公司。
1.2 ARDS模型构建与VNS干预将30只大鼠随机分对照组、LPS组和LPS+VNS组,每组10只。按Li等[8]所述方法构建ARDS模型和进行VNS干预。LPS组和LPS+VNS组大鼠经腹腔注射1%戊巴比妥钠麻醉后,经鼻腔滴注2 mg/kg LPS,同时将左侧颈部迷走神经暴露出来,以纱布覆盖创面。LPS+VNS组大鼠在鼻腔滴注LPS 6 h后给予VNS干预,所采用的VNS治疗仪为华佗牌电子针疗仪SDZ-V,刺激参数为电压5 V、频率5 Hz、脉冲宽度2 ms,持续10 min。LPS组不进行VNS。干预2 h后取样检测。
1.3 肺组织病理变化检测取大鼠肺叶用3.7%多聚甲醛溶液固定,石蜡包埋,切成厚度为5 μm的切片,常规H-E染色,在光学显微镜下观察。在每个切片中随机选择10个高倍镜视野(200×)进行组织学评价。
1.4 肺湿干比(wet to dry ratio,W/D)检测取大鼠左肺测量湿重,然后在60 ℃烘箱干燥72 h后测量得到干重。计算W/D,评价肺水肿程度。
1.5 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)总蛋白含量检测取无菌生理盐水2 mL灌洗大鼠肺3次,收集BALF。在4 ℃下,将BALF以800×g离心10 min后留上清液,用BCA试剂盒测定BALF上清液中的总蛋白浓度。
1.6 BALF中炎症因子水平检测取BALF在4 ℃下以800×g离心10 min,保存上清液。根据ELISA试剂盒说明书检测TNF-α、IL-1β、IL-6、IL-17和IL-10的水平。
1.7 肺和脾组织Foxp3、Rorγt蛋白表达检测 1.7.1 蛋白质印迹法取20 mg大鼠肺组织或脾组织,加入适当体积的裂解液(含1%蛋白酶及磷酸酶抑制剂)于冰上提取总蛋白,BCA法测定蛋白质浓度,按比例加入上样缓冲液,煮沸变性。取30 μg蛋白质样品,经SDS-PAGE分离后转移到PVDF膜上,经无蛋白快速封闭液室温封闭30 min后,将膜放置于相应的一抗中,于4 ℃摇床孵育过夜。第2天,将膜用TBST漂洗3次、每次8 min,加入相应的二抗室温孵育1 h,再用TBST漂洗3次、每次8 min,滴加ECL发光液进行曝光显影。用ImageJ软件分析蛋白条带的灰度值并计算相对表达量(目的蛋白与内参蛋白灰度值的比值)。
1.7.2 免疫组织化学染色将肺组织及脾组织石蜡包埋、切片(厚度为5 µm)、脱蜡、水化,用柠檬酸钠缓冲液处理,然后在室温下用3% H2O2处理15 min以阻断内源性过氧化物,用3%牛血清白蛋白溶液处理30 min以减少非特异性结合。然后滴加一抗在4 ℃下孵育16 h,滴加二抗在37 ℃下洗涤和孵育1 h,用DAB染色,苏木精复染。切片经脱水、清除、密封后,在显微镜下观察,分析相对染色强度。
1.8 统计学处理采用GraphPad Prism 9.0软件进行统计学分析。呈正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析,并运用Tukey法进行两两比较。检验水准(α)为0.05。
2 结果 2.1 各组大鼠肺部病理改变情况肺组织H-E染色结果(图 1A)显示,LPS组大鼠肺泡壁明显变厚,炎症细胞浸润到肺泡腔;LPS+VNS组大鼠上述病理表现较LPS组减轻。肺W/D及BALF总蛋白含量检测结果(图 1B、1C)显示,与对照组相比,LPS组大鼠出现了明显的肺水肿,BALF中总蛋白增多(均P<0.01);与LPS组相比,LPS+VNS组大鼠肺水肿减轻,BALF中总蛋白减少(均P<0.05)。上述结果表明LPS诱导的大鼠ARDS模型构建成功,而VNS能缓解LPS诱导的大鼠肺部病理改变。
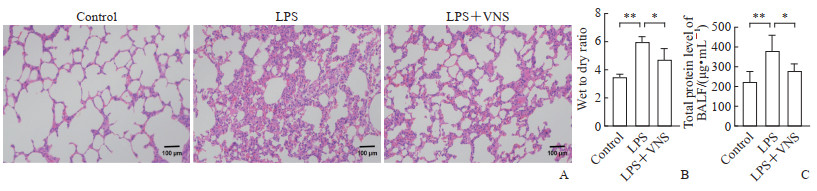
|
图 1 各组大鼠肺部病理改变 Fig 1 Pathological changes of rat lungs in each group A: Hematoxylin-eosin staining; B: Wet to dry ratio; C: Total protein level of BALF. *P<0.05, **P<0.01. n=10, x±s. LPS: Lipopolysaccharide; VNS: Vagus nerve stimulation; BALF: Bronchoalveolar lavage fluid. |
2.2 各组大鼠BALF中炎症因子水平
与对照组相比,LPS组大鼠BALF中促炎因子IL-1β、IL-6、IL-17水平增高(均P<0.01),TNF-α水平增高但差异无统计学意义(P>0.05);抗炎因子IL-10水平也高于对照组(P<0.01)。与LPS组相比,LPS+VNS组大鼠BALF中IL-6、IL-17水平降低(均P<0.05),IL-1β、TNF-α水平降低但差异无统计学意义(均P>0.05),IL-10水平进一步增高(P<0.01)。以上结果表明VNS能抑制LPS诱导的大鼠BALF中促炎因子的升高,促进抗炎因子的表达。见表 1。
|
|
表 1 各组大鼠BALF中炎症因子TNF-α、IL-1β、IL-6、IL-17、IL-10水平比较 Tab 1 Comparison of levels of inflammatory factors TNF-α, IL-1β, IL-6, IL-17, and IL-10 in BALF of rats in each group |
2.3 各组大鼠肺组织中Foxp3及Rorγt蛋白的表达
蛋白质印迹法检测结果显示,与对照组相比,LPS组大鼠肺组织中Treg转录蛋白Foxp3表达增加(P<0.01),Th17转录蛋白Rorγt表达也增加但差异无统计学意义(P>0.05);与LPS组相比,LPS+VNS组大鼠肺组织中Foxp3蛋白表达进一步增加,Rorγt蛋白表达则降低(均P<0.05)。免疫组织化学染色检测结果显示,与对照组相比,LPS组大鼠肺组织中Foxp3蛋白表达增加但差异无统计学意义(P>0.05),Rorγt蛋白表达增加(P<0.05);与LPS组相比,LPS+VNS组大鼠肺组织中Foxp3蛋白表达进一步增加(P<0.01),Rorγt蛋白表达降低但差异无统计学意义(P>0.05)。上述结果提示,VNS能进一步促进LPS诱导的大鼠肺组织中Foxp3蛋白的表达,但会下调LPS诱导的Rorγt表达增加。见图 2。
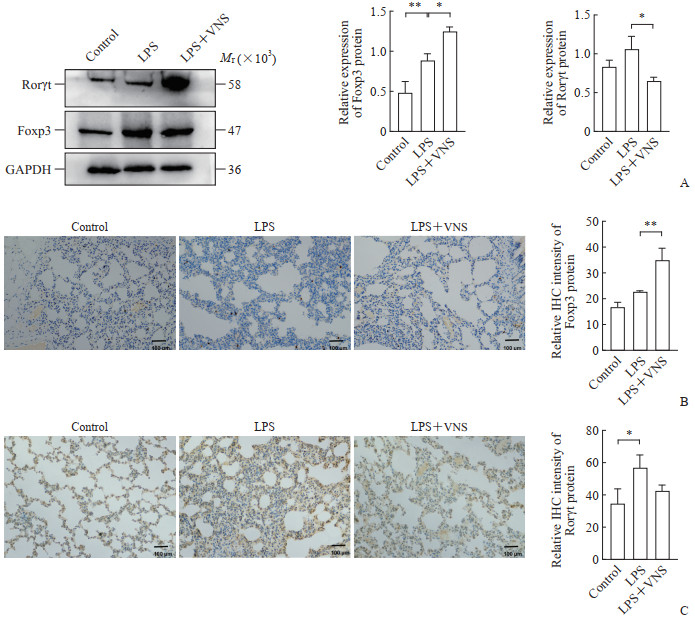
|
图 2 各组大鼠肺组织中Foxp3和Rorγt蛋白的表达情况 Fig 2 Expression of Foxp3 and Rorγt proteins in lung tissues of rats in each group A: The Foxp3 and Rorγt proteins were detected by Western blotting; B: The Foxp3 protein was detected by IHC staining; C: The Rorγt protein was detected by IHC staining. *P<0.05, **P<0.01. n=10, x±s. Foxp3: Forkhead box protein P3; Rorγt: Retinoic acid-related orphan receptor γt; LPS: Lipopolysaccharide; VNS: Vagus nerve stimulation; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; IHC: Immunohistochemistry. |
2.4 各组大鼠脾组织中Foxp3及Rorγt蛋白的表达
蛋白质印迹法检测结果显示,与对照组相比,LPS组大鼠脾组织中Foxp3和Rorγt蛋白表达增加(均P<0.05);与LPS组相比,LPS+VNS组大鼠脾组织中Foxp3蛋白表达进一步增加(P<0.05),Rorγt蛋白表达降低(P<0.01)。免疫组织化学染色检测结果与蛋白质印迹法检测结果一致,与对照组相比,LPS组大鼠脾组织中Foxp3蛋白和Rorγt蛋白表达增加(均P<0.01);与LPS组相比,LPS+VNS组大鼠脾组织中Foxp3蛋白表达进一步增加(P<0.05),Rorγt蛋白表达降低(P<0.05)。上述结果提示,VNS在大鼠脾组织和肺组织中的作用相同,能促进LPS诱导的大鼠脾组织中Foxp3蛋白表达、抑制Rorγt蛋白表达,调控Th17及Treg相关蛋白变化。见图 3。
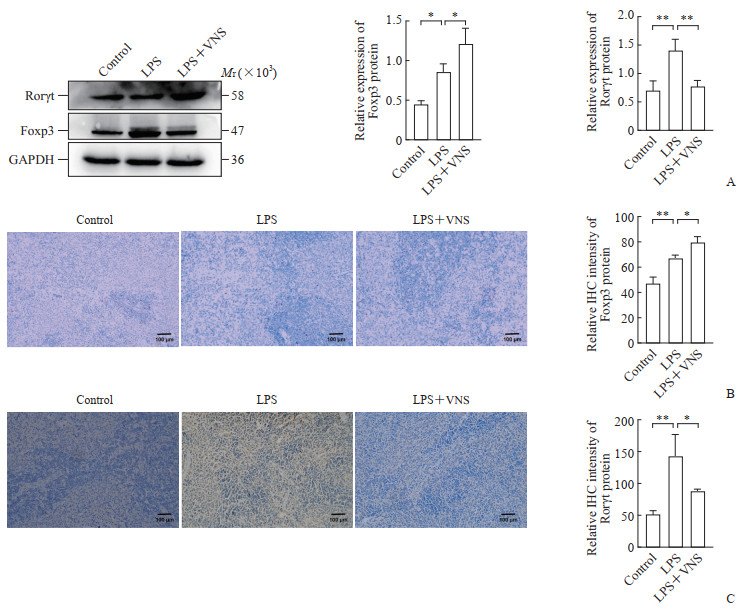
|
图 3 各组大鼠脾组织中Foxp3和Rorγt蛋白的表达情况 Fig 3 Expression of Foxp3 and Rorγt proteins in spleen tissues of rats in each group A: The Foxp3 and Rorγt proteins were detected by Western blotting; B: The Foxp3 protein was detected by IHC staining; C: The Rorγt protein was detected by IHC staining. *P<0.05, **P<0.01. n=10, x±s. Foxp3: Forkhead box protein P3; Rorγt: Retinoic acid-related orphan receptor γt; LPS: Lipopolysaccharide; VNS: Vagus nerve stimulation; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; IHC: Immunohistochemistry. |
3 讨论
ARDS是一种肺部急性、弥漫性、炎症性损伤,其发病机制涉及一系列炎症免疫细胞,包括巨噬细胞、淋巴细胞亚群、树突状细胞等[11-12]。过度炎症反应会导致细胞、组织和器官损害,一般认为炎症过程失控的触发是ARDS发展的关键,因此,免疫系统调节炎症反应的机制是目前ARDS研究的重点。近年研究发现,连接神经系统和免疫系统的CAIP在各种疾病中显示出抗炎作用[8]。烟碱样乙酰胆碱受体α7(α7 nicotinic acetylcholine receptor,α7nAchR)是CAIP的靶点,广泛表达于免疫细胞(包括CD4+ T细胞)表面[11],其在ARDS初始炎症反应阶段的重要作用已经得到证实[13-14]。
Th17和Treg参与了ARDS发展过程中失控的炎症反应,其中Th17是导致肺部炎症级联反应的炎症细胞。有证据表明,Th17的过度生成和激活可归因于高炎症损伤,它是促炎因子IL-17的主要分泌来源,也可激活IL-1、IL-6、TNF-α、IL-8等促炎因子[15]。IL-17过表达或聚集在肺内可导致一系列炎症因子的级联反应,募集各类炎症因子如TNF-α、TNF-β等进入气管,阻断IL-17可有效减缓LPS诱导的肺损伤[16]。与Th17不同的是,Treg具有抗炎功能,在缓解或治疗急性肺损伤和ARDS中发挥核心作用[17]。研究表明Treg可以限制效应T细胞的功能,而效应T细胞可以控制感染或介导炎症损伤[18]。Treg释放的IL-10是抗炎因子。IL-10可以抑制巨噬细胞产生的促炎因子,具有强大的免疫调节和抗炎作用[19]。因此,对Th17/Treg的调控可能成为治疗ARDS的靶点[20]。本研究结果显示,采用LPS诱导ARDS模型后,大鼠肺组织发生病理性改变,出现了明显肺水肿,大量炎症细胞和炎症因子渗透进肺泡腔,Th17转录蛋白Rorγt和Treg转录蛋白Foxp3上调,表明LPS诱导大鼠ARDS模型后Th17/Treg失调,导致炎症因子级联式增加,加重了肺损伤。
迷走神经是自主神经的组成部分之一,它作为输入和输出的载体,整合了内感受器信息及一系列自适应和调节反馈信息。VNS是一种物理治疗,具有作用迅速、安全、不良反应少等特点[21],目前在临床上已被应用于偏头痛、部分发作癫痫、难治性抑郁症等的治疗[22]。新兴的研究正在将VNS的潜在用途拓展到其他神经系统疾病。在ARDS领域,前期研究已证明VNS可以通过作用于CAIP和信号转导及转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)抑制促炎细胞因子的产生,从而减弱炎症反应[8]。乙酰胆碱作为神经节前和神经节后迷走传出神经的神经递质,可刺激烟碱受体抑制促炎细胞因子的释放,其中α7nAchR对于迷走神经抑制炎症反应至关重要[8]。这种由迷走神经、迷走神经末梢分泌的乙酰胆碱和受体α7nAChR组成的迷走神经抗炎反射被称为CAIP[23]。VNS可以激活和增强CAIP的活性,减轻炎症反应[24]。本研究发现VNS可减少LPS诱导的大鼠ARDS模型BALF中IL-1β、IL-6等促炎细胞因子的产生,减轻肺组织病理学改变,这些都是VNS降低ARDS炎症反应的重要机制。VNS调控信号通路的具体机制还需要进一步研究。
LPS可引起大鼠一系列炎症反应,脾脏是最大的外周免疫器官,含有的大量免疫细胞如巨噬细胞、T细胞、树突状细胞等可分泌一系列炎症因子,这些炎症因子可快速引起全身性炎症反应,在ARDS中起着重要作用[25]。同时脾也是CAIP的重要中间环节,Dhawan等[26]利用胆碱乙酰转移酶转基因小鼠开展研究,在小鼠脾脏中鉴定出胆碱能免疫细胞。本研究结果显示,VNS可下调ARDS大鼠脾中Th17转录因子Rorγt的表达,上调Treg转录因子Foxp3的表达,与肺组织中情况相同。考虑到脾脏是一个含有淋巴细胞的主要次级淋巴组织,我们猜测CAIP可以改变大鼠脾脏中CD4+ T细胞亚群的比例,进而可能改变肺中T细胞亚群的百分比。这种变化最终降低了全身炎症反应,减轻了ARDS大鼠的肺损伤。这一过程还需要进一步证实,其具体机制也需要进一步研究。
本研究存在以下不足之处:(1)ARDS发病机制复杂,涉及的信号通路众多,本研究仅从VNS对Th17及Treg相关蛋白的作用入手探讨,具有局限性。(2)由于VNS干预方式的局限性,本研究仅进行了体内实验,仅采用了VNS的1个治疗参数,治疗时间也仅有10 min,缺乏更长时间的刺激及不同设置参数之间效果的比较,也未设置切除迷走神经的组别进行对照。(3)本研究仅观察了VNS对大鼠肺和脾组织Th17、Treg相关蛋白及炎症因子的影响,没有对特异性通路如CAIP通路进行阻断或激活,无法验证其分子机制。在后续的研究中,我们将对CAIP通路进行特异性激活或抑制,同时增加不同VNS参数组别和切除迷走神经组别,进一步深入探讨VNS作用于Th17及Treg缓解ARDS炎症及病理表现的机制。
| [1] |
GORMAN E A, O'KANE C M, MCAULEY D F. Acute respiratory distress syndrome in adults: diagnosis, outcomes, long-term sequelae, and management[J]. Lancet, 2022, 400(10358): 1157-1170. DOI:10.1016/s0140-6736(22)01439-8 |
| [2] |
BERNARD G R, ARTIGAS A, BRIGHAM K L, et al. The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial coordination[J]. Am J Respir Crit Care Med, 1994, 149(3 Pt 1): 818-824. DOI:10.1164/ajrccm.149.3.7509706 |
| [3] |
BOS L D J, WARE L B. Acute respiratory distress syndrome: causes, pathophysiology, and phenotypes[J]. Lancet, 2022, 400(10358): 1145-1156. DOI:10.1016/s0140-6736(22)01485-4 |
| [4] |
CHEN L, YANG J, ZHANG M, et al. SPP1 exacerbates ARDS via elevating Th17/Treg and M1/M2 ratios through suppression of ubiquitination-dependent HIF-1α degradation[J]. Cytokine, 2023, 164: 156107. DOI:10.1016/j.cyto.2022.156107 |
| [5] |
CHENG L, JIAO Y, JIANG W, et al. IL-33 deficiency attenuates lung inflammation by inducing Th17 response and impacting the Th17/Treg balance in LPS-induced ARDS mice via dendritic cells[J]. J Immunol Res, 2022, 2022: 9543083. DOI:10.1155/2022/9543083 |
| [6] |
YU Z X, JI M S, YAN J, et al. The ratio of Th17/Treg cells as a risk indicator in early acute respiratory distress syndrome[J]. Crit Care, 2015, 19(1): 82. DOI:10.1186/s13054-015-0811-2 |
| [7] |
COURTIES A, BERENBAUM F, SELLAM J. Vagus nerve stimulation in musculoskeletal diseases[J]. Joint Bone Spine, 2021, 88(3): 105149. DOI:10.1016/j.jbspin.2021.105149 |
| [8] |
LI S, QI D, LI J N, et al. Vagus nerve stimulation enhances the cholinergic anti-inflammatory pathway to reduce lung injury in acute respiratory distress syndrome via STAT3[J]. Cell Death Discov, 2021, 7(1): 63. DOI:10.1038/s41420-021-00431-1 |
| [9] |
OGURA H, MURAKAMI M, OKUYAMA Y, et al. Interleukin-17 promotes autoimmunity by triggering a positive-feedback loop via interleukin-6 induction[J]. Immunity, 2008, 29(4): 628-636. DOI:10.1016/j.immuni.2008.07.018 |
| [10] |
CAMPOREALE A, POLI V. IL-6, IL-17 and STAT3: a holy trinity in auto-immunity?[J]. Front Biosci (Landmark Ed), 2012, 17(6): 2306. DOI:10.2741/4054 |
| [11] |
NAKAMURA Y, INOUE T. Neuroimmune communication in the kidney[J]. JMA J, 2020, 3(3): 164-174. DOI:10.31662/jmaj.2020-0024 |
| [12] |
UMBRELLO M, FORMENTI P, BOLGIAGHI L, et al. Current concepts of ARDS: a narrative review[J]. Int J Mol Sci, 2016, 18(1): 64. DOI:10.3390/ijms18010064 |
| [13] |
MIOSSEC P, KOLLS J K. Targeting IL-17 and TH17 cells in chronic inflammation[J]. Nat Rev Drug Discov, 2012, 11(10): 763-776. DOI:10.1038/nrd3794 |
| [14] |
ZHANG X, WEI X, DENG Y, et al. Mesenchymal stromal cells alleviate acute respiratory distress syndrome through the cholinergic anti-inflammatory pathway[J]. Signal Transduct Target Ther, 2022, 7(1): 307. DOI:10.1038/s41392-022-01124-6 |
| [15] |
SHI Y, WEI B, LI L, et al. Th17 cells and inflammation in neurological disorders: possible mechanisms of action[J]. Front Immunol, 2022, 13: 932152. DOI:10.3389/fimmu.2022.932152 |
| [16] |
DING Q, LIU G Q, ZENG Y Y, et al. Role of IL-17 in LPS-induced acute lung injury: an in vivo study[J]. Oncotarget, 2017, 8(55): 93704-93711. DOI:10.18632/oncotarget.21474 |
| [17] |
ZHANG Z T, XIE K, LUO R J, et al. Dexmedetomidine alleviates acute lung injury by promoting Tregs differentiation via activation of AMPK/SIRT1 pathway[J]. Inflammopharmacology, 2023, 31(1): 423-438. DOI:10.1007/s10787-022-01117-5 |
| [18] |
卓爱萍, 王袁, 杨雨涛, 等. 过继转移过表达Pellino-1的调节性T细胞对自身免疫性早发性卵巢功能不全小鼠卵巢功能的修复作用[J]. 海军军医大学学报, 2023, 44(4): 409-417. ZHUO A P, WANG Y, YANG Y T, et al. Repairing effect of adoptive transfer of regulatory T cells overexpressing Pellino-1 on ovarian function of mice with autoimmune premature ovarian insufficiency[J]. Acad J Naval Med Univ, 2023, 44(4): 409-417. DOI:10.16781/j.CN31-2187/R.20220346 |
| [19] |
BROCKMANN L, TRAN A, HUANG Y, et al. Intestinal microbiota-specific Th17 cells possess regulatory properties and suppress effector T cells via c-MAF and IL-10[J]. Immunity, 2023, 56(12): 2719-2735.e7. DOI:10.1016/j.immuni.2023.11.003 |
| [20] |
LIU Y J, TANG B, WANG F C, et al. Parthenolide ameliorates colon inflammation through regulating Treg/Th17 balance in a gut microbiota-dependent manner[J]. Theranostics, 2020, 10(12): 5225-5241. DOI:10.7150/thno.43716 |
| [21] |
THOMPSON S L, O'LEARY G H, AUSTELLE C W, et al. A review of parameter settings for invasive and non-invasive vagus nerve stimulation (VNS) applied in neurological and psychiatric disorders[J]. Front Neurosci, 2021, 15: 709436. DOI:10.3389/fnins.2021.709436 |
| [22] |
CAPILUPI M J, KERATH S M, BECKER L B. Vagus nerve stimulation and the cardiovascular system[J]. Cold Spring Harb Perspect Med, 2020, 10(2): a034173. DOI:10.1101/cshperspect.a034173 |
| [23] |
WANG W, XU H, LIN H, et al. The role of the cholinergic anti-inflammatory pathway in septic cardiomyopathy[J]. Int Immunopharmacol, 2021, 90: 107160. DOI:10.1016/j.intimp.2020.107160 |
| [24] |
BONAZ B, PICQ C, SINNIGER V, et al. Vagus nerve stimulation: from epilepsy to the cholinergic anti-inflammatory pathway[J]. Neurogastroenterol Motil, 2013, 25(3): 208-221. DOI:10.1111/nmo.12076 |
| [25] |
KHO W, VON HAEFEN C, PAESCHKE N, et al. Dexmedetomidine restores autophagic flux, modulates associated microRNAs and the cholinergic anti-inflammatory pathway upon LPS-treatment in rats[J]. J Neuroimmune Pharmacol, 2022, 17(1/2): 261-276. DOI:10.1007/s11481-021-10003-w |
| [26] |
DHAWAN S, DE PALMA G, WILLEMZE R A, et al. Acetylcholine-producing T cells in the intestine regulate antimicrobial peptide expression and microbial diversity[J]. Am J Physiol Gastrointest Liver Physiol, 2016, 311(5): G920-G933. DOI:10.1152/ajpgi.00114.2016 |
 2024, Vol. 45
2024, Vol. 45


