引用本文

聂吴仪, 周娟, 程东海, 王浩强, 谢波. 神经激肽1受体拮抗剂替代地塞米松二联方案预防中度致吐风险化疗所致恶心呕吐的随机对照试验[J]. 海军军医大学学报, 2024, 45(4): 462-469

NIE Wuyi, ZHOU Juan, CHENG Donghai, WANG Haoqiang, XIE Bo. Neurokinin-1 receptor antagonist as an alternative to dexamethasone in standard dual regimen for moderately emetogenic chemotherapy-induced nausea and vomiting: a randomized controlled trial[J]. Academic Journal of Naval Medical University, 2024, 45(4): 462-469 (in Chinese with English abstract)

神经激肽1受体拮抗剂替代地塞米松二联方案预防中度致吐风险化疗所致恶心呕吐的随机对照试验
聂吴仪
1
, 周娟
2, 程东海
2, 王浩强
2, 谢波
2

1. 广州中医药大学研究生院,广州 510006;
2. 中国人民解放军南部战区总医院肿瘤科,广州 510006
收稿日期: 2024-01-29 接受日期: 2024-03-29
基金项目: 广州市科技计划项目(201804010222).
摘要: 目的 比较神经激肽1(NK-1)受体拮抗剂(RA)联合托烷司琼与地塞米松联合托烷司琼预防中度致吐风险化疗所致恶心呕吐(MEC-CINV)的效果。方法 采用非劣效性试验设计,将中国人民解放军南部战区总医院肿瘤科2021年4月至2022年1月满足条件的拟接受中度致吐风险化疗的肿瘤患者按照随机数字表法分为NK-1 RA组和地塞米松组。NK-1 RA组患者采用NK-1 RA(阿瑞匹坦或福沙匹坦)+托烷司琼二联止吐方案,地塞米松组采用托烷司琼+地塞米松标准二联止吐方案。主要评价指标为总观察期(0~120 h)、延迟期(24~120 h)、急性期(24 h内)的呕吐完全缓解(CR)率,次要评价指标为各期恶心完全控制(CC)率及恶心呕吐总缓解(TR)率,安全性指标为止吐药物的不良反应(包括乏力、便秘、呃逆、失眠等症状指标,以及白细胞计数减少、中性粒细胞计数减少、血红蛋白下降、血小板计数减少、丙氨酸转氨酶和/或天冬氨酸转氨酶升高、血肌酐升高等实验室指标异常)。采用差异性检验(检验水准为0.05)和非劣效性检验(非劣效性界值为15%,检验水准为0.025)比较两组的干预效果。结果 最终共有101例患者全程参与本研究,其中NK-1 RA组51例,地塞米松组50例。NK-1 RA组和地塞米松组总观察期呕吐CR率分别为58.8%(30/51)和56.0%(28/50),非劣效性检验无统计学意义[P非劣效=0.035,率差(RD)=2.80%,95% CI -16.5%~22.1%];急性期呕吐CR率分别为80.4%(41/51)和78.0%(39/50),非劣效性检验有统计学意义(P非劣效=0.016,RD=2.40%,95% CI -13.4%~18.2%);延迟期呕吐CR率分别为62.7%(32/51)和58.0%(29/50),非劣效性检验有统计学意义(P非劣效=0.021,RD=4.70%,95% CI-14.4%~23.8%)。NK-1 RA组各期恶心CC率略高于地塞米松组,非劣效性检验有统计学意义(均P非劣效<0.025)。两组间各安全性指标差异无统计学意义(均P>0.05)。结论 在MEC-CINV患者中,NK-1 RA联合托烷司琼的二联止吐方案对恶心呕吐的控制效果非劣效于地塞米松联合托烷司琼标准二联止吐方案,且安全性良好。
关键词:
中度致吐风险化疗 恶心 呕吐 5-羟色胺3受体拮抗剂 神经激肽1受体拮抗剂 地塞米松
Neurokinin-1 receptor antagonist as an alternative to dexamethasone in standard dual regimen for moderately emetogenic chemotherapy-induced nausea and vomiting: a randomized controlled trial
NIE Wuyi
1
, ZHOU Juan
2, CHENG Donghai
2, WANG Haoqiang
2, XIE Bo
2

1. Graduate School, Guangzhou University of Chinese Medicine, Guangzhou 510006, Guangdong, China;
2. Department of Oncology, General Hospital of Southern Theater Command of PLA, Guangzhou 510006, Guangdong, China
Supported by Project of Guangzhou Science and Technology (201804010222).
Abstract: Objective To compare the effects of neurokinin-1 (NK-1) receptor antagonist (RA) plus tropisetron versus dexamethasone plus tropisetron against moderately emetogenic chemotherapy-induced nausea and vomiting (MEC-CINV). Methods A non-inferiority trial was designed. Patients who received moderately emetogenic chemotherapy in Department of Oncology of General Hospital of Southern Theater Command of PLA from Apr. 2021 to Jan. 2022 were randomly assigned to NK-1 RA (NK-1 RA+tropisetron) group or dexamethasone (tropisetron+dexamethasone) group by random number table method. Primary evaluation indexes were complete response (CR) rates of vomiting at overall phase (0-120 h), delayed phase (24-120 h) and acute phase (< 24 h). Secondary evaluation indexes were complete control (CC) rate of nausea and total response (TR) rate of nausea and vomiting at each phase. Safety indexes were adverse events (symptoms such as fatigue, constipation, hiccup and insomnia; abnormal laboratory indicators such as decline of leukocyte, neutrophil, hemoglobin and platelet and increase of alanine transaminase and/or aspartate transaminase and serum creatinine). The intervention effects of the 2 groups were compared by difference test (test level was 0.05) and non-inferiority test (non-inferiority margin was 15%, and test level was 0.025). Results A total of 101 patients participated in the study, including 51 in the NK-1 RA group and 50 in the dexamethasone group. The CR rates of vomiting at overall phase in the NK-1 RA group and dexamethasone group were 58.8% (30/51) and 56.0% (28/50), respectively, and non-inferiority test showed no statistical significance (Pnon-inferiority=0.035, rate difference [RD] =2.80%, 95% confidence interval [CI] -16.5%-22.1%); the CR rates of vomiting at acute phase were 80.4% (41/51) and 78.0% (39/50), respectively, and non-inferiority test was statistically significant (Pnon-inferiority=0.016, RD=2.40%, 95% CI -13.4%-18.2%); and the CR rates of vomiting at delayed phase were 62.7% (32/51) and 58.0% (29/50), respectively, and non-inferiority test was statistically significant (Pnon-inferiority=0.021, RD=4.70%, 95% CI -14.4%-23.8%). The CC rate of nausea at each phase was slightly higher in the NK-1 RA group than that in the dexamethasone group, and the non-inferiority test was statistically significant (all Pnon-inferiority < 0.025). There was no significant difference in the safety indicators between the 2 groups (all P > 0.05). Conclusion In MEC-CINV patients, the control effect of antiemetic regimen of NK-1 RA combined with tropisetron on nausea and vomiting is non-inferior to the standard dual regimen dexamethasone combined with tropisetron, and the safety is good.
Key words:
moderately emetogenic chemotherapy nausea vomiting 5-hydroxytryptamine 3 receptor antagonist neurokinin-1 receptor antagonist dexamethasone
恶心和呕吐是化疗期间常见的不良反应,如果化疗期间不进行预防性止吐干预,70%~80%的患者会出现化疗所致恶心呕吐(chemotherapy-induced nausea and vomiting,CINV),对CINV控制不佳可直接影响患者抗肿瘤治疗的整体预后[1]。糖皮质激素、5-羟色胺3(5-hydroxytryptamine 3,5-HT3)受体拮抗剂(receptor antagonist,RA)和神经激肽1(neurokinin-1,NK-1)RA是高-中度致吐风险化疗期间的常用止吐药物。对于高度致吐风险化疗(highly emetogenic chemotherpy,HEC),指南推荐的一线止吐方案为5-HT3 RA、NK-1 RA和地塞米松三联疗法;而对于中度致吐风险化疗(moderately emetogenic chemotherapy,MEC),各指南将5-HT3 RA联合地塞米松的二联止吐方案作为一线推荐,5-HT3 RA、NK-1 RA和地塞米松的三联方案只在同时合并恶心与呕吐高危因素的患者中使用[1-2]。地塞米松会给患者带来诸多不良反应,尤其是应用于患有糖尿病、胃溃疡等基础疾病的患者时更应谨慎[3-4],且地塞米松有免疫抑制作用,长期使用可能影响肿瘤免疫治疗的效果[5]。因此,开展去糖皮质激素止吐方案的临床探索非常必要。目前大多研究聚焦于HEC,对MEC导致的呕吐能否使用NK-1 RA替代地塞米松研究尚少。本研究比较了NK-1 RA联合托烷司琼的二联止吐方案与地塞米松联合托烷司琼的标准一线二联止吐方案对MEC-CINV的预防效果,为MEC-CINV的去糖皮质激素化防治提供参考依据。
1 资料和方法
1.1 研究对象
本研究是一项单中心前瞻性探索性研究,已通过中国人民解放军南部战区总医院伦理委员会审批(院伦理2021[28])。参考验证性研究非劣效性试验的样本量估算方法,综合既往研究和预试验结果,按照试验组与阳性对照组样本量1∶1的比例纳入参与者,主要观察指标设置为总观察期试验组完全缓解(complete response,CR)率42.6%、阳性对照组CR率66.9%,检验水准(α)设置为0.05(相当于非劣效性试验α=0.025),检验效能(1-β)设置为0.8,非劣效性界值Δ为15%,失访率5%,将以上数值代入统计平台在线工具(www.medsta.cn,浙江中医药大学)进行估算,得到每组样本量至少25例。用SPSS 15软件生成随机数字,将中国人民解放军南部战区总医院肿瘤科2021年4月至2022年1月满足纳入条件的患者随机分配至试验组和阳性对照组。
纳入标准:(1)性别不限,年龄≥18岁,经病理确诊为恶性肿瘤,拟接受MEC方案治疗[MED方案包括奥沙利铂+卡培他滨(XELOX)、5-氟尿嘧啶+亚叶酸钙+奥沙利铂(FOLFOX)、5-氟尿嘧啶+亚叶酸钙+伊立替康+奥沙利铂(FOLFIRINOX)、白蛋白紫杉醇+奈达铂/卡铂(总铂浓度-时间AUC值<4 mg/mL·min)等];(2)Karnofsky体力状态评分为70~100分或美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0~2分;(3)化疗前肝肾功能、血常规、心电图等检查未发现明显异常(血肌酐<正常参考值上限1.5倍,总胆红素<正常参考值上限1.5倍,丙氨酸转氨酶<正常参考值上限2.5倍,碱性磷酸酶<正常参考值上限2.5倍,血小板计数>85×109/L,中性粒细胞计数>1.5×109/L,白细胞计数>3.5×109/L,红细胞计数>2×1012/L,血红蛋白>80 g/L),无化疗禁忌证;(4)入组前1周至化疗前1 d无明显恶心呕吐症状;(5)预计生存期为3个月以上;(6)理解本研究方案,自愿参加本研究并签署知情同意书。
排除标准:(1)有长期使用糖皮质激素史;(2)化疗前24 h出现过呕吐;(3)妊娠或哺乳期女性;(4)对5-HT3 RA、NK-1 RA或地塞米松过敏;(5)其他非肿瘤因素所致的恶心呕吐或正在服用其他致吐性药物或酒精中毒者;(6)用药方案中包含多西他赛注射液、紫杉醇注射液、紫杉醇脂质体注射液、培美曲塞注射液、西妥昔单抗注射液、利妥昔单抗注射液等经临床医师判断需使用地塞米松做化疗前预处理的药物。
剔除标准:(1)各种因素导致未顺利完成1个周期化疗和止吐治疗者;(2)各种因素所致无法完成随访者。
1.2 止吐方案
试验组(NK-1 RA组)患者予NK-1 RA+托烷司琼二联止吐方案,阳性对照组(地塞米松组)患者予托烷司琼+地塞米松标准一线二联止吐方案。NK-1 RA给药方案:福沙匹坦于第1天静脉滴注150 mg 1次,或阿瑞匹坦于第1天口服125 mg 1次、第2天和第3天各口服80 mg1次;地塞米松给药方案:于第1~3天每天静脉滴注5 mg 1次;托烷司琼给药方案:于第1~3天每天静脉滴注5 mg 1次。
1.3 疗效评价
疗效观察期为化疗开始前1 d至化疗结束后第5天,观察两组间化疗后急性期(24 h内)、延迟期(24~120 h)及总观察期(0~120 h)CINV治疗有效率及不良反应发生率。患者填写国际癌症支持治疗协会止吐评价量表,评估CINV发生情况[1]。(1)主要评价指标为总观察期、延迟期及急性期获得的呕吐CR率。呕吐CR定义为没有呕吐或干呕发作、无明显恶心(视觉模拟量表评分≤4分)且不使用救援药物。(2)次要评价指标为总观察期、延迟期及急性期获得的恶心完全控制(complete control,CC)率和恶心呕吐总缓解(total response,TR)率。恶心CC定义为没有呕吐或干呕发作、无中至重度恶心且不使用救援药物,恶心呕吐TR定义为没有呕吐或干呕发作、无恶心且不使用救援药物[5-6]。(3)安全性指标:观察并记录止吐药物的不良反应,包括乏力、便秘、呃逆、失眠等症状,以及白细胞计数减少、中性粒细胞计数减少、血红蛋白下降、血小板计数减少、丙氨酸转氨酶和/或天冬氨酸转氨酶升高、血肌酐升高等实验室指标异常,采用美国国家癌症研究所常见不良事件评价标准(National Cancer Institute Common Terminology Criteria for Adverse Events,NCI-CTCAE)5.0进行评价。
1.4 统计学处理
采用SPSS 25.0软件进行统计学分析。两组的基线资料为二分类和多分类资料,以例数和百分数表示,组间比较采用χ2检验,当不满足χ2检验条件时采用连续校正的χ2检验或Fisher确切概率法,检验水准(α)为0.05。主要和次要评价指标为分类资料,以例数和百分数表示,组间比较采用χ2检验;当差异性检验没有统计学意义(P>0.05)但具有其他的临床优点时,进一步行非劣效性检验。计算两组率差(rate difference,RD)的95% CI,当RD 95% CI的下限包含在非劣效性界值Δ区间(-15%~15%)内,同时非劣效P值(P非劣效)<0.025(单侧)时认为非劣效性检验具有统计学意义。根据两组患者的肿瘤类型,各分为消化系统肿瘤与非消化系统肿瘤两个亚组,采用Cochran-Mantel-Haenszel(CMH)检验进行分层分析,计算OR及其95% CI,并采用Breslow-Day和Tarone’s检验对不同分层的OR进行一致性检验;当分层P>0.05时,可判断组间基线不均衡对疗效评价指标的评估没有明显影响。不良反应事件发生率为有序多分类变量,以例数和百分数表示,组间比较采用Mann-Whitney U检验,检验水准(α)为0.05。
2 结果
2.1 基线资料
本临床试验研究结果的报告遵循临床试验报告的统一标准(Consolidated Standards of Reporting Trials,CONSORT)2010。排除3例,因随访丢失剔除1例,最终共有101例(NK-1 RA组51例、地塞米松组50例)患者全程参与本研究,均顺利完成观察周期的化疗及止吐方案,依从性及耐受性较好。临床试验报告流程图见图 1。除肿瘤类型外,两组患者的性别、年龄、ECOG评分、TNM分期、MEC化疗用药天数、化疗史、MEC化疗药物等特征差异均无统计学意义(均P>0.05,表 1)。
表 1
(Tab 1)
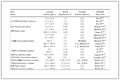
表 1 两组患者的基线特征
Tab 1 Baseline characteristics of 2 groups
| n (%) |
| Characteristic |
NK-1 RA group N=51 |
Dexamethasone group N=50 |
χ2 value |
P value |
| Gender |
|
|
0.095 |
0.758 |
| Male |
27 (52.9) |
28 (56.0) |
|
|
| Female |
24 (47.1) |
22 (44.0) |
|
|
| Age/year |
|
|
0.080 |
0.777 |
| <50 |
19 (37.3) |
20 (40.0) |
|
|
| ≥50 |
32 (62.7) |
30 (60.0) |
|
|
| ECOG score |
|
|
0.001a |
0.978a |
| 0-1 |
48 (94.1) |
46 (92.0) |
|
|
| 2 |
3 (5.9) |
4 (8.0) |
|
|
| Tumor type |
|
|
9.135 |
0.003 |
| Gastrointestinal cancer |
25 (49.0) |
39 (78.0) |
|
|
| Other cancers |
26 (51.0) |
11 (22.0) |
|
|
| Days of chemotherapy |
|
|
0.079 |
0.778 |
| Single-day |
16 (31.4) |
17 (34.0) |
|
|
| Multi-day |
35 (68.6) |
33 (66.0) |
|
|
| TNM classification |
|
|
0.378 |
0.539 |
| Ⅰ-Ⅲ |
15 (29.4) |
12 (24.0) |
|
|
| Ⅳ |
36 (70.6) |
38 (76.0) |
|
|
| Chemotherapy history |
|
|
0.083 |
0.774 |
| Yes |
39 (76.5) |
37 (74.0) |
|
|
| No |
12 (23.5) |
13 (26.0) |
|
|
| MEC agent |
|
|
0.238 |
0.626 |
| Oxaliplatin |
19 (37.3) |
21 (42.0) |
|
|
| Non-oxaliplatin |
32 (62.7) |
29 (58.0) |
|
|
| The patients in the NK-1 RA group received NK-1 RA+tropisetron and those in the dexamethasone group received tropisetron+dexamethasone. a: Continuity correction χ2 test. NK-1: Neurokinin-1; RA: Receptor antagonist; ECOG: Eastern Cooperative Oncology Group; MEC: Moderately emetogenic chemotherapy.
|
|
表 1 两组患者的基线特征
Tab 1 Baseline characteristics of 2 groups
|
2.2 CINV疗效评价
所有患者均顺利完成1个周期的治疗。NK-1 RA组和地塞米松组的呕吐CR率在总观察期分别为58.8%和56.0%,在急性期分别为80.4%和78.0%,在延迟期分别为62.7%和58.0%。χ2检验结果显示,两组间各期呕吐CR率差异无统计学意义(均P>0.05)。非劣效性检验结果显示,两组总观察期呕吐CR率无统计学意义(P非劣效=0.035),两组急性期和延迟期呕吐CR率均有统计学意义(P非劣效=0.016、P非劣效=0.021),表明NK-1 RA+托烷司琼二联止吐方案在急性期和延迟期对呕吐症状的控制效果与托烷司琼+地塞米松标准二联止吐方案相比具有非劣效性。见表 2。
表 2
(Tab 2)

表 2 两组患者各疗效观察期呕吐CR率的比较
Tab 2 Comparison of CR rates of vomiting at different curative observation phases between 2 groups
| n (%) |
| Phase |
NK-1 RA group N=51 |
Dexamethasone group N=50 |
χ2 test |
|
Non-inferiority testa |
| χ2 value |
P value |
|
RD (95% CI)/% |
Pnon-inferiority value |
| Acute (0-<24 h) |
41 (80.4) |
39 (78.0) |
0.088 |
0.767 |
|
2.40 (-13.4, 18.2) |
0.016 |
| Delayed (24-120 h) |
32 (62.7) |
29 (58.0) |
0.238 |
0.626 |
4.70 (-14.4, 23.8) |
0.021 |
| Overall (0-120 h) |
30 (58.8) |
28 (56.0) |
0.082 |
0.774 |
2.80 (-16.5, 22. 1) |
0.035 |
| The patients in the NK-1 RA group received NK-1 RA+tropisetron and those in the dexamethasone group received tropisetron+dexamethasone. a: The lower bound of 95% CI of RD included in Δ interval (-15%-15%) and Pnon-inferiority<0.025 (one-sided), indicating that non-inferiority test was statistically significant. CR: Complete response; NK-1: Neurokinin-1; RA: Receptor antagonist; RD: Rate difference; CI: Confidence interval; Δ: Non-inferiority margin.
|
|
表 2 两组患者各疗效观察期呕吐CR率的比较
Tab 2 Comparison of CR rates of vomiting at different curative observation phases between 2 groups
|
NK-1 RA组和地塞米松组的恶心CC率在总观察期分别为47.1%和36.0%,在急性期分别为72.5%和64.0%,在延迟期分别为49.0%和42.0%。χ2检验结果显示,两组间各期恶心CC率差异无统计学意义(均P>0.05)。非劣效性检验结果显示,两组间各期恶心CC率均有统计学意义(P非劣效=0.004、0.005、0.013),表明NK-1 RA+托烷司琼二联止吐方案在总观察期、急性期和延迟期对恶心症状的控制效果与托烷司琼+地塞米松标准二联止吐方案相比具有非劣效性。NK-1 RA组和地塞米松组的恶心呕吐TR率在总观察期分别为29.4%和28.0%,在急性期分别为62.7%和54.0%,在延迟期分别为31.4%和30.0%。χ2检验结果显示,两组间各期恶心呕吐TR率差异无统计学意义(均P>0.05)。非劣效性检验结果显示,两组总观察期和延迟期恶心呕吐TR率无统计学意义(P非劣效=0.034、0.037),急性期恶心呕吐TR率具有统计学意义(P非劣效=0.008),表明NK-1 RA+托烷司琼二联止吐方案在急性期对恶心呕吐发作的控制效果与托烷司琼+地塞米松标准二联止吐方案相比具有非劣效性。见表 3。
表 3
(Tab 3)

表 3 两组患者各疗效观察期恶心CC率和恶心呕吐TR率的比较
Tab 3 Comparison of CC rates of nausea and TR rates of nausea and vomiting at different curative observation phases between 2 groups
| n (%) |
| Index |
NK-1 RA group N=51 |
Dexamethasone group N=50 |
χ2 test |
|
Non-inferiority testa |
| χ2 value |
P value |
|
RD (95% CI)/% |
Pnon-inferiority value |
| CC rate of nausea |
|
|
|
|
|
|
|
| Acute (0-<24 h) |
37 (72.5) |
32 (64.0) |
0.853 |
0.356 |
8.50 (-9.6, 26.6) |
0.005 |
| Delayed (24-120 h) |
25 (49.0) |
21 (42.0) |
0.502 |
0.479 |
7.00 (-12.4, 26.4) |
0.013 |
| Overall (0-120 h) |
24 (47.1) |
18 (36.0) |
1.271 |
0.260 |
11.1 (-8.0, 30.2) |
0.004 |
| TR rate of nausea and vomiting |
|
|
|
|
|
|
| Acute (0-<24 h) |
32 (62.7) |
27 (54.0) |
0.795 |
0.373 |
8.70 (-10.5, 27.9) |
0.008 |
| Delayed (24-120 h) |
16 (31.4) |
15 (30.0) |
0.022 |
0.881 |
1.40 (-16.6, 19.4) |
0.037 |
| Overall (0-120 h) |
15 (29.4) |
14 (28.0) |
0.025 |
0.875 |
1.40 (-16.3, 19.0) |
0.034 |
| The patients in the NK-1 RA group received NK-1 RA+tropisetron and those in the dexamethasone group received tropisetron+dexamethasone. a: The lower bound of 95% CI of RD included in Δ interval (-15%-15%) and Pnon-inferiority<0.025 (one-sided), indicating that non-inferiority test was statistically significant. CC: Complete control; TR: Total response; NK-1: Neurokinin-1; RA: Receptor antagonist; RD: Rate difference; CI: Confidence interval; Δ: Non-inferiority margin.
|
|
表 3 两组患者各疗效观察期恶心CC率和恶心呕吐TR率的比较
Tab 3 Comparison of CC rates of nausea and TR rates of nausea and vomiting at different curative observation phases between 2 groups
|
2.3 不同肿瘤类型对疗效影响的分层分析
将两组患者分别分为消化系统肿瘤与非消化系统肿瘤两个亚组,χ2检验结果显示分层后两组各疗效观察期的呕吐CR率、恶心CC率和恶心呕吐TR率差异均无统计学意义(均P>0.05,表 4),CMH检验结果显示分层后两组间各疗效观察期OR的95% CI范围较大且均包含1(均P>0.05,表 5)。结果表明,不同肿瘤类型在两组间的基线不均衡对评价指标没有明显影响。
表 4
(Tab 4)

表 4 按肿瘤类型分层后两组患者各疗效观察期治疗结果比较
Tab 4 Comparison of outcomes at different curative observation phases between 2 groups after stratification by tumor types
| n (%) |
| Outcome |
Phase |
Tumor type |
NK-1 RA group |
|
Dexamethasone group |
χ2 value |
P value |
| N |
CR/CC/TR rate |
|
N |
CR/CC/TR rate |
| CR of vomiting |
Acute (0-<24 h) |
Gastrointestinal |
25 |
21 (84.0) |
|
39 |
31 (79.5) |
0.015a |
0.902a |
|
|
Others |
26 |
20 (76.9) |
11 |
8 (72.7) |
0.026a |
0.883a |
|
Delayed (24-120 h) |
Gastrointestinal |
25 |
18 (72.0) |
39 |
21 (53.8) |
2.109 |
0.146 |
|
|
Others |
26 |
14 (53.8) |
11 |
8 (72.7) |
0.494a |
0.482a |
|
Overall (0-120 h) |
Gastrointestinal |
25 |
16 (64.0) |
39 |
21 (53.8) |
0.644 |
0.422 |
|
|
Others |
26 |
14 (53.8) |
11 |
7 (63.6) |
0.035a |
0.852a |
| CC of nausea |
Acute (0-<24 h) |
Gastrointestinal |
25 |
19 (76.0) |
39 |
26 (66.7) |
0.636 |
0.425 |
|
|
Others |
26 |
18 (69.2) |
11 |
6 (54.5) |
0.229a |
0.632a |
|
Delayed (24-120 h) |
Gastrointestinal |
25 |
15 (60.0) |
39 |
14 (35.9) |
3.571 |
0.059 |
|
|
Others |
26 |
10 (38.5) |
11 |
7 (63.6) |
1.973 |
0.160 |
|
Overall (0-120 h) |
Gastrointestinal |
25 |
14 (56.0) |
39 |
14 (35.9) |
2.241 |
0.134 |
|
|
Others |
26 |
10 (38.5) |
11 |
4 (36.4) |
0.063a |
0.802a |
| TR of nausea and vomiting |
Acute (0-<24 h) |
Gastrointestinal |
25 |
15 (60.0) |
39 |
21 (53.8) |
0.234 |
0.628 |
|
Others |
26 |
17 (65.4) |
11 |
6 (54.5) |
0.063a |
0.802a |
|
Delayed (24-120 h) |
Gastrointestinal |
25 |
9 (36.0) |
39 |
11 (28.2) |
0.431 |
0.512 |
|
|
Others |
26 |
7 (26.9) |
11 |
4 (36.4) |
0.033a |
0.857a |
|
Overall (0-120 h) |
Gastrointestinal |
25 |
9 (36.0) |
39 |
11 (28.2) |
0.431 |
0.512 |
|
|
Others |
26 |
6 (23.1) |
11 |
3 (27.3) |
0.022a |
0.883a |
| The patients in the NK-1 RA group received NK-1 RA+tropisetron and those in the dexamethasone group received tropisetron+dexamethasone. a: Continuity correction χ2 test. CR: Complete response; CC: Complete control; TR: Total response; NK-1: Neurokinin-1; RA: Receptor antagonist.
|
|
表 4 按肿瘤类型分层后两组患者各疗效观察期治疗结果比较
Tab 4 Comparison of outcomes at different curative observation phases between 2 groups after stratification by tumor types
|
表 5
(Tab 5)

表 5 两组患者各疗效观察期治疗结果按肿瘤类型分层后的CMH检验结果
Tab 5 CMH test results of outcomes at different curative observation phases between 2 groups after stratification by tumor types
| Outcome |
Phase |
Tumor type |
OR (95% CI) |
|
Homogeneity test of OR |
| Stratification |
Total |
|
OR (95% CI) |
P value |
| CR of vomiting |
Acute (0-<24 h) |
Gastrointestinal |
0.738 (0.197, 2.768) |
0.865 (0.330, 2.263) |
|
0.762 (0.275, 2.114) |
0.601 |
|
|
Others |
0.800 (0.160, 4.003) |
|
|
|
|
Delayed (24-120 h) |
Gastrointestinal |
0.454 (0.155, 1.381) |
0.820 (0.369, 1.822) |
0.789 (0.342, 1.820) |
0.579 |
|
|
Others |
2.286 (0.493, 10.605) |
|
|
|
|
Overall (0-120 h) |
Gastrointestinal |
0.656 (0.234, 1.840) |
0.891 (0.405, 1.961) |
0.789 (0.342, 1.820) |
0.579 |
|
|
Others |
1.500 (0.352, 6.397) |
|
|
|
| CC of nausea |
Acute (0-<24 h) |
Gastrointestinal |
0.632 (0.203, 1.963) |
0.673 (0.289, 1.564) |
0.594 (0.243, 1.453) |
0.253 |
|
|
Others |
0.533 (0.125, 2.273) |
|
|
|
|
Delayed (24-120 h) |
Gastrointestinal |
0.373 (0.133, 1.049) |
0.753 (0.343, 1.652) |
0.751 (0.338, 1.671) |
0.483 |
|
|
Others |
2.800 (0.650, 12.064) |
|
|
|
|
Overall (0-120 h) |
Gastrointestinal |
0.458 (0.164, 1.282) |
0.653 (0.294, 1.453) |
0.578 (0.250, 1.338) |
0.200 |
|
|
Others |
0.914 (0.212, 3.939) |
|
|
|
| TR of nausea and vomiting |
Acute (0-<24 h) |
Gastrointestinal |
0.778 (0.275, 2.114) |
0.697 (0.315, 1.543) |
0.728 (0.317, 1.670) |
0.453 |
|
Others |
0.635 (0.275, 2.114) |
|
|
|
|
Delayed (24-120 h) |
Gastrointestinal |
0.698 (0.239, 2.044) |
0.938 (0.402, 2.185) |
0.913 (0.381, 2.188) |
0.838 |
|
|
Others |
1.551 (0.345, 6.975) |
|
|
|
|
Overall (0-120 h) |
Gastrointestinal |
0.698 (0.239, 2.044) |
0.933 (0.394, 2.211) |
0.835 (0.341, 2.047) |
0.694 |
|
|
Others |
1.250 (0.250, 6.255) |
|
|
|
| CMH: Cochran-Mantel-Haenszel; CR: Complete response; CC: Complete control; TR: Total response; OR: Odds ratio; CI: Confidence interval.
|
|
表 5 两组患者各疗效观察期治疗结果按肿瘤类型分层后的CMH检验结果
Tab 5 CMH test results of outcomes at different curative observation phases between 2 groups after stratification by tumor types
|
2.4 两组止吐方案的安全性分析
两组患者在治疗过程中均出现不同程度的不良反应(表 6)。与止吐药物相关的不良反应症状主要为乏力、便秘、呃逆、失眠,症状分级大多为1~2级。NK-1 RA组便秘的发生率(31.4%,16/51)略高于地塞米松组(26.0%,13/50),乏力、呃逆、失眠的发生率略低于地塞米松组,两组间上述症状发生率差异均无统计学意义(均P>0.05)。两组间各实验室指标异常的发生率差异也均无统计学意义(均P>0.05)。
表 6
(Tab 6)

表 6 两组患者不良反应发生率的比较
Tab 6 Comparison of incidence of adverse events between 2 groups
| n (%) |
| Adverse event |
NK-1 RA group N=51 |
|
Dexamethasone group N=50 |
Z value |
P value |
| No |
Grade 1-2 |
Grade 3-4 |
|
No |
Grade 1-2 |
Grade 3-4 |
| Symptom |
|
|
|
|
|
|
|
|
|
| Weak |
38 (74.5) |
10 (19.6) |
3 (5.9) |
38 (76.0) |
12 (24.0) |
0 |
-0.335 |
0.738 |
| Constipation |
35 (68.6) |
15 (29.4) |
1 (2.0) |
37 (74.0) |
13 (26.0) |
0 |
-0.649 |
0.516 |
| Hiccough |
42 (82.4) |
9 (17.6) |
0 |
34 (68.0) |
15 (30.0) |
1 (2.0) |
-1.701 |
0.089 |
| Insomnia |
39 (76.5) |
12 (23.5) |
0 |
35 (70.0) |
15 (30.0) |
0 |
-0.946 |
0.344 |
| Laboratory indicator abnormality |
|
|
|
|
|
|
|
|
| Leukocyte decrease |
43 (84.3) |
6 (11.8) |
2 (3.9) |
45 (90.0) |
5 (10.0) |
0 |
0.081 |
0.516 |
| Neutrophil decrease |
47 (92.2) |
3 (5.9) |
1 (2.0) |
46 (92.0) |
4 (8.0) |
0 |
-0.176 |
0.675 |
| Hemoglobin decrease |
48 (94.1) |
2 (3.9) |
1 (2.0) |
47 (94.0) |
2 (4.0) |
1 (2.0) |
0.088 |
0.684 |
| Platelet decrease |
45 (88.2) |
5 (9.8) |
1 (2.0) |
44 (88.0) |
5 (10.0) |
1 (2.0) |
-0.001 |
0.874 |
| ALT and/or AST increase |
47 (92.2) |
4 (7.8) |
0 |
44 (88.0) |
5 (10.0) |
1 (2.0) |
0.145 |
0.704 |
| Serum creatinine increase |
47 (92.2) |
4 (7.8) |
0 |
48 (96.0) |
2 (4.0) |
0 |
0.133 |
0.515 |
| The patients in the NK-1 RA group received NK-1 RA+tropisetron and those in the dexamethasone group received tropisetron+dexamethasone. NK-1: Neurokinin-1; RA: Receptor antagonist; ALT: Alanine transaminase; AST: Aspartate transaminase.
|
|
表 6 两组患者不良反应发生率的比较
Tab 6 Comparison of incidence of adverse events between 2 groups
|
3 讨论
本研究是针对接受MEC的患者设计的前瞻性随机对照试验,旨在探讨MEC治疗中NK-1 RA(阿瑞匹坦或福沙匹坦)联合托烷司琼的二联止吐方案疗效是否不劣于地塞米松联合托烷司琼的标准一线二联止吐方案,为探索去糖皮质激素化MEC止吐方案的可行性提供依据。
有多项临床研究探讨了减少地塞米松使用天数对CINV治疗效果的影响。Ito等[7]采用NK-1 RA、帕洛诺司琼联合地塞米松三联方案预防HEC-CINV,比较了地塞米松1 d用药方案与地塞米松连续3 d用药方案的疗效,发现两组总观察期的CR率相似。Aapro等[8]采用帕洛诺司琼联合地塞米松方案预防MEC-CINV,对比了地塞米松仅在第1天使用(第2~3天使用安慰剂)与第1~3天连续使用的疗效,结果显示在总观察期单日使用地塞米松组CR率不劣于3日组。但这些方案仍未完全停用地塞米松。针对这一争议,有学者开始设计并在ClinicalTrials.gov和ChiCTR注册头对头临床研究,探索非地塞米松CINV止吐方案的可行性。
本研究结果显示,去地塞米松的NK-1 RA(阿瑞匹坦或福沙匹坦)联合5-HT3 RA对MEC-CINV控制良好,且在急性期及延迟期其疗效不劣于指南推荐的托烷司琼+地塞米松标准二联止吐方案。此研究结论与2022年公布的一项Ⅲ期临床研究结果[9]类似。该研究在接受mFOLFOX6(奥沙利铂、亚叶酸钙和5-氟尿嘧啶)MEC方案的患者中观察了2种方案对CINV的预防效果,结果显示总观察期和延迟期阿瑞匹坦联合帕洛诺司琼组CR率高于地塞米松联合帕洛诺司琼组(88.8% vs 74.2%,P=0.001;90.6% vs 75.5%,P<0.000 1),急性期两组的CR率均>90%且差异无统计学意义(P=0.94)。在恶心症状控制方面,本研究结果显示NK-1 RA联合托烷司琼的表现也不劣于地塞米松联合托烷司琼(各疗效观察期P非劣效<0.025),但也未体现显著的优势。这与既往的研究结果[10-11]一致,这2项研究在5-HT3 RA联合地塞米松方案中加入阿瑞匹坦预防MEC-CINV,虽然总体CR率提高,但未能使恶心症状得到明显缓解。
在本研究中,对于呕吐的控制,两组各疗效观察期的CR率都明显低于现有研究结果。如Weinstein等[12]的研究发现采用联合止吐治疗后,急性期CR率为91.0%,延迟期和总观察期的CR率分别为68.5%和66.9%。分析原因可能与本研究选择了第1代5-HT3 RA托烷司琼有关,有研究显示第2代5-HT3 RA的疗效显著优于第1代5-HT3 RA[13]。同时本研究未对患者基线特征设置严格限制,未统一患者的化疗方案,这可能也会导致研究结果的差异。
此外,本研究观察到两组间不良反应发生率差异无统计学意义,两组不良反应发生率均未超过本试验的预期估计值,这表明患者对NK-1 RA联合托烷司琼止吐方案的耐受性良好,其不良反应的发生率与标准阳性对照组无显著差别。
综上所述,本研究结果提示对于接受MEC的患者,NK-1 RA联合托烷司琼的二联止吐方案对CINV的预防效果不劣于含地塞米松的标准二联止吐方案,且安全性良好,但本研究对入组患者未做严格基线限制,如是否首次化疗、肿瘤类型、化疗方案等,虽然使用分层分析验证了两组间肿瘤类型的差异不影响研究结论的可靠性,仍然不能忽视这些混杂因素对研究结果的影响。此外,本研究纳入的样本量较小,需在今后的研究中优化研究设计及扩大样本量。
参考文献
| [1] | |
| [2] |
HERRSTEDT J, CLARK-SNOW R, RUHLMANN C H, et al. 2023 MASCC and ESMO guideline update for the prevention of chemotherapy- and radiotherapy-induced nausea and vomiting[J]. ESMO Open, 2024, 9(2): 102195. DOI:10.1016/j.esmoop.2023.102195 |
| [3] |
JEONG Y, HAN H S, LEE H D, et al. A pilot study evaluating steroid-induced diabetes after antiemetic dexamethasone therapy in chemotherapy-treated cancer patients[J]. Cancer Res Treat, 2016, 48(4): 1429-1437. DOI:10.4143/crt.2015.464 |
| [4] |
NAKAMURA M, ISHIGURO A, MURANAKA T, et al. A prospective observational study on effect of short-term periodic steroid premedication on bone metabolism in gastrointestinal cancer (ESPRESSO-01)[J]. Oncologist, 2017, 22(5): 592-600. DOI:10.1634/theoncologist.2016-0308 |
| [5] |
JANOWITZ T, KLEEMAN S, VONDERHEIDE R H. Reconsidering dexamethasone for antiemesis when combining chemotherapy and immunotherapy[J]. Oncologist, 2021, 26(4): 269-273. DOI:10.1002/onco.13680 |
| [6] |
OKADA Y, OBA K, FURUKAWA N, et al. One-day versus three-day dexamethasone in combination with palonosetron for the prevention of chemotherapy-induced nausea and vomiting: a systematic review and individual patient data-based meta-analysis[J]. Oncologist, 2019, 24(12): 1593-1600. DOI:10.1634/theoncologist.2019-0133 |
| [7] |
ITO Y, TSUDA T, MINATOGAWA H, et al. Placebo-controlled, double-blinded phase Ⅲ study comparing dexamethasone on day 1 with dexamethasone on days 1 to 3 with combined neurokinin-1 receptor antagonist and palonosetron in high-emetogenic chemotherapy[J]. J Clin Oncol, 2018, 36(10): 1000-1006. DOI:10.1200/JCO.2017.74.4375 |
| [8] |
AAPRO M, FABI A, NOLÈ F, et al. Double-blind, randomised, controlled study of the efficacy and tolerability of palonosetron plus dexamethasone for 1 day with or without dexamethasone on days 2 and 3 in the prevention of nausea and vomiting induced by moderately emetogenic chemotherapy[J]. Ann Oncol, 2010, 21(5): 1083-1088. DOI:10.1093/annonc/mdp584 |
| [9] |
CHENG Y, WU Z, SHI L, et al. Aprepitant plus palonosetron versus dexamethasone plus palonosetron in preventing chemotherapy-induced nausea and vomiting in patients with moderate-emetogenic chemotherapy: a randomized, open-label, phase 3 trial[J]. EClinicalMedicine, 2022, 49: 101480. DOI:10.1016/j.eclinm.2022.101480 |
| [10] |
WARR D G, HESKETH P J, GRALLA R J, et al. Efficacy and tolerability of aprepitant for the prevention of chemotherapy-induced nausea and vomiting in patients with breast cancer after moderately emetogenic chemotherapy[J]. J Clin Oncol, 2005, 23(12): 2822-2830. DOI:10.1200/JCO.2005.09.050 |
| [11] |
HAYASHI T, SHIMOKAWA M, MATSUO K, et al. 5HT3 RA plus dexamethasone plus aprepitant for controlling delayed chemotherapy-induced nausea and vomiting in colorectal cancer[J]. Cancer Sci, 2021, 112(2): 744-750. DOI:10.1111/cas.14757 |
| [12] |
WEINSTEIN C, JORDAN K, GREEN S, et al. Single-dose fosaprepitant for the prevention of chemotherapy-induced nausea and vomiting in patients receiving moderately emetogenic chemotherapy regimens: a subgroup analysis from a randomized clinical trial of response in subjects by cancer type[J]. BMC Cancer, 2020, 20(1): 918. DOI:10.1186/s12885-020-07259-5 |
| [13] |
SUZUKI K, YAMANAKA T, HASHIMOTO H, et al. Randomized, double-blind, phase Ⅲ trial of palonosetron versus granisetron in the triplet regimen for preventing chemotherapy-induced nausea and vomiting after highly emetogenic chemotherapy: triple study[J]. Ann Oncol, 2016, 27(8): 1601-1606. DOI:10.1093/annonc/mdw220 |

 2024, Vol. 45
2024, Vol. 45


