2. 上海理工大学健康科学与工程学院,上海 200093
2. School of Health Science and Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China
麻痹性贝类毒素是海洋有毒甲藻代谢产生的一类神经麻痹剂[1-2],它通过阻断细胞钠离子通道造成神经传递障碍而导致瘫痪[3]。麻痹性贝类毒素主要有石房蛤毒素(saxitoxin,STX)、膝沟藻毒素及新石房蛤毒素(neosaxitoxin),其中STX是毒性最强和最常见的神经毒素之一。目前常用的STX检测方法主要有小鼠生物检测法、高效液相色谱法及免疫学检测法,这些方法存在重现性差、操作复杂、耗时长、成本高等问题,不利于STX的高效检测。
适配体能通过指数富集的配基系统进化技术(systematic evolution of ligands by exponential enrichment)筛选出对目标分析物具有高亲和力和高选择性的单链DNA或RNA[4-5]。较强的亲和力、良好的稳定性及易合成等优点使其受到分析化学领域研究者的关注,尤其是针对小分子的研究领域。目前为止,以适配体为识别元件的分析方法已经应用于生物学、环境卫生、食品安全监测等领域[6-8]。现已报道的多种STX适配体研究主要针对适配体APTSTX1及M-30f结合比色法[9]、荧光法[10]和电化学法[11]等检测方法,实现了对STX较灵敏、快速的检测。APTSTX1是由Handy等[12]通过较为复杂的固定靶标分离方法筛选出的STX的第1条核酸适配体,而M-30f是由Zheng等[13]通过对APTSTX1经过定点突变和截短得到的另一条适配体。相较于APTSTX1,M-30f的亲和力提高了30倍[13]。
Zhou等[14]通过固定化金属螯合-指数富集的配基系统进化技术筛选获得了与STX亲和力更高的核酸适配体45e-1(Kd=19 nmol/L),与适配体M-30f相比,Kd提升了3.2倍。本研究基于适配体45e-1建立了一种非标记型适配体传感器,用于绿色、经济、快速、灵敏和高选择性地检测STX。据分子动力学模拟得知45e-1自身存在G-四链体结构,并以G-四链体形式与STX形成稳定的复合物[14],而G-四链体又可以作为配体与各种荧光团分子结合诱导荧光变化,因此本研究选择噻唑橙(thiazole orange)作为荧光探针来指示45e-1与STX结合后产生的构象变化,以定量检测STX。本传感器不需要对适配体进行任何修饰,在均相溶液中经过溶液与样品的简单混合即可实现对STX的定量检测。
1 材料和方法 1.1 试剂噻唑橙、DEPC、DMSO、氯化钠、氯化钾、氯化钙(分析纯,上海泰坦科技股份有限公司),Tris(分析纯,大连美仑生物技术有限公司),盐酸(分析纯,国药集团化学试剂有限公司),核酸适配体45e-1(5’-CTCGGGGGCGCGGTTGATC-GGAGAGGG-3’)和含5’端生物素(biotin)修饰的核酸适配体45e-1[HPLC,生工生物工程(上海)股份有限公司],蒸馏水(广州屈臣氏食品饮料有限公司),STX、河豚毒素(tetrodotoxin)、岩沙海葵毒素(palytoxin)、大田软海绵酸(okadaic acid)、微囊藻毒素-LR(microcystin-LR)和节球藻毒素(nodularin)(中国台湾藻研有限公司)。
1.2 仪器与耗材FE20型pH计(瑞士METTLER TOLEDO公司),FL-6500型荧光分光光度仪(美国PerkinElmer公司),HA-202M型电子天平(日本A & D公司),SA8型多功能涡旋振荡混匀器(英国Stuart公司),OctetRED 96型生物膜干涉仪(美国ForteBio公司),超级链霉亲和素(super streptavidin)生物传感器(美国ForteBio公司),Chirascan型圆二色光谱仪(英国Applied Photophysics公司)。
1.3 非标记型适配体传感器荧光检测将50 nmol/L45e-1溶解在缓冲液(20 mmol/L Tris-HCl、100 mmol/LNaCl、2.5 mmol/L MgCl2、5 mmol/L KCl,pH=7.5)中,在95 ℃水浴中加热10 min,冰水浴中冷却5 min。将STX标准溶液加到上述溶液中,充分混匀后室温孵育10 min。然后将噻唑橙溶液加到45e-1与STX的混合物中,添加缓冲液使反应体系体积为100 μL,充分混合后在室温孵育2 min。最后在496 nm激发波长下测定体系的荧光强度。
1.4 原理验证的方法条件(1)圆二色光谱实验:将5 μmol/L 45e-1溶解在Tris-HCl缓冲液中,95 ℃水浴中加热10 min,冰水浴中冷却5 min。将50 nmol/LSTX标准溶液加到上述溶液中,充分混匀后室温孵育10 min。然后将噻唑橙加到45e-1与STX的混合物中,充分混合并在室温孵育2 min。最后,使用圆二色光谱仪记录圆二色光谱。
(2)生物膜干涉技术:用黑色96孔板进行加样,采用7个步骤顺序分析,即超级链霉亲和素生物传感器活化(20 mmol/L Tris-HCl,10 min)、基线平衡(20 mmol/L Tris-HCl,1 min)、含5’端生物素修饰的45e-1固定化(3 min)、清洗(20 mmol/L Tris-HCl,1 min)、与STX结合(3 min)、清洗(20 mmol/L Tris-HCl,1 min)、与噻唑橙结合(3 min)。竞争结合实验由4组实验组成[15-16],即实验组1,5 μmol/L 45e-1+5 μmol/L STX+5 μmol/L噻唑橙;实验组2,5 μmol/L 45e-1+0 μmol/L STX+5 μmol/L噻唑橙;对照组,5 μmol/L 45e-1+5 μmol/L STX+0 μmol/L噻唑橙;自反应组,5 μmol/L 45e-1+5 μmol/L STX+5 μmol/L STX。
1.5 实验条件优化(1)反应条件优化:对影响适配体传感器性能的实验条件进行选择与优化,包括噻唑橙与45e-1的摩尔浓度比(1∶5、1∶1、5∶1、10∶1、20∶1)、噻唑橙与45e-1的孵育时间(2、4、6、8、10、12、14、16、18、20 min)、45e-1与STX的孵育时间(5、10、15、20、25、30、35、40、45、50 min)。
(2)缓冲液优化:针对缓冲液中K+浓度(5、7.5、10 mmol/L)与Mg2+浓度(2.5、5、7.5 mmol/L)分别进行单因素考察,基于1.3节方法考察不同阳离子浓度对适配体传感器的影响。
1.6 方法学验证(1)专属性:在一系列离心管中加入50 nmol/L 45e-1溶液,并分别与50 nmol/L的STX、河豚毒素、岩沙海葵毒素、大田软海绵酸、微囊藻毒素-LR及节球藻毒素溶液充分混合均匀,室温下反应10 min。然后加入250 nmol/L噻唑橙溶液继续反应2 min,测定荧光强度。
(2)线性范围及检测限:分别对浓度为0、3.12、6.25、12.5、25、50 nmol/L的STX标准溶液进行荧光检测,并以STX浓度为横坐标、不同STX浓度体系的荧光强度与空白样品荧光强度的差值为纵坐标绘制标准曲线,并计算检测限。
(3)回收率:所用实际样品为2023年4月从浙江东海海域采集的海水。在上述优化的检测条件下,于海水中添加不同浓度的STX标准溶液,得到3个添加水平(10、20、30 nmol/L)的待测样品,样品经过滤处理后用Tris-HCl缓冲液稀释20倍,最后根据1.3节方法进行荧光检测并记录实测浓度。
2 结果 2.1 原理验证的实验结果45e-1的圆二色光谱(图 1)显示在265 nm处有1个正峰,245 nm处有1个负峰,峰位与典型的平行G-四链体构象的峰位[17]一致。反应体系分别加入STX与噻唑橙后,波长并未发生明显位移,但负峰的峰强度减弱、正峰的峰强度明显增强。
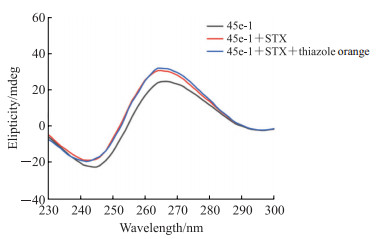
|
图 1 45e-1、复合物45e-1+STX及复合物45e-1+STX+噻唑橙的圆二色光谱图 Fig 1 Circular dichroism spectra of 45e-1, complex 45e-1+STX, and complex 45e-1+STX+thiazole orange STX: Saxitoxin; mdeg: Millidegree. |
见图 2,实验组1、实验组2、对照组及自反应组第2结合阶段的响应值分别为2.32、2.43、-0.061与0.039 nm。自反应组与实验组2的响应值比值为1.60%,实验组1与实验组2的响应值比值为95.47%。
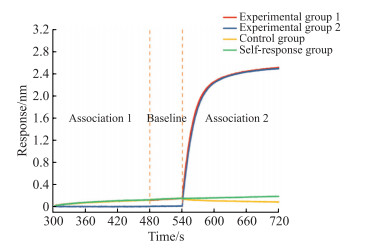
|
图 2 生物膜干涉技术检测STX与噻唑橙的结合位点竞争变化 Fig 2 Changes in competition between STX and thiazole orange in binding site detected by bio-layer interferometry Experimental group 1: 5 μmol/L 45e-1+5 μmol/L STX+5 μmol/L thiazole orange; Experimental group 2: 5 μmol/L 45e-1+0 μmol/L STX+5 μmol/L thiazole orange; Control group: 5 μmol/L 45e-1+5 μmol/L STX+0 μmol/L thiazole orange; Self-response group: 5 μmol/L 45e-1+5 μmol/L STX+5 μmol/L STX. STX: Saxitoxin. |
2.2 实验条件优化的实验结果 2.2.1 噻唑橙与45e-1的摩尔浓度比
见图 3,当噻唑橙与45e-1的摩尔浓度比为1∶5~5∶1时,随着摩尔浓度比的增大体系在535 nm处的荧光强度逐渐增强,当噻唑橙与45e-1的摩尔浓度比为5∶1时体系的荧光强度最强,之后随着摩尔浓度比继续增大体系的荧光强度逐渐减弱。
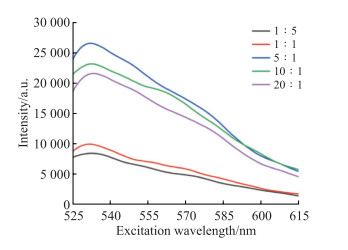
|
图 3 不同噻唑橙与45e-1摩尔浓度比反应体系的荧光强度变化图 Fig 3 Fluorescence intensity changes of reaction systems in different molar concentration ratios of thiazole orange to 45e-1 a.u.: Arbitrary unit. |
2.2.2 噻唑橙与45e-1的孵育时间
噻唑橙与45e-1(摩尔浓度比为5∶1)作用2 min荧光强度即达到稳定,在2~20 min的孵育时间范围内随着孵育时间的延长反应体系在535 nm处的荧光强度并没有发生明显变化(图 4)。
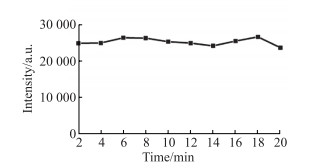
|
图 4 不同噻唑橙与45e-1孵育时间下反应体系的荧光强度变化图 Fig 4 Fluorescence intensity changes of reaction systems with different thiazole orange and 45e-1 incubation time a.u.: Arbitrary unit. |
2.2.3 STX与45e-1的孵育时间
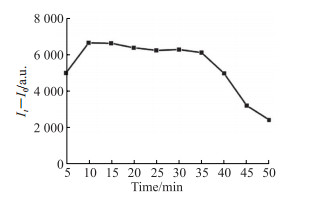
当45e-1与STX作用10 min时体系达到饱和,荧光强度趋于稳定(图 5)。45e-1与STX的孵育时间>35 min后反应体系的稳定性变差,样品荧光强度开始降低,荧光强度变化随之减小。
|
图 5 不同45e-1与STX孵育时间下反应体系的荧光强度变化 Fig 5 Fluorescence intensity changes of reaction systems with different 45e-1 and STX incubation time It-I0: The difference in fluorescence intensity between reaction systems with different incubation time and blank samples; STX: Saxitoxin; a.u.: Arbitrary unit. |
2.2.4 阳离子浓度的优化
当Mg2+的浓度为2.5、5、7.5 mmol/L时体系的荧光强度分别为7 816±114、1 036±171、5 555±307(n=3);而K+浓度为5、7.5、10 mmol/L时体系的荧光强度随着浓度增大而减小,荧光强度分别为7 883±47、3 390±346、245±20(n=3)。
2.3 方法学验证的实验结果 2.3.1 专属性分析50 nmol/L的STX、河豚毒素、岩沙海葵毒素、大田软海绵酸、微囊藻毒素-LR及节球藻毒素溶液与50 nmol/L 45e-1混合体系的荧光强度分别为8 115±136、1 070±73、633±99、1 227±33、600±82、1 506±14(n=3),STX与其他5种毒素的荧光强度相比差异均有统计学意义(均P<0.01)。
2.3.2 线性范围与检测限分析基于实验条件优化的结果,根据1.3节方法分别测定不同浓度STX存在时体系的荧光强度,其线性范围为3.12~50 nmol/L,拟合线性方程为Y=3 639.8X+2 341.5(R2=0.972 5,n=3),其中X为STX浓度(nmol/L)的常用对数(图 6)。按照检测限=3.3δ/S公式[18],式中δ为10个空白样品的荧光强度偏差(即735),S为标准曲线的斜率(即3 639.8),计算得该适配体传感器的检测限为0.67 nmol/L,与既往不同荧光适配体传感器线性范围与检测限的对比结果见表 1。

|
图 6 STX浓度与反应体系荧光强度的关系图 Fig 6 Relationships between STX concentration and fluorescence intensity of reaction systems A: Fluorescence spectra of STX at different concentrations; B: Linear relationship between Ic-I0 and STX concentrations. Ic-I0: The difference in fluorescence intensity between reaction systems with different STX concentrations and blank samples; STX: Saxitoxin; a.u.: Arbitrary unit. |
|
|
表 1 不同荧光适配体传感器检测STX的对比结果 Tab 1 Comparison of different fluorescent aptasensors for STX detection |
2.3.3 回收率实验
STX添加浓度为10、20、30 nmol/L时STX实测浓度分别为(9.07±0.99)、(21.74±1.55)、(32.31±2.95)nmol/L,回收率分别为(90.7±10.9)%、(108.7±7.1)%和(107.7±9.1)%(n=3)。
3 讨论 3.1 原理验证圆二色光谱在测定二级结构及折叠特性方面有重要作用[23],因此本研究使用圆二色光谱技术进行构象变化的验证。45e-1经过变复性后在阳离子的诱导下自身部分形成了平行G-四链体。随着STX的加入,45e-1与STX发生相互作用,265 nm波长处的峰强度得到增强可能是由于形成了更多的平行G-四链体。加入噻唑橙后,G-四链体复合物的构象并未发生太大变化,说明噻唑橙不会破坏复合物的G-四链体结构。峰位的细微变化可能是由于噻唑橙与G-四链体小凹槽结合导致DNA水合层发生变化,影响了DNA的螺旋性,然而小型沟槽结合剂并不会显著扰乱复合物的圆二色光谱[24],此结果说明STX与噻唑橙之间未形成竞争关系,即45e-1与STX和噻唑橙可能形成复合物并达到三者共存的状态。
为了进一步验证噻唑橙能否与G-四链体复合物共存,用生物膜干涉技术进行结合竞争实验以考察噻唑橙与STX之间是否存在结合位点的竞争关系。用超级链霉亲和素生物传感器在溶液中先饱和结合含5’端生物素修饰的45e-1,然后再通过4组实验进行结合位点的竞争考察。自反应组与实验组2的响应值比值仅为1.60%,证明45e-1与5 μmol/LSTX已饱和结合,不会干扰后续复合物与噻唑橙竞争结合的结果;实验组1与实验组2的响应值比值为95.47%,说明STX与噻唑橙之间几乎没有竞争关系,即它们各自与45e-1的不同位点进行结合。以上结果表明45e-1与STX和噻唑橙在反应体系中能够达到三者共存的状态。
3.2 反应条件优化在水溶液中噻唑橙主要以单体的形式存在,不能检测到荧光信号,而与G-四链体相互作用时,噻唑橙与其小凹槽结合会产生荧光增强效应,荧光强度随着浓度比的增大而增强;当噻唑橙的浓度过高时,噻唑橙分子倾向形成二聚体或三聚体,无法插入到45e-1的结构中,造成体系的荧光增强效应降低[25]。所以本实验选择5∶1作为噻唑橙与45e-1的最佳摩尔浓度比。
在最佳摩尔浓度比的条件下继续考察反应时间对检测结果的影响。噻唑橙与45e-1孵育2 min便可达到饱和且不再受时间的影响。45e-1与STX作用10 min时达到饱和,荧光强度趋于稳定,当孵育时间>35 min时复合物稳定性变差,样品荧光强度开始降低,荧光强度变化随之减小,因此选择10 min为适配体45e-1与STX的最佳孵育时间。最终,本适配体传感器的实验操作与反应时间仅需15 min便可完成对毒素的检测。
据报道金属阳离子也可以影响G-四链体构象的形成[26],从而影响反应的进行。在不同Mg2+和K+浓度的影响下传感器的荧光强度不同,可能是因为阳离子浓度的增加会加快诱导45e-1的构象变化,导致适配体与STX诱导结合产生的构象变化减小。本研究结果表明,当Mg2+的浓度为2.5 mmol/L且K+的浓度为5 mmol/L时荧光强度达到峰值,因此选择2.5 mmol/L Mg2+及5 mmol/L K+为最佳阳离子浓度。
3.3 方法学验证为了评价适配体传感器对STX的特异性,本适配体传感器对STX和其他5种海洋毒素进行了高浓度检测。结果表明本适配体传感器检测STX的荧光强度远远高于其他5种毒素,具有非常好的特异性,对其他常见海洋毒素的交叉反应可以忽略。
在最佳实验条件下,检测范围为3.12~50 nmol/L时本适配体传感器可实现良好的线性检测,灵敏度高于绝大多数荧光适配体传感器。相较于其他荧光传感器,本传感器不需要对适配体进行荧光标记[10],也不必借助高温辅助反应[19],更不用通过核酸酶辅助信号放大[22],仅通过构象变化即能达到高灵敏度检测STX的目的。
最后为了验证本适配体传感器的可靠性,将其应用于检测海水中的STX。在优化的检测条件和样品预处理条件下测定10、20、30 nmol/L 3个添加水平的浓度,并与加标值进行比较,回收率实验结果表明海水对本适配体传感器响应的干扰不显著,且本适配体传感器重复性良好。因此,本适配体传感器的操作简便性与成本低于其他荧光传感器,具有较大的潜力应用于实际样品中STX的快速检测。
综上所述,本研究成功建立了一种灵敏、快速、无标记的非标记型适配体传感器用于STX的快速检测,具有良好的特异性和重现性。噻唑橙是由2个不同的杂环亚基组成并通过1个或几个桥联的次甲基键连接的一种不对称花菁染料。在水溶液中由于分子内围绕次甲基键扭曲运动,噻唑橙通常表现出可忽略的荧光,这导致其激发态快速非辐射衰变;当噻唑橙与G-四链体小凹槽结合后,连接杂环不同片段的键周围的扭转运动受到限制,导致扭曲段之间实现了平面性,最终使荧光得到明显增强[27]。因此噻唑橙可以作为荧光探针灵敏地识别含有G-四链体结构的核酸[20],经过变性的直链适配体45e-1受STX诱导结合产生了构象变化,该变化可通过荧光探针噻唑橙的荧光强度进行表征。在一定范围内,随着STX浓度增大荧光强度变化呈现良好的线性关系。相较于其他的适配体传感器,本适配体传感器可绿色、经济、快速、灵敏和高选择性地检测STX,有望应用于实际样品中STX的快速检测。
| [1] |
KIBLER S R, LITAKER R W, MATWEYOU J A, et al. Paralytic shellfish poisoning toxins in butter clams (Saxidomus gigantea) from the Kodiak Archipelago, Alaska[J]. Harmful Algae, 2022, 111: 102165. DOI:10.1016/j.hal.2021.102165 |
| [2] |
TAN K, SUN Y, ZHANG H, et al. Effects of harmful algal blooms on the physiological, immunity and resistance to environmental stress of bivalves: special focus on paralytic shellfish poisoning and diarrhetic shellfish poisoning[J]. Aquaculture, 2023, 563: 739000. DOI:10.1016/j.aquaculture.2022.739000 |
| [3] |
KNAACK J S, PORTER K A, JACOB J T, et al. Case diagnosis and characterization of suspected paralytic shellfish poisoning in Alaska[J]. Harmful Algae, 2016, 57(Pt B): 45-50. DOI:10.1016/j.hal.2016.03.006 |
| [4] |
ELLINGTON A D, SZOSTAK J W. In vitro selection of RNA molecules that bind specific ligands[J]. Nature, 1990, 346(6287): 818-822. DOI:10.1038/346818a0 |
| [5] |
TUERK C, GOLD L. Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase[J]. Science, 1990, 249(4968): 505-510. DOI:10.1126/science.2200121 |
| [6] |
PARK K S. Nucleic acid aptamer-based methods for diagnosis of infections[J]. Biosens Bioelectron, 2018, 102: 179-188. DOI:10.1016/j.bios.2017.11.028 |
| [7] |
GUO W, ZHANG C, MA T, et al. Advances in aptamer screening and aptasensors' detection of heavy metal ions[J]. J Nanobiotechnology, 2021, 19(1): 166. DOI:10.1186/s12951-021-00914-4 |
| [8] |
YANG C, BIE J, ZHANG X, et al. A label-free aptasensor for the detection of tetracycline based on the luminescence of SYBR Green Ⅰ[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2018, 202: 382-388. DOI:10.1016/j.saa.2018.05.075 |
| [9] |
QIANG L, ZHANG Y, GUO X, et al. A rapid and ultrasensitive colorimetric biosensor based on aptamer functionalized Au nanoparticles for detection of saxitoxin[J]. RSC Adv, 2020, 10(26): 15293-15298. DOI:10.1039/d0ra01231a |
| [10] |
DOU X, XU S, JIANG Y, et al. Aptamers-functionalized nanoscale MOFs for saxitoxin and tetrodotoxin sensing in sea foods through FRET[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2023, 284: 121827. DOI:10.1016/j.saa.2022.121827 |
| [11] |
NOUREEN B, ULLAH N, TIAN Y, et al. An electrochemical PAH-modified aptasensor for the label-free and highly-sensitive detection of saxitoxin[J]. Talanta, 2022, 240: 123185. DOI:10.1016/j.talanta.2021.123185 |
| [12] |
HANDY S M, YAKES B J, DEGRASSE J A, et al. First report of the use of a saxitoxin-protein conjugate to develop a DNA aptamer to a small molecule toxin[J]. Toxicon, 2013, 61: 30-37. DOI:10.1016/j.toxicon.2012.10.015 |
| [13] |
ZHENG X, HU B, GAO S X, et al. A saxitoxin-binding aptamer with higher affinity and inhibitory activity optimized by rational site-directed mutagenesis and truncation[J]. Toxicon, 2015, 101: 41-47. DOI:10.1016/j.toxicon.2015.04.017 |
| [14] |
ZHOU R, GAO Y, YANG C, et al. A novel SELEX based on immobilizing libraries enables screening of saxitoxin aptamers for BLI aptasensor applications[J]. Toxins (Basel), 2022, 14(3): 228. DOI:10.3390/toxins14030228 |
| [15] |
ALANINE D G W, QUINKERT D, KUMARASINGHA R, et al. Human antibodies that slow erythrocyte invasion potentiate malaria-neutralizing antibodies[J]. Cell, 2019, 178(1): 216-228.e21. DOI:10.1016/j.cell.2019.05.025 |
| [16] |
WU Y, LI S, DU L, et al. Neutralization of Zika virus by germline-like human monoclonal antibodies targeting cryptic epitopes on envelope domain Ⅲ[J]. Emerg Microbes Infect, 2017, 6(10): e89. DOI:10.1038/emi.2017.79 |
| [17] |
VORLÍČKOVÁ M, KEJNOVSKÁ I, SAGI J, et al. Circular dichroism and guanine quadruplexes[J]. Methods, 2012, 57(1): 64-75. DOI:10.1016/j.ymeth.2012.03.011 |
| [18] |
ZHAO L, GUO H, CHEN H, et al. A rapid and sensitive aptamer-based biosensor for amnesic shellfish toxin domoic acid[J]. Bioengineering (Basel), 2022, 9(11): 684. DOI:10.3390/bioengineering9110684 |
| [19] |
CHENG S, ZHENG B, YAO D, et al. Study of the binding way between saxitoxin and its aptamer and a fluorescent aptasensor for detection of saxitoxin[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2018, 204: 180-187. DOI:10.1016/j.saa.2018.06.036 |
| [20] |
PAN L, HUANG Y, WEN C, et al. Label-free fluorescence probe based on structure-switching aptamer for the detection of interferon gamma[J]. Analyst, 2013, 138(22): 6811-6816. DOI:10.1039/c3an01275a |
| [21] |
GU H, DUAN N, XIA Y, et al. Magnetic separation-based multiple SELEX for effectively selecting aptamers against saxitoxin, domoic acid, and tetrodotoxin[J]. J Agric Food Chem, 2018, 66(37): 9801-9809. DOI:10.1021/acs.jafc.8b02771 |
| [22] |
GU H, HAO L, YE H, et al. Nuclease-assisted target recycling signal amplification strategy for graphene quantum dot-based fluorescent detection of marine biotoxins[J]. Mikrochim Acta, 2021, 188(4): 118. DOI:10.1007/s00604-020-04684-y |
| [23] |
GREENFIELD N J. Using circular dichroism spectra to estimate protein secondary structure[J]. Nat Protoc, 2006, 1(6): 2876-2890. DOI:10.1038/nprot.2006.202 |
| [24] |
HUSAIN M A, YASEEN Z, REHMAN S U, et al. Naproxen intercalates with DNA and causes photocleavage through ROS generation[J]. FEBS J, 2013, 280(24): 6569-6580. DOI:10.1111/febs.12558 |
| [25] |
CHOUDHURY S D, BHASIKUTTAN A C, PAL H, et al. Surfactant-induced aggregation patterns of thiazole orange: a photophysical study[J]. Langmuir, 2011, 27(20): 12312-12321. DOI:10.1021/la202414h |
| [26] |
NISHIO M, TSUKAKOSHI K, IKEBUKURO K. G-quadruplex: flexible conformational changes by cations, pH, crowding and its applications to biosensing[J]. Biosens Bioelectron, 2021, 178: 113030. DOI:10.1016/j.bios.2021.113030 |
| [27] |
SUSS O, MOTIEI L, MARGULIES D. Broad applications of thiazole orange in fluorescent sensing of biomolecules and ions[J]. Molecules, 2021, 26(9): 2828. DOI:10.3390/molecules26092828 |
 2024, Vol. 45
2024, Vol. 45


