肝癌起病隐匿,以手术切除为主的综合治疗是肝癌的首选治疗方法,但是大部分患者在确诊时已发展至肝癌中晚期,失去了手术治疗机会。WHO国际癌症研究机构发布的2020年全球最新癌症负担数据显示,全球新确诊肝癌人数超过90万,因肝癌死亡人数超过83万,死亡人数接近新发病人数;中国新发肝癌病例约41万例,位居癌症发病率第5位,死亡病例约39万例,高居癌症死亡率第2位[1]。肝癌的发病率稍低但死亡率偏高,这提示肝癌的治疗效果和预后相对较差[2]。因此,肝癌患者急需安全、有效的抗癌新技术以延长生存时间和提高生活质量。
三氧化二砷(arsenic trioxide,ATO)是一种无机化合物,化学式为As2O3,有剧毒,无臭、无味,为白色霜状粉末,是砒霜的主要成分。作为一种传统中医药,砒霜味辛、酸,性热,归肺、脾、胃、大肠经,具有蚀疮去腐、杀虫、劫痰、截疟之功效。现代医学研究发现,ATO联合全反式维甲酸可将急性早幼粒白血病患者的无病生存率提高至95%以上,达到基本治愈标准[3]。在胰腺导管腺癌中,ATO可以通过靶向肽基脯氨酰基顺反异构酶NIMA相互作用蛋白1(peptidyl-prolyl cis-trans isomerase NIMA-interacting 1,Pin1)明显抑制癌相关成纤维细胞的增殖,且联合程序性死亡蛋白1抗体治疗可以达到消除胰腺导管腺癌的效果[4]。
本研究利用DepMap和GEPIA数据库探索Pin1在人肝癌细胞系和组织中的表达情况,通过体内外实验检测ATO在肝癌中对Pin1异常激活的抑制作用,并通过RNA测序分析具体的信号通路,为寻找新的肝癌治疗策略提供参考。
1 材料和方法 1.1 DepMap数据库和GEPIA数据库中Pin1表达数据分析统计DepMap数据库23种人肝癌细胞系中Pin1的表达情况,以及GEPIA数据库中肝癌组织和正常肝组织中Pin1的表达情况并绘图。
1.2 细胞培养、传代与质粒转染小鼠肝癌细胞系H22购自中国典型培养物保藏中心,人肝癌细胞系Huh7购自中国科学院上海细胞库。H22细胞在添加10% FBS(货号C04001-500,上海逍鹏生物科技有限公司)的RPMI 1640培养基(货号L210KJ,上海源培生物科技股份有限公司)中培养。Huh7细胞在添加10% FBS的DMEM(货号L110KJ,上海源培生物科技股份有限公司)中培养。所有培养基均含有抗生素-抗真菌素三抗溶液(货号S120JV,上海源培生物科技股份有限公司)。从37 ℃培养箱(型号KBF115,德国BINDER公司)中取出细胞,用显微镜观察细胞形态和状态,去除旧培养基,用生理盐水清洗1次。加入适量胰蛋白酶,于37 ℃培养箱消化3~5 min,在显微镜下观察到细胞悬浮后,加入适量含血清培养基终止消化。随后将细胞转移到无菌离心管中,放入离心机(型号Microfuge 20R,美国Beckman Coulter公司)于140×g离心3 min。弃上清后加入适量培养基吹打混匀,接种在细胞培养皿或培养板中进行实验。当单层贴壁细胞生长密度达到80%~95%时进行细胞传代或给药处理。
1.3 ATP法检测细胞活力使用CellTiter-Glo®发光法细胞活力检测试剂盒(北京普洛麦格生物技术有限公司)进行实验。在96孔白色底透板中每孔接种8 000~10 000个细胞(细胞密度为30%~40%),每孔加培养基100 μL,每组设3个复孔。在第2天每孔加入含不同浓度(0.01、0.05、0.1、0.5、1、3、5 μg/mL)注射用ATO(北京双鹭药业股份有限公司)的培养基继续培养,H22和Huh7细胞均在加药处理48 h开始测量发光信号。室温避光融化CellTiter试剂,将CellTiter试剂和无血清培养基按1∶3的比例配成混合液。吸弃96孔白色底透板中的培养基,用生理盐水清洗1次,然后每孔加入100 μL配好的混合液,轻轻混匀,于37 ℃孵育15 min。使用多功能酶标仪(中国安捷伦科技有限公司)读取发光(全波长)信号值,以未加药孔为对照,各浓度ATO孔的测量值与对照孔测量值的比值即为各浓度ATO孔的细胞活力。
1.4 细胞免疫荧光染色在共聚焦培养小皿中加入适量Huh7细胞,用ATO(1 μg/mL)处理细胞16 h后加入4%中性甲醛溶液固定10 min,用PBS清洗1次;加入适量的0.2% TritonX-100进行样品穿孔,室温放置5 min,用TBS清洗3次;加入封闭液,室温封闭45~60 min;加入Pin1多克隆抗体(货号10495-1-AP,武汉三鹰生物技术有限公司,稀释比例为1∶200)、溶酶体相关膜蛋白1(lysosomal-associated membrane protein 1,LAMP1)多克隆抗体(货号9091S,美国CST公司,稀释比例为1∶200),于4 ℃孵育过夜,TBS清洗3次;加入对应的荧光二抗(货号分别为A11008、A21424,美国Invitrogen公司,稀释比例均为1∶200),于37 ℃避光孵育约1 h,用TBS清洗3次;再用DAPI染核10~15 min,最后用共聚焦荧光显微镜(德国Leica公司)进行观察和拍照。
1.5 蛋白质印迹法检测Huh7细胞用或不用10 μmol/L氯喹预处理3 h后再加入ATO(0.5 μg/mL或1 μg/mL)处理20 h进行检测。Huh7细胞用或不用5 μmol/L Pin1抑制剂sulfopin(别名PIN1-3;货号S9782,美国斯莱克生物科技有限公司)处理48 h进行检测。H22细胞用ATO(0.5 μg/mL或1 μg/mL)处理20 h进行检测。吸弃培养基,加入RIPA强裂解液(上海碧云天生物技术有限公司)与蛋白酶抑制剂、磷酸酶抑制剂(上海陶术生物科技有限公司)混合液(体积比均为100∶1),于冰上超声处理30 s破碎细胞(UP-250型超声仪,上海净信实业发展有限公司;30%强度,3 s/次,间隔1 s),4 ℃、13 201×g离心15 min。使用BCA蛋白定量检测试剂盒并通过多功能酶标仪进行蛋白质定量。根据待检测蛋白质的分子量分别配制10%和12%的SDS-PAGE胶,将胶固定在电泳槽(E260-10A-1.0型电泳仪,江苏博美达生命科学有限公司)中并倒入Tris-甘氨酸电泳缓冲液,当蛋白质样品分离至SDS-PAGE胶底部时结束电泳。用湿转法(VE-186型转膜仪,上海天能科技有限公司)、3M滤纸、NC膜转膜80 min。转膜结束后,用5%牛血清白蛋白溶液室温封闭NC膜1 h。用TBST清洗NC膜3次,每次5 min。加入用5%牛血清白蛋白溶液稀释的Pin1多克隆抗体(货号10495-1-AP,武汉三鹰生物技术有限公司,稀释比例为1∶1 000)、β-连环素多克隆抗体(货号8480,美国CST公司,稀释比例为1∶1 000)、GAPDH多克隆抗体(货号AC002,武汉爱博泰克生物科技有限公司,稀释比例为1∶1 000)、β-肌动蛋白多克隆抗体(货号AC026,武汉爱博泰克生物科技有限公司,稀释比例为1∶1 000),于4 ℃过夜孵育。第2天用TBST清洗3次,每次5 min。然后加入用5%牛血清白蛋白溶液稀释的荧光二抗(货号分别为D28802-25、D20621-05,北京安诺伦生物科技有限公司,稀释比例为1∶5 000),室温避光孵育1 h,用TBST清洗3次,每次5 min。最后用Odyssey光扫描仪(北京安诺伦生物科技有限公司)进行图像扫描。
1.6 qPCR检测Huh7细胞用或不用ATO(0.5 μg/mL或1 μg/mL)处理20 h或5 μmol/L PIN1-3处理48 h后进行检测。H22细胞用ATO(0.5 μg/mL或1 μg/mL)处理20 h后进行检测。吸弃培养基,加适量生理盐水清洗1次,采用TRIzol法提取总RNA,使用NanoDrop 2000超微量分光光度计(美国ThermoFisher Scientific公司)测量RNA浓度。用R223-01反转录试剂盒(南京诺唯赞生物科技股份有限公司)合成cDNA,将cDNA用ddH2O稀释10倍。将稀释好的cDNA、引物[生工生物工程(上海)股份有限公司]和SYBR Green试剂(货号70871300,瑞士Roche公司)按比例混合成10 μL体系(384孔板),每个样品设3个复孔,使用PCR仪(LightCycler® 384孔,瑞士Roche公司)进行扩增。人Pin1正向引物序列为5’-ACAGTTCAGCGACTGCAGCTCA-3’,反向引物序列为5’-GCAGCGCAAACGAGGCGTCTT-3’;小鼠Pin1正向引物序列为5’-GAGGAAGACTTTGA-ATCTCTGGC-3’,反向引物序列为5’-TGTCCGT-AGAGCAAACGACGCA-3’;人β-连环素正向引物序列为5’-CACAAGCAGAGTGCTGAAGGTG-3’,反向引物序列为5’-GATTCCTGAGAGTCCAAAG-ACAG-3’;内参18S RNA正向引物序列为5’-CG-GCTACCACATCCAAGGAA-3’,反向引物序列为5’-GCTGGAATTACCGCGGCT-3’。
1.7 H22细胞皮下荷瘤小鼠模型的构建生理盐水重悬的H22细胞悬液与基质胶按照1∶1的体积比混合后再次重悬,然后接种于6周龄雄性BALB/c小鼠皮下,每只小鼠接种体积为100 μL,接种细胞数量为1×106个。接种后第5~7天观察肿瘤生长情况,第7天将小鼠随机分为两组(n≥5),分别予腹腔注射PBS、ATO(3 mg/kg)处理,每2 d 1次。每2 d测量1次肿瘤体积(计算方法为0.5LW2,其中L为肿瘤最长直径,W为肿瘤最短直径)。第17天用CO2窒息法处死小鼠,然后收取新鲜肿瘤组织备用或采用石蜡包埋制作标本。
1.8 H-E染色收集小鼠肿瘤组织样本进行石蜡包埋(EG1150H型包埋机,德国Leica公司)和切片(RM2245型切片机,德国Leica公司),采用KD-PI型摊片机(金华科迪仪器设备有限公司)、KD-HI型烘片机(金华科迪仪器设备有限公司)对切片进行相应处理后常温保存。在65 ℃电热恒温箱(型号DHP-9272,上海一恒科学仪器有限公司)中烘烤组织切片1 h,然后采用Autostainer XL型全自动染色机(德国Leica公司)进行H-E染色处理。将样本切片置于苏木精染液中染色10 min,用ddH2O洗掉多余苏木精染液,迅速在盐酸乙醇分化液中涮洗2次,用缓慢流动的自来水冲洗返蓝30 min,取出片子后沥干水分,放置在ddH2O中5 min,最后用全自动染色机进行脱水处理。滴加约50 μL中性树脂,取盖玻片封片,放在烘箱中烘烤过夜,干燥后在显微镜下观察染色结果。
1.9 免疫组织化学染色将组织切片在60~65 ℃电热恒温箱中烘烤1 h后,使用全自动染色机进行脱蜡处理。脱蜡后加入3%过氧化氢溶液清洗,然后选择合适的酸性修复或碱性修复方式进行抗原修复。自然冷却到室温后,用ddH2O清洗切片3次,每次5 min,再用PBS(pH=7.4)清洗5 min。用1%牛血清白蛋白溶液于37 ℃封闭30~60 min。吸弃封闭液,滴加Pin1多克隆抗体(货号10495-1-AP,武汉三鹰生物技术有限公司,稀释比例为1∶1 000)、Ki-67多克隆抗体(货号9949,美国CST公司,稀释比例为1∶1 000),每个组织切片约50 μL,于湿盒中4 ℃孵育过夜。第2天室温复温湿盒中的切片15 min,用PBS清洗4次,每次5 min,再滴加相应二抗,于37 ℃孵育30~50 min。PBS同前清洗4次后用DAB溶液(A液与B液的体积比为50∶1)显色至出现明显砖红色为止,显色时间为1~10 min。将切片放进ddH2O中终止反应,再用ddH2O清洗2次,每次5 min。然后将切片置于苏木精染液中复染10 min,用ddH2O洗去多余苏木精染液,迅速在盐酸乙醇分化液中涮洗2次,用自来水流水冲洗返蓝30 min后取出切片,沥干水分,在ddH2O中放置5 min,最后进行脱水处理。滴加中性树脂封片,待彻底干燥后在显微镜下观察染色结果。
1.10 RNA测序分析从ATO处理和未处理的H22细胞样品中分别提取总RNA(1 μg)并去除污染的DNA,按照Poly(A)法构建链特异mRNA文库并合成cDNA文库。测序前使用Agilent 4200型生物分析仪评估cDNA文库的浓度和分布,然后使用Illumina NovaSeq 6000系统进行测序。高通量测序过程完全按照制造商说明书(美国Illumina公司)进行。用Seqtk工具过滤原始reads,使用Hisat2 2.0.4软件定位基因组。使用StringTie 1.3.3b软件对基因片段进行计数。差异表达基因是指错误发现率高于阈值(q<0.05)和差异倍数(fold-change)>2的基因。在联川生物云平台上进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)基因集富集分析。
1.11 统计学处理所有实验重复至少3次。应用SPSS 21.0软件及GraphPad Prism 8.0软件进行统计学分析与绘图。数据以x±s表示,组间比较采用t检验或单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 Pin1在人类肝癌细胞系中的表达对DepMap数据库23种人肝癌细胞系(HEP3B217、JHH7、SNU878、SNU739、SKHEP1、SNU449、JHH4、HLF、SNU182、SNU761、JHH2、JHH5、Huh7、SNU886、PLCPRF5、SNU423、SNU398、HUH1、JHH1、LI7、SNU387、JHH6、SNU475)和GEPIA数据库人肝癌组织中Pin1的表达情况进行分析,结果显示Pin1在肝癌细胞系和肝癌组织中高表达(图 1)。根据数据库和实验条件,选择Pin1表达水平相对较高的Huh7细胞进行后续实验。
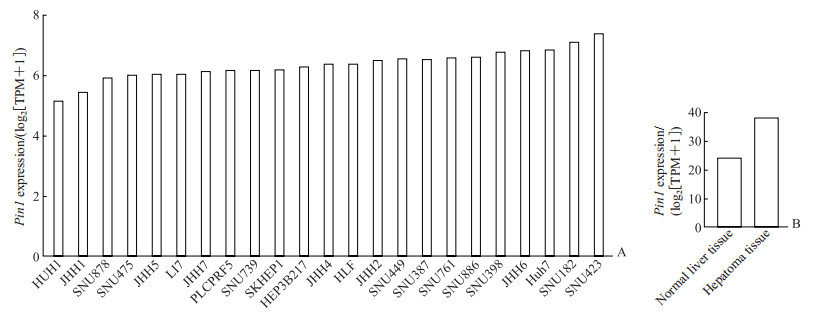
|
图 1 DepMap数据库人肝癌细胞系和GEPIA数据库人肝癌组织中Pin1基因的表达情况 Fig 1 Expression of Pin1 gene in human hepatocellular carcinoma cell lines in DepMap database and human hepatocellular carcinoma tissue in GEPIA database A: Analysis of Pin1 expression in 23 kinds of human hepatocellular carcinoma cell lines from DepMap database; B: Analysis of Pin1 expression in human hepatoma tissue from GEPIA database. Pin1: Peptidyl-prolyl cis-trans isomerase NIMA-interacting 1; TPM: Transcripts per million. |
2.2 ATO在体外对Pin1表达的抑制作用
ATP法检测结果显示,ATO在Huh7和H22细胞中具有明显的细胞毒性,ATO处理后Huh7和H22细胞的细胞活力均降低,IC50分别为1.087 μg/mL和0.245 9 μg/mL(图 2)。

|
图 2 ATP法检测ATO对Huh7和H22细胞活力的影响 Fig 2 Effect of ATO on viability of Huh7 and H22 cells detected by ATP method n=3, x±s. ATP: Adenosine triphosphate; ATO: Arsenic trioxide. |
免疫荧光染色结果显示,ATO处理后Huh7细胞中Pin1的表达降低(图 3A)。蛋白质印迹法检测结果显示,ATO处理后Huh7和H22细胞中Pin1表达均降低(图 3B)。qPCR检测结果显示,ATO处理后Huh7和H22细胞中Pin1在转录水平上表达下调(图 3C)。
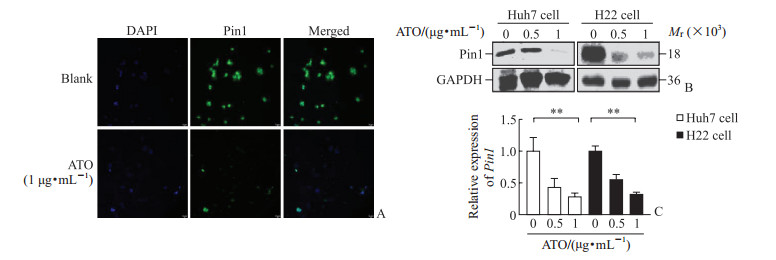
|
图 3 ATO对Huh7和H22细胞中Pin1表达的影响 Fig 3 Effect of ATO on Pin1 expression in Huh7 and H22 cells A: Immunofluorescence diagram of Huh7 cells (200×); B: Western blotting pictures; C: Results of quantitative polymerase chain reaction (**P < 0.01. n=3, x±s). ATO: Arsenic trioxide; Pin1: Peptidyl-prolyl cis-trans isomerase NIMA-interacting 1; DAPI: 4', 6-diamidino-2-phenylindole; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
2.3 ATO可能通过溶酶体途径抑制Pin1表达
预先用氯喹预处理抑制溶酶体途径后,通过蛋白质印迹法检测观察到ATO处理的Huh7细胞中Pin1表达降低被逆转(图 4A)。随后通过免疫荧光染色进行共定位分析,Pin1和LAMP1在Huh7细胞中的分布呈现一定相关性(图 4B),表明ATO可能通过溶酶体途径影响Pin1的表达。
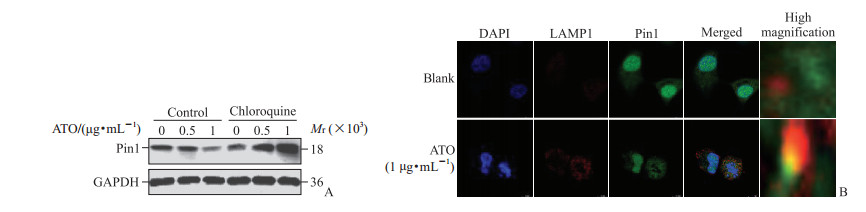
|
图 4 Huh7细胞中氯喹预处理对ATO处理后Pin1表达的影响 Fig 4 Effect of chloroquine pretreatment on expression of Pin1 in Huh7 cells after ATO treatment A: Expression of Pin1 in Huh7 cells detected by Western blotting; B: Co-localization expression of LAMP1 and Pin1 proteins in Huh7 cells detected by immunofluorescence (630× in the left 4 column images and 12 000× in the right 1 column image). Chloroquine is an autophagy lysosome inhibitor. ATO: Arsenic trioxide; Pin1: Peptidyl-prolyl cis-trans isomerase NIMA-interacting 1; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; DAPI: 4', 6-diamidino-2-phenylindole; LAMP1: Lysosomal-associated membrane protein 1. |
2.4 ATO在体内对Pin1表达的抑制作用
用H22细胞对小鼠进行皮下荷瘤造模后,第7天开始腹腔注射ATO(3 mg/kg,每2 d 1次);第17天处死小鼠并取肿瘤组织,观察肿瘤体积发现ATO在体内具有一定抗肿瘤效果(图 5A)。对肿瘤组织进行H-E染色可见肝癌细胞多行排列,核质分布异常,而在ATO干预后肝癌细胞皱缩变圆(图 5B)。免疫组织化学染色结果显示,ATO治疗组小鼠肝癌组织中Pin1阳性染色和Ki-67阳性染色均减少(图 5C)。上述结果说明ATO抑制了肝癌细胞增殖及Pin1表达。
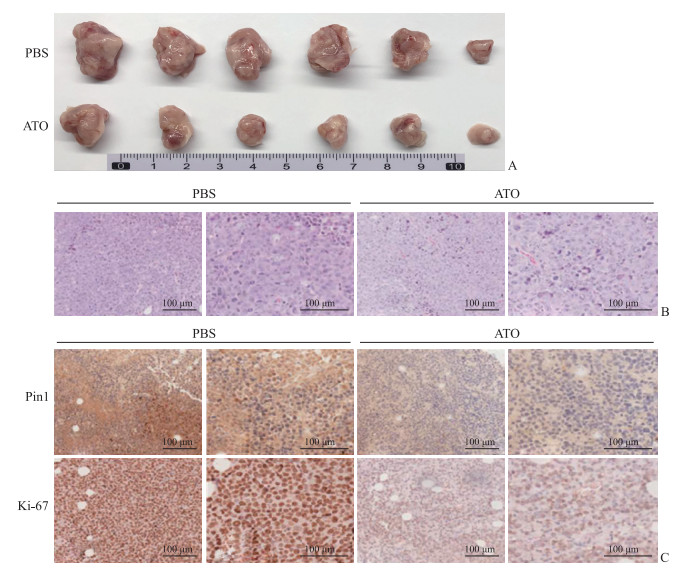
|
图 5 ATO对H22细胞皮下荷瘤小鼠肝癌生长及肿瘤组织中Pin1和Ki-67表达的影响 Fig 5 Effects of ATO on hepatocellular carcinoma growth and Pin1 and Ki-67 expression in tumor tissue of H22 cell subcutaneous tumor-bearing mice A: Therapeutic effect of ATO on tumor growth; B: Hepatocellular carcinoma pathology detected by hematoxylin-eosin staining; C: Expression of Pin1 and Ki-67 in tumor tissue detected by immunohistochemical staining. ATO: Arsenic trioxide; Pin1: Peptidyl-prolyl cis-trans isomerase NIMA-interacting 1; PBS: Phosphate-buffered saline. |
2.5 ATO通过抑制Pin1调节Wnt/β-连环素通路
RNA测序数据的基因集富集分析结果显示,在ATO处理的H22细胞中Wnt/β-连环素通路相关基因显著富集(P=0.030 9,图 6A)。蛋白质印迹法检测结果显示,在ATO处理的Huh7细胞中β-连环素表达降低(图 6B),说明ATO通过抑制Pin1减缓肝癌细胞生长可能与下调Wnt/β-连环素信号通路有关。进一步使用PIN1-3抑制Huh7细胞中Pin1的表达后,检测观察到抑制Pin1对Wnt/β-连环素通路在蛋白质水平有抑制作用(图 6C),但在转录水平没有明显影响(图 6D),这表明抑制Pin1对肝癌生长的影响可能与β-连环素的蛋白质降解有关。

|
图 6 ATO处理和抑制Pin1表达对肝癌细胞Wnt/β-连环素通路的影响 Fig 6 Effects of ATO treatment and inhibiting Pin1 expression on Wnt/β-catenin pathway in hepatocellular carcinoma cells A: Gene set enrichment analysis results showed that Wnt/β-catenin pathway-related genes were significantly enriched in H22 cells after ATO treatment; B: The effect of ATO on β-catenin expression in Huh7 cells detected by Western blotting; C: The effect of PIN1-3on β-catenin expression in Huh7 cells detected by Western blotting; D: The effect of PIN1-3 on β-catenin transcriptional level in Huh7 cells detected by quantitative polymerase chain reaction (n=3, x±s). PIN1-3, also known as sulfopin, is an inhibitor of Pin1. ATO: Arsenic trioxide; Pin1: Peptidyl-prolyl cis-trans isomerase NIMA-interacting 1; PBS: Phosphate-buffered saline; KEGG: Kyoto Encyclopedia of Genes and Genomes. |
3 讨论
Pin1是一种肽基脯氨酰基顺反异构酶,参与调节细胞增殖等多种重要细胞行为学过程。在正常组织和细胞中,Pin1的表达水平随着年龄的增长而下降[5]。然而,Pin1在大多数恶性肿瘤中广泛过表达,其过度激活与临床预后不良密切相关[6-7]。异常高表达的Pin1通过激活包括致癌Kras信号转导通路中多个分子在内的60多种癌蛋白和灭活30多种抑癌因子来促进肿瘤发生[8]。研究发现,敲除Pin1的小鼠对肿瘤有高度的抵抗性,且自身发育正常[9-10]。本研究分析发现,Pin1在肝癌中过度表达,通过ATO降低Pin1在肿瘤细胞中的表达可以抑制肝癌细胞增殖。
ATO在我国中医药领域具有悠久的研究历史,多项研究表明ATO具有抑制肝癌细胞增殖的效果[11-13]。哈佛医学院华人科学家卢坤平教授与周小珍教授等探寻了ATO靶向抑制Pin1治疗胰腺导管腺癌的可能性,结果显示ATO非共价结合Pin1活性位点,直接抑制Pin1蛋白并激发Pin1降解,从而下调Pin1水平,抑制癌细胞生长[4]。在乳腺癌中ATO和全反式维甲酸协同抑制Pin1表达,阻断β-连环素等途径,从而抑制乳腺癌细胞生长[14]。本研究观察到在抗肝癌治疗中,ATO对Pin1在蛋白质水平上有抑制作用,并通过RNA测序数据富集分析发现ATO抑制Pin1可能与Wnt/β-连环素通路有关。
Wnt/β-连环素信号通路是一条进化的高度保守信号通路,参与细胞分化、增殖等多个过程[15]。Pin1与β-连环素相互作用,抑制β-连环素的细胞核输出和蛋白质降解[16]。研究表明,Pin1表达与人食管鳞状细胞癌中的细胞周期蛋白D1表达呈正相关,且通过调节Wnt/β-连环素通路促进肿瘤发生[17]。在肝癌中Wnt/β-连环素信号通路往往过度激活[18]。本实验结果显示,ATO可能通过溶酶体途径抑制Pin1表达,并且抑制Wnt/β-连环素信号通路。
本研究结果表明,ATO在肝癌中通过溶酶体途径抑制Pin1表达,并且下调Wnt/β-连环素通路。在肝癌临床治疗中,对于Pin1异常激活和Wnt/β-连环素信号通路过度活跃的患者ATO不失为一种潜在的治疗方案。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
LLOVET J M, KELLEY R K, VILLANUEVA A, et al. Hepatocellular carcinoma[J]. Nat Rev Dis Primers, 2021, 7(1): 6. DOI:10.1038/s41572-020-00240-3 |
| [3] |
DE THÉ H, PANDOLFI P P, CHEN Z. Acute promyelocytic leukemia: a paradigm for oncoprotein-targeted cure[J]. Cancer Cell, 2017, 32(5): 552-560. DOI:10.1016/j.ccell.2017.10.002 |
| [4] |
KOIKAWA K, KIBE S, SUIZU F, et al. Targeting Pin1 renders pancreatic cancer eradicable by synergizing with immunochemotherapy[J]. Cell, 2021, 184(18): 4753-4771.e27. DOI:10.1016/j.cell.2021.07.020 |
| [5] |
SAEGUSA M, HASHIMURA M, KUWATA T. Pin1 acts as a modulator of cell proliferation through alteration in NF-κB but not β-catenin/TCF4 signalling in a subset of endometrial carcinoma cells[J]. J Pathol, 2010, 222(4): 410-420. DOI:10.1002/path.2773 |
| [6] |
LU Z, HUNTER T. Prolyl isomerase Pin1 in cancer[J]. Cell Res, 2014, 24(9): 1033-1049. DOI:10.1038/cr.2014.109 |
| [7] |
SHINODA K, KUBOKI S, SHIMIZU H, et al. Pin1 facilitates NF-κB activation and promotes tumour progression in human hepatocellular carcinoma[J]. Br J Cancer, 2015, 113(9): 1323-1331. DOI:10.1038/bjc.2015.272 |
| [8] |
ZHOU X Z, LU K P. The isomerase PIN1 controls numerous cancer-driving pathways and is a unique drug target[J]. Nat Rev Cancer, 2016, 16(7): 463-478. DOI:10.1038/nrc.2016.49 |
| [9] |
GIRARDINI J E, NAPOLI M, PIAZZA S, et al. A Pin1/mutant p53 axis promotes aggressiveness in breast cancer[J]. Cancer Cell, 2011, 20(1): 79-91. DOI:10.1016/j.ccr.2011.06.004 |
| [10] |
LIOU Y C, RYO A, HUANG H K, et al. Loss of Pin1 function in the mouse causes phenotypes resembling cyclin D1-null phenotypes[J]. Proc Natl Acad Sci USA, 2002, 99(3): 1335-1340. DOI:10.1073/pnas.032404099 |
| [11] |
KITO M, AKAO Y, OHISHI N, et al. Arsenic trioxide-induced apoptosis and its enhancement by buthionine sulfoximine in hepatocellular carcinoma cell lines[J]. Biochem Biophys Res Commun, 2002, 291(4): 861-867. DOI:10.1006/bbrc.2002.6525 |
| [12] |
JIANG H, MA Y, CHEN X, et al. Genistein synergizes with arsenic trioxide to suppress human hepatocellular carcinoma[J]. Cancer Sci, 2010, 101(4): 975-983. DOI:10.1111/j.1349-7006.2009.01464.x |
| [13] |
CAI X, YU L, CHEN Z, et al. Arsenic trioxide-induced upregulation of miR-1294 suppresses tumor growth in hepatocellular carcinoma by targeting TEAD1 and PIM1[J]. Cancer Biomark, 2020, 28(2): 221-230. DOI:10.3233/CBM-190490 |
| [14] |
KOZONO S, LIN Y M, SEO H S, et al. Arsenic targets Pin1 and cooperates with retinoic acid to inhibit cancer-driving pathways and tumor-initiating cells[J]. Nat Commun, 2018, 9(1): 3069. DOI:10.1038/s41467-018-05402-2 |
| [15] |
ZHANG Y, WANG X. Targeting the Wnt/β-catenin signaling pathway in cancer[J]. J Hematol Oncol, 2020, 13(1): 165. DOI:10.1186/s13045-020-00990-3 |
| [16] |
RYO A, NAKAMURA M, WULF G, et al. Pin1 regulates turnover and subcellular localization of β-catenin by inhibiting its interaction with APC[J]. Nat Cell Biol, 2001, 3(9): 793-801. DOI:10.1038/ncb0901-793 |
| [17] |
FUKUCHI M, FUKAI Y, KIMURA H, et al. Prolyl isomerase Pin1 expression predicts prognosis in patients with esophageal squamous cell carcinoma and correlates with cyclinD1 expression[J]. Int J Oncol, 2006, 29(2): 329-334. |
| [18] |
MANI S K K, ZHANG H, DIAB A, et al. EpCAM-regulated intramembrane proteolysis induces a cancer stem cell-like gene signature in hepatitis B virus-infected hepatocytes[J]. J Hepatol, 2016, 65(5): 888-898. DOI:10.1016/j.jhep.2016.05.022 |
 2024, Vol. 45
2024, Vol. 45


