2. 保定市第一医院血液内科,保定 071000
2. Department of Hematology, Baoding No. 1 Hospital, Baoding 071000, Hebei, China
骨髓增殖性肿瘤起源于多能造血干细胞,是分化相对成熟的一系或多系骨髓造血细胞异常性克隆增殖的一组肿瘤性疾病,原发性骨髓纤维化(primary myelofibrosis,PMF)是其中的一种。临床上大多数PMF患者生活质量低、生存期短,且对羟基脲、α干扰素等治疗药物反应不佳[1],目前仅有异基因造血干细胞移植方法能根治高危组PMF[2],但由于年龄、体能状况、供者等各种局限,大多数患者只能给予姑息性治疗[3]。研究人员也在积极探索PMF的发病机制以进一步改善其诊疗效果。
血管新生在肿瘤发生、发展中起重要作用,其不仅对实体瘤有重要作用[4],而且对血液系统恶性肿瘤的作用也不可忽视[5-6]。研究表明骨髓增殖性肿瘤患者的血管新生增加[7-8]。
外泌体是一种由细胞分泌的微小膜泡,直径为30~150 nm,可将所携带的蛋白质、脂质和RNA等生物分子传递至靶细胞而发挥作用。近年来,有研究表明外泌体在骨髓增殖性肿瘤的发生、发展中发挥不可忽视的作用[9-10]。
骨髓增殖性肿瘤多存在基因突变并通过激活Janus激酶(Janus kinase,JAK)-信号转导及转录活化因子(signal transducer and activator of transcription,STAT)通路发挥作用[11-13]。新型靶向药物JAK抑制剂可通过阻止JAK-STAT信号通路的活化产生临床疗效。芦可替尼(ruxolitinib)作为JAK1/JAK2抑制剂,具有改善临床症状、缩小脾脏和延长生存期等疗效[14],已成为临床上中高危组PMF患者的首选治疗方法。研究表明,新诊断的骨髓增殖性肿瘤患者中血管新生相关指标与JAK2 V617F等位基因突变负荷相关,芦可替尼可抑制JAK2 V617F突变细胞中磷酸化JAK2的表达及血管新生[15]。
目前外泌体与骨髓增殖性肿瘤的相关研究较少,特别是与PMF的相关研究鲜见报道。对于骨髓源性外泌体能否通过血管新生机制促进PMF的发生、发展,以及芦可替尼能否通过骨髓源性外泌体抑制血管新生从而抑制PMF的发生、发展尚未见研究报道。本研究提取了PMF患者骨髓液的外泌体,检测外泌体中促血管新生相关因子的水平,并将外泌体与人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)共培养后检测细胞中的侵袭增殖相关因子水平及血管新生功能,以明确芦可替尼能否在外泌体层面抑制血管新生从而对PMF患者治疗起到作用。
1 材料和方法 1.1 细胞、仪器与试剂HUVEC购自中国科学院上海生命科学研究院。JEM-1230型透射电子显微镜(日本JEOL公司),LightCycler 480Ⅱ型实时定量PCR仪(瑞士Roche公司),基因扩增仪(美国Applied Biosystems公司),流式细胞仪(美国BD公司)。DMEM、FBS、胰蛋白酶(美国Gibco公司),PBS(以色列BI公司),总RNA提取试剂RNAex、AceQ® qPCR SYBR®高特异性染料法qPCR检测试剂盒、HiScript® Ⅲ qPCR专用反转录预混液(去基因组)(日本TaKaRa公司),引物[生工生物工程(上海)股份有限公司],蛋白质印迹法相关试剂、CCK-8试剂盒、细胞周期检测试剂盒(日本DOJINDO公司),鼠抗人CD9、CD63、CD81单克隆抗体(英国Abcam公司),鼠抗人血管内皮生长因子(vascular endothelial growth factor,VEGF)、基质金属蛋白酶(matrix metalloproteinase,MMP)-9、局部黏着斑激酶(focal adhesion kinase,FAK)单克隆抗体(美国Santa Cruz公司),兔抗人VEGF受体1(VEGF receptor 1,VEGFR1)、低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)单克隆抗体(英国Abcam公司),鼠抗人环氧合酶-2(cyclooxygenase-2,COX-2)、MMP-2、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单克隆抗体(英国Abcam公司),鼠抗人β-肌动蛋白单克隆抗体(英国Abcam公司),羊抗鼠IgG、羊抗兔IgG(美国SeraCare公司)。
1.2 研究对象与分组采集来自深圳市龙华区中心医院及保定市第一医院3例初诊PMF患者治疗前(初诊组)及芦可替尼治疗3个月后(芦可替尼组)的骨髓液,并采集3例原发免疫性血小板减少症患者(对照组)的骨髓液,提取外泌体。将HUVEC分别与各组的骨髓源性外泌体共培养。本研究通过深圳市龙华区中心医院伦理委员会审批(2021-019-02)。
1.3 外泌体的提取与观察鉴定室温下将骨髓液标本于1 500×g离心20 min获得少血小板血浆,然后室温下于13 000×g离心2 min获得无血小板血浆。将无血小板血浆在4 ℃ 16 000×g离心45 min,弃上清,用PBS重悬外泌体沉淀后立即进行实验或短时间内储存于4 ℃冰箱备用。用戊二酸固定约米粒大小的外泌体沉淀,进行脱水、包埋、聚合等处理后,用超薄切片机切片并染色。采用透射电子显微镜观察外泌体的大小及形态。采用蛋白质印迹法测定外泌体标志物CD9、CD63、CD81及外泌体中促血管新生相关因子VEGF、VEGFR1、HIF-1α、COX-2的表达水平。
1.4 细胞培养HUVEC用含1%青霉素-链霉素双抗、10% FBS的DMEM在37 ℃、5% CO2条件下的细胞培养箱内培养。细胞铺满80%~90%时进行传代,弃原培养基,用PBS洗涤后加入0.25%胰蛋白酶,置于培养箱中消化1~2 min,待细胞面呈布纹孔状时沿细胞表面加入适量培养基结束消化,离心,重悬细胞沉淀,按合适比例分瓶培养。
1.5 蛋白质印迹法收集外泌体沉淀或与外泌体共培养的HUVEC,加入配制好的裂解液,冰上裂解30 min,离心并收集上清液,按说明书要求配制BCA工作液并测定蛋白质浓度。分别配制SDS-PAGE分离胶和浓缩胶进行凝胶电泳,转膜封闭后分别加入CD9、CD63、CD81、VEGF、VEGFR1、HIF-1α、COX-2、MMP-2、MMP-9、FAK、PCNA和β-肌动蛋白抗体(稀释比例均为1∶1 000),4 ℃孵育过夜;洗膜后加入相应二抗(稀释比例均为1∶5 000),洗膜,扫膜采集图像,使用ImageJ软件分析蛋白质条带灰度值。
1.6 HUVEC增殖能力的检测HUVEC经消化、离心、计数后以5×104/mL接种于96孔板,每孔100 μL,分别加入以上3组患者来源的外泌体,并使外泌体终浓度为10 μg/mL。于培养箱中,将外泌体与HUVEC共培养24 h后,加入CCK-8试剂孵育2 h,检测HUVEC的增殖活力。
1.7 HUVEC细胞周期的检测将外泌体(外泌体终浓度为10 μg/mL)与1×105~1×106/孔的HUVEC在6孔板共培养24 h后,于1 000×g离心5 min收集细胞沉淀;然后用预冷的70%乙醇轻轻混匀,4 ℃固定过夜,1 000×g离心2次、每次5 min,弃上清。根据说明书配制PI染色液,每管细胞样品中加入适量PI染色液,37 ℃避光孵育30 min,5 h内采用流式细胞仪在激发波长488 nm检测红色荧光,同时检测光散射情况。采用ModFit LT 5.0软件进行细胞周期分析。
1.8 HUVEC血管新生能力的检测 1.8.1 划痕实验将HUVEC接种到6孔板,细胞总数为5×105/孔,于培养箱中过夜培养。分别加入各组外泌体(外泌体终浓度为10 μg/mL)后做垂直划痕,用倒置显微镜观察划痕区域并拍照。放入培养箱继续培养24 h,再次在显微镜下观察划痕并拍照。采用ImageJ软件测量划痕面积并计算划痕愈合率:划痕愈合率(%)=(迁移前划痕面积-迁移后划痕面积)/迁移前划痕面积×100%。
1.8.2 侵袭实验于冰上4 ℃过夜融化基质胶,按说明书吸取稀释后的基质胶垂直加入Transwell上室中,放入培养箱中孵育3 h使基质胶聚合成薄膜。弃上清液,在每孔中加入DMEM基础培养基后,于培养箱中放置30 min水化基底膜。常规培养HUVEC,待细胞汇合度达70%~80%时进行消化,离心后弃上清液,重悬细胞,并调整细胞密度为5×104/孔。在24孔板加入完全培养基,将Transwell小室置于24孔板内。在Transwell上室中加入细胞悬液及各组外泌体(外泌体终浓度50 μg/mL),培养24 h。在24孔板加入4%多聚甲醛溶液固定20~30 min,弃去固定液,用PBS洗涤。加入0.1%结晶紫染液染色5~10 min,用PBS洗涤3次,将Transwell上室上表面的染料擦掉,适当风干后随机选取5个视野观察细胞并计数。
1.9 HUVEC侵袭增殖相关因子的检测以5×104/mL的密度接种HUVEC后加入外泌体,使外泌体的终浓度为10 µg/mL,共培养24 h后,采用qPCR分析细胞中侵袭增殖相关因子MMP-2、MMP-9、FAK、PCNA mRNA的表达水平。每1×106~2×107个细胞加入1 mL RNAex,混匀后室温静置;加入1/5 RNAex体积的氯仿,室温静置离心,吸取上清液转移至新的离心管;加入1/2 RNAex体积的异丙醇,室温静置,离心后弃上清液;加入与RNAex等体积的80%乙醇,离心后弃上清液。干燥沉淀,向离心管中加入适量的无RNA酶水溶解RNA,于-80 ℃保存。使用紫外分光光度计测定RNA浓度和纯度。按说明书反转录合成cDNA,然后通过qPCR进行基因扩增。GAPDH正向引物序列为5’-GACTTCAACAGCGACACCCACTC-3’,反向引物序列为5’-CCCAGCCACATACCAGGAA-ATGAG-3’;MMP-2正向引物序列为5’-TCTCCA-GTCCTTCTCCAACCTTCC-3’,反向引物序列为5’-CCCAAACCCACCCAGAAACATCC-3’;MMP-9正向引物序列为5’-TCCTCTTATGCCTGCCTGTC-TCC-3’,反向引物序列为5’-CTTGGTCCACCTG-GTTCAACTCAC-3’;FAK正向引物序列为5’-TTC-CCTCCTTCCTCCTTTCCTTCC-3’,反向引物序列为5’-CTTGTCCATGTGCCTGCCAGTC-3’;PCNA正向引物序列为5’-GCGTAGCAGAGTGG-TCGTTGTC-3’,反向引物序列为5’-AGGCGGGA-AGGAGGAAAGTCTAG-3’。采用2-ΔΔCt法分析目的基因mRNA的相对表达水平。同时采用蛋白质印迹法检测MMP-2、MMP-9、FAK和PCNA的蛋白质表达水平。
1.10 统计学处理采用SPSS 16.0软件进行统计学分析。计量资料以x±s表示,组间差异分析采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 外泌体的形态观察与鉴定用透射电子显微镜观察初诊组、芦可替尼组、对照组外泌体,均可见直径为30.0~120.0 nm的完整囊泡(图 1A)。3组外泌体均表达CD9、CD63、CD81,符合外泌体的鉴定标准(图 1B)。
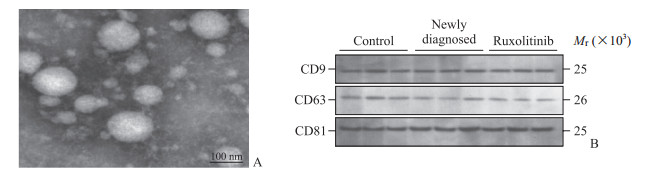
|
图 1 透射电子显微镜下外泌体形态(A)及蛋白质印迹法检测各组外泌体标志蛋白的表达(B) Fig 1 Exosome morphology in transmission electron microscopy (A) and expression of exosome marker proteins in each group detected by Western blotting (B) |
2.2 外泌体中促血管新生相关因子的表达
蛋白质印迹法检测结果提示,初诊组外泌体中VEGF、VEGFR1、HIF-1α、COX-2表达与对照组相比均升高(均P<0.01);芦可替尼组外泌体中VEGF、HIF-1α、COX-2表达与对照组相比亦升高(均P<0.05),但VEGF、VEGFR1、HIF-1α、COX-2表达均低于初诊组(均P<0.01)。见图 2。
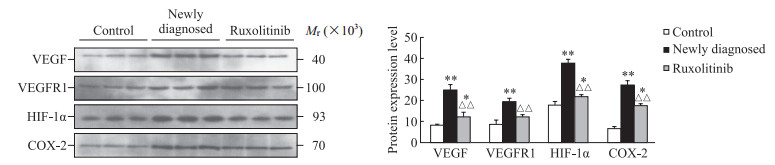
|
图 2 蛋白质印迹法检测各组外泌体中促血管新生相关因子的表达 Fig 2 Expression of angiogenesis-related factors in exosomes of each group detected by Western blotting *P < 0.05, **P < 0.01 vs control group; △△P < 0.01 vs newly diagnosed group. n=3, x±s. VEGF: Vascular endothelial growth factor; VEGFR1: VEGF receptor 1; HIF-1α: Hypoxia inducible factor-1α; COX-2: Cyclooxygenase-2. |
2.3 外泌体对HUVEC增殖活力的影响
CCK-8法检测结果显示,与对照组、初诊组、芦可替尼组外泌体共培养的HUVEC增殖活力分别为0.61±0.14、1.36±0.06、0.80±0.12。与初诊组外泌体共培养的HUVEC增殖活力高于对照组和芦可替尼组(均P<0.05)。
2.4 外泌体对HUVEC细胞周期的影响流式细胞术测定结果显示,与对照组、初诊组、芦可替尼组外泌体共培养的HUVEC中S期细胞占比分别为18.5%、38.6%、25.7%。与对照组相比,与初诊组、芦可替尼组外泌体共培养的HUVEC中S期细胞占比较高,但与芦可替尼组外泌体共培养的HUVEC中S期细胞占比低于初诊组(图 3)。
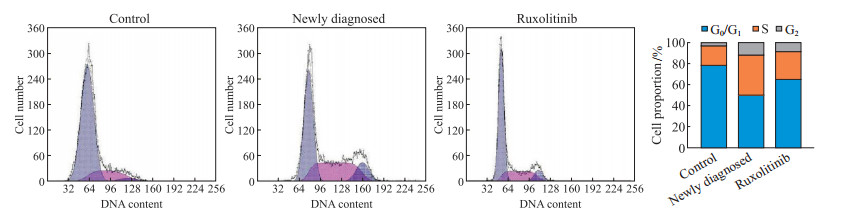
|
图 3 流式细胞术检测HUVEC与各组外泌体共培养后的细胞周期分布 Fig 3 Cell cycle distribution of HUVECs co-cultured with exosomes of each group detected by flow cytometry The proportions of S phase cells in the total cycle cells co-cultured with exosomes of the control group, newly diagnosed group, and ruxolitinib group were 18.5%, 38.6%, and 25.7%, respectively. HUVEC: Human umbilical vein endothelial cell. |
2.5 外泌体对HUVEC迁移、侵袭的影响
划痕实验结果(图 4A)显示,与对照组、初诊组、芦可替尼组外泌体共培养的HUVEC的划痕愈合率分别为(41±6)%、(86±9)%、(51±7)%。与对照组相比,与初诊组、芦可替尼组外泌体共培养的HUVEC向划痕区域迁移增加(均P<0.05),但与芦可替尼组外泌体共培养的HUVEC的迁移增加效果低于初诊组(P<0.01)。侵袭实验结果(图 4B)显示,与对照组、初诊组、芦可替尼组外泌体共培养的HUVEC的侵袭细胞数分别为32.40±4.21、77.60±5.94、47.40±2.41。与对照组相比,与初诊组、芦可替尼组外泌体共培养的HUVEC的侵袭能力较强(均P<0.05),但与芦可替尼组外泌体共培养的HUVEC的侵袭能力低于初诊组(P<0.01)。
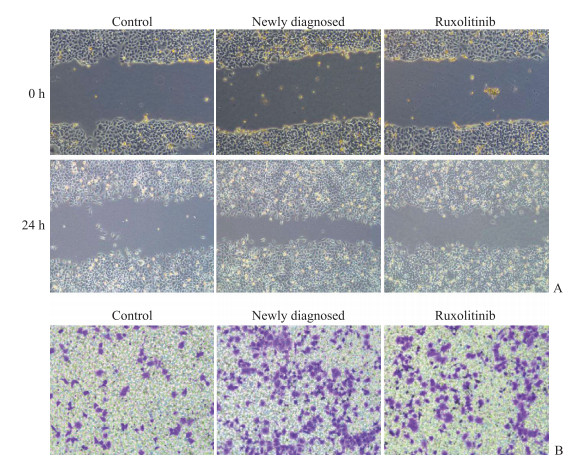
|
图 4 与各组外泌体共培养的HUVEC的迁移、侵袭能力检测(200×) Fig 4 Migration and invasion of HUVECs co-cultured with exosomes of each group (200×) A: Cell migration scratch assay results; B: Invasion assay results. HUVEC: Human umbilical vein endothelial cell. |
2.6 外泌体对HUVEC侵袭增殖相关因子表达的影响
qPCR和蛋白质印迹法检测结果显示,与对照组相比,与初诊组外泌体共培养的HUVEC中MMP-2、MMP-9、FAK、PCNA mRNA和蛋白质表达水平均较高(均P<0.01);与芦可替尼组MMP-2、MMP-9、PCNA表达水平也高于对照组(均P<0.05),但与初诊组相比,与芦可替尼组外泌体共培养的HUVEC中MMP-2、MMP-9、FAK、PCNA mRNA和蛋白质表达水平均下降(均P<0.01)。见图 5。
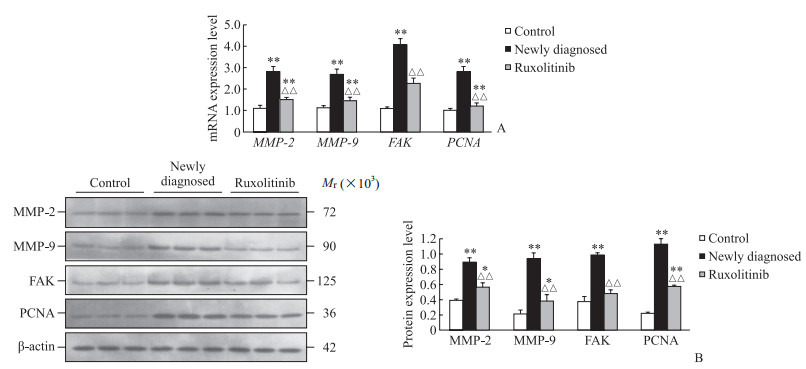
|
图 5 与各组外泌体共培养的HUVEC中侵袭增殖相关因子的表达 Fig 5 Expression of invasion- and proliferation-related factors in HUVECs co-cultured with exosomes in each group A: mRNA levels detected by quantitative polymerase chain reaction; B: Protein levels detected by Western blotting. *P < 0.05, **P < 0.01 vs control group; △△P < 0.01 vs newly diagnosed group. n=3, x±s. HUVEC: Human umbilical vein endothelial cell; MMP: Matrix metalloproteinase; FAK: Focal adhesion kinase; PCNA: Proliferating cell nuclear antigen. |
3 讨论
肿瘤血管新生是由血管新生因子所诱导的,而VEGF是最强的血管新生刺激因子,其与受体结合会引起内皮细胞增殖、迁移、侵袭及通透性增加,促进血管新生[16]。HIF-1α可通过与VEGF mRNA结合诱导VEGF表达,目前已发现肿瘤内缺氧和HIF-1α表达是引起血管新生的重要驱动因素[17]。COX-2在多种肿瘤(包括血液肿瘤)中表达增加,其能够促进肿瘤细胞增殖、侵袭、迁移和血管新生并抑制肿瘤细胞凋亡[18]。VEGF与COX-2通过多条通路协同诱导肿瘤的血管新生[19-20]。有研究发现,COX-2参与了骨髓增殖性肿瘤患者的肿瘤血管新生[5]。
本研究提取了3例原发免疫性血小板减少症患者(对照组)及3例PMF患者治疗前(初诊组)、芦可替尼治疗3个月后(芦可替尼组)的骨髓液外泌体,应用蛋白质印迹法对它们内含的促血管新生相关因子VEGF、VEGFR1、HIF-1a、COX-2水平进行检测,结果显示,与对照组相比,初诊组骨髓源性外泌体中上述促血管新生相关因子表达增加,而芦可替尼组外泌体中上述因子的表达水平较初诊组降低,表明PMF可引起含有较高水平促血管新生相关因子的外泌体释放至细胞外,从而促进肿瘤发展,而芦可替尼治疗后PMF患者释放的外泌体中促血管新生相关因子水平下降,有一定的肿瘤抑制效果。
为了验证外泌体对细胞功能的影响,本研究将骨髓液外泌体与HUVEC共培养并进行划痕实验、Transwell侵袭实验、CCK-8实验、细胞周期实验。实验结果提示,初诊PMF患者的骨髓源性外泌体可诱导HUVEC增殖、迁移和侵袭,而采用芦可替尼治疗后骨髓源性外泌体对HUVEC增殖、迁移和侵袭的诱导效果降低。
内皮细胞的增殖、迁移、侵袭在血管新生中发挥重要作用[16]。通过免疫组织化学检测发现,细胞核PCNA表达水平与细胞增殖活性呈正相关,且只有细胞处于增殖周期时PCNA才能被检测到[21]。FAK作为细胞增殖的关键介导因子,对血管新生具有重要作用[22]。MMP是细胞增殖和侵袭的关键影响因子,尤其MMP-2、MMP-9活性增高可通过降解基底膜中Ⅳ型胶原引起肿瘤侵袭与转移[23-24]。研究表明,白血病、淋巴瘤、多发性骨髓瘤、骨髓增生异常综合征等血液病均存在MMP异常表达[25-26],在骨髓增殖性肿瘤中亦存在MMP表达上调[27]。本研究结果显示,与对照组相比,与初诊组外泌体共培养的HUVEC中MMP-2、MMP-9、FAK和PCNA表达增加,而与芦可替尼组外泌体共培养的HUVEC中上述因子的表达较初诊组下降,表明芦可替尼组外泌体可降低血管新生程度。研究表明,骨髓增殖性肿瘤患者的血管新生增加,芦可替尼可抑制JAK2 V617F突变细胞中的血管新生相关因子表达[15],本研究结果与之一致,而本研究的创新之处在于此结果是基于外泌体层面,这一点此前尚未见报道。
综上所述,PMF患者可释放含有较高水平促血管新生相关因子的外泌体,HUVEC受到PMF患者骨髓源性外泌体中促血管新生相关因子的靶向影响后增殖、迁移和侵袭能力及相关因子的表达增加,血管新生程度提高。芦可替尼治疗后PMF患者释放的外泌体内促血管新生相关因子水平下降,与外泌体共培养的HUVEC侵袭增殖相关因子表达也下降,对HUVEC增殖、迁移、侵袭的诱导效果减低,说明芦可替尼对PMF有不错的治疗效果。然而,本研究结果表明芦可替尼治疗后PMF患者的肿瘤负荷并不能减低到非PMF患者水平。本研究结果有助于进一步了解PMF的发病机制,也为PMF的诊疗策略研究提供了一定理论依据。后续研究将继续探讨在血管新生机制方面外泌体可通过哪些通路促进PMF的发生、发展,以及除了血管新生机制外泌体还可能通过哪些机制影响PMF的发生、发展。
| [1] |
徐泽锋, 黄励思. 年轻骨髓增殖性肿瘤患者的生存预期显著高于老年患者[J]. 循证医学, 2019, 19(2): 76-79. DOI:10.12019/j.issn.1671-5144.2019.02.006 |
| [2] |
MCLORNAN D, EIKEMA D J, CZERW T, et al. Trends in allogeneic haematopoietic cell transplantation for myelofibrosis in Europe between 1995 and 2018: a CMWP of EBMT retrospective analysis[J]. Bone Marrow Transplant, 2021, 56(9): 2160-2172. DOI:10.1038/s41409-021-01305-x |
| [3] |
IURLO A, CATTANEO D, BUCELLI C. Management of myelofibrosis: from diagnosis to new target therapies[J]. Curr Treat Options Oncol, 2020, 21(6): 46. DOI:10.1007/s11864-020-00734-y |
| [4] |
张波, 吴国豪, 吴肇汉, 等. Robo4在实体肿瘤血管新生中的表达及其意义[J]. 复旦学报(医学版), 2008, 35(4): 585-589. DOI:10.3969/j.issn.1672-8467.2008.04.022 |
| [5] |
成志勇, 付建珠, 徐倩, 等. PTEN、VEGF、COX-2与JAK2 V617F突变阳性骨髓增殖性肿瘤血管新生[J]. 中国病理生理杂志, 2016, 32(5): 938-942. DOI:10.3969/j.issn.1000-4718.2016.05.029 |
| [6] |
YADAV N, KATARIA S P, KUMAR S, et al. A study of bone marrow angiogenesis and its correlation with serum vascular endothelial growth factor levels in acute leukaemia[J]. Int J Res Med Sci, 2022, 10(12): 2842. DOI:10.18203/2320-6012.ijrms20223086 |
| [7] |
MEDINGER M, PASSWEG J. Angiogenesis in myeloproliferative neoplasms, new markers and future directions[J]. Memo, 2014, 7: 206-210. DOI:10.1007/s12254-014-0142-z |
| [8] |
BOVERI E, PASSAMONTI F, RUMI E, et al. Bone marrow microvessel density in chronic myeloproliferative disorders: a study of 115 patients with clinicopathological and molecular correlations[J]. Br J Haematol, 2008, 140(2): 162-168. DOI:10.1111/j.1365-2141.2007.06885.x |
| [9] |
齐林, 张朝, 王素云, 等. 雷帕霉素对人红白血病HEL细胞外泌体及PD-1/PD-L1的影响[J]. 肿瘤防治研究, 2022, 49(10): 1021-1027. DOI:10.3971/j.issn.1000-8578.2022.22.0188 |
| [10] |
吴梦月, 谭振亚, 阚晨, 等. Ptpn11激活突变骨髓细胞来源的外泌体在骨髓增殖性肿瘤中的作用[J]. 安徽医科大学学报, 2021, 56(11): 1679-1686. DOI:10.19405/j.cnki.issn1000-1492.2021.11.001 |
| [11] |
BAXTER E J, SCOTT L M, CAMPBELL P J, et al. Acquired mutation of the tyrosine kinase JAK2 in human myeloproliferative disorders[J]. Lancet, 2005, 365(9464): 1054-1061. DOI:10.1016/S0140-6736(05)71142-9 |
| [12] |
NANGALIA J, MASSIE C E, BAXTER E J, et al. Somatic CALR mutations in myeloproliferative neoplasms with nonmutated JAK2[J]. N Engl J Med, 2013, 369(25): 2391-2405. DOI:10.1056/NEJMoa1312542 |
| [13] |
RAMPAL R, AL-SHAHROUR F, ABDEL-WAHAB O, et al. Integrated genomic analysis illustrates the central role of JAK-STAT pathway activation in myeloproliferative neoplasm pathogenesis[J]. Blood, 2014, 123(22): e123-e133. DOI:10.1182/blood-2014-02-554634 |
| [14] |
KONG Y, WU Y L, SONG Y, et al. Ruxolitinib/nilotinib cotreatment inhibits leukemia-propagating cells in Philadelphia chromosome-positive ALL[J]. J Transl Med, 2017, 15(1): 184. DOI:10.1186/s12967-017-1286-5 |
| [15] |
CHENG Z, FU J, LIU G, et al. Angiogenesis in JAK2 V617F positive myeloproliferative neoplasms and ruxolitinib decrease VEGF, HIF-1 enesis in JAK2 V617F positive cells[J]. Leuk Lymphoma, 2018, 59(1): 196-203. DOI:10.1080/10428194.2017.1324155 |
| [16] |
ZHANG W, SUN L, GAO H, et al. Mechanism of the HIF-1α/VEGF/VEGFR-2 pathway in the proliferation and apoptosis of human haemangioma endothelial cells[J]. Int J Exp Pathol, 2023, 104(5): 258-268. DOI:10.1111/iep.12485 |
| [17] |
孙旭芳, 曾水清, 张虹, 等. 缺氧条件下视网膜微血管内皮细胞中缺氧诱导因子1和血管内皮生长因子mRNA表达的研究[J]. 中国现代医学杂志, 2005, 15(6): 825-827. DOI:10.3969/j.issn.1005-8982.2005.06.008 |
| [18] |
YU H, LIU Z, ZHOU H, et al. JAK-STAT pathway modulates the roles of iNOS and COX-2 in the cytoprotection of early phase of hydrogen peroxide preconditioning against apoptosis induced by oxidative stress[J]. Neurosci Lett, 2012, 529(2): 166-171. DOI:10.1016/j.neulet.2012.09.013 |
| [19] |
BUTKIEWICZ D, KRZEŚNIAK M, DROSIK A, et al. The VEGFR2, COX-2 and MMP-2 polymorphisms are associated with clinical outcome of patients with inoperable non-small cell lung cancer[J]. Int J Cancer, 2015, 137(10): 2332-2342. DOI:10.1002/ijc.29605 |
| [20] |
HUA K T, LEE W J, YANG S F, et al. Vascular endothelial growth factor-C modulates proliferation and chemoresistance in acute myeloid leukemic cells through an endothelin-1-dependent induction of cyclooxygenase-2[J]. Biochim Biophys Acta, 2014, 1843(2): 387-397. DOI:10.1016/j.bbamcr.2013.10.015 |
| [21] |
OHTA Y, ICHIMURA K. Proliferation markers, proliferating cell nuclear antigen, Ki67, 5-bromo-2'-deoxyuridine, and cyclin D1 in mouse olfactory epithelium[J]. Ann Otol Rhinol Laryngol, 2000, 109(11): 1046-1048. DOI:10.1177/000348940010901110 |
| [22] |
TAVORA B, BATISTA S, REYNOLDS L E, et al. Endothelial FAK is required for tumour angiogenesis[J]. EMBO Mol Med, 2016, 8(10): 1229. DOI:10.15252/emmm.201606907 |
| [23] |
CABRAL-PACHECO G A, GARZA-VELOZ I, CASTRUITA-DE LA ROSA C, et al. The roles of matrix metalloproteinases and their inhibitors in human diseases[J]. Int J Mol Sci, 2020, 21(24): 9739. DOI:10.3390/ijms21249739 |
| [24] |
NAPOLI S, SCUDERI C, GATTUSO G, et al. Functional roles of matrix metalloproteinases and their inhibitors in melanoma[J]. Cells, 2020, 9(5): 1151. DOI:10.3390/cells9051151 |
| [25] |
KAMIGUTI A S, LEE E S, TILL K J, et al. The role of matrix metalloproteinase 9 in the pathogenesis of chronic lymphocytic leukaemia[J]. Br J Haematol, 2004, 125(2): 128-140. DOI:10.1111/j.1365-2141.2004.04877.x |
| [26] |
JANOWSKA-WIECZOREK A, MAJKA M, MARQUEZ-CURTIS L, et al. Bcr-abl-positive cells secrete angiogenic factors including matrix metalloproteinases and stimulate angiogenesis in vivo in Matrigel implants[J]. Leukemia, 2002, 16(6): 1160-1166. DOI:10.1038/sj.leu.2402486 |
| [27] |
SAG S O, GORUKMEZ O, TURE M, et al. MMP2 gene-735 C/T and MMP9 gene-1562 C/T polymorphisms in JAK2V617F positive myeloproliferative disorders[J]. Asian Pac J Cancer Prev, 2015, 16(2): 443-449. DOI:10.7314/apjcp.2015.16.2.443 |
 2024, Vol. 45
2024, Vol. 45


