根据来源不同,中枢神经系统中的单核巨噬细胞可以分为两大类:第一类是常驻中枢的定植巨噬细胞——小胶质细胞,定居于脑实质内,生理条件下其数量占据绝对优势;第二类是血源性单核细胞来源的浸润巨噬细胞,生理条件下其主要分布在脉络丛和硬脑膜等交界区域,数量较少[1-3]。尽管在生理条件下浸润巨噬细胞数量较少,但是在神经损伤或疾病过程中,由于血脑屏障通透性升高该类巨噬细胞大量浸润到脑实质中,参与疾病的病理进程。研究表明,在寄生虫感染时这2类细胞共同参与了病理过程,并且它们具有不同可塑性和命运,发挥不同作用[4]。在肿瘤病程中,浸润巨噬细胞促进肿瘤生长,而小胶质细胞在不同阶段发挥着抑制肿瘤转移和进展或促进肿瘤细胞逃逸免疫杀伤的复杂作用[5]。双侧颈总动脉狭窄(bilateral common carotid artery stenosis,BCAS)模型是一种模拟脑血流低灌注的病理模型[6],在低灌注病程中血脑屏障通透性升高,巨噬细胞被招募到中枢神经系统中参与疾病进展[7-8]。
PLX5622是一种可渗透血脑屏障、具有口服吸收活性的集落刺激因子1受体抑制剂,可以有效清除小鼠脑内的小胶质细胞[9]。氯膦酸盐是一种用于治疗溶骨性疾病的双膦酸盐类药物,高浓度氯膦酸盐可以诱导细胞产生不可逆代谢损伤和凋亡。氯膦酸盐脂质体(clodronate liposome,Cld)是脂质体包裹的氯膦酸盐,腹腔注射Cld可以被巨噬细胞吞噬并诱导巨噬细胞凋亡,从而选择性清除浸润巨噬细胞[10]。
既往大量研究受限于研究手段并未区分中枢小胶质细胞和浸润巨噬细胞,得出的结论或是基于2类细胞整体上的混合结果,或归因为其中一方的非精确判断,阻碍了对疾病机制的认识[11]。本研究通过CD45、CD11b和淋巴细胞抗原6家族成员C(lymphocyte antigen 6 family member C,Ly6C)抗体区分这2类细胞,采用流式细胞分选术(fluorescence-activated cell sorting,FACS)进行分选,为精确研究这2类细胞在疾病中的作用提供参考。
1 材料和方法 1.1 实验动物雄性C57BL/6小鼠(8周龄,体重18~22 g)购自上海吉辉实验动物饲养有限公司[动物生产许可证号为SCXK(沪)2022-0009],小鼠饲养于海军军医大学(第二军医大学)实验动物中心SPF级动物房[动物使用许可证号为SYXK(沪)2022-0002],饲养过程严格按标准进行,保证12 h/12 h昼夜循环。本研究的动物实验方案经海军军医大学(第二军医大学)实验动物伦理委员会审批。
1.2 试剂与材料PLX5622购自上海陶术生物科技有限公司,Cld和不含氯膦酸盐的脂质体均购自荷兰LIPOSOMA公司,微型弹簧线圈(内径0.18 mm)购自北京西浓科技有限公司,Percoll购自美国GE公司,藻红蛋白(phycoerythrin,PE)标记的抗小鼠CD45抗体、别藻蓝蛋白(allophycocyanin,APC)标记的抗小鼠CD11b抗体和藻红蛋白-花青苷7复合染料(phycoerythrin-cyanine 7,PE-Cy7)标记的抗小鼠Ly6C抗体均购自美国BD公司,DMSO购自美国Sigma公司,羟甲基纤维素钠购自国药集团化学试剂有限公司。
1.3 实验仪器流式细胞仪购自美国Beckman公司,手术显微镜购自德国ZEISS公司,麻醉仪购自深圳市瑞沃德生命科技有限公司,共聚焦显微镜购自日本Nikon公司,冰冻切片机购自德国Leica公司。
1.4 BCAS模型的构建通过吸入异氟烷麻醉C57BL/6小鼠,将小鼠置于加热垫上并固定,维持麻醉状态;使用75%乙醇消毒小鼠颈部腹侧部位,并在颈部剪开1个长1~1.5 cm的切口,在手术显微镜下将2条颈总动脉从鞘中暴露出来,放置微弹簧线圈于两侧颈总动脉,确保弹簧线圈完全缠绕;缝合切口,用75%乙醇再次消毒。假手术组进行同样操作但免于线圈植入。
1.5 小胶质细胞消融验证实验用DMSO溶解PLX5622配制PLX5622母液(79 mg/mL),用蒸馏水配制0.5%羟甲基纤维素钠溶液,再用0.5%羟甲基纤维素钠溶液稀释母液配制成PLX5622工作液(7.9 mg/mL)。从BCAS手术前14 d开始每天按照45 mg/kg的剂量予小鼠灌胃给药至术后28 d取材。对照组小鼠予不含PLX5622的DMSO与0.5%羟甲基纤维素钠配制的对照药灌胃处理,用药体积和操作步骤同BCAS+PLX5622组。
1.6 浸润巨噬细胞消融验证实验在BCAS手术前3 d开始予小鼠腹腔注射Cld清除巨噬细胞,每只小鼠注射50 μL,每3 d注射1次,给药至术后28 d。对照组小鼠予不含氯膦酸盐的脂质体腹腔注射给药,用药体积和操作步骤同BCAS+Cld组。
1.7 单细胞悬液的制备术后28 d,取BCAS模型组及BCAS+PLX5622组、BCAS+Cld组和相应对照组小鼠各5只,通过吸入过量CO2处死。使用预冷的PBS灌注处理后分离脑及脊髓并置于4 mL EP管中,加入等体积0.25%胰酶和1 mL DNA酶后剪碎,放入37 ℃水浴锅中消化30 min(每隔10 min摇晃1次),用1 mL枪头吹散后过100 μm滤网,将滤液于300×g离心10 min获得细胞沉淀。
1.8 Percoll梯度分离单核细胞Percoll分离液配制方法如下。Percoll母液:10×PBS 1.4 mL+Percoll 12.6 mL;37% Percoll分离液:Percoll母液3.7 mL+DMEM/F12培养基6.3 mL;70% Percoll分离液:Percoll母液7 mL+PBS 3 mL;30% Percoll分离液:Percoll母液3 mL+PBS 7 mL。先用37% Percoll分离液10 mL重悬1.7节获得的细胞沉淀,在下层缓慢加入70% Percoll分离液10 mL,在上层缓慢加入30% Percoll分离液10 mL,于900×g缓慢离心30 min,吸除最上层的髓鞘片段;再吸取37% Percoll与70% Percoll分离液之间的单核细胞层,加入等量PBS混匀,于700×g再次离心7 min,收集细胞沉淀。
1.9 FACS分选配制FACS缓冲液(含2% FBS的PBS),用200~500 μL FACS缓冲液重悬1.8节获得的细胞沉淀,按照1∶200的稀释比例加入PE标记的CD45抗体、APC标记的CD11b抗体和PE-Cy7标记的Ly6C抗体,冰上避光孵育30 min后400×g离心,弃上清,再用FACS缓冲液清洗1次,然后用DMEM/F12培养基重悬后置于冰上待测。用流式细胞仪进行检测,首先通过侧向散射(side scatter,SSC)和前向散射(forward scatter,FSC)分离出活细胞和单个细胞,在此基础上进一步选出CD11b+CD45low和CD11b+CD45high 2群细胞,利用CD11b+CD45lowLy6C-门控分选出小胶质细胞,利用CD11b+CD45highLy6C+门控分选出浸润巨噬细胞。
1.10 免疫荧光染色BCAS模型组小鼠经灌注后取脑组织,在4%多聚甲醛溶液中过夜固定,再通过20%、30%蔗糖溶液进行脱水处理。用包埋剂包埋脑组织,在冰冻切片机上切片后贴于载玻片,得到10 μm组织切片,用PBS洗去包埋剂。用PBS配制10%驴血清作为抗体稀释液,将荧光染料标记的抗体按照CD11b抗体1∶200、CD45抗体1∶200、Ly6C抗体1∶200的比例稀释后,加到脑组织切片上,4 ℃孵育过夜。PBS清洗3次后用甘油封片。通过共聚焦显微镜观察内侧前额叶皮质(medial prefrontal cortex,mPFC)、胼胝体(corpus callosum,CC)和海马角3(cornu ammonis 3,CA3)脑区中的小胶质细胞(CD11b+CD45+Ly6C-)和浸润巨噬细胞(CD11b+CD45+Ly6C+)。
1.11 统计学处理应用GraphPad Prism 8.0软件进行统计学分析。经正态性检验和方差齐性检验,计量资料均呈正态分布且方差齐,以x±s表示,两组间比较采用独立样本t检验。检验水准(α)为0.05。
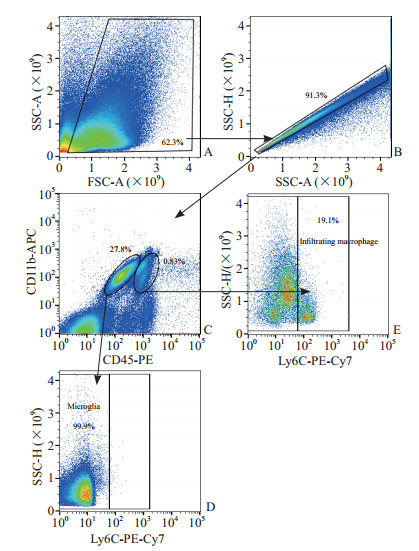
2 结果 2.1 BCAS模型小鼠中枢神经系统内小胶质细胞和浸润巨噬细胞分群选取BCAS造模后28 d的小鼠进行流式细胞分选,首先以FSC-A为横坐标、SSC-A为纵坐标,选出单细胞悬液中的活细胞,活细胞比例为62.3%(图 1A)。在此基础上以SSC-A为横坐标、SSC-H为纵坐标选出单个细胞,占活细胞的91.3%(图 1B)。再以CD45-PE为横坐标、CD11b-APC为纵坐标选出CD45+CD11b+细胞,其中CD11b+CD45low细胞比例为27.8%,CD11b+CD45high细胞比例为0.83%(图 1C)。在CD11b+CD45low细胞群中,以Ly6C-PE-Cy7为横坐标、SSC-H为纵坐标选出小胶质细胞(CD11b+CD45lowLy6C-细胞),比例为99.9%(图 1D)。在CD11b+CD45high细胞群中,以Ly6C-PE-Cy7为横坐标、SSC-H为纵坐标选出浸润巨噬细胞(CD11b+CD45highLy6C+细胞),比例为19.1%(图 1E)。
|
图 1 BCAS造模28 d后小鼠中枢神经系统流式细胞分选结果 Fig 1 Fluorescence-activated cell sorting results in mouse central nervous system 28 d after BCAS modeling A: Select live cells from the single cell suspension with FSC-A as the abscissa and SSC-A as the ordinate; B: Select singe cells from the live cells with SSC-A as the abscissa and SSC-H as the ordinate; C: Select CD11b+CD45+ cells with CD45-PE as the abscissa and CD11b-APC as the ordinate; D: Select microglia (CD11b+CD45lowLy6C- cells) from the CD11b+CD45low cells with Ly6C-PE-Cy7 as the abscissa and SSC-H as the ordinate; E: Select infiltrating macrophages (CD11b+CD45highLy6C+cells) from the CD11b+CD45high cells with Ly6C-PE-Cy7 as the abscissa and SSC-H as the ordinate. BCAS: Bilateral common carotid artery stenosis; FSC-A: Forward scatter-area; SSC-A: Side scatter-area; SSC-H: Side scatter-height; PE: Phycoerythrin; APC: Allophycocyanin; Ly6C: Lymphocyte antigen 6 family member C; PE-Cy7: Phycoerythrin-cyanine 7. |
2.2 小胶质细胞或浸润巨噬细胞的分选效果验证
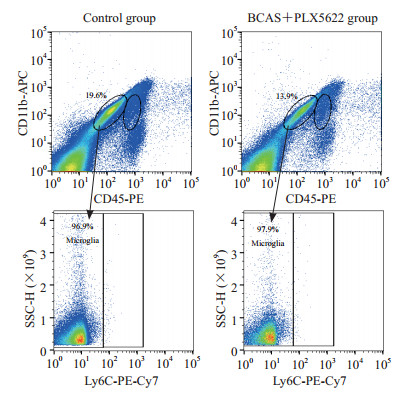
利用小胶质细胞消融的BCAS模型小鼠,在BCAS手术后第28天取材进行抗体标记和FACS分选,验证CD11b+CD45lowLy6C-所标记的细胞群是否为小胶质细胞。与对照组[(18.99±1.66)%,n=4]相比,BCAS+PLX5622组的CD11b+CD45lowLy6C-细胞数量[(13.6±1.36)%,n=4]减少(P=0.001)。见图 2。
|
图 2 PLX5622处理对BCAS造模28 d小鼠中枢神经系统小胶质细胞数量的影响 Fig 2 Effect of PLX5622 on number of microglia in mouse central nervous system 28 d after BCAS modeling PLX5622 is an inhibitor of colony stimulating factor 1 receptor. BCAS: Bilateral common carotid artery stenosis; PE: Phycoerythrin; APC: Allophycocyanin; Ly6C: Lymphocyte antigen 6 family member C; PE-Cy7: Phycoerythrin-cyanine 7; SSC-H: Side scatter-height. |
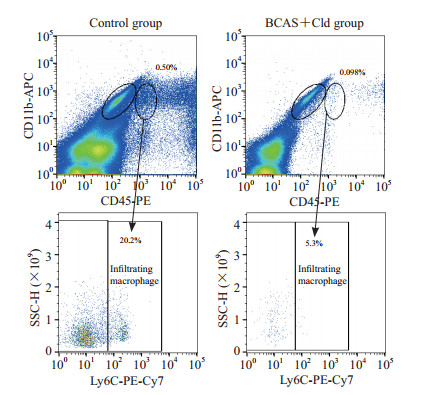
利用浸润巨噬细胞消融的BCAS模型小鼠,在BCAS手术后第28天取材进行抗体标记和流式细胞分选,验证CD11b+CD45highLy6C+所标记的细胞群是否为浸润巨噬细胞。与对照组[(0.101±0.064)%,n=6]相比,BCAS+Cld组的CD11b+CD45highLy6C+细胞数量[(0.005±0.000)%,n=6]减少(P<0.001)。见图 3。
|
图 3 Cld处理对BCAS造模28 d小鼠中枢神经系统浸润巨噬细胞数量的影响 Fig 3 Effect of Cld on number of infiltrating macrophages in mouse central nervous system 28 d after BCAS modeling Cld: Clodronate liposome; BCAS: Bilateral common carotid artery stenosis; PE: Phycoerythrin; APC: Allophycocyanin; Ly6C: Lymphocyte antigen 6 family member C; PE-Cy7: Phycoerythrin-cyanine 7; SSC-H: Side scatter-height. |
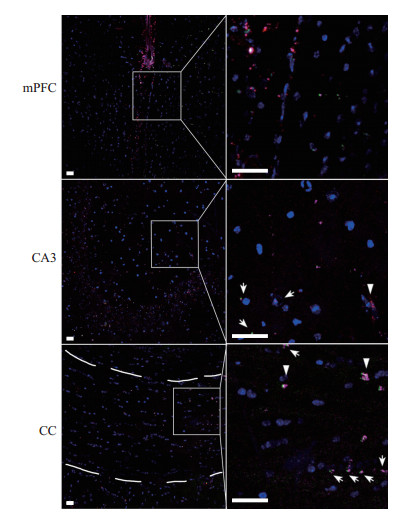
免疫荧光染色结果显示,BCAS模型小鼠脑组织中CD11b+CD45+Ly6C-细胞的比例为(20.15±3.56)%(n=6),而CD11b+CD45+Ly6C+细胞的比例为(0.13±0.02)%(n=6),与FACS分选结果一致。见图 4。
|
图 4 BCAS模型小鼠脑组织中小胶质细胞和浸润巨噬细胞的免疫荧光染色分析 Fig 4 Microglia and infiltrating macrophages in brain tissue of BCAS mice detected by immunofluorescence staining Representative images of CD45 (green), Ly6C (red), CD11b (magenta) and cell nuclei (DAPI, blue) showing the microglia and infiltrating macrophages in mPFC, hippocampal CA3 and CC regions of mice 28 d after BCAS. Scale bar: 50 μm. Arrowheads indicate macrophages and arrows indicate microglia. The dotted area is CC. BCAS: Bilateral common carotid artery stenosis; mPFC: Medial prefrontal cortex; CA3: Cornu ammonis 3; CC: Corpus callosum; Ly6C: Lymphocyte antigen 6 family member C; DAPI: 4', 6-diamidino-2-phenylindole. |
3 讨论
FACS是分离纯化细胞的重要实验方法,其先利用荧光抗体标记不同的细胞,再通过调节合适的电压等将目标细胞分选出来。既往大多数研究利用FACS分选小胶质细胞仅通过CD11b+和CD45low作为标准区分[12-13]。Wisor等[14]利用磁珠细胞分选小胶质细胞,只采用了CD11b单个标记进行区分。单细胞测序分群研究表明,在稳态成年中枢神经系统中小胶质细胞占免疫细胞总数的78.79%,而浸润巨噬细胞仅占3.07%[1]。尽管在生理条件下血源性单核巨噬细胞数量较少,但是在神经损伤或疾病过程中这些细胞会大量浸润到脑实质并与小胶质细胞共同参与疾病的发生[4]。研究表明,BCAS会引起长期脑血流量供应不足,慢性低灌注导致小鼠血脑屏障破坏,通透性增加[15-16]。在病理状态下,以往对于小胶质细胞和浸润巨噬细胞的区分方法存在精细度不够等缺点,且没有验证细胞的类型,所得到的小胶质细胞往往包含浸润巨噬细胞,对于实验结果的判断解读可能存在偏差。本研究在CD11b和CD45标记分离的基础上进一步利用Ly6C抗体标记,在分离的细胞群中验证了所得到的细胞为小胶质细胞并标记出了浸润巨噬细胞。
PLX5622口服给药可以有效清除小胶质细胞[9],而腹腔注射Cld可以清除浸润巨噬细胞[10]。本实验利用CD45、CD11b和Ly6C抗体这3种抗体定量分析了采用FACS收集的2类细胞数量,结果显示在各自给药组中所标记的细胞数量减少,进一步验证了所建立的分选方法的可靠性、准确性。
小胶质细胞和浸润巨噬细胞作为中枢神经系统天然免疫的主要成员,对外界刺激非常敏感[4]。而FACS实验流程较长,对细胞有一定的刺激,可能会影响分选细胞的性状。在实验中应注意以下几点:(1)取材时对于脑组织和脊髓样品需要机械剪碎到足够小的组织碎块,以提高细胞得率。(2)消化组织样品时建议加入DNA酶,并使用温和的蛋白消化酶,以减少细胞损伤,提高正常状态细胞的数量和质量。(3)在采用FACS分选前通过DMEM/F12培养基替代磷酸盐等渗缓冲液重悬细胞并冰浴,同时缩短等待时间,有利于维持细胞活性。
总之,本实验所建立的分选技术可以更加精准地区分中枢神经系统内定植的小胶质细胞和浸润的巨噬细胞,有助于细化2类细胞在疾病中的作用和机制研究。
| [1] |
KORIN B, BEN-SHAANAN T L, SCHILLER M, et al. High-dimensional, single-cell characterization of the brain's immune compartment[J]. Nat Neurosci, 2017, 20(9): 1300-1309. DOI:10.1038/nn.4610 |
| [2] |
PRINZ M, MASUDA T, WHEELER M A, et al. Microglia and central nervous system-associated macrophages-from origin to disease modulation[J]. Annu Rev Immunol, 2021, 39: 251-277. DOI:10.1146/annurev-immunol-093019-110159 |
| [3] |
MASTORAKOS P, MCGAVERN D. The anatomy and immunology of vasculature in the central nervous system[J]. Sci Immunol, 2019, 4(37): eaav0492. DOI:10.1126/sciimmunol.aav0492 |
| [4] |
DE VLAMINCK K, VAN HOVE H, KANCHEVA D, et al. Differential plasticity and fate of brain-resident and recruited macrophages during the onset and resolution of neuroinflammation[J]. Immunity, 2022, 55(11): 2085-2102.e9. DOI:10.1016/j.immuni.2022.09.005 |
| [5] |
MUNDT S, GRETER M, BECHER B. The CNS mononuclear phagocyte system in health and disease[J]. Neuron, 2022, 110(21): 3497-3512. DOI:10.1016/j.neuron.2022.10.005 |
| [6] |
ISHIKAWA H, SHINDO A, MIZUTANI A, et al. A brief overview of a mouse model of cerebral hypoperfusion by bilateral carotid artery stenosis[J]. J Cereb Blood Flow Metab, 2023, 43(2_suppl): 18-36. DOI:10.1177/0271678X231154597 |
| [7] |
HOLLAND P R, SEARCY J L, SALVADORES N, et al. Gliovascular disruption and cognitive deficits in a mouse model with features of small vessel disease[J]. J Cereb Blood Flow Metab, 2015, 35(6): 1005-1014. DOI:10.1038/jcbfm.2015.12 |
| [8] |
BRIOSCHI S, ZHOU Y, COLONNA M. Brain parenchymal and extraparenchymal macrophages in development, homeostasis, and disease[J]. J Immunol, 2020, 204(2): 294-305. DOI:10.4049/jimmunol.1900821 |
| [9] |
HUANG Y, XU Z, XIONG S, et al. Repopulated microglia are solely derived from the proliferation of residual microglia after acute depletion[J]. Nat Neurosci, 2018, 21(4): 530-540. DOI:10.1038/s41593-018-0090-8 |
| [10] |
SERRATS J, SCHILTZ J C, GARCÍA-BUENO B, et al. Dual roles for perivascular macrophages in immune-to-brain signaling[J]. Neuron, 2010, 65(1): 94-106. DOI:10.1016/j.neuron.2009.11.032 |
| [11] |
LI Q, BARRES B A. Microglia and macrophages in brain homeostasis and disease[J]. Nat Rev Immunol, 2018, 18(4): 225-242. DOI:10.1038/nri.2017.125 |
| [12] |
KOHMAN R A, BHATTACHARYA T K, WOJCIK E, et al. Exercise reduces activation of microglia isolated from hippocampus and brain of aged mice[J]. J Neuroinflammation, 2013, 10: 114. DOI:10.1186/1742-2094-10-114 |
| [13] |
JIANG L, MU H, XU F, et al. Transcriptomic and functional studies reveal undermined chemotactic and angiostimulatory properties of aged microglia during stroke recovery[J]. J Cereb Blood Flow Metab, 2020, 40(1_suppl): S81-S97. DOI:10.1177/0271678X20902542 |
| [14] |
WISOR J P, SCHMIDT M A, CLEGERN W C. Cerebral microglia mediate sleep/wake and neuroinflammatory effects of methamphetamine[J]. Brain Behav Immun, 2011, 25(4): 767-776. DOI:10.1016/j.bbi.2011.02.002 |
| [15] |
YANG L, SONG J, NAN D, et al. Cognitive impairments and blood-brain barrier damage in a mouse model of chronic cerebral hypoperfusion[J]. Neurochem Res, 2022, 47(12): 3817-3828. DOI:10.1007/s11064-022-03799-3 |
| [16] |
RAJEEV V, FANN D Y, DINH Q N, et al. Intermittent fasting attenuates hallmark vascular and neuronal pathologies in a mouse model of vascular cognitive impairment[J]. Int J Biol Sci, 2022, 18(16): 6052-6067. DOI:10.7150/ijbs.75188 |
 2024, Vol. 45
2024, Vol. 45


