2. 安徽医科大学第五临床医学院,合肥 230032;
3. 中国人民解放军联勤保障部队第九〇四医院心内科,无锡 214044
2. The Fifth Clinical Medical College, Anhui Medical University, Hefei 230032, Anhui, China;
3. Department of Cardiology, No. 904 Hospital of Joint Logistics Support Force of PLA, Wuxi 214044, Jiangsu, China
冠心病是目前发达国家和发展中国家人群的主要死亡原因。流行病调查显示近年我国冠心病患者越来越多并逐渐年轻化,冠心病的危险因素不断增加[1]。通过监测心电图和炎症指标对冠心病进行有效的早期诊断、及时调整治疗和患者管理能使死亡率下降,所以早发现、采取适合的治疗计划和患者后期管理十分重要[2-4]。冠心病是一种动脉粥样硬化性疾病,本质上是炎症反应和免疫反应失调[5]。冠心病的发生和严重程度可以通过某些炎症指标进行预测。研究发现中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)具有预测冠心病发生和严重程度及预后的能力,单核细胞与淋巴细胞比值(monocyte to lymphocyte ratio,MLR)和血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)与冠心病严重程度相关[6-7]。在NLR基础上,分别纳入血小板计数和单核细胞计数建立的系统性免疫炎症指数(systemic immune-inflammation index,SII)和系统性炎症反应指数(systemic inflammatory response index,SIRI)能够很好地预测冠心病患者的冠状动脉狭窄程度及其远期主要不良心血管事件(major adverse cardiovascular event,MACE)的发生风险[8-9]。
全身免疫炎症反应指数(systemic immune-inflammation response index,SIIRI)是结合SII、SIRI而成的复合炎症标志物,研究表明,SIIRI能够预测急性冠状动脉综合征患者的冠状动脉病变程度,且高SIIRI水平是急性冠状动脉综合征患者冠状动脉重度狭窄的独立预测因素[9]。目前对SIIRI与冠心病患者冠状动脉病变程度关系的研究较少,同时未见SIIRI与其远期MACE相关性的报道。相较于传统的炎症指标SII、SIRI,SIIRI能否更好地反映冠心病患者冠状动脉狭窄严重程度,以及作为冠心病患者远期不良预后的生物标志物有待进一步探索。本研究主要探讨SIIRI与冠心病患者冠状动脉病变严重程度的相关性及SIIRI对冠心病患者行经皮冠状动脉介入(percutaneous coronary intervention,PCI)治疗后发生MACE的预测价值,并对不同炎症指标的预测能力进行评估和比较。
1 资料和方法 1.1 研究对象回顾性连续纳入2020年12月至2021年12月因胸痛在中国人民解放军联勤保障部队第九〇四医院住院治疗并行冠状动脉造影检查的545例患者。根据美国心脏协会/美国心脏病学会冠心病诊断指南[10],以任一主要冠状动脉(如冠状动脉左主干、左前降支、左回旋支、右冠状动脉)或其主要分支(血管直径>1.5 mm的对角支、钝缘支、左室后支、后降支等)狭窄≥50%作为冠心病的诊断标准。纳入标准:(1)年龄为30~85岁,因胸痛入院择期行冠状动脉造影检查;(2)神志清楚,能自然交流沟通,无严重神经及精神类疾病;(3)入院后规范服用阿司匹林联合替格瑞洛/氯吡格雷双联抗血小板治疗。排除标准:(1)有陈旧性心肌梗死、PCI治疗或冠状动脉旁路移植术史的患者;(2)ST段抬高型心肌梗死或急诊行冠状动脉造影检查者;(3)有缺血性脑卒中病史者;(4)伴有肺栓塞、主动脉夹层、急/慢性肾炎或其他系统病变者;(5)合并血液系统疾病、恶性肿瘤或自身免疫病者;(6)合并急/慢性感染性疾病者。根据冠状动脉造影检查结果将研究对象分为冠心病组(435例)和非冠心病组(110例)。本研究通过中国人民解放军联勤保障部队第九〇四医院伦理委员会审批(20230614)。
1.2 观察指标记录患者的人口学特征和病史资料,包括性别、年龄、身高、体重及高血压病、糖尿病、冠心病和吸烟等情况,计算BMI。入院后采集患者静脉血,检测白细胞、中性粒细胞、淋巴细胞、单核细胞和血小板计数,以及白蛋白、血红蛋白、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、甘油三酯、总胆固醇、血尿酸、胱抑素C和血肌酐水平,并计算SIIRI、SII、SIRI、NLR、PLR和MLR,其中SIIRI(×1018/L2)=血小板计数(×109/L)×中性粒细胞计数(×109/L)×单核细胞计数(×109/L)/淋巴细胞计数(×109/L),SII(×109/L)=血小板计数(×109/L)×中性粒细胞计数(×109/L)/淋巴细胞计数(×109/L),SIRI(×109/L)=中性粒细胞计数(×109/L)×单核细胞计数(×109/L)/淋巴细胞计数(×109/L)。
1.3 冠状动脉狭窄判断所有患者均采用标准Judkins方法[10]行冠状动脉造影检查。冠状动脉狭窄程度由至少2名经验丰富的高级职称医师根据Gensini评分[11-12]判断。狭窄节段系数:冠状动脉左主干5,左前降支近段2.5,左回旋支近段2.5,左前降支中段1.5,左前降支远段1,左回旋支远段1,右冠状动脉1,后降支1,第一对角支1,第二对角支0.5,其他小分支0.5。管腔狭窄程度:1%~25%计1分,26%~50%计2分,51%~75%计4分,76%~90%计8分,91%~99%计16分,完全闭塞计32分。Gensini评分为所有狭窄的冠状动脉节段系数乘以相应狭窄段评分的总和。根据Gensini评分将冠心病患者分为冠状动脉重度狭窄组(Gensini评分≥30分)和冠状动脉轻度狭窄组(Gensini评分为1~<30分)。
1.4 随访于出院后1个月、6个月、1年随访。主要通过电话询问并全面记录随访期间MACE的发生情况。对于再次住院的患者,查询住院病历系统明确是否发生MACE。
1.5 结局定义MACE包括通过临床症状和头颅CT或MRI诊断的缺血性脑卒中,通过胸痛症状、心电图改变和心肌酶水平诊断的心肌梗死,新发心力衰竭或心力衰竭加重再入院,全因死亡,恶性心律失常,以及非计划内的血运重建。由至少2名具有心脑血管疾病临床经验的主治医师手动查看随访期间住院或门诊就诊的电子病历,并结合电话随访最终确认有无终点事件。
1.6 统计学处理使用SPSS 27.0软件进行统计学分析。使用Kolmogorov-Smirnov检验进行正态性分析,呈正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验;呈偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,多组间比较采用Kruskal-Wallis H检验,两组间比较采用Mann-Whitney U检验。计数资料以例数和百分数表示,组间比较采用χ2检验或Fisher确切概率法。采用Spearman秩相关进行相关性分析。采用logistic回归模型分析冠心病和冠状动脉重度狭窄的独立预测因素。采用Cox比例风险回归模型分析冠心病患者PCI治疗后发生MACE的独立危险因素。使用Kaplan-Meier法绘制生存曲线,并通过log-rank检验评估生存曲线的差异。采用ROC曲线分析SIIRI、SII、SIRI、NLR、PLR和MLR预测冠状动脉重度狭窄和MACE的效能并计算最佳临界值,采用MedCalc软件通过DeLong检验分析AUC值的差异。所有检验均采用双侧检验,检验水准(α)为0.05。
2 结果 2.1 SIIRI与冠心病的关系 2.1.1 冠心病组与非冠心病组临床资料比较共入选545例患者,年龄为30~85岁,冠心病组435例(男341例,女94例),非冠心病组110例(男58例,女52例)。两组BMI、糖尿病患者占比、总胆固醇、甘油三酯、血红蛋白、淋巴细胞计数和尿酸差异均无统计学意义(均P>0.05)。与非冠心病组相比,冠心病组男性患者占比较高,年龄较大,吸烟和高血压病患者占比较高(均P<0.05)。冠心病组LDL-C、血肌酐、白细胞计数、中性粒细胞计数、血小板计数、单核细胞计数、CRP、SIIRI、SII、SIRI、PLR、NLR和MLR均高于非冠心病组,而HDL-C和白蛋白均低于非冠心病组(均P<0.05)。见表 1。
|
|
表 1 CHD组和非CHD组患者的临床资料比较 Tab 1 Comparison of clinical data among patients with or without CHD |
2.1.2 冠心病影响因素的logistic回归分析
单因素logistic回归分析显示,男性、年龄、吸烟、高血压病、HDL-C、LDL-C、血肌酐、白细胞计数、CRP、白蛋白、PLR、NLR、MLR、SII、SIRI和SIIRI均有统计学意义。共线性诊断提示SII、SIRI、PLR、NLR、MLR和SIIRI的方差膨胀因子均>10、容忍度<0.1,考虑主要研究SIIRI,故去除SII、SIRI、PLR、NLP和MLR。将男性、吸烟、高血压病、年龄、HDL-C、LDL-C、血肌酐、白细胞计数、CRP、白蛋白和SIIRI纳入多因素二元logistic回归模型,结果如表 2所示,男性、年龄、LDL-C和SIIRI是冠心病的独立危险因素。
|
|
表 2 CHD独立预测因素的logistic回归分析 Tab 2 Logistic regression analyses of independent predictors of CHD |
2.1.3 SIIRI、SII、SIRI、PLR、NLR和MLR对冠心病的预测价值
构建SIIRI、SII、SIRI、PLR、NLR和MLR预测冠心病的ROC曲线,SIIRI对冠心病的发生具有一定预测效能(AUC=0.809,95% CI 0.770~0.848)。经DeLong检验分析,SIIRI的预测能力高于SII(AUC=0.785,95% CI 0.745~0.825)、SIRI(AUC=0.728,95% CI 0.682~0.773)、PLR(AUC=0.704,95% CI 0.657~0.751)、NLR(AUC=0.682,95% CI 0.636~0.728)和MLR(AUC=0.645,95% CI 0.597~0.694),差异均有统计学意义(均P<0.05)。SIIRI最佳临界值为251.02×1018/L2,预测冠心病的灵敏度为58.9%,特异度为90.9%。见图 1。

|
图 1 SIIRI、SII、SIRI、PLR、NLR和MLR预测CHD的ROC曲线分析 Fig 1 ROC curve analysis of SIIRI, SII, SIRI, PLR, NLR, and MLR for predicting CHD SIIRI: Systemic immune-inflammation response index; SII: Systemic immune-inflammation index; SIRI: Systemic inflammatory response index; PLR: Platelet to lymphocyte ratio; NLR: Neutrophil to lymphocyte ratio; MLR: Monocyte to lymphocyte ratio; CHD: Coronary heart disease; ROC: Receiver operating characteristic; AUC: Area under curve. |
2.2 SIIRI与冠状动脉病变严重程度的关系 2.2.1 冠状动脉轻度狭窄和重度狭窄患者的临床资料比较
435例冠心病患者中冠状动脉轻度狭窄组163例、重度狭窄组272例。两组年龄、BMI、糖尿病患者占比、总胆固醇、甘油三酯、血肌酐、淋巴细胞计数和尿酸差异均无统计学意义(均P>0.05)。与冠状动脉轻度狭窄组相比,冠状动脉重度狭窄组男性和吸烟的患者比例高(均P<0.001)。冠状动脉重度狭窄组LDL-C、血红蛋白、白细胞计数、中性粒细胞计数、血小板计数、单核细胞计数、CRP、SIIRI、SII、SIRI、PLR、NLR和MLR均高于冠状动脉轻度狭窄组,而高血压病患者占比、HDL-C和白蛋白均低于冠状动脉轻度狭窄组(均P<0.05)。见表 3。
|
|
表 3 冠状动脉轻度狭窄组和重度狭窄组CHD患者的临床资料比较 Tab 3 Comparison of clinical data among CHD patients with mild or severe coronary artery stenosis |
2.2.2 冠心病患者冠状动脉重度狭窄影响因素的logistic回归分析
单因素logistic回归分析显示,男性、吸烟、HDL-C、LDL-C、白细胞计数、CRP、白蛋白、PLR、NLR、MLR、SII、SIRI和SIIRI有统计学意义。共线性诊断提示SII、SIRI、PLR、NLP、MLR和SIIRI的方差膨胀因子均>10、容忍度<0.1,考虑主要研究SIIRI,故去除SII、SIRI、PLR、NLP和MLR。将男性、吸烟、HDL-C、LDL-C、白细胞计数、CRP、白蛋白和SIIRI纳入多因素二元logistic回归模型,分析结果如表 4所示,LDL-C、白细胞计数和SIIRI是冠状动脉重度狭窄的独立危险因素,而白蛋白是冠状动脉重度狭窄的保护因素。
|
|
表 4 CHD患者冠状动脉重度狭窄独立预测因素的logistic回归分析 Tab 4 Logistic regression analyses of independent predictors of severe coronary artery stenosis in CHD patients |
2.2.3 SIIRI、SII、SIRI、PLR、NLR和MLR对冠心病患者冠状动脉重度狭窄的预测价值
ROC曲线分析显示,SIIRI对冠心病患者冠状动脉重度狭窄具有较好的预测效能(AUC=0.775,95% CI 0.732~0.819)。经DeLong检验分析,SIIRI的预测效能高于SII(AUC=0.755,95% CI 0.710~0.800)、SIRI(AUC=0.730,95% CI 0.684~0.777)、PLR(AUC=0.596,95% CI 0.544~0.648)、NLR(AUC=0.700,95% CI 0.651~0.749)和MLR(AUC=0.589,95% CI 0.536~0.642),差异均有统计学意义(均P<0.05)。SIIRI最佳临界值为304.86×1018/L2,预测冠心病患者冠状动脉重度狭窄的灵敏度为68.0%,特异度为79.1%。见图 2。

|
图 2 SIIRI、SII、SIRI、PLR、NLR和MLR预测CHD患者冠状动脉重度狭窄的ROC曲线分析 Fig 2 ROC curve analysis of SIIRI, SII, SIRI, PLR, NLR, and MLR for predicting severe coronary artery stenosis in CHD patients SIIRI: Systemic immune-inflammation response index; SII: Systemic immune-inflammation index; SIRI: Systemic inflammatory response index; PLR: Platelet to lymphocyte ratio; NLR: Neutrophil to lymphocyte ratio; MLR: Monocyte to lymphocyte ratio; CHD: Coronary heart disease; ROC: Receiver operating characteristic; AUC: Area under curve. |
2.3 Gensini评分与SIIIRI的相关性
冠状动脉重度狭窄组的SIIRI[420.75×1018(238.76×1018,810.13×1018)/L2]高于非冠心病组[121.25×1018(91.17×1018,194.41×1018)/L2]和冠状动脉轻度狭窄组[185.41×1018(127.39×1018,294.07×1018)/L2],差异有统计学意义(H=181.915,P<0.001)。Spearman秩相关分析显示,Gensini评分与SIIRI(rs=0.431,P<0.001)、SII(rs=0.419,P<0.001)、SIRI(rs=0.401,P<0.001)、PLR(rs=0.249,P<0.001)、NLR(rs=0.372,P<0.001)和MLR(rs=0.293,P<0.001)呈正相关。
2.4 SIIRI对冠心病患者行PCI治疗后发生MACE的预测价值对435例冠心病患者进行随访,成功随访216例患者,根据是否发生MACE分为MACE组(77例)和非MACE组(139例)。两组性别、年龄、BMI、高血压病、糖尿病、总胆固醇、甘油三酯、HDL-C、LDL-C、血肌酐、血红蛋白、白蛋白差异均无统计学意义(均P>0.05)。与非MACE组相比,MACE组吸烟患者占比较高(P=0.009)。MACE组白细胞计数、中性粒细胞计数、单核细胞计数、CRP、尿酸、SIIRI、SII、SIRI、PLR、NLR、MLR均高于非MACE组,而淋巴细胞计数低于非MACE组(均P<0.05)。见表 5。单因素Cox回归分析显示,吸烟、白细胞计数、CRP、尿酸、SIIRI、PLR、NLR、MLR、SII和SIRI有统计学意义。共线性诊断提示SII、SIRI、PLR、NLP、MLR和SIIRI的方差膨胀因子均>10、容忍度<0.1,考虑主要研究SIIRI,故去除SII、SIRI、PLR、NLP和MLR。将吸烟、白细胞计数、CRP、尿酸和SIIRI纳入多因素Cox回归模型,结果如表 6所示,吸烟、CRP和SIIRI是冠心病患者行PCI治疗后发生MACE的独立危险因素。
|
|
表 5 非MACE组和MACE组CHD患者的临床资料比较 Tab 5 Comparison of clinical data of CHD patients between non-MACE group and MACE group |
|
|
表 6 CHD患者行PCI治疗后发生远期MACE预测因素的Cox比例风险回归分析 Tab 6 Cox proportional hazard regression analyses of predictors of long-term MACEs in CHD patients after PCI |
依据SIIRI预测冠心病患者冠状动脉重度狭窄的临界值304.86×1018/L2,将患者分为高SIIRI组和低SIIRI组,Kaplan-Meier生存曲线如图 3所示。经log-rank检验分析,高SIIRI组患者的无MACE生存率低于低SIIRI组患者,差异有统计学意义(χ2=24.58,P<0.001)。

|
图 3 不同SIIRI组CHD患者的Kaplan-Meier生存曲线 Fig 3 Kaplan-Meier survival curves of CHD patients in different SIIRI groups High SIIRI group: SIIRI≥304.86×1018/L2; Low SIIRI group: SIIRI < 304.86×1018/L2. SIIRI: Systemic immune-inflammation response index; CHD: Coronary heart disease; MACE: Major adverse cardiovascular event. |
ROC曲线分析显示,SIIRI对冠心病患者经PCI治疗后发生MACE具有一定预测效能(AUC=0.798,95% CI 0.732~0.864)。经DeLong检验分析,SIIRI的预测能力高于SII(AUC=0.719,95% CI 0.645~0.792)、SIRI(AUC=0.788,95% CI 0.721~0.856)、PLR(AUC=0.613,95% CI0.535~0.691)、NLR(AUC=0.704,95% CI 0.629~0.780)和MLR(AUC=0.729,95% CI 0.657~0.800),差异均有统计学意义(均P<0.05)。SIIRI最佳临界值为650.23×1018/L2,预测MACE的灵敏度为71.4%,特异度为84.9%。见图 4。
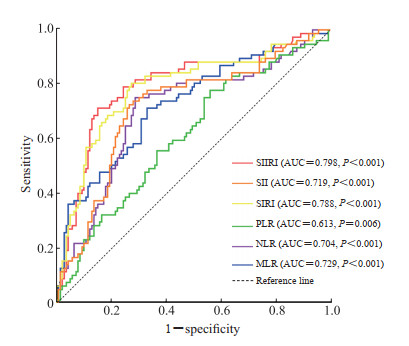
|
图 4 SIIRI、SII、SIRI、PLR、NLR和MLR预测CHD患者行PCI治疗后发生远期MACE的ROC曲线分析 Fig 4 ROC curve analysis of SIIRI, SII, SIRI, PLR, NLR, and MLR for predicting long-term MACEs in CHD patients after PCI SIIRI: Systemic immune-inflammation response index; SII: Systemic immune-inflammation index; SIRI: Systemic inflammatory response index; PLR: Platelet to lymphocyte ratio; NLR: Neutrophil to lymphocyte ratio; MLR: Monocyte to lymphocyte ratio; CHD: Coronary heart disease; PCI: Percutaneous coronary intervention; MACE: Major adverse cardiovascular event; ROC: Receiver operating characteristic; AUC: Area under curve. |
3 讨论
炎症是冠心病发生和发展的重要危险因素,本研究讨论了复合炎症指标SIIRI与冠心病患者冠状动脉病变严重程度的相关性,并提出SIIRI能更好地预测冠心病患者远期MACE的发生风险。通过比较SIIRI与其他传统炎症指标(SII、SIRI、PLR、NLP和MLR)的AUC值证明其预测冠心病患者冠状动脉病变严重程度及远期MACE的优越性。相关性分析也显示SIIRI与Gensini评分呈正相关,说明SIIRI越高冠状动脉病变越严重。Kaplan-Meier生存曲线分析显示,高SIIRI组患者无MACE生存率低于低SIIRI组。多因素二元logistic回归分析结果表明SIIRI是冠心病及冠状动脉重度狭窄的独立危险因素,同时多因素Cox比例风险回归分析结果支持SIIRI是冠心病患者经PCI治疗后发生远期MACE的独立危险因素。
炎症反应、免疫机制与代谢因素参与动脉粥样硬化的发生和发展。具体来说,中性粒细胞分泌的炎症物质导致内皮功能紊乱和血管壁退化,并且促进单核细胞、巨噬细胞和树突状细胞招募和激活,从而引发炎症和动脉粥样硬化性改变[13-15]。单核细胞被激活后,合成炎症因子导致血管内皮功能障碍[16-18]。血小板可能通过释放趋化因子、促炎细胞因子和血小板源性生长因子促进内皮细胞耗竭[17-20]。中性粒细胞和血小板相互作用、凝血因子裂解、促血栓分子释放和单核细胞浸润加速了动脉粥样硬化并引起血管斑块不稳定,甚至引发斑块破裂、血栓形成,最终导致心血管事件[17-18]。相反,淋巴细胞具有抗动脉粥样硬化的作用[20-21]。抑制炎症可在一定程度上延缓动脉粥样硬化的发展,降低心血管事件的发生率[22]。因此,中性粒细胞、单核细胞、血小板、淋巴细胞等对冠心病的发生和严重程度具有预测价值,而且相较于单一细胞成分或生物化学指标,NLR、MLR、PLR等组合指标的预测价值可能更高。
SII、SIRI是复合炎症指标,SII通过中性粒细胞计数、淋巴细胞计数和血小板计数计算得出。Liu等[23]证实SII对冠心病的发生和严重程度的预测能力优于NLR、PLR和CRP。Yang等[24]的研究结果显示,SII是冠心病患者发生不良心血管事件的独立危险因素。SIRI是将SII中的血小板换为单核细胞进行类似计算得出的参数。Han等[25]证实SIRI是急性冠状动脉综合征患者经PCI治疗后发生不良心血管事件的独立危险因素,可为接受PCI的急性冠状动脉综合征患者提供增量预后信息。SIIRI作为一种新的标志物,由Mangalesh等[9]在2024年首次报道并用于急性冠状动脉综合征患者冠状动脉病变严重程度的预测。SIIRI是结合SII、SIRI而成的复合炎症标志物,理论上对冠状动脉病变严重程度及远期不良心血管事件的预测能力比传统炎症指标更好。
本研究探索了SIIRI与冠心病患者冠状动脉狭窄程度及其远期MACE的相关性,具有一定的创新性。采用Gensini积分、病变血管支数评价冠状动脉病变情况,确保了冠状动脉病变程度描述的客观性,研究结果较为客观、准确。本研究结果表明,SIIRI与冠心病患者冠状动脉狭窄的严重程度呈正相关,并且SIIRI对冠状动脉病变严重程度的预测能力优于SII、SIRI、PLR、NLR和MLR。此外,SIIRI对冠心病患者行PCI治疗后远期MACE的预测能力也优于SII、SIRI、PLR、NLR和MLR。
本研究有以下不足之处:(1)使用Gensini积分评价冠状动脉病变情况具有一定的局限性,评分系统未包括分支病变、扭曲病变及钙化病变等特征;(2)排除了患有陈旧性心肌梗死、缺血性脑卒中、肺栓塞、主动脉夹层、急/慢性肾炎、急/慢性感染性疾病、血液系统疾病、恶性肿瘤、自身免疫病的患者,研究结果不能推广到所有患者。在未来的研究中,SIIRI的实用性有待进一步探索。
综上所述,SIIRI是冠心病及其冠状动脉病变严重程度的独立危险因素,也是冠心病患者PCI治疗后发生远期MACE的独立危险因素。SIIRI在冠心病、冠状动脉病变严重程度及PCI治疗后发生远期MACE方面的预测价值优于SII、SIRI等炎症指标。总之,SIIRI作为一个容易获得且成本低的指标,对于协助临床医师早期做出诊断、及时制定治疗方案、提高患者生活质量具有重要价值。
| [1] |
GUPTA M D, GUPTA P, MP G, et al. Risk factors for myocardial infarction in very young South Asians[J]. Curr Opin Endocrinol Diabetes Obes, 2020, 27(2): 87-94. DOI:10.1097/MED.0000000000000532 |
| [2] |
ZHAO Z, ZHANG X, SUN T, et al. Prognostic value of systemic immune-inflammation index in CAD patients: systematic review and meta-analyses[J]. Eur J Clin Invest, 2024, 54(2): e14100. DOI:10.1111/eci.14100 |
| [3] |
李燕杰, 杜晓, 刘存梅. 12导联动态心电图对冠心病心肌缺血的临床诊断价值分析[J]. 包头医学, 2023, 47(4): 21-22, 56. DOI:10.3969/j.issn.1007-3507.2023.04.008 |
| [4] |
周明洋. 冠心病早防早治三步走[J]. 家庭生活指南, 2020(3): 215. |
| [5] |
MALAKAR A K, CHOUDHURY D, HALDER B, et al. A review on coronary artery disease, its risk factors, and therapeutics[J]. J Cell Physiol, 2019, 234(10): 16812-16823. DOI:10.1002/jcp.28350 |
| [6] |
徐梦媛. 血小板/淋巴细胞比值、中性粒细胞/淋巴细胞比值对冠心病患者诊断价值的研究[D]. 青岛: 青岛大学, 2021.
|
| [7] |
赵贺, 赵东明. 单核细胞与高密度脂蛋白比值及单核细胞与淋巴细胞比值在冠心病中的研究[J]. 医学信息, 2020, 33(23): 31-33, 37. DOI:10.3969/j.issn.1006-1959.2020.23.010 |
| [8] |
杲建波, 马瑞聪, 刘春蕊, 等. 全身免疫炎症指数对急性心肌梗死患者直接经皮冠状动脉介入治疗术后院内主要不良心血管事件的预测价值[J]. 临床急诊杂志, 2022, 23(3): 192-197. DOI:10.13201/j.issn.1009-5918.2022.03.006 |
| [9] |
MANGALESH S, DUDANI S, MAHESH N K. Development of a novel inflammatory index to predict coronary artery disease severity in patients with acute coronary syndrome[J]. Angiology, 2024, 75(3): 231-239. DOI:10.1177/00033197231151564 |
| [10] |
RYAN T J, BAUMAN W B, KENNEDY J W, et al. Guidelines for percutaneous transluminal coronary angioplasty. A report of the American Heart Association/American College of Cardiology Task Force on Assessment of Diagnostic and Therapeutic Cardiovascular Procedures (Committee on Percutaneous Transluminal Coronary Angioplasty)[J]. Circulation, 1993, 88(6): 2987-3007. DOI:10.1161/01.cir.88.6.2987 |
| [11] |
GENSINI G G. A more meaningful scoring system for determining the severity of coronary heart disease[J]. Am J Cardiol, 1983, 51(3): 606. DOI:10.1016/s0002-9149(83)80105-2 |
| [12] |
SULLIVAN D R, MARWICK T H, FREEDMAN S B. A new method of scoring coronary angiograms to reflect extent of coronary atherosclerosis and improve correlation with major risk factors[J]. Am Heart J, 1990, 119(6): 1262-1267. DOI:10.1016/s0002-8703(05)80173-5 |
| [13] |
DÖRING Y, DRECHSLER M, SOEHNLEIN O, et al. Neutrophils in atherosclerosis: from mice to man[J]. Arterioscler Thromb Vasc Biol, 2015, 35(2): 288-295. DOI:10.1161/ATVBAHA.114.303564 |
| [14] |
孙慧娟, 朱鏐娈, 曾辉, 等. 中性粒细胞对动脉粥样硬化免疫机制影响的研究进展[J]. 中华临床医师杂志(电子版), 2019, 13(7): 544-547. DOI:10.3877/cma.j.issn.1674-0785.2019.07.013 |
| [15] |
FERNÁNDEZ-RUIZ I. Neutrophil-driven SMC death destabilizes atherosclerotic plaques[J]. Nat Rev Cardiol, 2019, 16(8): 455. DOI:10.1038/s41569-019-0214-1 |
| [16] |
MOORE K J, SHEEDY F J, FISHER E A. Macrophages in atherosclerosis: a dynamic balance[J]. Nat Rev Immunol, 2013, 13(10): 709-721. DOI:10.1038/nri3520 |
| [17] |
JENNINGS L K. Mechanisms of platelet activation: need for new strategies to protect against platelet-mediated atherothrombosis[J]. Thromb Haemost, 2009, 102(2): 248-257. DOI:10.1160/TH09-03-0192 |
| [18] |
NAGY B Jr, MISZTI-BLASIUS K, KERENYI A, et al. Potential therapeutic targeting of platelet-mediated cellular interactions in atherosclerosis and inflammation[J]. Curr Med Chem, 2012, 19(4): 518-531. DOI:10.2174/092986712798918770 |
| [19] |
MULHOLLAND M, JAKOBSSON G, LEI Y, et al. IL-2Rβγ signalling in lymphocytes promotes systemic inflammation and reduces plasma cholesterol in atherosclerotic mice[J]. Atherosclerosis, 2021, 326: 1-10. DOI:10.1016/j.atherosclerosis.2021.04.010 |
| [20] |
KYAW T, PETER K, LI Y, et al. Cytotoxic lymphocytes and atherosclerosis: significance, mechanisms and therapeutic challenges[J]. Br J Pharmacol, 2017, 174(22): 3956-3972. DOI:10.1111/bph.13845 |
| [21] |
WEBER C, ZERNECKE A, LIBBY P. The multifaceted contributions of leukocyte subsets to atherosclerosis: lessons from mouse models[J]. Nat Rev Immunol, 2008, 8(10): 802-815. DOI:10.1038/nri2415 |
| [22] |
NÚÑEZ J, MIÑANA G, BODÍ V, et al. Low lymphocyte count and cardiovascular diseases[J]. Curr Med Chem, 2011, 18(21): 3226-3233. DOI:10.2174/092986711796391633 |
| [23] |
LIU Y, YE T, CHEN L, et al. Systemic immune-inflammation index predicts the severity of coronary stenosis in patients with coronary heart disease[J]. Coron Artery Dis, 2021, 32(8): 715-720. DOI:10.1097/MCA.0000000000001037 |
| [24] |
YANG Y L, WU C H, HSU P F, et al. Systemic immune-inflammation index (SⅡ) predicted clinical outcome in patients with coronary artery disease[J]. Eur J Clin Invest, 2020, 50(5): e13230. DOI:10.1111/eci.13230 |
| [25] |
HAN K, SHI D, YANG L, et al. Prognostic value of systemic inflammatory response index in patients with acute coronary syndrome undergoing percutaneous coronary intervention[J]. Ann Med, 2022, 54(1): 1667-1677. DOI:10.1080/07853890.2022.2083671 |
 2024, Vol. 45
2024, Vol. 45


