2. 上海中医药大学附属岳阳中西医结合医院药学部, 上海 200437;
3. 海军军医大学(第二军医大学)第一附属医院虹口院区药剂科, 上海 200081
2. Department of Pharmacy, Yueyang Hospital of Integrated Traditional Chinese and Western Medicine, Shanghai University of Traditional Chinese Medicine, Shanghai 200437, China;
3. Department of Pharmacy, Hongkou Branch of The First Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200081, China
高尿酸血症(hyperuricemia,HUA)是由嘌呤代谢紊乱、尿酸(uric acid,UA)生成增多或排泄异常等导致体内UA>420 μmol/L而引起的一种代谢障碍性疾病[1]。流行病学研究显示,国内HUA患病率从1980年的1.4%逐渐上升至2019年的14.1%,且仍以每年约1%的速度递增[2-3]。目前,HUA与高血压、糖尿病、高脂血症统称为“四高”疾病,严重危害公众健康。研究发现,UA水平过高不仅会导致痛风及肾损伤,还会引起骨质疏松、骨关节炎等骨代谢异常,晚期可见骨侵蚀,甚至诱发骨折、畸形,有致残风险[4-6]。
临床上,常用于治疗HUA的药物主要有抑制UA合成的别嘌醇(allopurinol,ALLO)和促进UA排泄的苯溴马隆等,暂无特异性调控HUA骨代谢异常的药物。此外,临床用药面临着许多痛难点问题,如长期服药会诱发肝肾毒性、胃肠道反应、皮肤黏膜损害、骨髓抑制等不良反应,促UA排泄剂难以用于HUA伴肾功能不全患者,药物联合使用会增加用药风险等[7-8]。因此,开发具有多重抗HUA作用的药物是当前医疗研究的重点攻关方向。
啤酒花(Humulus lupulus L.)中以黄腐酚(xanthohumol,XAN)为代表的异戊烯基黄酮类成分具有抗炎、抗氧化、抗肿瘤、降血压、降血糖、抗骨质疏松、雌激素样作用等效用[9-10]。有研究表明,XAN可降低黄嘌呤氧化酶(xanthine oxidase,XOD)活性[11-12]。本课题组前期通过小鼠骨质疏松模型发现XAN可以减少骨丢失、维持骨稳态,体外实验证实其具有调控骨代谢作用[13-17]。本实验通过构建HUA大鼠模型,考察XAN降低HUA大鼠UA水平及调节骨代谢的作用,为HUA防治的新药研发提供依据。
1 材料和方法 1.1 实验动物及分组SPF级雄性Wistar大鼠48只,体重(150±10)g,购自上海斯莱克实验动物有限责任公司[合格证号:20220004024235;动物生产许可证号:SCXK(沪)2022-0004]。所有大鼠饲养于海军军医大学(第二军医大学)药学系动物中心。大鼠经适应性饲养1周后,随机分为空白组、模型组、ALLO组、XAN低剂量(XAN low-dose,XAN-L)组、XAN中剂量(XAN medium-dose,XAN-M)组、XAN高剂量(XAN high-dose,XAN-H)组,每组8只。研究期间,所有动物实验均符合海军军医大学(第二军医大学)动物实验伦理和使用原则。
1.2 药物、主要试剂与仪器XAN标准品(货号8065102,上海历鼎生物技术有限公司),氧嗪酸钾、次黄嘌呤(货号分别为38139C、76897C)购于上海泰坦科技股份有限公司,ALLO(货号78683,江苏坛墨质检科技股份有限公司),羧甲基纤维素钠(carboxymethyl cellulose sodium,CMC-Na;货号C104985,上海阿拉丁生化科技股份有限公司)。UA、尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,CRE)、XOD检测试剂盒(货号分别为C012-2-1、C013-2-1、C011-2-1、A002-1-1)均购于南京建成生物工程研究所;Runt相关转录因子2(Runt-related transcription factor 2,Runx2)、核因子κB受体活化因子配体(receptor activator of nuclear factor kappa B ligand,RANKL)、护骨因子(osteoprotegerin,OPG)、组织蛋白酶K(cathepsin K,CTSK)、碱性磷酸酶(alkaline phosphatase,ALP;货号分别为ER1313、ER1604、ER1212、ER0269、ER0761)检测试剂盒均购于武汉菲恩生物科技有限公司。
JA1003型电子天平(上海舜宇恒平科学仪器有限公司),BT25S型精密电子天平(德国Sartorius公司),UV-6100 PCS型紫外分光光度计(上海美谱达仪器有限公司),DL-1000B型超声波清洗溶解器(上海之信仪器有限公司),MX-S型可调式涡旋混合器(北京大龙兴创实验仪器有限公司),DHG-9240A型电热恒温鼓风干燥箱(上海一恒科学仪器有限公司),CKX53型倒置生物显微镜(含荧光)(日本Olympus公司),TGL16M型离心机(上海安亭科学仪器厂);ELX800型酶标仪(美国Bio-Tex公司)。
1.3 药物制备 1.3.1 0.5% CMC-Na混悬液称取CMC-Na粉末500 mg,于75 ℃水浴下加入适量蒸馏水不断搅拌均匀、分散,最终定容至100 mL,即得0.5% CMC-Na混悬液。
1.3.2 造模药混悬液称取氧嗪酸钾粉末1 g和次黄嘌呤粉末1.25 g,研磨分散均匀后转移至50 mL 0.5% CMC-Na中,涡旋并超声溶解混悬均匀,即得造模药混悬液(氧嗪酸钾20 mg/mL,次黄嘌呤25 mg/mL)。
1.3.3 ALLO混悬液称取ALLO粉末100 mg,加入50 mL 0.5% CMC-Na,涡旋并超声溶解混悬均匀,即得ALLO混悬液(2 mg/mL)。
1.3.4 XAN混悬液称取XAN粉末25、75、225 mg,分别转移至50 mL 0.5% CMC-Na中,涡旋并超声溶解混悬均匀,即得不同浓度的XAN混悬液(0.5、1.5、4.5 mg/mL)。
1.4 动物处置方案根据文献报道[18]及课题组预实验结果设定用药剂量。造模时,除空白组给予同体积0.5% CMC-Na外,其余5组给予造模药(氧嗪酸钾200 mg·kg-1·d-1、次黄嘌呤250 mg·kg-1·d-1)灌胃。造模2 h后,除空白组和模型组给予同体积0.5% CMC-Na外,XAN用药组分别给予低、中、高浓度的XAN混悬液(5、15、45 mg·kg-1·d-1)灌胃,ALLO组给予ALLO混悬液(20 mg·kg-1·d-1)灌胃,每天灌胃2次,连续干预14 d。
1.5 取材和检测第3、7、10、14天于大鼠眼眶取血,5 180×g离心10 min取上清,按照试剂盒说明检测各组大鼠血清中UA、CRE、BUN和XOD水平。实验结束时检测各组大鼠血清中ALP、Runx2、CTSK、RANKL和OPG水平。
1.6 统计学处理应用GraphPad Prism 9.0软件进行统计学分析。实验数据以x±s表示,经过正态性检验且方差齐时,多组间比较采用单因素方差分析,多重比较采用Newman-Keuls检验;若方差不齐则对数据进行适当的变量转换,满足方差齐性后,用转换后的数据进行统计。检验水准(α)为0.05。
2 结果 2.1 XAN对HUA大鼠血清UA水平的影响第3、7、10、14天,模型组大鼠血清UA水平均高于空白组(均P<0.01),表明大鼠HUA模型构建成功。XAN-M、XAN-H组大鼠血清UA水平在第3、7、10、14天均低于模型组(均P<0.01),而XAN-L组大鼠血清UA水平从第7天开始才低于模型组(均P<0.01)。第14天时,XAN-M、XAN-H组大鼠血清UA水平与ALLO组相比差异无统计学意义(均P>0.05)。结果提示,XAN具有良好的降低HUA大鼠血清UA水平的作用。见表 1。
|
|
表 1 XAN对HUA大鼠血清UA水平的影响 Tab 1 Effect of XAN on serum UA levels in HUA rats |
2.2 XAN对HUA大鼠血清XOD活性的影响
第3、7、10、14天,模型组大鼠血清XOD活性高于空白组(均P<0.01),表明HUA模型大鼠XOD活性明显升高;与模型组相比,ALLO组和XAN各剂量组大鼠血清XOD活性均下降(均P<0.01)。从第7天开始,XAN各剂量组大鼠血清XOD活性与ALLO组相比差异均无统计学意义(均P>0.05)。结果提示,XAN能显著抑制大鼠血清XOD活性,从而减少UA合成,发挥降UA作用。见表 2。
|
|
表 2 XAN对HUA大鼠血清XOD活性的影响 Tab 2 Effect of XAN on serum XOD activities in HUA rats |
2.3 XAN对HUA大鼠肾功能指标的影响 2.3.1 血清CRE
第3、7、10、14天,模型组大鼠血清CRE水平均高于空白组(均P<0.01),表明HUA模型大鼠伴发肾功能不全;与模型组相比,ALLO组和XAN各剂量组大鼠血清CRE水平均有不同程度的下降(第14天XAN-L组除外,均P<0.01),且XAN-H组与ALLO组效果相当。第3、7、10、14天,XAN-H组大鼠血清CRE水平与空白组相比差异无统计学意义(均P>0.05)。结果提示,XAN能有效降低HUA大鼠血清CRE水平,改善HUA诱发的肾损伤,具有肾脏保护作用。见表 3。
|
|
表 3 XAN对HUA大鼠血清CRE水平的影响 Tab 3 Effect of XAN on serum CRE levels in HUA rats |
2.3.2 血清BUN
第3、7、10、14天,模型组大鼠血清BUN水平高于空白组(均P<0.05),表明HUA模型大鼠伴发肾功能不全;与模型组相比,ALLO组和XAN各剂量组大鼠血清BUN水平均有不同程度的下降(第7、10天XAN-L组除外,均P<0.05)。结果提示,中、高剂量的XAN能有效降低HUA大鼠血清BUN水平,防止HUA诱发的肾损伤,具有较好的肾脏保护作用。见表 4。
|
|
表 4 XAN对HUA大鼠血清BUN水平的影响 Tab 4 Effect of XAN on serum BUN levels in HUA rats |
2.4 XAN对HUA大鼠骨代谢指标的影响
如图 1A所示,模型组大鼠血清ALP活性低于空白组(P<0.01),表明HUA模型大鼠骨形成受到抑制;与模型组相比,ALLO组和XAN各剂量组大鼠血清ALP活性均得到不同程度的纠正(均P<0.01),表明XAN能够上调HUA大鼠血清ALP活性,促进骨形成。如图 1B所示,模型组大鼠血清Runx2水平低于空白组(P<0.01),表明HUA模型大鼠骨转换受到抑制;与模型组相比,XAN-M、XAN-H及ALLO组大鼠血清Runx2水平升高(均P<0.01),XAN-H组与空白组相比差异无统计学意义(P>0.05),表明XAN能够上调HUA大鼠血清Runx2水平,促进骨转换。如图 1C所示,模型组大鼠血清CTSK水平高于空白组(P<0.01),表明HUA模型大鼠体内骨破坏明显增强;与模型组相比,XAN各剂量组及ALLO组大鼠血清CTSK水平下降(均P<0.01),XAN-M、XAN-H组大鼠血清CTSK水平低于空白组(均P<0.05),表明XAN能够抑制HUA大鼠血清CTSK的表达,抑制骨破坏,发挥骨保护作用。
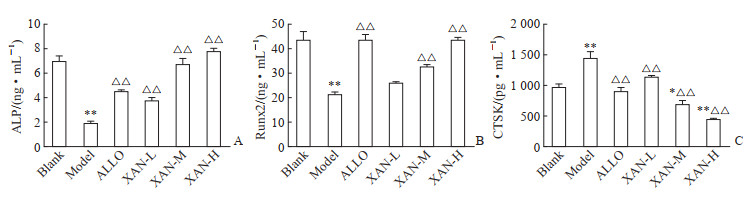
|
图 1 XAN对HUA大鼠骨代谢指标的影响 Fig 1 Effect of XAN on indexes of bone metabolism in HUA rats A: Serum ALP; B: Serum Runx2; C: Serum CTSK. *P < 0.05, **P < 0.01 vs blank group; △△P < 0.01 vs model group. n=8, x±s. XAN: Xanthohumol; HUA: Hyperuricemia; ALP: Alkaline phosphatase; Runx2: Runt-related transcription factor 2; CTSK: Cathepsin K; ALLO: Allopurinol; XAN-L: Xanthohumol low-dose; XAN-M: Xanthohumol medium-dose; XAN-H: Xanthohumol high-dose. |
2.5 XAN对HUA大鼠RANKL/OPG信号通路蛋白表达的影响
如图 2A所示,与空白组相比,模型组大鼠血清中RANKL表达增多(P<0.01),表明HUA大鼠体内大量分泌RANKL。与模型组相比,ALLO组和XAN各剂量组大鼠血清中RANKL表达减少(均P<0.01),表明XAN能够抑制RANKL的分泌。如图 2B所示,模型组大鼠血清中OPG水平低于空白组(P<0.01),而XAN-H组OPG的表达上调(P<0.01)。如图 2C所示,模型组RANKL/OPG比值高于空白组(P<0.01),而ALLO组及XAN各剂量组该比值不同程度下降(均P<0.05),且XAN-M、XAN-H组该比值与空白组相比差异无统计学意义(均P>0.05)。结果提示,XAN可能是通过RANKL/OPG信号通路发挥骨代谢调控作用。

|
图 2 XAN对HUA大鼠RANKL/OPG信号通路蛋白表达的影响 Fig 2 Effect of XAN on the expression of RANKL/OPG signaling pathway proteins in HUA rats A: Serum RANKL; B: Serum OPG; C: RANKL/OPG ratio in serum. **P < 0.01 vs blank group; △P < 0.05, △△P < 0.01 vs model group. n=8, x±s. XAN: Xanthohumol; HUA: Hyperuricemia; RANKL: Receptor activator of nuclear factor kappa B ligand; OPG: Osteoprotegerin; ALLO: Allopurinol; XAN-L: Xanthohumol low-dose; XAN-M: Xanthohumol medium-dose; XAN-H: Xanthohumol high-dose. |
3 讨论
XOD是催化黄嘌呤和次黄嘌呤转化为UA的关键酶,XOD活性过高会导致UA过度合成。本研究证实XAN通过抑制XOD活性减少UA产生,有效降低血UA水平,这也是临床一线药物ALLO等XOD抑制剂的作用机制。此外,UA主要通过肾脏排泄,而CRE和BUN是衡量肾功能的重要指标,UA排泄剂通过影响肾小管的重吸收和肾脏排泄功能,减少UA的重吸收,促进UA排出体外[19]。但是在HUA伴肾功能不全患者中,UA排泄剂的疗效和安全性受限,这是该类药物的痛点问题[8]。为考察XAN对急、慢性HUA大鼠血UA水平及肾功能的影响,以及在HUA伴肾功能不全的情况下XAN的降UA效果,本实验选取第3、7、10、14天采集血样并检测分析。本研究发现,从第3天开始,XAN-M、XAN-H组大鼠血清UA水平下降,XOD活性下调,肾功能指标CRE和BUN明显降低,且第14天与ALLO组效果相当,表明中、高剂量XAN对急、慢性HUA都有治疗作用,且其降血清UA及保护肾功能的效果与用药时间存在关联。低剂量XAN从第7天开始具有降血清UA作用,可见低剂量XAN对急性HUA降血清UA效果不明显,但能降低慢性HUA的血清UA水平;第3天XAN-L组血清CRE和BUN水平降低,但之后未见明显改善,可见其对急性HUA伴肾功能不全具有一定肾保护作用,但对慢性HUA伴肾功能不全的肾保护作用不明显。因此,XAN可以多靶点、多途径治疗急、慢性HUA伴肾功能不全,既可作为XOD抑制剂减少UA合成,又能作为肾保护剂增加UA排泄,属于相对理想、安全的治疗HUA及其并发症的潜在药物。
HUA导致骨代谢异常的机制与体内高UA水平及氧化应激状态等密切相关[20]。当UA水平过高时会抑制ALP活性,降低Ⅰ型胶原氨基端前肽和骨钙素等骨形成相关因子水平,并上调Ⅰ型胶原羧基末端肽等骨吸收相关因子表达,引起骨代谢失衡[21-24]。此外,嘌呤被分解为UA时产生大量活性氧(reactive oxygen species,ROS),触发氧化应激反应,不仅诱导成骨细胞凋亡、抑制Runx2和成骨细胞特异性转录因子Osterix表达、导致成骨细胞介导的骨形成减少[25],还激活破骨细胞分化,促进活化T细胞核因子1和抗酒石酸酸性磷酸酶等骨吸收相关蛋白的表达,导致骨破坏占据主导地位,最终造成骨质流失或骨侵蚀等[26-30]。本课题组前期证实,啤酒花和XAN可抑制氧化应激反应,清除ROS等氧化因子以发挥抗氧化作用,从而有效调控骨稳态[16-17]。本研究发现,XAN可增强HUA大鼠血清ALP活性,升高Runx2水平,促进骨形成;还能上调OPG水平,抑制RANKL分泌,调节RANKL/OPG比值,下调CTSK的表达,抑制骨吸收,发挥调控骨代谢作用。
综上所述,本研究首次证实XAN具有降UA作用,其还能同时改善肾功能及调控骨代谢,而其调控骨代谢的作用与RANKL/OPG信号通路有关。因此,XAN作为多靶点治疗HUA的潜在药物,对于HUA伴肾功能不全及骨代谢异常等的治疗有一定潜力,这为新药研发提供了一定依据,也为啤酒花植物资源的开发利用提供了新的思路与方向。
| [1] |
方宁远, 吕力为, 吕晓希, 等. 中国高尿酸血症相关疾病诊疗多学科专家共识(2023年版)[J]. 中国实用内科杂志, 2023, 43(6): 461-480. DOI:10.19538/j.nk2023060106 |
| [2] |
杨玉杰, 陆明, 朱垚. 高尿酸血症流行病学调查进展[J]. 保健医学研究与实践, 2023, 20(3): 173-177. DOI:10.11986/j.issn.1673-873X.2023.03.041 |
| [3] |
张超, 常岭迪, 冯伟, 等. 高尿酸血症发病机制与治疗策略的研究进展[J/OL]. 空军军医大学学报, 2023. (2023-10-08) [2024-03-01]. https://kns.cnki.net/kcms/detail/61.1526.R.20231007.1556.002.html.
|
| [4] |
DALBETH N, BECCE F, BOTSON J K, et al. Dual-energy CT assessment of rapid monosodium urate depletion and bone erosion remodelling during pegloticase plus methotrexate co-therapy[J]. Rheumatology (Oxford), 2022, 61(12): 4898-4904. DOI:10.1093/rheumatology/keac173 |
| [5] |
WANG Y, ZHOU R, ZHONG W, et al. Association of gout with osteoporotic fractures[J]. Int Orthop, 2018, 42(9): 2041-2047. DOI:10.1007/s00264-018-4033-5 |
| [6] |
ZONG Q, HU Y, ZHANG Q, et al. Associations of hyperuricemia, gout, and UA-lowering therapy with the risk of fractures: a meta-analysis of observational studies[J]. Joint Bone Spine, 2019, 86(4): 419-427. DOI:10.1016/j.jbspin.2019.03.003 |
| [7] |
BI L, JIANG T. Science popularization interventions on rational medication in patients with hyperuricemia[J]. Am J Health Behav, 2023, 47(1): 153-164. DOI:10.5993/AJHB.47.1.16 |
| [8] |
蔡莉, 詹勇慧. 降尿酸药物影响肾功能不全老年患者肾功能的研究进展[J]. 现代药物与临床, 2020, 35(10): 2105-2108. DOI:10.7501/j.issn.1674-5515.2020.10.036 |
| [9] |
GIRISA S, SAIKIA Q, BORDOLOI D, et al. Xanthohumol from hop: hope for cancer prevention and treatment[J]. IUBMB Life, 2021, 73(8): 1016-1044. DOI:10.1002/iub.2522 |
| [10] |
赵怡凡, 刘天鹏, 赵少川, 等. 啤酒花活性成分黄腐酚治疗骨质疏松症的机制研究进展[J]. 中国医药导报, 2022, 19(29): 34-37, 45. DOI:10.20047/j.issn1673-7210.2022.29.07 |
| [11] |
SCHEMPP H, VOGEL S, HÜCKELHOVEN R, et al. Re-evaluation of superoxide scavenging capacity of xanthohumol[J]. Free Radic Res, 2010, 44(12): 1435-1444. DOI:10.3109/10715762.2010.515216 |
| [12] |
CASSIDY C E, SETZER W N. Cancer-relevant biochemical targets of cytotoxic Lonchocarpus flavonoids: a molecular docking analysis[J]. J Mol Model, 2010, 16(2): 311-326. DOI:10.1007/s00894-009-0547-5 |
| [13] |
SUN X, XIA T, ZHANG S, et al. Hops extract and xanthohumol ameliorate bone loss induced by iron overload via activating Akt/GSK3β/Nrf2 pathway[J]. J Bone Miner Metab, 2022, 40(3): 375-388. DOI:10.1007/s00774-021-01295-2 |
| [14] |
XIA T, LIU X, WANG N, et al. PI3K/AKT/Nrf2 signalling pathway is involved in the ameliorative effects of xanthohumol on amyloid β-induced oxidative damage and bone loss[J]. J Pharm Pharmacol, 2022, 74(7): 1017-1026. DOI:10.1093/jpp/rgac007 |
| [15] |
夏天爽, 林柳悦, 蒋益萍, 等. 苦味酸类成分蛇麻酮和葎草酮对大鼠成骨细胞和破骨细胞的干预作用[J]. 第二军医大学学报, 2019, 40(1): 25-30. XIA T S, LIN L Y, JIANG Y P, et al. Intervening effects of lupulone and humulone in Humulus lupulus L. on osteoblasts and osteoclasts of rats[J]. Acad J Sec Mil Med Univ, 2019, 40(1): 25-30. DOI:10.16781/j.0258-879x.2019.01.0025 |
| [16] |
XIA T S, LIN L Y, ZHANG Q Y, et al. Humulus lupulus L. extract prevents ovariectomy-induced osteoporosis in mice and regulates activities of osteoblasts and osteoclasts[J]. Chin J Integr Med, 2021, 27(1): 31-38. DOI:10.1007/s11655-019-2700-z |
| [17] |
XU S, XIA T, ZHANG J, et al. Protective effects of bitter acids from Humulus lupulus L. against senile osteoporosis via activating Nrf2/HO-1/NQO1 pathway in D-galactose induced aging mice[J]. J Funct Foods, 2022, 94: 105099. DOI:10.1016/j.jff.2022.105099 |
| [18] |
孟晶, 田婧卓, 王连嵋, 等. 适宜中药筛选的高尿酸血症动物模型初探[J]. 中国实验方剂学杂志, 2021, 27(17): 46-56. DOI:10.13422/j.cnki.syfjx.20211601 |
| [19] |
GUO X L, GAO Y Y, YANG Y X, et al. Amelioration effects of α-viniferin on hyperuricemia and hyperuricemia-induced kidney injury in mice[J]. Phytomedicine, 2023, 116: 154868. DOI:10.1016/j.phymed.2023.154868 |
| [20] |
XU R, LIAN D, XIE Y, et al. Relationship between serum uric acid levels and osteoporosis[J]. Endocr Connect, 2023, 12(11): e230040. DOI:10.1530/EC-23-0040 |
| [21] |
WU Z Q, CHEN X T, XU Y Y, et al. High uric acid (UA) downregulates bone alkaline phosphatase (BALP) expression through inhibition of its promoter activity[J]. Oncotarget, 2017, 8(49): 85670-85679. DOI:10.18632/oncotarget.21110 |
| [22] |
YAN D D, WANG J, HOU X H, et al. Association of serum uric acid levels with osteoporosis and bone turnover markers in a Chinese population[J]. Acta Pharmacol Sin, 2018, 39(4): 626-632. DOI:10.1038/aps.2017.165 |
| [23] |
WU Y, XIANG S, JIANG X, et al. Relationship of bone status with serum uric acid and bilirubin in men with type 2 diabetes: a cross-sectional study[J]. Med Sci Monit, 2021, 27: e930410. DOI:10.12659/MSM.930410 |
| [24] |
XU M, SU J, HAO J, et al. Positive association between serum uric acid and bone mineral density in Chinese type 2 diabetes mellitus stratified by gender and BMI[J]. J Bone Miner Metab, 2018, 36(5): 609-619. DOI:10.1007/s00774-017-0877-9 |
| [25] |
YAN B, LIU D, ZHU J, et al. The effects of hyperuricemia on the differentiation and proliferation of osteoblasts and vascular smooth muscle cells are implicated in the elevated risk of osteopenia and vascular calcification in gout: an in vivo and in vitro analysis[J]. J Cell Biochem, 2019, 120(12): 19660-19672. DOI:10.1002/jcb.29272 |
| [26] |
SAVIO L E B, LEITE-AGUIAR R, ALVES V S, et al. Purinergic signaling in the modulation of redox biology[J]. Redox Biol, 2021, 47: 102137. DOI:10.1016/j.redox.2021.102137 |
| [27] |
YANG K, LI J, TAO L. Purine metabolism in the development of osteoporosis[J]. Biomed Pharmacother, 2022, 155: 113784. DOI:10.1016/j.biopha.2022.113784 |
| [28] |
WANG F S, WU R W, CHEN Y S, et al. Biophysical modulation of the mitochondrial metabolism and redox in bone homeostasis and osteoporosis: how biophysics converts into bioenergetics[J]. Antioxidants (Basel), 2021, 10(9): 1394. DOI:10.3390/antiox10091394 |
| [29] |
WANG S, MA Q, XIE Z, et al. An antioxidant sesquiterpene inhibits osteoclastogenesis via blocking IPMK/TRAF6 and counteracts OVX-induced osteoporosis in mice[J]. J Bone Miner Res, 2021, 36(9): 1850-1865. DOI:10.1002/jbmr.4328 |
| [30] |
IANTOMASI T, ROMAGNOLI C, PALMINI G, et al. Oxidative stress and inflammation in osteoporosis: molecular mechanisms involved and the relationship with microRNAs[J]. Int J Mol Sci, 2023, 24(4): 3772. DOI:10.3390/ijms24043772 |
 2024, Vol. 45
2024, Vol. 45


