2. 海军军医大学(第二军医大学)第一附属医院麻醉科, 上海 200433
2. Department of Anesthesiology, The First Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200433, China
胰腺癌的恶性程度极高,绝大多数患者出现相关症状就诊或确诊时即已达晚期。胰腺癌对周围组织的侵袭性强,进展迅速,预后较差[1]。近年来随着医疗技术的进步,微创化已成为外科手术的发展趋势,在临床上衍生出腹腔镜手术、机器人辅助腹腔镜手术等多种微创手术方式[2-3]。2003年,Giulianotti等[4]首次报道了达芬奇机器人辅助胰腺手术,因其手术视野广、图像显影清晰、操作灵活精准等优势在胰腺外科领域受到关注。
优化围手术期监测对获得最佳围手术期结局至关重要。在诸多生命体征监测与管理中,围手术期体温管理是重点也是难点[5]。围手术期非计划性低体温是指围手术期患者核心体温低于36 ℃,其中术后发生的低体温现象又称作术后意外低体温(unexpected postoperative hypothermia,UPH)[6]。UPH是手术患者的常见并发症之一,发生率为20%~90%[7]。对于接受胰腺癌手术的患者,UPH可导致术后麻醉恢复延迟、围手术期失血量增加和术后感染风险增高,并可进一步导致包括不良心血管事件在内的严重并发症[8]。因此,识别UPH有助于更好地进行达芬奇机器人辅助胰腺癌手术患者的围手术期管理。本研究旨在探讨达芬奇机器人辅助腹腔镜胰腺癌手术UPH发生的危险因素,为今后在此类手术人群中加强UPH防控提供依据。
1 资料和方法 1.1 研究对象收集2020年12月至2021年12月在我院行达芬奇机器人辅助腹腔镜胰腺癌根治手术的患者1 375例,根据纳入、排除标准,共246例患者进入本研究,其中男80例、女166例。根据UPH的发生情况,将患者分为UPH组和非UPH组。纳入标准:(1)年龄18~75岁;(2)临床资料完整;(3)美国麻醉医师学会(American Society of Anesthesiologists,ASA)分级Ⅰ~Ⅲ级;(4)行达芬奇机器人辅助腹腔镜胰腺癌根治术。排除标准:达芬奇机器人辅助腹腔镜胰腺手术失败和/或未行根治性治疗。
本研究为回顾性研究,获得我院伦理委员会审批(CHE 2020-148)并豁免患者的知情同意,完成中国临床试验注册中心注册(注册号ChiCTR2200064418)。本研究严格遵守《药物临床试验质量管理规范》和《赫尔辛基宣言》。
1.2 数据采集利用患者ID号在我院Medical System麻醉数据中心检索收集临床数据。以中文术语“全身麻醉”和“胰腺”为关键词,检索时间为“2020-12-01至2021-12-31”,整合检索结果,剔除重复项及非本研究项。此外通过DoCare麻醉临床信息系统(V 5.0版本)及我院嘉和电子病例系统查询本研究所需的具体数据及记录。
1.3 麻醉实施所有患者术前均未接受任何精神或麻醉药物治疗。由医护人员使用配备海绵垫和毯子的转运车将患者运送至手术室等候区,并根据季节温度变化增减保温覆盖物。待准备好手术室环境和相关物品后,将患者转移到铺有床单的手术床上,连接心电监护,监测无创血压和血氧饱和度,开放上肢外周静脉进行补液治疗。麻醉诱导前采用红外鼓膜温度计(型号:ThermoScan IRT6520,德国Braun公司)测定患者体温,确保每次使用前按照仪器说明书予以校准。术前使用本院自制保暖垫覆盖患者的胸、肩、臂,术中全程使用输血输液加温仪(型号:HL-90,美国史密斯医疗ASD有限公司)给予深静脉通路补液。
使用丙泊酚、咪达唑仑、芬太尼和罗库溴铵通过静脉注射方式实施麻醉快速诱导。当麻醉深度达到气管插管要求时,用可视喉镜完成经口气管插管,成功后连接麻醉机进行机械通气。之后建立有创动脉监测和深静脉穿刺置管。麻醉维持采用静吸复合模式,使用七氟烷(1.5%~3.0%)联合静脉泵注丙泊酚(3~6 mg·kg-1·h-1)和瑞芬太尼(10~15 μg·kg-1·h-1)。术中根据患者生命体征及手术需要给予适当的血管活性药物,当出现低血压,心率低于60 min-1时静脉注射6 mg麻黄碱,心率超过100 min-1时静脉推注100 μg苯肾上腺素,未达治疗效果时可适量复给以上血管活性药物。当术中突发高血压或因病情需要控制性降压时,除补充镇痛药物外,可适当静脉给予乌拉地尔。患者在整个围手术期的血液动力学目标是平均动脉压不低于70 mmHg(1 mmHg=0.133 kPa),收缩压不低于100 mmHg。
1.4 临床信息收集收集的患者临床信息包括:(1)一般资料(年龄、性别、ASA分级、BMI、术前血红蛋白、术前白蛋白、基础体温等);(2)手术资料(手术方式、神经阻滞类型、麻醉时间、手术时间、人工气腹建立时间、术后体温、术后并发症、院内结局等);(3)围手术期液体管理资料(晶体液量、胶体液量、红细胞悬液量、新鲜冰冻血浆量、失血量、尿量等)。术后体温是指术后转至麻醉复苏室后的即刻体温,采用红外鼓膜温度计测量。
1.5 统计学处理应用SPSS 25.0软件进行统计学分析。呈正态分布的计量资料以x±s表示,组间比较采用方差分析,事后检验采用最小显著性差异法;非正态分布的计量资料以中位数(下四分位数,上四分位数)表示,组间比较采用Mann-Whitney U检验。计数资料以例数和百分数表示,组间比较采用χ2检验。建立结果变量为二值变量的多重logistic回归模型,分析发生UPH的影响因素,采用Hosmer-Lemeshow检验评估模型的拟合优度,绘制ROC曲线和决策曲线评价模型预测发生UPH的价值,并建立列线图模型。检验水准(α)为0.05。
2 结果 2.1 患者的一般资料和术后转归246例行达芬奇机器人辅助腹腔镜胰腺癌根治手术的患者中共117(47.6%)例发生UPH。与非UPH组(129例,52.4%)相比,UPH组患者的术后肺部并发症(P=0.039)和非肺部术后感染(P=0.018)的发生率均升高,总住院时间(P=0.001)延长,BMI(P=0.047)和术前血浆白蛋白水平(P=0.038)均较低。两组的年龄、性别、ASA分级、术前血红蛋白水平、基础体温及院内结局等的差异均无统计学意义(均P>0.05)。见表 1。
|
|
表 1 两组行达芬奇机器人辅助腹腔镜胰腺癌根治手术患者的一般资料、手术资料及围手术期液体管理资料比较 Tab 1 Comparison of general data, surgical data and perioperative fluid management data of 2 groups undergoing da Vinci robot-assisted laparoscopic radical surgery for pancreatic cancer |
2.2 患者围手术期资料分析
本研究的达芬奇机器人辅助手术方式有胰十二指肠切除术和部分胰腺切除术2种,UPH组中实施胰十二指肠切除术的患者比例高于非UPH组(P=0.042),手术时间(P=0.038)及术中人工气腹建立时间(P=0.004)均长于非UPH组。两组患者均实施了全身麻醉联合区域神经阻滞,UPH组患者以椎旁神经阻滞为主(P=0.004)。UPH组患者的术后体温低于非UPH组(P<0.001)。两组的麻醉时间及围手术期液体管理资料等的差异均无统计学意义(均P>0.05)。见表 1。
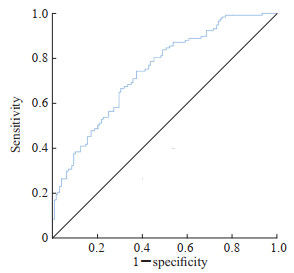
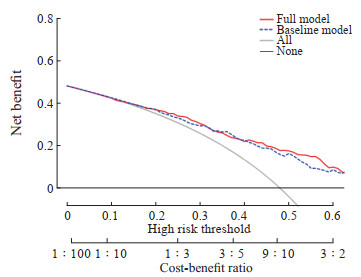
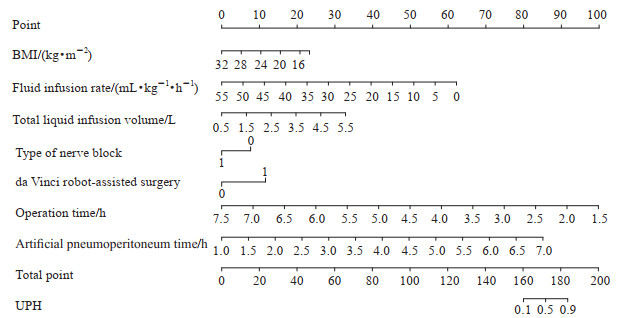
2.3 达芬奇机器人辅助手术发生UPH的影响因素分析结果变量为二值变量的多重logistic回归分析结果显示,达芬奇机器人辅助术式、BMI、手术时间、人工气腹建立时间、输液速率、输液总量、神经阻滞类型与UPH的发生具有独立相关性(表 2)。Hosmer-Lemeshow检验结果显示logistic回归模型的拟合效果较好(P<0.001)。ROC曲线分析结果显示,该模型AUC为0.739,取约登指数最大(0.406)时的临界值作为最佳临界值,其预测发生UPH的灵敏度为0.778,特异度为0.628(图 1)。决策曲线分析结果显示,该模型预测UPH的临床净收益较好(图 2)。建立的列线图模型见图 3。
|
|
表 2 行达芬奇机器人辅助腹腔镜胰腺癌根治手术患者发生UPH的危险因素分析 Tab 2 Risk factors for UPH in patients undergoing da Vinci robot-assisted laparoscopic radical surgery for pancreatic cancer |
|
图 1 行达芬奇机器人辅助腹腔镜胰腺癌根治手术患者UPH预测模型的ROC曲线 Fig 1 ROC curve of prediction model for UPH in patients undergoing da Vinci robot-assisted laparoscopic radical surgery for pancreatic cancer UPH: Unexpected postoperative hypothermia; ROC: Receiver operating characteristic. |
|
图 2 行达芬奇机器人辅助腹腔镜胰腺癌根治手术患者UPH预测模型的决策曲线 Fig 2 Decision curve of prediction model for UPH in patients undergoing da Vinci robot-assisted laparoscopic radical surgery for pancreatic cancer UPH: Unexpected postoperative hypothermia. |
|
图 3 行达芬奇机器人辅助腹腔镜胰腺癌根治手术患者UPH预测的列线图模型 Fig 3 Nomograph for UPH in patients undergoing da Vinci robot-assisted laparoscopic radical surgery for pancreatic cancer For type of nerve block, 1=Transversus abdominis plane block, 0=Paravertebral blockade; for da Vinci robot-assisted surgery, 1=Pancreaticoduodenectomy, 0=Partial pancreatectomy. UPH: Unexpected postoperative hypothermia; BMI: Body mass index. |
3 讨论
传统胰腺癌根治手术切除范围广,术中涉及组织器官多、整体创伤大,而达芬奇机器人辅助腹腔镜手术具有创伤小、精准度高、出血少、术后恢复快等优点,逐渐成为胰腺切除的主流手术方式[9]。手术患者出现UPH的现象较为普遍[7]。达芬奇机器人辅助手术系统在临床操作时均在3D成像下完成,内脏组织暴露环境时间短、范围小,全程治疗巾覆盖面广,患者的体温变化易被忽视。本研究对246例接受达芬奇机器人辅助腹腔镜胰腺癌根治手术患者的分析发现,UPH的发生率达47.6%(117/246),与文献报道[7]一致。手术患者核心温度过低不仅可以引发寒战、出血量增加、麻醉苏醒延迟、伤口感染概率增大,同时还会影响血氧、脉搏,可导致并发症[8, 10]。本研究中UPH组患者术后并发症的发生率较高,主要为肺部并发症(9.4%,11/117)和非肺部术后感染(18.8%,22/117),与既往研究结果[8]一致。
流行病学研究显示,肥胖、低体力活动和高能量饮食是胰腺癌发病的危险因素[11]。这些危险因素不仅在胰腺癌的发病中发挥作用,还会增加机体的产热。BMI是衡量人体健康状况的一个常用指标,其数值偏低提示该患者可能存在能量摄入不足或机体谢消耗增加的现象,低BMI是患者发生低核心体温的危险因素[12]。本研究以BMI作为评价患者肥胖程度的指标,虽然所有患者的年龄和性别构成相似,但UPH组患者的BMI更低。
本研究同时发现,UPH组患者术前血浆白蛋白水平较低。内源性白蛋白主要在肝脏合成,容易受营养状况、激素水平、疾病状况的影响,胰腺癌患者出现某些临床症状(如胆道梗阻、黄疸等)时,会间接损伤肝脏功能,导致肝细胞合成的白蛋白量减少[13]。此外,胰腺癌属于恶性程度极高的肿瘤,对全身蛋白质的消耗大。部分患者日常摄入的高蛋白食物占比较少,机体处于营养不均衡状态。这些因素都是导致患者血浆白蛋白水平低的原因[14]。但在本研究中,仅单因素分析显示UPH组与非UPH组患者白蛋白水平存在差异,而多重logistic回归分析提示低白蛋白水平并不是UPH发生的危险因素,这一现象在后续研究中将进一步探索。
本研究的所有患者均在全身麻醉联合区域神经阻滞下完成手术治疗。全身麻醉期间患者肌肉放松,身体对寒冷感觉的反馈受到限制,无法通过战栗或收缩等方式持续产热来维持正常的体温[15],这也许能解释所有患者体温均下降的这一现象。全身麻醉后,机体的核心温度会在一定时间内(常表现在麻醉诱导后的1 h)快速下降,随后下降程度减慢[16]。相关研究表明,在实施麻醉后的3~4 h机体核心温度达到平衡状态,之后体温的改变就受产热与散热相关因素的影响[17]。UPH的发生可能与全身麻醉联合使用的神经阻滞类型有关。腹横肌平面阻滞作用范围仅是手术切口区域的体表,对内脏的阻滞效果差。而椎旁神经阻滞的效果更趋向硬膜外麻醉,阻滞范围广,对脊髓平面支配的皮肤和内脏均有作用,使血管收缩和寒战的阈值降低,温度觉传导受阻,从而影响体温的调节,常表现为阻滞区域皮温略有升高,但核心温度降低[18-19]。本研究中UPH组患者以椎旁神经阻滞为主,提示采用椎旁神经阻滞的患者更易发生UPH。
本研究中,人工气腹建立时间长是发生UPH的危险因素。达芬奇机器人手术需要使用二氧化碳来创造人工气腹,术中气体通过对流、传导、蒸发消耗热量,导致术后低体温。UPH组和非UPH组患者手术方式的差异也有统计学意义,两组均有患者行部分胰腺切除术和胰十二指肠切除术,但UPH组实施胰十二指肠切除术的患者比例高于非UPH组患者。胰十二指肠切除术更复杂,手术时间更长,以至人工气腹建立的时间更久,因此行这类手术的患者发生UPH的风险也会增加[20]。
手术室温度较低时患者易发生低体温,随着手术时间的延长,较低的手术室温度也是患者发生UPH的危险因素[21]。因此,应避免手术室温度过低,必须在术前提前调整好室内温度,以减少患者的热损失,维持患者术中体温稳定。本中心手术室温度均控制在24~25 ℃,因此本研究并未发现手术室温度对患者体温有直接影响。
本研究通过多重logistic回归分析最终得到7个(达芬奇机器人辅助术式、BMI、手术时间、人工气腹建立时间、输液速率、输液总量、神经阻滞类型)导致UPH发生的危险因素,并建立了列线图模型。胰腺手术患者术前如果合并营养不良或高代谢状态,可存在BMI较低现象,对于这些患者实施创伤较大的胰十二指肠切除术及作用范围更广的神经阻滞时极大程度地增加了UPH的发生风险。此外术中大量补液、长时间建立人工气腹、输液速率过慢这些因素也促进了UPH的发生。Hosmer-Lemeshow检验结果显示logistic回归模型的拟合效果较好,ROC的AUC为0.739,决策曲线分析表明模型预测UPH的临床净收益较好。结果提示此预测模型对达芬奇机器人辅助腹腔镜胰腺癌根治手术患者发生UPH的预测能力良好,作为围手术期患者UPH的预测工具,可为临床筛查达芬奇机器人辅助腹腔镜胰腺癌根治手术UPH高危患者提供参考。
本研究仍有一些局限性。(1)本研究为小样本单中心回顾性研究,为了确定目前的危险因素是否具有较高的预测能力,还需要进行多中心、临床大样本、观察性研究;(2)本研究纳入的对象为接受达芬奇机器人辅助腹腔镜胰腺癌根治手术的患者,可能存在选择偏倚和混杂因素;(3)有研究表明红外鼓膜温度计监测清醒患者的体温具有较高的准确性[22],但对于全身麻醉后的患者可能存在一定的偏差,尚需进一步探讨;(4)本研究结果显示输液总量可影响患者UPH的发生,但对于液体的加温情况及输注路径未予明确,这可能会是导致UPH的因素,在今后的研究中将加以探讨。
综上所述,BMI低、输液速率慢、输液总量大、椎旁神经阻滞、胰十二指肠切除术、手术时间长、人工气腹建立时间长是达芬奇机器人辅助腹腔镜胰腺癌根治手术患者发生UPH的危险因素,根据上述因素构建的风险预测模型效果较好。对高危人群进行UPH预测,加强患者围手术期体温管理,实施相应的保温措施,对保障患者围手术期安全具有重要意义。
| [1] |
RAWLA P, SUNKARA T, GADUPUTI V. Epidemiology of pancreatic cancer: global trends, etiology and risk factors[J]. World J Oncol, 2019, 10(1): 10-27. DOI:10.14740/wjon1166 |
| [2] |
SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. DOI:10.3322/caac.21654 |
| [3] |
KOLBEINSSON H M, CHANDANA S, WRIGHT G P, et al. Pancreatic cancer: a review of current treatment and novel therapies[J]. J Invest Surg, 2023, 36(1): 2129884. DOI:10.1080/08941939.2022.2129884 |
| [4] |
GIULIANOTTI P C, CORATTI A, ANGELINI M, et al. Robotics in general surgery: personal experience in a large community hospital[J]. Arch Surg, 2003, 138(7): 777-784. DOI:10.1001/archsurg.138.7.777 |
| [5] |
KOH W, CHAKRAVARTHY M, SIMON E, et al. Perioperative temperature management: a survey of 6 Asia-Pacific countries[J]. BMC Anesthesiol, 2021, 21(1): 205. DOI:10.1186/s12871-021-01414-6 |
| [6] |
YOO J H, OK S Y, KIM S H, et al. Efficacy of active forced air warming during induction of anesthesia to prevent inadvertent perioperative hypothermia in intraoperative warming patients: comparison with passive warming, a randomized controlled trial[J]. Medicine (Baltimore), 2021, 100(12): e25235. DOI:10.1097/MD.0000000000025235 |
| [7] |
MENDONÇA F T, FERREIRA J D S, GUILARDI V H F, et al. Prevalence of inadvertent perioperative hypothermia and associated factors: a cross-sectional study[J]. Ther Hypothermia Temp Manag, 2021, 11(4): 208-215. DOI:10.1089/ther.2020.0038 |
| [8] |
SIMEGN G D, BAYABLE S D, FETENE M B. Prevention and management of perioperative hypothermia in adult elective surgical patients: a systematic review[J]. Ann Med Surg (Lond), 2021, 72: 103059. DOI:10.1016/j.amsu.2021.103059 |
| [9] |
DAMANI T, BALLANTYNE G. Robotic foregut surgery[J]. Surg Clin North Am, 2020, 100(2): 249-264. DOI:10.1016/j.suc.2019.11.002 |
| [10] |
GABRIEL P, HÖCKER J, STEINFATH M, et al. Prevention of inadvertent perioperative hypothermia-guideline compliance in German hospitals[J]. Ger Med Sci, 2019, 17: Doc07. DOI:10.3205/000273 |
| [11] |
LOVEDAY B P, LIPTON L, THOMSON B N. Pancreatic cancer: an update on diagnosis and management[J]. Aust J Gen Pract, 2019, 48(12): 826-831. DOI:10.31128/AJGP-06-19-4957 |
| [12] |
ASHOOBI M T, SHAKIBA M, KESHAVARZMOTAMED A, et al. Prevalence of postoperative hypothermia in the post-anesthesia care unit[J]. Anesth Pain Med, 2023, 13(5): e136730. DOI:10.5812/aapm-136730 |
| [13] |
OCSKAY K, VINKÓ Z, NéMETH D, et al. Hypoalbuminemia affects one third of acute pancreatitis patients and is independently associated with severity and mortality[J]. Sci Rep, 2021, 11(1): 24158. DOI:10.1038/s41598-021-03449-8 |
| [14] |
CHOI S R, LEE Y K, CHO A J, et al. Malnutrition, inflammation, progression of vascular calcification and survival: inter-relationships in hemodialysis patients[J]. PLoS One, 2019, 14(5): e0216415. DOI:10.1371/journal.pone.0216415 |
| [15] |
GROENE P, ZEUZEM C, BAASNER S, et al. The influence of body mass index on temperature management during general anaesthesia-a prospective observational study[J]. J Eval Clin Pract, 2019, 25(2): 340-345. DOI:10.1111/jep.13064 |
| [16] |
LENHARDT R. Body temperature regulation and anesthesia[J]. Handb Clin Neurol, 2018, 157: 635-644. DOI:10.1016/B978-0-444-64074-1.00037-9 |
| [17] |
YANG F, WANG J, CUI J, et al. An overview of the implications for perianesthesia nurses in terms of intraoperative changes in temperature and factors associated with unintentional postoperative hypothermia[J]. J Healthc Eng, 2022, 2022: 6955870. DOI:10.1155/2022/6955870 |
| [18] |
YOSHIMURA M, SHIRAMOTO H, KOGA M, et al. Skin temperature changes after ultrasound-guided supra-inguinal fascia iliaca block: a prospective observational study[J]. JA Clin Rep, 2021, 7(1): 31. DOI:10.1186/s40981-021-00435-x |
| [19] |
ZHANG S, LIU Y, LIU X, et al. Infrared thermography for assessment of thoracic paravertebral block: a prospective observational study[J]. BMC Anesthesiol, 2021, 21(1): 168. DOI:10.1186/s12871-021-01389-4 |
| [20] |
NIWANO F, BABAYA N, HIROMINE Y, et al. Glucose metabolism after pancreatectomy: opposite extremes between pancreaticoduodenectomy and distal pancreatectomy[J]. J Clin Endocrinol Metab, 2021, 106(5): e2203-e2214. DOI:10.1210/clinem/dgab036 |
| [21] |
PAAL P, PASQUIER M, DAROCHA T, et al. Accidental hypothermia: 2021 update[J]. Int J Environ Res Public Health, 2022, 19(1): 501. DOI:10.3390/ijerph19010501 |
| [22] |
RAUCH S, MILLER C, BRÄUER A, et al. Perioperative hypothermia—a narrative review[J]. Int J Environ Res Public Health, 2021, 18(16): 8749. DOI:10.3390/ijerph18168749 |
 2024, Vol. 45
2024, Vol. 45


