骨关节炎(osteoarthritis,OA)是以受累关节疼痛、肿胀或功能受限为主要表现的关节退行性疾病,是导致关节疼痛和残疾的主要原因之一,严重影响患者的生活质量[1]。随着肥胖人数的增多及人口老龄化的加剧,OA患病率逐渐升高,在我国40岁以上的人群中OA发病率高达30%,造成巨大的社会经济负担[2]。
软骨细胞在维持细胞外基质合成与降解的动态平衡、保证正常的软骨结构和功能中发挥着关键作用。在OA的发病过程中,软骨细胞炎症反应及细胞凋亡的异常激活是造成软骨退行性的改变重要生物学因素。其中,IL-1β、IL-18等炎症因子在软骨细胞外基质丢失、软骨退变、直接诱导软骨细胞凋亡等方面起重要作用[3]。研究表明,细胞焦亡关键分子核苷酸结合寡聚化结构域样受体3(nucleotide-binding oligomerization domain-like receptor 3,NLRP3)所介导的炎症小体激活可以诱导细胞膜肿胀、细胞孔隙增多,导致IL-1β、IL-18等促炎细胞因子分泌增多,加重软骨细胞损伤,加剧OA进展[4]。进一步研究发现,抑制IL-1β、IL-18和细胞焦亡相关蛋白NLRP3、消皮素D N端片段(N-terminal fragment of gasdermin D,GSDMD-N)、caspase 1表达可减轻OA小鼠的软骨损伤[5]。以上研究结果表明炎症反应、细胞焦亡与OA存在一定的因果关系,抑制炎症因子分泌及细胞焦亡相关蛋白表达可能是治疗OA潜在的分子靶点,值得深入研究。
低强度脉冲聚焦超声(focused low-intensity pulsed ultrasound,FLIPUS)是一种无创、安全的物理治疗方法,可以有效缓解OA患者关节疼痛,改善关节功能障碍和健康状况[6]。体内实验表明,FLIPUS通过缓解软骨细胞氧化应激、减轻软骨细胞损伤、抑制软骨细胞凋亡延缓软骨基质退变[7]。然而,FLIPUS对软骨细胞保护的分子机制还有待进一步深入研究。本研究通过脂多糖(lipopolysaccharide,LPS)构建小鼠OA样软骨细胞损伤模型,探究FLIPUS对炎症因子和细胞焦亡相关蛋白表达的影响,揭示FLIPUS保护软骨细胞的作用机制,以期为临床防治OA提供参考。
1 材料和方法 1.1 实验动物与主要试剂SPF级C57BL/6J小鼠(8~10 d),由重庆医科大学实验动物中心提供,实验动物使用许可证号为SYXK(渝)2022-0016。本研究通过重庆医科大学动物伦理委员会审批。
FBS、DMEM/F12购于美国Gibco公司;胰蛋白酶、乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购于上海碧云天生物技术股份有限公司;Ⅱ型胶原酶购于德国BioFroxx公司;Ⅱ型胶原蛋白α1(collagen Ⅱ α1,COL2α1)、血小板结合蛋白基序的解聚蛋白样金属蛋白酶5(a disintegrin and metalloproteinase with thrombospondin 5,ADAMTS5)抗体购于武汉博士德生物工程有限公司;基质金属蛋白酶(matrix metalloproteinase,MMP)13、MMP3、IL-18、β-肌动蛋白抗体购于武汉三鹰生物技术有限公司;NLRP3、IL-1β抗体购于英国Abcam公司;GSDMD-N抗体购于美国Affinity公司;cleaved caspase 1抗体购于美国Santa Cruz公司;小鼠IL-18、IL-1β ELISA检测试剂盒购于上海酶联生物科技有限公司;HRP标记的羊抗兔二抗购于北京中杉金桥生物技术有限公司;BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶制备试剂盒、RIPA强效细胞裂解液、SDS-PAGE上样缓冲液、无蛋白快速封闭液购于上海雅酶生物科技有限公司;ECL发光液购于美国MCE公司;PVDF膜购于美国Millipore公司。
1.2 小鼠膝关节原代软骨细胞的提取与培养将小鼠浸泡于75%乙醇消毒5 min后,使用微型剪及眼科镊分离出小鼠膝关节;用含5%青霉素-链霉素的PBS浸泡10 min后,加入0.25%胰蛋白酶于37 ℃、5% CO2孵箱中消化10 min,再进一步获取完整的膝关节软骨;加入0.1% Ⅱ型胶原酶,于37 ℃、5% CO2孵箱中消化过夜。第2天,将已消化好的软骨细胞悬液离心弃除上清液后,用完全培养基(10% FBS、90% DMEM/F12、1%青霉素-链霉素溶液)重悬细胞并接种于培养皿中,于37 ℃、5% CO2孵箱中常规培养,以备后续实验。
1.3 小鼠OA样软骨细胞损伤模型建立及FLIPUS干预将细胞分为3组:对照组、LPS组、LPS+FLIPUS组。将原代软骨细胞接种于6孔板或3.5 cm培养皿,用LPS(1 μg/mL)处理12 h体外模拟OA样软骨细胞损伤[8]。使用FLIPUS干预细胞20 min,FLIPUS干预时探头上涂耦合剂,将其紧贴培养皿下方。所采用的超声治疗仪(CZG200型)购于重庆海扶医疗科技股份有限公司,频率0.6 MHz,声强120 mW/cm2,治疗头焦平面距离28 mm,脉冲宽度200 μs,占空比20%。对照组细胞用仅含10% FBS的培养基培养,不予任何处理。
1.4 LDH释放实验将细胞接种于12孔板,分组处理细胞,取各组细胞上清液120 μL加入96孔板,再按照试剂盒使用说明书配置工作液,每孔加入60 μL工作液,室温避光孵育30 min后采用酶标仪(美国Bio-Rad公司)检测490 nm波长处各组上清液的光密度值。
1.5 免疫细胞荧光染色将细胞接种于放置爬片的6孔板中,细胞生长到60%~70%时取出爬片;使用4%多聚甲醛溶液常温固定30 min,PBS浸洗5 min、3次;0.1% Triton X-100常温通透20 min,PBS浸洗5 min、3次,山羊血清常温封闭30 min;加入COL2α1(稀释比例1∶100)抗体于4 ℃冰箱孵育过夜。第2天,用PBS浸洗5 min、3次,孵育山羊抗小鼠荧光二抗(稀释比例1∶500)1 h,PBS浸洗5 min、3次,滴加含DAPI的抗荧光淬灭剂后,于荧光显微镜下观察。
1.6 扫描电子显微镜观察分析如前所述制作细胞爬片后,PBS清洗3次,使用3%戊二醛溶液常温固定30 min后,将样本送至重庆医科大学电子显微镜扫描室进行观察分析。
1.7 蛋白质印迹法检测蛋白的表达用预冷的PBS清洗各组细胞3次,加入适当体积的裂解液(含1%蛋白酶及磷酸酶抑制剂)于冰上提取总蛋白,用BCA蛋白浓度测定试剂盒测定蛋白浓度,按比例加入上样缓冲液,煮沸变性。取20 μg的蛋白经不同浓度的SDS-PAGE凝胶分离后,转移到PVDF膜上,经无蛋白快速封闭液室温封闭30 min后,将膜放置于相应的一抗中,于4 ℃摇床孵育过夜。第2天,TBST漂洗10 min、3次;加入相应的二抗室温孵育1 h,TBST漂洗10 min、3次,滴加ECL发光液进行曝光显影,用ImageJ软件分析并计算,以目的蛋白与内参蛋白灰度值的比值作为目的蛋白的相对表达量。
1.8 ELISA法检测细胞上清液中IL-18、IL-1β的水平将细胞接种于6孔板,分组处理细胞,取各组细胞上清液,4 ℃ 1 500×g离心10 min,取上清。按照ELISA检测试剂盒说明书检测细胞上清液中IL-18、IL-1β水平。采用酶标仪检测450 nm波长处各组细胞上清液的光密度值。
1.9 钙黄绿素乙酰氧基甲酯(calcein acetoxymethyl ester,calcein AM)/PI荧光染色将细胞接种于24孔板,分组处理细胞,吸除培养基,每孔加入100 μL calcein AM/PI检测工作液,37 ℃避光孵育30 min后,吸除培养基,PBS洗涤3次,加入培养基于倒置荧光显微镜下观察。
1.10 统计学处理应用GraphPad Prism 9软件进行统计学分析。呈正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析,并运用Tukey法多重检验进行两两比较。检验水准(α)为0.05。
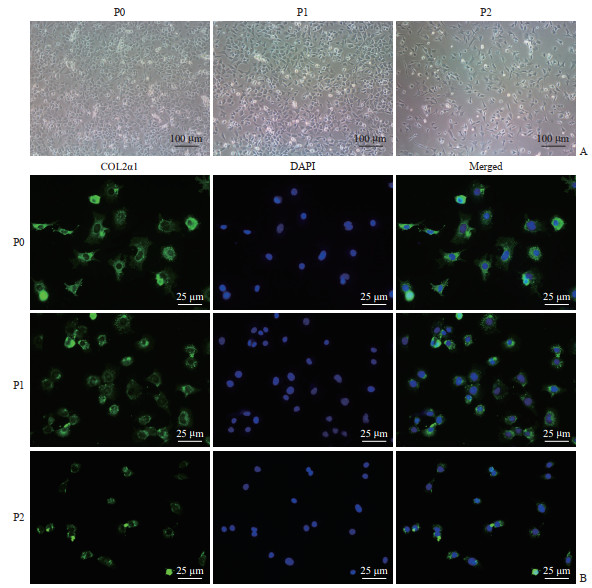
2 结果 2.1 小鼠膝关节软骨细胞的形态学观察及鉴定由图 1A可见,小鼠膝关节软骨细胞接种于培养皿后,贴壁生长,约2~3 d长满皿底,形状呈不规则圆形或多边形;经传代培养后,第1代软骨细胞生长良好,仍保持不规则圆形;第2代软骨细胞逐渐衰老,生长减缓,外观呈长梭形。
|
图 1 小鼠膝关节软骨细胞形态学观察(A)及鉴定(B) Fig 1 Morphological observation (A) and identification (B) of mouse knee joint chondrocytes P0: Primary culture cells; P1: First-passage cells; P2: Second-passage cells. COL2α1: Collagen Ⅱ α1; DAPI: 4', 6-diamidino-2-phenylindole. |
免疫细胞荧光染色结果显示,与原代和第1代软骨细胞相比,第2代软骨细胞COL2α1表达减少、表型逐渐丢失(图 1B)。因此,为了保证实验的准确性,后续实验选用原代或第1代软骨细胞。
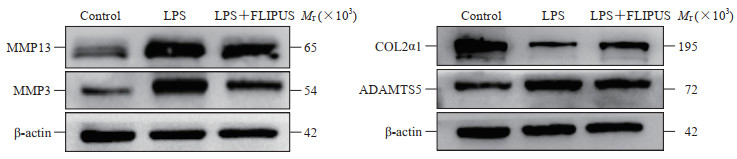
2.2 FLIPUS对LPS诱导的小鼠膝关节软骨细胞损伤的影响蛋白质印迹法分析结果显示,与对照组相比,LPS组小鼠膝关节软骨细胞中MMP13、MMP3和ADAMTS5蛋白的表达增加(均P<0.01)、COL2α1蛋白表达受到抑制(P<0.01),表明LPS成功诱导了体外OA样软骨细胞损伤。与LPS组相比,LPS+FLIPUS组小鼠膝关节软骨细胞中MMP13、MMP3和ADAMTS5蛋白的表达降低(P<0.05,P<0.01)、COL2α1蛋白表达升高(P<0.01),表明FLIPUS能减轻LPS诱导的小鼠膝关节软骨细胞损伤。见图 2、表 1。
|
图 2 蛋白质印迹法检测各组小鼠膝关节软骨细胞中MMP13、MMP3、ADAMTS5、COL2α1蛋白的表达 Fig 2 Expression of MMP13, MMP3, ADAMTS5 and COL2α1 in mouse knee joint chondrocytes in each group detected by Western blotting MMP: Matrix metalloproteinase; ADAMTS5: A disintegrin and metalloproteinase with thrombospondin 5; COL2α1: Collagen Ⅱ α1; LPS: Lipopolysaccharide; FLIPUS: Focused low-intensity pulsed ultrasound. |
|
|
表 1 各组小鼠膝关节软骨细胞中MMP13、MMP3、ADAMTS5、COL2α1蛋白表达水平的比较 Tab 1 Comparison of expression levels of MMP13, MMP3, ADAMTS5 and COL2α1 in mouse knee joint chondrocytes in each group |
2.3 FLIPUS可改善LPS诱导的小鼠膝关节软骨细胞活性受损
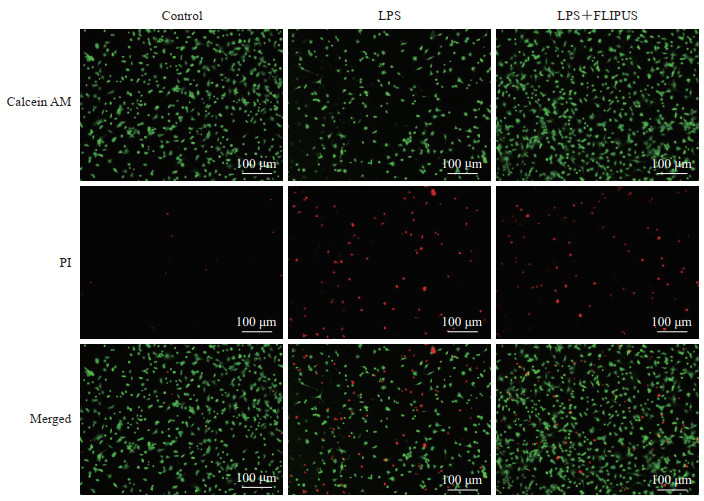
通过calcein AM/PI荧光染色及LDH释放实验观察小鼠膝关节软骨细胞活性变化,calcein AM被活细胞中的内源性酯酶水解,生成不能通透细胞膜的钙黄绿素,发绿色荧光;细胞膜完整性被破坏的死细胞可以被PI染色,发红色荧光,并且释放LDH。与对照组相比,LPS组小鼠膝关节组软骨细胞PI阳性率升高(P<0.01),且细胞上清液中LDH释放增加(P<0.01);与LPS组相比,LPS+FLIPUS组小鼠膝关节软骨细胞PI阳性率下降(P<0.05)、LDH释放减少(P<0.05)。结果提示FLIPUS能增加小鼠膝关节软骨细胞活性、减少软骨细胞死亡。见表 2、图 3。
|
|
表 2 各组小鼠膝关节软骨细胞PI阳性率及LDH释放率比较 Tab 2 PI positive rates and LDH release rates of mouse knee joint chondrocytes in each group |
|
图 3 各组小鼠膝关节软骨细胞calcein AM/PI荧光染色 Fig 3 Calcein AM/PI fluorescent staining of mouse knee joint chondrocytes in each group AM: Acetoxymethyl ester; PI: Propidium iodide; LDH: Lactate dehydrogenase; LPS: Lipopolysaccharide; FLIPUS: Focused low-intensity pulsed ultrasound. |
2.4 FLIPUS对LPS诱导的小鼠膝关节软骨细胞肿胀变形及膜穿孔等焦亡表征的影响
扫描电子显微镜观察结果(图 4)显示,对照组小鼠膝关节软骨细胞呈圆形,细胞膜完整光滑;LPS组小鼠膝关节软骨细胞肿胀变形,边界不规则,细胞膜上出现较多孔隙和气泡;LPS+FLIPUS组小鼠膝关节软骨细胞形态改善,肿胀程度减轻,细胞膜上孔隙及气泡减少。

|
图 4 SEM观察各组小鼠膝关节软骨细胞形态的变化 Fig 4 Morphological changes in mouse knee joint chondrocytes in each group detected by SEM White arrows indicate cell membrane pores. SEM: Scanning electron microscopy; LPS: Lipopolysaccharide; FLIPUS: Focused low-intensity pulsed ultrasound. |
2.5 FLIPUS对炎症因子和焦亡相关蛋白表达的影响
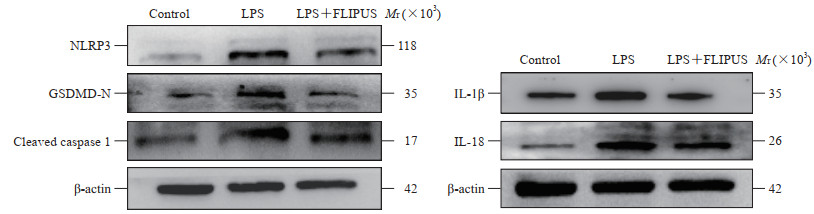
蛋白质印迹法分析结果(图 5、表 3)显示,与对照组相比,LPS组小鼠膝关节软骨细胞中NLRP3、GSDMD-N、cleaved caspase 1、IL-1β、IL-18蛋白的表达水平升高(均P<0.01);与LPS组相比,LPS+FLIPUS组小鼠膝关节软骨细胞中NLRP3、GSDMD-N、cleaved caspase 1、IL-1β、IL-18蛋白表达水平降低(P<0.05,P<0.01)。ELISA检测结果(表 4)显示,与对照组相比,LPS组小鼠膝关节软骨细胞上清液中IL-1β、IL-18水平升高(均P<0.01);与LPS组相比,FLIPUS+LPS组小鼠膝关节软骨细胞上清液中IL-1β、IL-18水平降低(均P<0.01)。
|
图 5 蛋白质印迹法检测各组小鼠膝关节软骨细胞中NLRP3、GSDMD-N、cleaved caspase 1、IL-1β和IL-18蛋白的表达 Fig 5 Expression of NLRP3, GSDMD-N, cleaved caspase 1, IL-1β and IL-18 in mouse knee joint chondrocytes in each group detected by Western blotting NLRP3: Nucleotide-binding oligomerization domain-like receptor 3; GSDMD-N: N-terminal fragment of gasdermin D; caspase 1: Cysteine aspartic acid specific protease 1; IL: Interleukin; LPS: Lipopolysaccharide; FLIPUS: Focused low-intensity pulsed ultrasound. |
|
|
表 3 各组小鼠膝关节软骨细胞中NLRP3、GSDMD-N、cleaved caspase 1、IL-1β和IL-18蛋白表达水平的比较 Tab 3 Comparison of expression levels of NLRP3, GSDMD-N, cleaved caspase 1, IL-1β and IL-18 in mouse knee joint chondrocytes in each group |
|
|
表 4 各组小鼠膝关节软骨细胞上清液中炎症因子IL-1β、IL-18水平比较 Tab 4 Comparison of levels of inflammatory factors IL-1β and IL-18 in supernatants of mouse knee joint chondrocytes in each group |
3 讨论
OA由多种因素引起,是以关节软骨纤维化、皲裂、软骨下骨损伤及继发性骨赘形成为特点的退行性疾病,证据表明炎症因子IL-1β和IL-18可介导软骨细胞损伤、软骨基质降解并刺激关节周围神经导致关节疼痛[9-10]。同时,MMP3和MMP13可协同裂解胶原分子中三维螺旋结构,高效地降解Ⅱ型胶原,继而破坏软骨的拱形纤维结构[11-12]。ADAMTS5主要对软骨基质中的蛋白多糖进行降解,能加速OA病情进展[13]。因此,抑制炎症反应是治疗OA的重要策略之一。
细胞焦亡是一种促炎程序性细胞死亡,形态学特征表现为焦亡细胞质膜上形成直径为10~15 nm的孔隙,细胞肿胀并出现破裂。细胞焦亡的生化特征包括炎症小体形成、相关caspase和消皮素激活及大量促炎症因子(IL-1β、IL-18)释放[14]。相关研究表明,细胞焦亡途径中的炎症小体、caspase蛋白、IL-1β和IL-18与OA发生、发展有着密切关系[4]。其中,NLRP3炎症小体是近年来细胞焦亡途径的研究热点,各种致病因素激活模式识别受体NLRP3,NLRP3发生寡聚化并募集caspase 1前体蛋白(pro-caspase 1)形成NLRP3炎症小体,将pro-caspase 1加工为有活性的cleaved caspase 1。cleaved caspase 1裂解消皮素D并释放其N端结构域,该结构域可与细胞膜结合并使其穿孔,介导细胞内容物的释放,造成细胞损伤。同时,cleaved caspase 1促进IL-1β和IL-18的成熟与分泌,导致滑膜炎症和软骨退变[15-16]。既往研究表明,在小鼠OA模型及OA患者中软骨细胞焦亡水平上升[5]。新型脂肪细胞因子meteorin-like及鸢尾素(irisin)通过NLRP3信号通路抑制软骨细胞焦亡,减轻软骨损伤,缓解OA进展,提示通过NLRP3信号通路调控细胞焦亡可能是OA治疗的新途径、新方法[17-18]。
超声作为一种物理因子,具有无创、不良反应小、性价比高等特点,在临床上广泛应用于治疗肌肉骨骼及神经系统疾病[18-20]。既往研究发现,传统非聚焦超声主要利用其温热效应增加毛细血管通透性,达到改善组织循环、促进炎症物质代谢等作用[21]。与传统非聚焦超声相比,FLIPUS采用低频率(0.6 MHz)以聚焦的方式将超声能量投射至关节深处的软骨组织,主要通过机械效应在OA中发挥治疗作用。软骨对机械负荷刺激极其敏感,生理性机械负荷可以降低软骨细胞的炎症反应,增加软骨细胞代谢活性,促进细胞外基质合成[22]。本课题组前期研究也发现,FLIPUS通过机械效应改善新西兰兔膝骨关节炎模型的炎症微环境,促进炎症介质前列腺素E2(prostaglandin E2,PGE2)及一氧化氮(nitric oxide,NO)代谢,保护退变的关节软骨[7]。FLIPUS保护关节软骨的潜在作用机制还有待进一步研究。
本研究结果显示,LPS造成小鼠膝关节软骨细胞炎症性损伤后,细胞软骨基质降解因子ADAMTS5、MMP3、MMP13表达上升。同时,细胞焦亡相关蛋白NLRP3、GSDMD-N、cleaved caspase 1及炎症因子IL-1β、IL-18表达升高,细胞上清液中IL-1β、IL-18水平上升,而细胞中COL2α1表达下降,软骨细胞活性下降,死亡率增加。扫描电子显微镜观察到LPS刺激后软骨细胞肿胀变形,细胞膜穿孔,完整性丧失,出现明显的焦亡形态学改变。以上结果表明LPS可诱导软骨细胞焦亡,导致炎症因子释放增加,加重软骨细胞损伤。
本研究发现FLIPUS能有效下调LPS处理后软骨细胞中软骨基质降解因子ADAMTS5、MMP13、MMP3蛋白表达,抑制焦亡相关蛋白NLRP3、GSDMD-N、cleaved caspase 1及炎症因子IL-1β、IL-18表达,降低细胞上清液中IL-1β、IL-18水平。同时,FLIPUS上调细胞中COL2α1表达,增加软骨细胞活性,降低软骨细胞死亡率。扫描电子显微观察到FLIPUS可减轻软骨细胞肿胀并减少细胞膜孔隙形成,一定程度上逆转LPS诱导的软骨细胞焦亡形态学变化。以上结果表明,FLIPUS可能通过抑制焦亡相关蛋白及炎症因子表达,减轻LPS诱导的炎症反应、Ⅱ型胶原降解和软骨细胞损伤,保护软骨。
本研究有以下不足之处:(1)OA发病机制复杂,涉及众多的分子机制及信号通路,本研究仅从FLIPUS对炎症因子和焦亡相关蛋白入手探讨其作用机制,还需进一步探究FLIPUS是否有其他保护机制;(2)本研究只进行了体外细胞实验,FLIPUS抗炎和抗细胞焦亡的体内效应还有待进一步证实;(3)本研究仅观察了FLIPUS对细胞炎症因子水平及细胞焦亡相关蛋白的影响,没有沉默、过表达关键靶蛋白或采取特异性通路阻断剂进一步验证FLIPUS抗炎和抗细胞焦亡的分子机制。在下一步研究中,我们将通过转染病毒的方式干预NLRP3表达,更加深入地探讨FLIPUS抑制软骨细胞焦亡、降低炎症因子表达的机制。
综上所述,FLIPUS通过抑制炎症因子和细胞焦亡相关蛋白表达减轻LPS诱导的小鼠膝关节软骨细胞损伤。
| [1] |
谢天顺, 邱萍, 朱锦宇. 2019版OARSI《膝、髋和多关节骨关节炎非手术治疗指南》膝关节骨关节炎部分更新内容的解读[J]. 中华骨与关节外科杂志, 2020, 13(9): 705-708. DOI:10.3969/j.issn.2095-9958.2020.09.01 |
| [2] |
中华医学会骨科学分会关节外科学组, 中国医师协会骨科医师分会骨关节炎学组, 国家老年疾病临床医学研究中心(湘雅医院), 等. 中国骨关节炎诊疗指南(2021年版)[J]. 中华骨科杂志, 2021, 41(18): 1291-1314. DOI:10.3760/cma.j.cn121113-20210624-00424 |
| [3] |
邓丽, 文振华, 田锋, 等. 艾拉莫德通过TLR4/NF-κB通路抑制骨关节炎软骨细胞模型凋亡及炎症反应[J]. 国际检验医学杂志, 2023, 44(3): 316-321. DOI:10.3969/j.issn.1673-4130.2023.03.012 |
| [4] |
AN S, HU H, LI Y, et al. Pyroptosis plays a role in osteoarthritis[J]. Aging Dis, 2020, 11(5): 1146-1157. DOI:10.14336/AD.2019.1127 |
| [5] |
NI B, PEI W, QU Y, et al. MCC950, the NLRP3 inhibitor, protects against cartilage degradation in a mouse model of osteoarthritis[J]. Oxid Med Cell Longev, 2021, 2021: 4139048. DOI:10.1155/2021/4139048 |
| [6] |
JIA L, LI D, WEI X, et al. Efficacy and safety of focused low-intensity pulsed ultrasound versus pulsed shortwave diathermy on knee osteoarthritis: a randomized comparative trial[J]. Sci Rep, 2022, 12(1): 12792. DOI:10.1038/s41598-022-17291-z |
| [7] |
JIA L, CHEN J, WANG Y, et al. Focused low-intensity pulsed ultrasound affects extracellular matrix degradation via decreasing chondrocyte apoptosis and inflammatory mediators in a surgically induced osteoarthritic rabbit model[J]. Ultrasound Med Biol, 2016, 42(1): 208-219. DOI:10.1016/j.ultrasmedbio.2015.08.010 |
| [8] |
GUO Q, ZHANG M, DONG Y, et al. Isobavachalcone ameliorates the progression of osteoarthritis by suppressing NF-κB signaling pathway[J]. Int Immunopharmacol, 2023, 119: 110102. DOI:10.1016/j.intimp.2023.110102 |
| [9] |
LIEBERTHAL J, SAMBAMURTHY N, SCANZELLO C R. Inflammation in joint injury and post-traumatic osteoarthritis[J]. Osteoarthritis Cartilage, 2015, 23(11): 1825-1834. DOI:10.1016/j.joca.2015.08.015 |
| [10] |
KAPOOR M, MARTEL-PELLETIER J, LAJEUNESSE D, et al. Role of proinflammatory cytokines in the pathophysiology of osteoarthritis[J]. Nat Rev Rheumatol, 2011, 7(1): 33-42. DOI:10.1038/nrrheum.2010.196 |
| [11] |
ZHANG Y, LI S, JIN P, et al. Dual functions of microRNA-17 in maintaining cartilage homeostasis and protection against osteoarthritis[J]. Nat Commun, 2022, 13(1): 2447. DOI:10.1038/s41467-022-30119-8 |
| [12] |
WANG T, HE C. Pro-inflammatory cytokines: the link between obesity and osteoarthritis[J]. Cytokine Growth Factor Rev, 2018, 44: 38-50. DOI:10.1016/j.cytogfr.2018.10.002 |
| [13] |
ZHOU H, SHEN X, YAN C, et al. Extracellular vesicles derived from human umbilical cord mesenchymal stem cells alleviate osteoarthritis of the knee in mice model by interacting with METTL3 to reduce m6A of NLRP3 in macrophage[J]. Stem Cell Res Ther, 2022, 13(1): 322. DOI:10.1186/s13287-022-03005-9 |
| [14] |
CHANG X, KANG Y, YANG Y, et al. Pyroptosis: a novel intervention target in the progression of osteoarthritis[J]. J Inflamm Res, 2022, 15: 3859-3871. DOI:10.2147/JIR.S368501 |
| [15] |
HUANG Y, XU W, ZHOU R. NLRP3 inflammasome activation and cell death[J]. Cell Mol Immunol, 2021, 18(9): 2114-2127. DOI:10.1038/s41423-021-00740-6 |
| [16] |
YU P, ZHANG X, LIU N, et al. Pyroptosis: mechanisms and diseases[J]. Signal Transduct Target Ther, 2021, 6(1): 128. DOI:10.1038/s41392-021-00507-5 |
| [17] |
LIU J, JIA S, YANG Y, et al. Exercise induced meteorin-like protects chondrocytes against inflammation and pyroptosis in osteoarthritis by inhibiting PI3K/Akt/NF-κB and NLRP3/caspase-1/GSDMD signaling[J]. Biomed Pharmacother, 2023, 158: 114118. DOI:10.1016/j.biopha.2022.114118 |
| [18] |
JIA S, YANG Y, BAI Y, et al. Mechanical stimulation protects against chondrocyte pyroptosis through irisin-induced suppression of PI3K/Akt/NF-κB signal pathway in osteoarthritis[J]. Front Cell Dev Biol, 2022, 10: 797855. DOI:10.3389/fcell.2022.797855 |
| [19] |
LIAO Q, LI B J, LI Y, et al. Low-intensity pulsed ultrasound promotes osteoarthritic cartilage regeneration by BMSC-derived exosomes via modulating the NF-κB signaling pathway[J]. Int Immunopharmacol, 2021, 97: 107824. DOI:10.1016/j.intimp.2021.107824 |
| [20] |
SONG W S, SUNG C Y, KE C H, et al. Anti-inflammatory and neuroprotective effects of transcranial ultrasound stimulation on Parkinson's disease[J]. Ultrasound Med Biol, 2022, 48(2): 265-274. DOI:10.1016/j.ultrasmedbio.2021.10.001 |
| [21] |
CAKIR S, HEPGULER S, OZTURK C, et al. Efficacy of therapeutic ultrasound for the management of knee osteoarthritis: a randomized, controlled, and double-blind study[J]. Am J Phys Med Rehabil, 2014, 93(5): 405-412. DOI:10.1097/PHM.0000000000000033 |
| [22] |
SANCHEZ-ADAMS J, LEDDY H A, MCNULTY A L, et al. The mechanobiology of articular cartilage: bearing the burden of osteoarthritis[J]. Curr Rheumatol Rep, 2014, 16(10): 451. DOI:10.1007/s11926-014-0451-6 |
 2024, Vol. 45
2024, Vol. 45


