近年来,全球约15%的育龄夫妇面临不孕不育问题,中国育龄女性中不孕症患者占10%~15%,并呈现逐年升高趋势[1]。体外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)是当前最常用的辅助生殖技术[2],而胚胎种植率低(约30%)是困扰辅助生殖技术发展的难题,存在难以突破的瓶颈[3]。其中,反复着床失败(repeated implantation failure,RIF)在IVE-ET患者中的发生率高达10%[4]。研究显示,子宫内膜免疫细胞因子异常与胚胎种植失败密切相关[5]。子宫内膜呈动态周期性变化,该动态过程的中断是导致胚胎种植失败的关键因素[6]。有研究证实,RIF患者中80%以上存在子宫内膜免疫异常,主要包括自然杀伤(natural killer,NK)细胞、巨噬细胞、T细胞和树突状细胞异常,其中,NK细胞和T细胞异常与不孕症患者胚胎移植失败相关性较为明确[7]。在月经周期的黄体中期,RIF患者子宫内膜辅助性T细胞(helper T cell,Th)1与Th2比值高于正常可孕女性,导致母体对胚胎的排异作用和胚胎移植失败[8]。Th1产生的细胞因子主要包括TNF-α、干扰素γ(interferon γ,IFN-γ)和IL-2等,对胚胎着床有不良影响;Th2产生的细胞因子包括IL-4、IL-5、IL-6、IL-10等,对妊娠结局有积极影响。Th1/Th2比值升高对胚胎毒性增加,最终导致胚胎植入失败,有可能成为检测RIF患者子宫内膜和移植胚胎间排异的有效指标[9-10]。
目前,关于不孕症子宫内膜的研究多数以细胞和动物模型为基础,但细胞模型因基因改变无法模拟子宫内膜周期性变化的微环境且很难长期培养,动物模型存在种属差异、研究周期长、成本高、成功率低和伦理等问题,此外各项研究间药效指标差异较大,导致研究结果无法互推和应用。
类器官是一种干细胞或原始组织来源的3D体外模型,可弥补细胞和动物模型的不足,已被广泛应用于肝脏、小肠、结肠、胰腺等疾病的研究,也已扩展到子宫内膜疾病[11]。子宫内膜类器官技术经过长期探索,逐渐成熟,保留了遗传和表型的稳定性[12],为研究子宫内膜的变化提供有效的体外模型。本研究拟通过建立非免疫因素致不孕症和RIF子宫内膜组织类器官,并比较两者免疫细胞因子的差异,为RIF病理机制研究及相关治疗药物的体外评价提供工具。
1 材料和方法 1.1 主要试剂基础培养基(adDMEM/F12)(货号12634010)、N2补充剂(货号17502-048)、不含维生素A的B27补充剂(货号17504-044)、L-谷氨酰胺(货号35050-061)为美国Gibco公司产品,Y-267632(货号129830-38-2)、TGF-β/Alk抑制剂A83-01(货号M5037)、p38抑制剂SB202190(货号M2062)为美国AbMole BioScience公司产品,重组人表皮生长因子(epidermal growth factor,EGF;货号315-09)、重组人Noggin蛋白(货号120-10C)、Wnt激活剂(货号315-20)、重组人成纤维细胞生长因子10(fibroblast growth factor 10,FGF-10;货号100-26)、重组人R-spondin-1(货号120-38)、上皮钙黏蛋白抗体(货号60335-1)、角蛋白抗体(货号26411-1)为美国PeproTech公司产品,ITS液体培养基补充液(货号13146)、N-乙酰-L-半胱氨酸(货号A9165)为美国Sigma-Aldrich公司产品;雌激素受体(estrogen receptor,ER)抗体(货号8002)为美国Santa Cruz公司产品。
1.2 样本收集标本采自本院生殖医学中心行宫腔镜检查的不孕症患者,经海军军医大学(第二军医大学)第一附属医院伦理委员会批准。采样时间为月经周期排卵后5 d[经超声检查确认,相当于黄体生成素(luteinizing hormone,LH)达峰值后7 d,月经周期的种植窗口期]。
纳入标准:(1)对照组年龄25~39岁,有生育史,由于输卵管或男性因素不育,IVF-ET次数≤1次。(2)实验组年龄25~39岁,无生育史,不育原因不明,IVF-ET次数≥3次。
排除标准:近期采用避孕措施(如过去3个月内使用宫内节育器或激素);内分泌代谢异常(如胰岛素抵抗、甲状腺功能减退);遗传异常(如严重子宫腺肌病或子宫内膜异位症、严重输卵管积水、中度至重度宫内粘连、子宫畸形);复发性流产;血栓形成;自身免疫性疾病;BMI>30 kg/m2。
1.3 子宫内膜类器官建立 1.3.1 原代培养在室温下将组织样品转移到含青霉素/链霉素的基础培养基中,并在1 h内处理。将选择的组织在基础培养基中清洗,去除污染的血液后倒入培养皿中。用镊子将组织片转移到干净的盘子里,用手术刀将其切成0.5~1 mm3大小的碎片。随后加入胶原酶及分散酶于培养皿中,盖上盖子,放入37 ℃的培养箱中于摇床上轻轻摇晃消化1 h后,加入2倍体积的中和培养基以中和消化液,随后进行细胞计数。按每孔(2~4)×105个细胞的密度接种于6孔板中,加入基质胶混匀,子宫内膜培养基与基质胶比例为4∶6。在37 ℃细胞培养箱中放置40~50 min后,每孔加入800 μL培养基。培养期间,每2~3 d更换培养基,7~10 d后传代。
1.3.2 传代培养用预冷枪头吹打类器官和基质胶后,转移至培养基中,洗涤,4 ℃下800×g离心5 min,用3~5 mL胰酶替代物(货号12604021,TrypLE,美国Gibco公司)消化10 min,加入中和培养基终止消化。随后4 ℃下800×g离心5 min,按照1∶(2~5)的比例重悬于培养基与基质胶混合物中,接种于6孔板中培养。
1.3.3 免疫荧光染色溶液1:用0.08 g牛血清白蛋白加入80 μL Triton X-100及40 mL PBS配制;溶液2:用80 μL Tween-20及40 mL PBS配制。从培养箱中取出6孔板,吸出细胞板中原有培养基,加入基础培养基,用巴斯德吸管吹打类器官和基质胶后,转移至15 mL离心管中,4 ℃下800×g离心5 min,去除上清。在收集的类器官中加入10 mL冰的溶液1,轻微晃动混合,在4 ℃下孵育10 min,4 ℃下800×g离心5 min。再以冷的溶液2重悬,转移到24孔板中,每孔2 mL悬液。在4 ℃孵育15 min。将200 μL溶液2加入一个空白孔作为参照孔。倾斜24孔板,确认类器官在孔底。吸出1.8 mL溶液2,剩余大约200 μL(参照200 μL溶液2空白孔)。将200 μL含一抗的溶液2加入到每一孔,并在4 ℃摇床上孵育过夜。吸出溶液2,使每孔剩余大约200 μL液体(参照200 μL溶液2空白孔);每孔再加入1 mL溶液2,轻微摇晃孵育10 min,重复2~3次。每孔加入200 μL含有二抗的溶液2,在震荡条件下室温孵育1 h,重复洗涤3次。用共聚焦显微镜拍摄照片。
1.3.4 ELISA法测定IL-4、IL-10、TNF-α、IFN-γ、IL-17、TGF-β1水平类器官上清液用于检测分泌性的成分,800×g离心20 min,用无菌管收集上清。提前配制好实验所用试剂,空白孔加入50 μL标准品/样品稀释液,其余孔各对应加入标准品或待测样品50 μL,贴上封板胶纸,将反应板混匀后37 ℃孵育50 min;洗板操作:用洗涤液将反应板充分洗涤3次,每孔加入洗涤液300 μL,充分洗涤后,甩干液体,重复此步骤4次,避免异物进入反应板;空白孔加入100 μL生物素化抗体稀释液,其余孔各加入生物素化抗体工作液100 μL,贴上封板胶纸,混匀后37 ℃孵育50 min;重复洗板操作;每孔加入链霉亲和素-生物素-过氧化物酶复合物工作液100 μL,贴上封板胶纸,混匀后37 ℃孵育30 min;重复洗板操作;每孔加入提前配制好的TMB显色液100 μL,混匀后贴上封板胶纸,置于37 ℃避光显色15~20 min(若颜色偏浅,可适当延长时间);每孔加入100 μL终止液,混匀,30 min内使用酶标仪在450 nm波长处测光密度(D)值。
1.4 统计学处理应用SPSS 26.0和GraphPad Prism 5软件进行统计学分析。数据符合正态分布,以x±s表示,组间比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 患者的基本情况最终纳入3例非免疫因素致不孕症患者子宫内膜组织(对照组)及5例RIF患者子宫内膜组织(实验组)。对照组患者情况如下:患者1,38岁,移植失败1次,2次顺产(末次2019年),术中见宫腔形态规则,内膜分布均匀,左侧宫角局部内膜充血;患者2,43岁,备孕2年未孕,男方弱精,胚胎移植失败1次;患者3,28岁,因男方无精症行睾丸穿刺IVF-ET,胚胎移植失败1次,术中见前壁内膜局部漂浮、充血。
实验组患者情况如下:患者1,27岁,胚胎移植失败3次,异位妊娠1次,自然受孕生化4次,术中见宫腔形态规则,内膜分布均匀;患者2,30岁,因卵巢功能减退行IVF-ET,胚胎移植3次,1次异位妊娠(孕32周死胎引产),术中见宫腔双侧壁略内聚,以微剪剪开;患者3,26岁,胚胎移植失败3次,术中见前后壁内膜均匀性增厚,呈厚毯样改变,后壁局部内膜片状隆起;患者4,30岁,未避孕未孕3年,胚胎移植失败3次,术中见双侧宫角处前壁内膜呈微息肉样改变,充血明显,双侧输卵管通畅;患者5,37岁,胚胎移植失败3次,术中见宫腔形态规则,前壁内膜不均匀增厚,后壁内膜尚均匀。
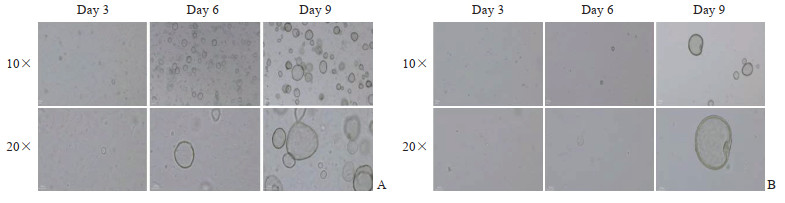
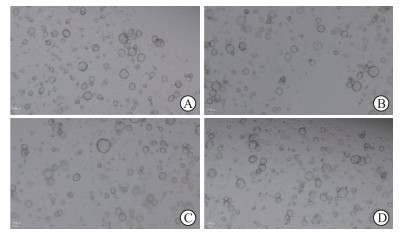
2.2 子宫内膜类器官的形成将子宫内膜组织消化成细胞进行接种,2~3 d后镜下可见类器官初步形成,内部呈现空泡状,细胞大小不一。培养子宫内膜类器官,每隔3 d镜下观察,第3~9天随着培养时间延长类器官的细胞数量逐渐增多、体积不断增大,形状逐渐趋于圆形,大者长径200~300 μm,7~10 d后可进行传代。相同时间内对照组子宫内膜类器官数量比实验组更多,可能由于实验组RIF患者组织细胞量少所致(图 1)。经过TrypLE消化液的消化后,子宫内膜类器官消化为单细胞或类器官碎片,重新包埋于基质胶中,在培养基中细胞因子和信号因子的作用下,使类器官细胞重新自组装形成球型结构,且传代后数量不断增多(图 2)。子宫内膜类器官可以长期扩增,可传代至第8代及以上。
|
图 1 非免疫因素致不孕症患者(A)与RIF患者(B)子宫内膜类器官的光镜下观察 Fig 1 Endometrial organoids from patients with non-immune infertility (A) and RIF (B) under light microscope RIF: Repeated implantation failure. |
|
图 2 RIF患者子宫内膜类器官传代后的光镜下观察(10×) Fig 2 Observation under light microscope after passage of endometrial organoids from patients with RIF (10×) A: The 5th generation; B: The 6th generation; C: The 7th generation; D: The 8th generation. RIF: Repeated implantation failure. |
2.3 非免疫因素致不孕症与RIF患者子宫内膜类器官的验证
免疫荧光染色结果显示,子宫内膜特异性标志物ER、角蛋白和上皮钙黏蛋白均表达(图 3),提示构建的子宫内膜类器官具备子宫内膜的特征。

|
图 3 非免疫因素致不孕症患者(A)与RIF患者(B)子宫内膜类器官的免疫荧光染色结果 Fig 3 Immunofluorescence staining of endometrial organoids in patients with non-immune infertility (A) and RIF (B) Scale bar=100 μm. RIF: Repeated implantation failure; DAPI: 4', 6-diamidino-2-phenylindole; ER: Estrogen receptor. |
2.4 类器官Th1和Th2细胞因子表达情况
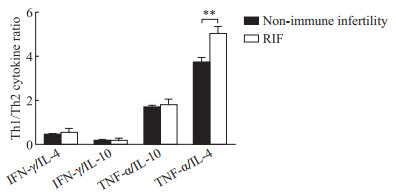
对照组子宫内膜类器官IFN-γ[(6.56±0.17)pg/mL]、IL-10[(30.23±0.87)pg/mL]、TNF-α[(51.93±1.51)pg/mL]和IL-4[(13.82±0.25)pg/mL]表达水平分别高于实验组子宫内膜类器官IFN-γ[(3.30±0.43)pg/mL]、IL-10[(17.32±5.51)pg/mL]、TNF-α[(30.76±6.09)pg/mL]和IL-4[(6.10±1.21)pg/mL]表达水平,差异均有统计学意义(P<0.05或P<0.01)。对照组与实验组TGF-β1水平分别为(197.23±4.13)pg/mL和(200.54±15.74)pg/mL,IL-17水平分别为(16.95±4.04)pg/mL和(16.52±4.04)pg/mL,IL-17/TGF-β1比值分别为0.09±0.02和0.08±0.02,两组间TGF-β1水平、IL-17水平和IL-17/TGF-β1比值差异均无统计学意义(均P>0.05)。用IFN-γ/IL-4、IFN-γ/IL-10、TNF-α/IL-10和TNF-α/IL-4比值代表Th1/Th2比值,结果显示(图 4),对照组IFN-γ/IL-4和TNF-α/IL-10比值低于实验组,IFN-γ/IL-10比值高于实验组,但差异均无统计学意义(均P>0.05);而实验组TNF-α/IL-4比值高于对照组,差异有统计学意义(P<0.05)。本结果提示Th1/Th2比值与RIF的发生有一定的关系,Th1/Th2比值或可成为检测RIF和移植胚胎间排异的有效指标,值得进一步研究。
|
图 4 非免疫因素致不孕症患者与RIF患者子宫内膜类器官Th1/Th2产生的细胞因子比值 Fig 4 Ratio of cytokines produced by Th1/Th2 of endometrial organoids from patients with non-immune infertility and RIF **P < 0.01. RIF: Repeated implantation failure; Th: Helper T cell; IFN-γ: Interferon γ; IL: Interleukin; TNF-α: Tumor necrosis factor α. |
3 讨论
子宫内膜类器官是代表子宫内膜结构和功能的、自组织的子宫内膜细胞的三维聚集体[13]。子宫内膜作为着床部位和妊娠的营养支持具有重要意义,但目前还没有长期的体外培养系统能再现子宫内膜的功能。二维单层细胞培养常用于体外研究。然而,原代细胞在长期培养中不能扩增且传代效率低,易丢失柱状表型和极性[14]。这些模型不能准确地反映人类子宫内膜发育和功能的所有特征。被称为类器官的3D细胞团能够从多种器官发展而来,成为研究组织生物学和疾病的有力工具[15]。
Turco等[16]建立了未怀孕女性的子宫内膜类器官和早期妊娠女性蜕膜类器官。Boretto等[17]成功建立了人和小鼠来源的子宫内膜类器官。本研究根据上述研究的培养条件对子宫内膜类器官培养条件进行优化调整,成功构建了非免疫相关不孕症患者及免疫相关RIF患者的子宫内膜类器官。本研究结果显示,子宫内膜类器官具有个体差异性,在相同培养时间内非免疫因素不孕症患者子宫内膜类器官的数量较RIF患者的多。这可能与免疫因素有关,也可能是组织大小、细胞数量差异及患者本身的个体差异所致。免疫荧光染色结果显示,RIF患者与非免疫因素不孕症患者子宫内膜类器官均表达子宫内膜标志物。
RIF可能是由子宫因素或胚胎因素改变引起的,子宫内膜容受性破坏、基因表达改变、外周血和/或子宫内膜免疫紊乱均与RIF有关。然而,并非所有患有RIF的女性都有相同类型的免疫功能障碍,这表明RIF是一种异质性疾病,与不同的免疫反应有关[18]。Th1细胞产生IL-2、IFN-γ和TNF-α等诱导细胞介导的细胞毒性和炎症反应;Th2细胞产生IL-4、IL-5、IL-6和IL-10等细胞因子,这些细胞因子在抗体的产生中起重要作用[19]。Kuroda等[20]对197例≥3次胚胎移植周期后RIF和/或≥2次临床妊娠失败后复发性妊娠丢失的患者进行Th检测,结果显示这两类患者的Th1水平和Th1/Th2比值高于可育和一般不育妇女。本研究结果表明,非免疫因素致不孕症患者的Th1和Th2相关细胞因子(IFN-γ、TNF-α、IL-4和IL-10)表达水平均高于RIF患者,差异均有统计学意义(P<0.05或P<0.01),TNF-α/IL-4比值高于RIF患者(P<0.01)。上述研究结果证实了Th1和Th2分泌的细胞因子可能在不同的生理或病理条件下发挥作用。研究证实,调节性T细胞(regulatory T cell,Treg)是子宫免疫调节的关键,其数量减少和功能下降与RIF密切相关,子宫内膜Th17与Treg细胞呈负相关[21],Th17/Treg细胞参与RIF患者外周血和子宫内膜组织的免疫调节[22],Th17和Treg之间的平衡可能更多地解释了生殖失败的病理生理过程[23]。子宫内膜Th1/Th2及Th17/Treg比例失衡会影响胚胎种植,是不明原因反复流产的关键因素[24]。本研究中非免疫因素不孕症患者与RIF患者的IL-17、TGF-β1及IL-17/TGF-β1比值差异无统计学意义,其原因可能是由于本研究样本量较小,后续拟扩大样本量进一步验证。
子宫内膜类器官体外模型可用于重复和标准化研究子宫内膜生理学和相关疾病,也是研究不孕症的工具[25]。Turco等[16]成功建立了恶性子宫内膜类器官,为研究子宫内膜异位症和子宫内膜癌等常见疾病以及早期妊娠生理学提供了有效的体外模型。此外,在激素刺激下,人子宫内膜类器官能够在形态组织学和分子水平上模拟正常的月经周期[17]。
关于子宫内膜类器官仍有一些障碍需要解决。首先,可变性和实用性是类器官研究的一个常见障碍;其次,开发一种能够包括免疫细胞、内皮细胞和子宫肌层细胞等其他细胞类型的培养系统是很困难的;最后,因为子宫内膜具有特殊的解剖特征,包括基底层和功能层,体外模拟很难再现类器官子宫内膜的特殊特征。但是,子宫内膜类器官为子宫内膜研究开辟了新的途径,为研究子宫内膜提供了极好的机会,推动了对子宫内膜发育和疾病的分子和细胞机制的理解。从疾病建模到个性化医疗,子宫内膜类器官将成为广泛的生物医学应用的有前途的工具。
| [1] |
CUNNINGHAM J. Infertility: a primer for primary care providers[J]. JAAPA, 2017, 30(9): 19-25. DOI:10.1097/01.JAA.0000522130.01619.b7 |
| [2] |
RANISAVLJEVIC N, RAAD J, ANAHORY T, et al. Embryo transfer strategy and therapeutic options in infertile patients with thin endometrium: a systematic review[J]. J Assist Reprod Genet, 2019, 36(11): 2217-2231. DOI:10.1007/s10815-019-01576-w |
| [3] |
ZHAO X, ZHAO Y, JIANG Y, et al. Deciphering the endometrial immune landscape of RIF during the window of implantation from cellular senescence by integrated bioinformatics analysis and machine learning[J]. Front Immunol, 2022, 13: 952708. DOI:10.3389/fimmu.2022.952708 |
| [4] |
王萌莹. Notch1、VEGFA在反复着床失败子宫内膜的表达及机制研究[D]. 郑州: 郑州大学, 2019.
|
| [5] |
MALI P, YANG L, ESVELT K M, et al. RNA-guided human genome engineering via Cas9[J]. Science, 2013, 339(6121): 823-826. DOI:10.1126/science.1232033 |
| [6] |
HEIDARI-KHOEI H, ESFANDIARI F, MOINI A, et al. Derivation of hormone-responsive human endometrial organoids and stromal cells from cryopreserved biopsies[J]. Exp Cell Res, 2022, 417(1): 113205. DOI:10.1016/j.yexcr.2022.113205 |
| [7] |
GHASEMNEJAD-BERENJI H, GHAFFARI NOVIN M, HAJSHAFIHA M, et al. Immunomodulatory effects of hydroxychloroquine on Th1/Th2 balance in women with repeated implantation failure[J]. Biomedecine Pharmacother, 2018, 107: 1277-1285. DOI:10.1016/j.biopha.2018.08.027 |
| [8] |
VACCA P, VITALE C, MUNARI E, et al. Human innate lymphoid cells: their functional and cellular interactions in decidua[J]. Front Immunol, 2018, 9: 1897. DOI:10.3389/fimmu.2018.01897 |
| [9] |
VALENCIA-ORTEGA J, SAUCEDO R, PEÑA-CANO M I, et al. Immune tolerance at the maternal-placental interface in healthy pregnancy and pre-eclampsia[J]. J Obstet Gynaecol Res, 2020, 46(7): 1067-1076. DOI:10.1111/jog.14309 |
| [10] |
CHANG R Q, ZHOU W J, LI D J, et al. Innate lymphoid cells at the maternal-fetal interface in human pregnancy[J]. Int J Biol Sci, 2020, 16(6): 957-969. DOI:10.7150/ijbs.38264 |
| [11] |
GU Z Y, JIA S Z, LIU S, et al. Endometrial organoids: a new model for the research of endometrial-related diseases[J]. Biol Reprod, 2020, 103(5): 918-926. DOI:10.1093/biolre/ioaa124 |
| [12] |
GUO J, ZHOU W, SACCO M, et al. Using organoids to investigate human endometrial receptivity[J]. Front Endocrinol, 2023, 14: 1158515. DOI:10.3389/fendo.2023.1158515 |
| [13] |
SONG Y, FAZLEABAS A T. Endometrial organoids: a rising star for research on endometrial development and associated diseases[J]. Reprod Sci, 2021, 28(6): 1626-1636. DOI:10.1007/s43032-021-00471-z |
| [14] |
STRUG M R, SU R W, KIM T H, et al. The Notch family transcription factor, RBPJκ, modulates glucose transporter and ovarian steroid hormone receptor expression during decidualization[J]. Reprod Sci, 2019, 26(6): 774-784. DOI:10.1177/1933719118799209 |
| [15] |
JAMALUDDIN M F B, GHOSH A, INGLE A, et al. Bovine and human endometrium-derived hydrogels support organoid culture from healthy and cancerous tissues[J]. Proc Natl Acad Sci USA, 2022, 119(44): e2208040119. DOI:10.1073/pnas.2208040119 |
| [16] |
TURCO M Y, GARDNER L, HUGHES J, et al. Long-term, hormone-responsive organoid cultures of human endometrium in a chemically defined medium[J]. Nat Cell Biol, 2017, 19(5): 568-577. DOI:10.1038/ncb3516 |
| [17] |
BORETTO M, COX B, NOBEN M, et al. Development of organoids from mouse and human endometrium showing endometrial epithelium physiology and long-term expandability[J]. Development, 2017, 144(10): 1775-1786. DOI:10.1242/dev.148478 |
| [18] |
MUKHERJEE N, SHARMA R, MODI D. Immune alterations in recurrent implantation failure[J]. Am J Reprod Immunol, 2023, 89(2): e13563. DOI:10.1111/aji.13563 |
| [19] |
MOSMANN T R, SAD S. The expanding universe of T-cell subsets: Th1, Th2 and more[J]. Immunol Today, 1996, 17(3): 138-146. DOI:10.1016/0167-5699(96)80606-2 |
| [20] |
KURODA K, NAKAGAWA K, HORIKAWA T, et al. Increasing number of implantation failures and pregnancy losses associated with elevated Th1/Th2 cell ratio[J]. Am J Reprod Immunol, 2021, 86(3): e13429. DOI:10.1111/aji.13429 |
| [21] |
MROZIKIEWICZ A E, OAROWSKI M, JDRZEJCZAK P. Biomolecular markers of recurrent implantation failure-a review[J]. Int J Mol Sci, 2021, 22(18): 10082. DOI:10.3390/ijms221810082 |
| [22] |
SADEGHPOUR S, GHASEMNEJAD BERENJI M, NAZARIAN H, et al. Effects of treatment with hydroxychloroquine on the modulation of Th17/Treg ratio and pregnancy outcomes in women with recurrent implantation failure: clinical trial[J]. Immunopharmacol Immunotoxicol, 2020, 42(6): 632-642. DOI:10.1080/08923973.2020.1835951 |
| [23] |
LEE S K, KIM J Y, LEE M, et al. Th17 and regulatory T cells in women with recurrent pregnancy loss[J]. Am J Reprod Immunol, 2012, 67(4): 311-318. DOI:10.1111/j.1600-0897.2012.01116.x |
| [24] |
LOGIODICE F, LOMBARDELLI L, KULLOLLI O, et al. Decidual interleukin-22-producing CD4+ T cells (Th17/Th0/IL-22+ and Th17/Th2/IL-22+, Th2/IL-22+, Th0/IL-22+), which also produce IL-4, are involved in the success of pregnancy[J]. Int J Mol Sci, 2019, 20(2): 428. DOI:10.3390/ijms20020428 |
| [25] |
NIKOLAKOPOULOU K, TURCO M Y. Investigation of infertility using endometrial organoids[J]. Reproduction, 2021, 161(5): R113-R127. DOI:10.1530/REP-20-0428 |
 2024, Vol. 45
2024, Vol. 45


