《景岳全书·新方八阵》中的玉女煎由生石膏、熟地黄、知母、牛膝和麦冬等药物组成,具有滋阴清热作用,临床用于治疗牙周炎和口腔溃疡等炎症性疾病[1]。有研究显示,玉女煎复方及其各单味药材均具有不同程度的抗炎作用[2-4]。玉女煎对血热风燥型面部脂溢性皮炎有治疗作用[5]。生石膏具有良好的清热抗炎作用,可以有效改善热应激引起的小鼠下丘脑炎症[6]。熟地黄多糖能降低炎症因子IL-1β和TNF-α的表达,改善骨关节炎症状[7]。知母皂苷B-Ⅱ(timosaponin B-Ⅱ,TB-Ⅱ)能够激活JNK、NF-κB和MAPK信号通路,减少炎症小体表达,发挥抗炎作用[8]。知母皂苷元能够抑制脂多糖(lipopolysaccharide,LPS)诱导的小胶质细胞上清液中炎症因子表达,减少一氧化氮(nitric oxide,NO)的产生,促进原代小胶质细胞由M1亚型转变为M2亚型[9]。牛膝总皂苷可以降低骨关节炎小鼠关节渗出液中促炎因子的表达和NALP3炎症小体的活化[10]。麦冬中的皂苷D可以通过抑制NF-κB通路减轻LPS诱导的人肺上皮细胞炎症反应[11]。本课题组前期研究显示,玉女煎及其主要成分芒果苷具有抗炎活性[12-15]。本研究对玉女煎抗炎的最佳活性部位进行筛选,并初步探讨该部位的抗炎物质基础。
1 材料和方法 1.1 细胞株小鼠巨噬细胞RAW264.7购自北京协和细胞库。
1.2 主要试剂和仪器RPMI 1640培养基、0.25%胰蛋白酶-EDTA消化液购自上海达特希尔生物科技有限公司(批号:2244286、2223103),FBS购自澳大利亚Biological Industries公司(批号:2134232),LPS购自美国Sigma-Aldrich公司(批号:0000130083),N-(1-萘基)-乙二胺二盐酸盐[N-(1-naphthyl)-ethylenediamine, dihydrochloride,NED]、磺胺购自生工生物工程(上海)股份有限公司(批号:D703BA0016、D505BA0035),MTT购自北京索莱宝科技有限公司(批号:1123A051),通用型细胞组织固定液购自赛文创新(北京)生物科技有限公司(批号:20210115),兔NF-κB p65单克隆抗体购自上海碧云天生物科技有限公司,CoraLite594标记的山羊抗兔IgG(H+L)购自武汉三鹰生物技术有限公司(批号:20000439),无水乙醇、正丁醇、氯仿、甲醇购自天津市百世化工有限工司,D101大孔树脂、中压色谱分离凝胶(middle chromatogram isolated gel,MCI)购自日本三菱公司。311型细胞恒温培养箱(美国ThermoFisher Scientific公司),SW-CJ-2FD型超净工作台(苏净集团安泰公司),IX73型倒置荧光显微镜(日本奥林巴斯公司),Thermo Multiskan GO型多功能全波长酶标仪(美国Bio-Tek Instruments公司),Varian Mercury plus-600型核磁共振仪(德国布鲁克公司)。
1.3 玉女煎水提液及不同极性部位提取液的制备分别精准称取15 g生石膏、30 g熟地黄、6 g麦冬、5 g知母和5 g牛膝,加入10倍量的水中,煎煮1 h,过滤出滤渣,再以8倍量的水继续煎煮1 h,最终收集滤液,使用旋转蒸发仪对其进行浓缩。浓缩后的样品置于-80 ℃冰箱冷冻过夜,采用真空冷冻干燥机干燥后备用。使用D101大孔树脂吸附样品,然后用去离子水及30%、60%、95%乙醇-水溶液进行洗脱,以获得最佳的吸附效果。将各洗脱液用旋转蒸发仪旋蒸浓缩成稠膏,用真空冷冻干燥机制备为干粉,分别装瓶备用。
1.4 玉女煎水提液及不同极性部位提取液的抗炎活性考察采用LPS诱导的小鼠巨噬细胞炎症模型评价玉女煎水提液及各洗脱部位的抗炎活性。
1.4.1 RAW264.7细胞相对活力检测将RAW264.7细胞以2×105个/孔的密度铺到96孔板中。将细胞用玉女煎不同极性部位提取液处理1 h后,每孔加入10 μL LPS(终浓度为1 μg/mL)诱导24 h。诱导结束后,每孔加入15 μL MTT,继续培养4 h。弃上清液,每孔加入150 μL DMSO,于37 ℃恒温震荡10 min,采用全波长酶标仪检测450 nm处的光密度值,计算细胞相对活力。
1.4.2 NO及炎症细胞因子检测将RAW264.7细胞以2×105个/孔的密度铺到96孔板中。将细胞用玉女煎不同极性部位提取液处理1 h后,每孔加入10 μL LPS(终浓度为1 μg/mL)诱导24 h。诱导结束后,收集细胞上清液用于后续检测。在新的96孔板中加入各组细胞上清液50 μL,随后每孔加入50 μL磺胺和50 μL NED避光反应10 min,将96孔板轻轻震荡混匀后采用全波长酶标仪检测540 nm处的光密度值,采用NO反应标准曲线计算各待测样品的NO含量。另取细胞上清液,采用ELISA试剂盒检测IL-1β、IL-6及TNF-α水平。
1.4.3 细胞形态观察将洁净、无菌的载玻片置于6孔板中。取对数生长期的细胞,以2×107个/孔的密度铺到6孔板中。将细胞用玉女煎不同极性部位提取液处理1 h后,每孔加入10 μL LPS(终浓度为1 μg/mL)诱导24 h。诱导结束后,用细胞固定液固定细胞。将固定好的样品置于显微镜载物台上,先用普通聚光镜调整光路,调整好光路后将普通聚光镜更换为暗场聚光镜,进行暗场成像并采集图片。
1.4.4 免疫荧光实验将RAW264.7细胞以2×104个/孔的密度铺到96孔板中。将细胞用玉女煎不同极性部位提取液处理1 h后,每孔加入10 μL LPS(终浓度为1 μg/mL)诱导24 h。诱导结束后弃上清液,用PBS洗涤3次,每次5 min。用固定液固定细胞15 min后,每孔加入适量的0.3% Triton X-100通透15 min。随后用5%牛血清白蛋白于37 ℃封闭1 h,加入NF-κB p65抗体(稀释比例为1∶100)于4 ℃孵育过夜,用PBST轻轻震荡洗涤3次,每次5 min。加入CoraLite594标记的二抗(稀释比例为1∶400)于37 ℃避光孵育1 h,用PBST轻轻震荡洗涤3次,每次5 min。最后用DAPI细胞核染色液染核,用PBS洗涤细胞后,在荧光显微镜下观察并拍照。
1.5 玉女煎抗炎活性最佳部位成分考察 1.5.1 正丁醇萃取活性部位取玉女煎60%乙醇-水洗脱部位干燥粉末12.086 3 g,加纯水400 mL溶解,于分液漏斗中加正丁醇400 mL,萃取,随后将水相与正丁醇相均用旋转蒸发仪蒸干。
1.5.2 MCI柱分离正丁醇相用36 mL甲醇溶解正丁醇相,分2次和MCI拌样,研细装柱,分别用水、50%甲醇、100%甲醇以8 mL/min流速洗脱50 min,洗脱液分别蒸干。
1.5.3 MCI柱分离正丁醇相甲醇洗脱部位正丁醇相的甲醇洗脱部位干燥后,取粉末称取6.8 g,加40 mL甲醇溶解,分2次拌样并装柱,用75%甲醇-水冲洗柱子80 min、甲醇洗脱70 min,流速均为10 mL/min,将洗脱的75%甲醇相和甲醇相分别蒸干称重。
将甲醇相加甲醇溶解并和反相填料拌样装柱,先用20%甲醇-水冲洗柱子30 min,再用50%、60%、70%、80%、90%、100%甲醇分别洗脱3个柱体积,收集洗脱液并分别蒸干,用甲醇分别点硅胶板,展开剂用氯仿-甲醇(体积比为20∶1),根据硅胶板各点比移值将合适管中样品进行合并。
1.5.4 化合物的纯化采用HPLC对样品中活性部位的化合物进行纯化。流动相为乙腈-水(体积比为40∶60),流速为2.5 mL/min。将各峰分别收集在锥形瓶中,于旋转蒸发仪上蒸干,用甲醇洗在西林瓶中,点硅胶板。
1.5.5 化合物鉴定用核磁共振仪检测HPLC分离得到的4个峰收集液的碳谱和氢谱,并进行谱图分析。
1.6 统计学处理使用SPSS 22.0软件对数据进行分析。所有数据均以x±s表示,多组间比较采用单因素方差分析,并采用最小显著性差异法(方差齐)或Dunnett’s T3法(方差不齐)进行事后多重比较。检验水准(α)为0.05。
2 结果 2.1 玉女煎不同洗脱部位对RAW264.7细胞相对活力的影响由表 1可见,质量浓度为1、2 mg/mL的玉女煎95%乙醇-水洗脱部位有一定细胞毒性(P<0.01),其他洗脱部位对细胞相对活力无明显影响。如表 2所示,1 μg/mL LPS处理诱导的RAW264.7细胞相对活力约降低为空白组的85%(P<0.01),玉女煎水提液能对LPS诱导的细胞活力降低产生逆转作用并存在浓度依赖性,当浓度为1、2 mg/mL时细胞相对活力与LPS组比较差异有统计学意义(P<0.01);水洗脱部位对LPS诱导的细胞活力降低无明显影响(P>0.05);30%乙醇-水洗脱部位质量浓度为0.5 mg/mL时能改善LPS诱导的细胞活力降低(P<0.05),但当质量浓度为1、2 mg/mL时与LPS组比较差异无统计学意义(P>0.05);60%乙醇-水洗脱部位(50、100、200 μg/mL)随着浓度增大对细胞活力的保护作用增强,与LPS组比较差异均有统计学意义(P<0.01);95%乙醇-水洗脱部位则加重了细胞损伤,细胞相对活力比LPS组更低(P<0.01)。
|
|
表 1 玉女煎水提液及不同极性部位对RWA264.7细胞相对活力的影响 Tab 1 Effects of water extract and different polarity fractions of Yunüjian on viability of RWA264.7 cells |
|
|
表 2 玉女煎水提液及不同极性部位对LPS诱导的RWA264.7细胞相对活力降低和NO生成的影响 Tab 2 Effects of water extract and different polarity fractions of Yunüjian on viability decrease and NO production induced by LPS in RWA264.7 cells |
2.2 玉女煎不同活性部位对RAW264.7细胞NO生成的影响
玉女煎水提液(0.5、1、2 mg/mL)、60%乙醇-水洗脱部位(50、100、200 μg/mL)均以浓度依赖方式抑制LPS诱导的NO生成,与LPS组比较差异有统计学意义(P<0.05);玉女煎水洗脱部位(0.5、1、2 mg/mL)和30%乙醇-水洗脱部位(0.5、1、2 mg/mL)也能抑制NO生成活性,但没有明显的浓度依赖性。见表 2。
2.3 玉女煎60%乙醇-水洗脱部位对LPS诱导的RAW264.7细胞炎症因子分泌的影响如表 3所示,与对照组相比,LPS组的IL-1β、IL-6及TNF-α水平均增高(P<0.01);与LPS组比较,NF-κB抑制剂BAY11-7082(10 μmol/L)能降低IL-1β、IL-6及TNF-α的水平(P<0.01);玉女煎60%乙醇-水洗脱部位(100、200 μg/mL)能以浓度依赖的方式抑制LPS诱导的炎症因子分泌(P<0.01)。
|
|
表 3 玉女煎60%乙醇-水洗脱部位对RWA264.7细胞炎症因子分泌的影响 Tab 3 Effect of 60% ethanol-water elution fraction of Yunüjian on secretion of inflammatory cytokines in RWA264.7 cells |
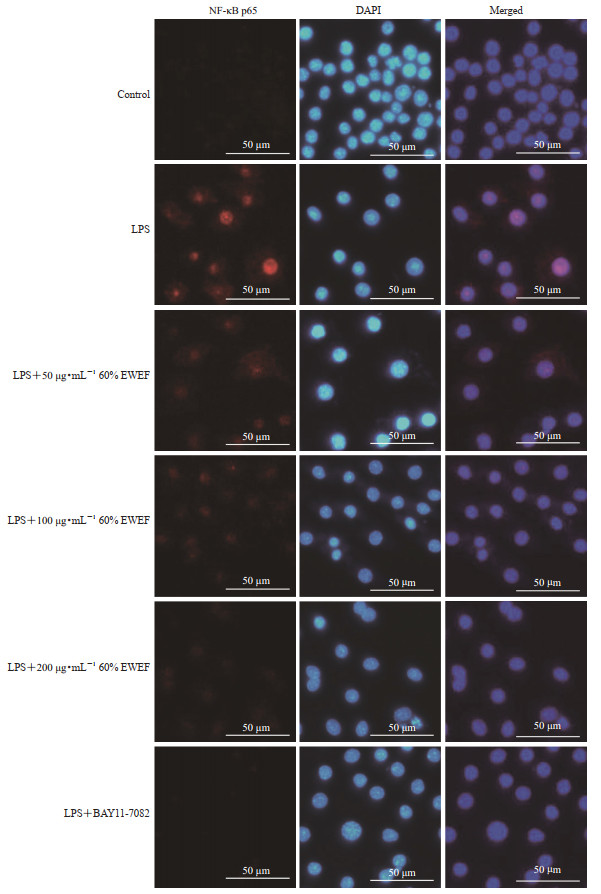
2.4 玉女煎60%乙醇-水洗脱部位对RAW264.7细胞形态及NF-κB表达的影响
如图 1所示,对照组RAW264.7细胞形态规则,细胞轮廓清晰;LPS处理后,细胞形态变得不规则;玉女煎60%乙醇-水洗脱部位不同浓度(50、100、200 μg/mL)组及NF-κB抑制剂BAY11-7082(10 μmol/L)组细胞形态有所恢复。由图 2可见,对照组细胞中NF-κB表达量较低;LPS组NF-κB表达量提高,且出现细胞核移位;玉女煎60%乙醇-水洗脱部位不同浓度(50、100、200 μg/mL)组NF-κB表达有不同程度的降低,且随着药物浓度的增大NF-κB表达降低更多。

|
图 1 玉女煎60%乙醇-水洗脱部位(EWEF)对RWA264.7细胞形态的影响 Fig 1 Effect of 60% ethanol-water elution fraction (EWEF) of Yunüjian on morphology of RWA264.7 cells The pictures were obtained by dark-field microssopy. BAY11-7082 is an inhibitor of nuclear factor κ B. LPS: Lipopolysaccharide. |
|
图 2 玉女煎60%乙醇-水洗脱部位(EWEF)对RWA264.7细胞NF-κB表达的影响 Fig 2 Effect of 60% ethanol-water elution fraction (EWEF) of Yunüjian on NF-κB expression of RWA264.7 cells BAY11-7082 is an inhibitor of NF-κB. NF-κB: Nuclear factor κ B; LPS: Lipopolysaccharide; DAPI: 4', 6-diamidino-2-phenylindole. |
2.5 玉女煎60%乙醇-水洗脱部位成分分析
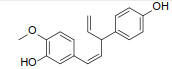
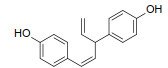
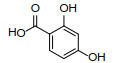
通过HPLC共分离出了面积较大的4个峰,检测了其13CNMR和1HNMR(图 3)。谱图解析发现,1号峰为sonnerphenolic B,2号峰为(+)-nyasol(归属知母),3号峰为broussonin A(归属知母),4号峰为2,4-二甲基苯甲酸和2,4-二羟基苯甲酸(归属知母)的混合物(组分比例约为2∶1),且在当前很可能是以羧酸盐的形式存在(表 4)。数据库查询结果显示,sonnerphenolic B和2,4-二甲基苯甲酸不能归属到玉女煎中任一味药材。
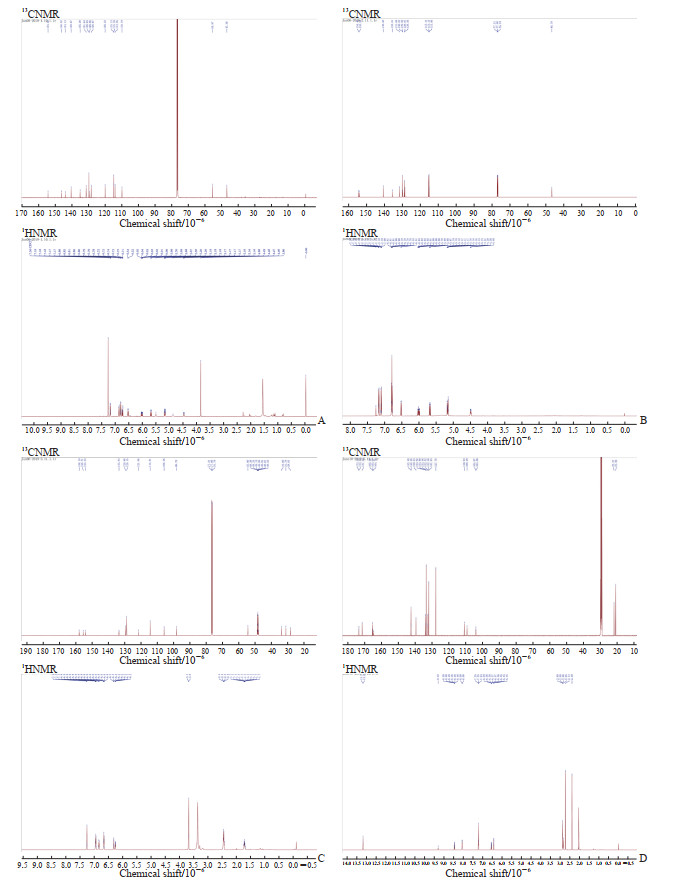
|
图 3 玉女煎60%乙醇-水洗脱部位HPLC分离峰1~4的13CNMR和1HNMR谱 Fig 3 13CNMR and 1HNMR spectra of peaks 1-4 isolated from 60% ethanol-water elution fraction of Yunüjian by HPLC A: Peak 1 (sonnerphenolic B); B: Peak 2 ((+)-nyasol); C: Peak 3 (broussonin A); D: Peak 4 (mixture of 2,4-dimethylbenzoic acid and 2,4-dihydroxybenzoic acid). HPLC: High-performance liquid chromatography; 13CNMR: Carbon-13 nuclear magnetic resonance; 1HNMR: Hydrogen-1 nuclear magnetic resonance. |
|
|
表 4 玉女煎60%乙醇-水洗脱部位HPLC分离峰1~4鉴定出的化合物 Tab 4 Compounds of peaks 1-4 isolated from 60% ethanol-water elution fraction of Yunüjian by HPLC |
3 讨论
玉女煎复方由生石膏等5味药材组成,具有清脏腑热等功效[16]。现代药理学研究显示,中医“热”与炎症有密切关系[17]。风热血热型患者体内的促炎细胞因子TNF-α、干扰素γ及IL-1表达水平升高,而抗炎因子IL-10表达减少[18]。本课题组前期研究结果显示玉女煎具有抗炎活性,对LPS诱导的BV2细胞炎症有抑制作用,在体内对大鼠关节炎有改善作用[13-15]。为了进一步明确玉女煎抗炎的物质基础,本研究以树脂分离结合活性追踪的方法对玉女煎的最佳抗炎活性部位进行筛选,并对最佳活性部位含量较大的4个峰进行了成分鉴定。
3.1 60%乙醇-水洗脱部位是玉女煎抗炎的最佳活性部位本研究首先采用D101大孔树脂分离获得玉女煎不同极性部位,包括水洗脱部位、30%乙醇-水洗脱部位、60%乙醇-水洗脱部位和95%乙醇-水洗脱部位。采用LPS诱导RAW264.7细胞炎症模型,通过检测NO的分泌量评价抗炎活性。NO是一氧化氮合酶在L-精氨酸转化为L-瓜氨酸的过程中产生的,可以引起血管舒张、白细胞黏附和血管通透性增加,是一种重要的炎症细胞因子[19]。在单核细胞中,LPS可通过激活NF-κB和MAPK信号通路引起IL-1、TNF-α、IL-6及NO释放,产生炎症反应[20]。本研究结果显示,玉女煎60%乙醇-水洗脱部位具有最强的NO分泌抑制活性,其作用也强于玉女煎水提液。
本研究通过暗场成像观察细胞形态的变化,用免疫荧光实验检测了NF-κB的细胞核移位水平。炎症发生时,RAW264.7细胞出现多形性,发生明显的伪足伸长、变多,体积增大,细胞质中出现空泡[21]。NF-κB是一种核转录因子,静息状态时与其抑制蛋白IκB结合并定位于细胞质中,当受到LPS等触发时NF-κB与IκB解离并移位至细胞核中,启动下游炎症因子IL-1β、IL-6、TNF-α等的表达[22],故当细胞发生炎症反应时会出现NF-κB核移位现象[23]。本研究发现,玉女煎60%乙醇-水洗脱部位能抑制RAW264.7细胞促炎形态的转变和NF-κB核移位。
3.2 玉女煎60%乙醇-水洗脱部位化学成分分析本研究通过MCI柱分离、HPLC分离及核磁共振仪分析了60%乙醇-水洗脱部位的化学成分,对HPLC分离获得的4个面积较大的峰进行13CNMR和1HNMR鉴定。结果发现,峰1为化合物sonnerphenolic B,峰2为化合物(+)-nyasol,峰3为化合物broussonin A,峰4为化合物2,4-二甲基苯甲酸和2,4-二羟基苯甲酸的混合物(组成比例约为2∶1)。nyasol是一种类二十酸和NO生成的广谱抑制剂,可以增加大鼠嗜碱性白血病细胞和小鼠巨噬细胞中类二十烷酸和NO的产生[24],降低LPS诱导的小鼠小胶质细胞中IL-1β和TNF-α的mRNA水平,具有很好的抗炎作用[25]。broussonin A是一种二芳基丙烷天然产物,可以调节NF-κB、Akt和ERK信号通路,在转录水平上抑制LPS刺激的诱导型一氧化氮合酶表达[26-27]。sonnerphenolic B是一种酚类化合物,具有潜在的乙酰胆碱酯酶抑制作用[28]。2,4-二甲基苯甲酸是1,2,4-三甲基苯的代谢产物,具有广谱抗菌活性[29]。在特异性的ADCK4敲除小鼠足细胞中,2,4-二羟基苯甲酸通过上调辅酶Q复合物水平逆转线粒体功能障碍[30]。查阅PubChem、PubMed、EMBASE、Cochrane Library数据库,未见sonnerphenolic B、2,4-二甲基苯甲酸和2,4-二羟基苯甲酸有抗炎活性的相关报道。
3.3 知母可能是玉女煎抗炎活性的重要贡献者为了对鉴定出的4个化合物进行药材归属,首先在PubChem数据库中检索分子信息,随后从中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)、传统中药百科全书数据库(The Encyclopedia of Traditional Chinese Medicine,ETCM)、本草组鉴(HERB)和中医药综合数据库(Traditional Chinese Medicine Information Database,TCMID)等中药数据库获取玉女煎复方中各味药材的化学成分进行比对。结果显示,(+)-nyasol、broussonin A和2,4-二羟基苯甲酸均归属于知母,而sonnerphenolic B、2,4-二甲基苯甲酸无法确定归属,可能是药材在煎煮过程中产生的新化合物。已有研究显示,sonnerphenolic B是植物卵叶海桑中的成分[25],2,4-二甲基苯甲酸是真菌头孢菌属AL031的次级代谢物[26]。我们后续将对玉女煎中这2个化合物的来源进行深入研究。
综上所述,本研究筛选出60%乙醇-水洗脱部位为玉女煎的最佳抗炎活性部位,鉴定出含量较大的5个化合物,其中有3个归属于知母,为玉女煎抗炎物质基础的研究奠定了一定的实验基础。
| [1] |
王卫, 吕佳楗, 王欣, 等. 玉女煎治疗糖尿病及并发症研究进展[J]. 中国实验方剂学杂志, 2022, 28(15): 223-231. DOI:10.13422/j.cnki.syfjx.20220925 |
| [2] |
YE Q, LIN B, XU P, et al. Yunvjian decoction attenuates lipopolysaccharide-induced periodontitis by suppressing NFκB/NLRP3/IL-1β pathway[J]. J Ethnopharmacol, 2024, 319(Pt 2): 117279. DOI:10.1016/j.jep.2023.117279 |
| [3] |
李倩, 陈香茗, 常鑫鑫, 等. 知母活性成分对脓毒症性心肌损伤模型小鼠的改善作用[J]. 中国药房, 2023, 34(1): 29-33, 39. DOI:10.6039/j.issn.1001-0408.2023.01.06 |
| [4] |
孙欣彤, 于艳华, 李梦佳, 等. 清胃散合玉女煎对牙周炎大鼠炎症因子和细胞外基质金属蛋白酶的影响[J]. 中华老年口腔医学杂志, 2021, 19(5): 286-290, 311. DOI:10.19749/j.cn.cjgd.1672-2973.2021.05.007 |
| [5] |
汪胜红. 血热风燥型面部脂溢性皮炎行加味玉女煎治疗的临床疗效研究[J]. 中国社区医师, 2020, 36(21): 130-131. DOI:10.3969/j.issn.1007-614X.2020.21.079 |
| [6] |
时文凤, 曹艳, 曹国胜, 等. 矿物药石膏的研究进展[J]. 中药材, 2021, 44(7): 1793-1796. DOI:10.13863/j.issn1001-4454.2021.07.045 |
| [7] |
凤雯晴, 刘凯洋, 张嘉宁, 等. 基于网络药理学和分子对接的熟地黄治疗骨关节炎的作用机制研究[J]. 中国中药杂志, 2022, 47(19): 5336-5343. DOI:10.19540/j.cnki.cjcmm.20220427.401 |
| [8] |
武双敏, 李泽运, 侯书涵, 等. 知母皂苷B-Ⅱ药理活性及作用机制研究进展[J]. 上海中医药大学学报, 2021, 35(6): 92-96. DOI:10.16306/j.1008-861x.2021.06.013 |
| [9] |
杨志友, 胡雪琼. 知母皂苷元对脂多糖诱导的BV2小胶质细胞亚型M1/M2的极化及其抗炎活性[J]. 现代食品科技, 2020, 36(11): 1-8. DOI:10.13982/j.mfst.1673-9078.2020.11.0406 |
| [10] |
那莎, 段陈方圆, 王璐, 等. 牛膝总皂苷对大鼠急性痛风性关节炎的防治作用及机制研究[J]. 中国临床药理学与治疗学, 2017, 22(9): 966-971. |
| [11] |
徐玲文, 王华兵, 揭凤英, 等. 麦冬皂苷D预处理对LPS介导的人肺上皮Beas-2B细胞炎性及氧化损伤的抑制作用[J]. 沈阳药科大学学报, 2021, 38(12): 1302-1308. DOI:10.14066/j.cnki.cn21-1349/r.2020.1110 |
| [12] |
雷莉妍, 王瑞成, 周瑞, 等. 基于NF-κB通路的芒果苷干预脂多糖诱导的细胞炎症作用机制研究[J]. 中国中西医结合杂志, 2019, 39(5): 597-602. DOI:10.7661/j.cjim.20190116.096 |
| [13] |
LEI L Y, WANG R C, PAN Y L, et al. Mangiferin inhibited neuroinflammation through regulating microglial polarization and suppressing NF-κB, NLRP3 pathway[J]. Chin J Nat Med, 2021, 19(2): 112-119. DOI:10.1016/S1875-5364(21)60012-2 |
| [14] |
雷莉妍, 王瑞成, 唐志书, 等. 玉女煎对脂多糖诱导的BV2细胞炎性损伤的保护作用及机制研究[J]. 中药药理与临床, 2019, 35(1): 6-10. DOI:10.13412/j.cnki.zyyl.2019.01.002 |
| [15] |
雷莉妍, 王瑞成, 谢培, 等. 玉女煎对大鼠佐剂性关节炎的治疗作用及机制研究[J]. 中国现代中药, 2017, 19(2): 196-199, 213. DOI:10.13313/j.issn.1673-4890.2017.2.007 |
| [16] |
李梦佳, 王宏, 董臣林, 等. 基于网络药理学探讨玉女煎治疗牙周炎的作用机制[J]. 中国医院用药评价与分析, 2022, 22(8): 904-909, 914. DOI:10.14009/j.issn.1672-2124.2022.08.003 |
| [17] |
LUO W Y, GAO L, ZHAO D D, et al. Yunvjian improves glucose and insulin function in diabetic rats by regulating gastric emptying function[J]. Evid Based Complement Alternat Med, 2023, 2023: 8551406. DOI:10.1155/2023/8551406 |
| [18] |
陈若曦, 张益生, 孙占学. 玉肤褪红汤对风热血热型激素依赖性皮炎患者的临床疗效及TEWL、血清IL-4、IFN-γ水平的影响[J]. 中国皮肤性病学杂志, 2020, 34(2): 205-208. DOI:10.13735/j.cjdv.1001-7089.201903135 |
| [19] |
LIY P M, PUZI N N A, JOSE S, et al. Nitric oxide modulation in neuroinflammation and the role of mesenchymal stem cells[J]. Exp Biol Med (Maywood), 2021, 246(22): 2399-2406. DOI:10.1177/1535370221997052 |
| [20] |
XU R, MA L, CHEN T, et al. Sophorolipid suppresses LPS-induced inflammation in RAW264.7 cells through the NF-κB signaling pathway[J]. Molecules, 2022, 27(15): 5037. DOI:10.3390/molecules27155037 |
| [21] |
SUN S, DU Y, YIN C, et al. Water-separated part of Chloranthus serratus alleviates lipopolysaccharide- induced RAW264.7 cell injury mainly by regulating the MAPK and Nrf2/HO-1 inflammatory pathways[J]. BMC Complement Altern Med, 2019, 19(1): 343. DOI:10.1186/s12906-019-2755-6 |
| [22] |
SOMENSI N, RABELO T K, GUIMARÃES A G, et al. Carvacrol suppresses LPS-induced pro-inflammatory activation in RAW 264.7 macrophages through ERK1/2 and NF-kB pathway[J]. Int Immunopharmacol, 2019, 75: 105743. DOI:10.1016/j.intimp.2019.105743 |
| [23] |
ZUSSO M, LUNARDI V, FRANCESCHINI D, et al. Ciprofloxacin and levofloxacin attenuate microglia inflammatory response via TLR4/NF-kB pathway[J]. J Neuroinflammation, 2019, 16(1): 148. DOI:10.1186/s12974-019-1538-9 |
| [24] |
LIM H, NAM J W, SEO E K, et al. (-)-nyasol (cis-hinokiresinol), a norneolignan from the rhizomes of Anemarrhena asphodeloides, is a broad spectrum inhibitor of eicosanoid and nitric oxide production[J]. Arch Pharm Res, 2009, 32(11): 1509-1514. DOI:10.1007/s12272-009-2102-4 |
| [25] |
LEE H J, LI H, CHANG H R, et al. (-)-nyasol, isolated from Anemarrhena asphodeloides suppresses neuroinflammatory response through the inhibition of I-κBα degradation in LPS-stimulated BV-2 microglial cells[J]. J Enzyme Inhib Med Chem, 2013, 28(5): 954-959. DOI:10.3109/14756366.2012.697057 |
| [26] |
LEE J P, KANG M G, LEE J Y, et al. Potent inhibition of acetylcholinesterase by sargachromanol I from Sargassum siliquastrum and by selected natural compounds[J]. Bioorg Chem, 2019, 89: 103043. DOI:10.1016/j.bioorg.2019.103043 |
| [27] |
LEE E J, CHUNG H J, PYEE Y, et al. Suppression of inducible nitric oxide synthase expression by nyasol and broussonin A, two phenolic compounds from Anemarrhena asphodeloides, through NF-κB transcriptional regulation in vitro and in vivo[J]. Chem Biodivers, 2014, 11(5): 749-759. DOI:10.1002/cbdv.201400003 |
| [28] |
NGUYEN T H T, PHAM H V T, PHAM N K T, et al. Chemical constituents from Sonneratia ovata Backer and their in vitro cytotoxicity and acetylcholinesterase inhibitory activities[J]. Bioorg Med Chem Lett, 2015, 25(11): 2366-2371. DOI:10.1016/j.bmcl.2015.04.017 |
| [29] |
毕韵梅, 包蕾, 鲍伟, 等. 头孢霉AL031真菌次生代谢产物的抗菌活性研究[J]. 中药材, 2004, 27(4): 270-272. DOI:10.13863/j.issn1001-4454.2004.04.019 |
| [30] |
WIDMEIER E, YU S, NAG A, et al. ADCK4 deficiency destabilizes the coenzyme Q complex, which is rescued by 2,4-dihydroxybenzoic acid treatment[J]. J Am Soc Nephrol, 2020, 31(6): 1191-1211. DOI:10.1681/ASN.2019070756 |
 2024, Vol. 45
2024, Vol. 45