蜱媒脑炎是以中枢神经系统病变为主要表现的一种自然疫源性、病毒性疾病,在中欧和东欧的许多地区其发病率远高于其他虫媒病毒感染性疾病[1-2]。蜱媒脑炎的病原体蜱媒脑炎病毒(tick-borne encephalitis virus,TBEV)是欧洲和亚洲北部最重要的虫媒病毒,并且蜱媒脑炎的地理分布近年呈扩张趋势,已传播到高海拔地区[3]。TBEV主要通过蜱叮咬传播,也可因误食未经消毒的TBEV污染乳制品而感染[4]。在自然界,TBEV的主要宿主是森林中的小型哺乳动物和鸟类,但这些动物感染后一般不发病,而是作为病毒的储存宿主[5]。TBEV感染人类可引起脑炎、脑膜炎、脑膜脑炎,并可伴永久性后遗症,甚至导致死亡[6]。据报道,TBEV在欧洲和俄罗斯每年造成1万~1.3万例感染者,而且感染人数呈逐年增加趋势,是人类健康的潜在威胁[7]。
小动物模型不仅在研究TBEV致病机制和宿主免疫应答方面发挥重要作用,而且是研发TBEV疫苗和抗病毒药物的必要工具。更经济、更可靠的动物模型对于评估虫媒病毒感染性疾病疫苗和抗病毒药物研发尤为重要。BALB/c小鼠对多种病毒易感,是开展病毒致病机制及免疫应答研究、抗病毒药物研发和病毒疫苗评估的常用实验动物。本研究将TBEV经腹腔注射途径感染BALB/c小鼠,考察其在小鼠体内的复制增殖情况及对小鼠的致病性。
1 材料和方法 1.1 病毒、小鼠腹水和动物TBEV和TBEV免疫小鼠的腹水由海军军医大学(第二军医大学)海军医学系生物医学防护教研室保存,TBEV的培养和滴度测定参照文献[8]。6周龄雌性BALB/c小鼠购自上海灵畅生物科技有限公司[动物生产许可证号:SCXK(沪)2018-0003],体重为15~17 g。小鼠饲养与实验操作在海军军医大学(第二军医大学)生物安全三级实验室进行,符合动物实验医学研究伦理要求。
1.2 试剂DMEM(美国Invitrogen公司),3%过氧化氢溶液、中性树胶、无水乙醇、正丁醇和二甲苯(国药集团化学试剂有限公司),4%多聚甲醛溶液(北京鼎国昌盛生物技术有限责任公司);脱蜡液、柠檬酸抗原修复液、苏木精染液、苏木精分化液、苏木精返蓝液、H-E染液、牛血清白蛋白、HRP标记的羊抗鼠IgG和DAB显色液(武汉塞维尔生物科技有限公司)。
1.3 BALB/c小鼠腹腔注射攻毒BALB/c小鼠用电子天平(上海舜宇恒平科学仪器有限公司)称量,根据体重按随机数字表法进行分组。将15只小鼠分为未感染病毒对照组、1×103空斑形成单位(plaque-forming unit,PFU)TBEV感染组和1×104 PFU TBEV感染组,每组5只,用于观察小鼠感染症状、体重变化和死亡情况;另将12只小鼠分为未感染病毒对照组、1×103 PFU TBEV感染组,每组6只,用于组织学检测和病毒滴度测定。病毒感染组小鼠分别按每只1×103或1×104 PFU的剂量腹腔注射TBEV(用DMEM稀释),对照组小鼠腹腔注射等体积DMEM,每只100 μL。
1.4 BALB/c小鼠感染症状、体重变化和死亡情况观察攻毒当天标记为第0天,之后每日观察3组小鼠的表现,包括弓背、后肢瘫痪等感染症状及死亡情况,并记录小鼠体重。
1.5 BALB/c小鼠脑与脾样品收集及检测分别于攻毒后第5天、第7天取半数小鼠,在生物安全柜(美国ThermoFisher Scientific公司)内处死。使用手术器械(上海三友外科器材有限公司)解剖小鼠,摘取脑与脾。脑与脾用PBS洗涤后,一部分用4%多聚甲醛溶液固定,采用H-E染色分析组织病理学变化,通过免疫组织化学染色检测TBEV蛋白表达;一部分加入PBS用冷冻研磨仪(上海净信实业发展有限公司)研磨,研磨样品经低温高速离心机(美国ThermoFisher Scientific公司)离心,收集上清液,采用空斑试验检测上清液病毒滴度。
1.5.1 H-E染色将4%多聚甲醛溶液固定的小鼠脑与脾用脱水机(意大利Diapath公司)脱水处理,在包埋机(武汉俊杰电子有限公司)内行石蜡包埋,用病理切片机(上海徕卡仪器有限公司)切片。石蜡组织切片在脱蜡液、无水乙醇、75%乙醇中脱蜡处理,水洗后加苏木精染液染色5 min,水洗,用苏木精分化液分化,水洗,再用苏木精返蓝液返蓝,水洗。切片依次放入85%、95%乙醇溶液梯度脱水各5 min,放入H-E染液染色5 min。在无水乙醇、二甲苯、中性树胶中脱水封片,使用Nikon DS-U3成像系统(日本尼康公司)观察、采集图像,使用全景切片扫描仪(匈牙利3DHISTECH公司)分析图像。
1.5.2 免疫组织化学染色将小鼠脑与脾石蜡组织切片在脱蜡液、无水乙醇中脱蜡处理并水洗,在柠檬酸抗原修复液内修复抗原。切片经PBS洗涤3次,加入3%过氧化氢溶液避光孵育25 min,用PBS洗涤3次,加入3%牛血清白蛋白溶液封闭30 min。将TBEV免疫小鼠腹水(1︰500稀释)加至切片上,置于湿盒中,4 ℃冰箱孵育过夜。切片经PBS洗涤3次,加入HRP标记的羊抗鼠IgG(1︰1 000稀释)孵育50 min。用PBS洗涤3次,加入DAB显色液于显微镜下控制显色。切片用苏木精染液复染3 min后水洗,苏木精分化液分化数秒后水洗,苏木精返蓝液返蓝后水洗。切片依次放入75%乙醇、85%乙醇、无水乙醇、正丁醇、二甲苯中脱水、透明,中性树胶封片,使用Nikon DS-U3成像系统采集图像。
1.5.3 空斑试验参照文献[8],小鼠脑与脾研磨样品内的TBEV滴度在猪肾细胞PK-15(复旦大学基础医学院病原生物学系叶荣研究员馈赠)上用空斑试验测定。脑、脾样品稀释后加至长满的单层PK-15细胞,吸附3 h,加入2%羧甲基纤维素钠覆盖液(3 mL/孔)培养6 d,经4%多聚甲醛溶液固定、1%结晶紫染色,计数空斑,确定病毒滴度(PFU/mL)。
1.6 统计学处理采用GraphPad Prism 8.0软件进行数据分析。计量资料以x±s表示,用Student t检验进行组间差异比较;计数资料以频数表示,绘制生存曲线,用log-rank检验进行生存曲线比较。检验水准(α)为0.05。
2 结果 2.1 攻毒BALB/c小鼠出现感染症状在实验期间,对照组小鼠无异常表现,体重逐渐增加,无死亡。1×104 PFU TBEV感染组小鼠从感染后第6天开始出现弓背与后肢瘫痪症状,1×103 PFU TBEV感染组小鼠于第7天出现上述感染症状;TBEV感染的两组小鼠活动迟缓,出现感染症状的小鼠数量逐日增加,感染症状逐渐加重。
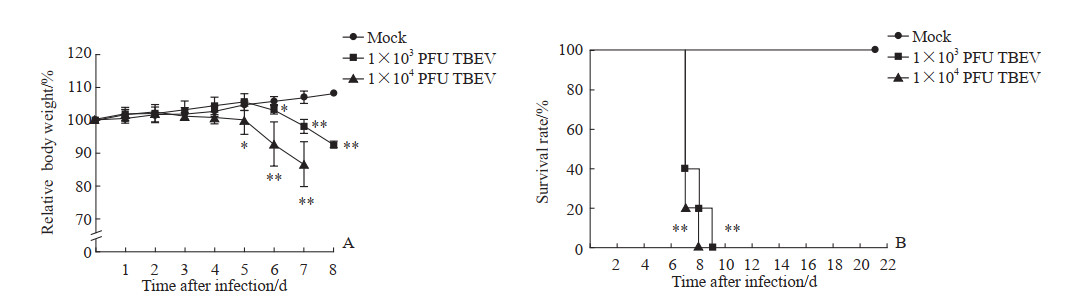
由图 1A可见,1×104 PFU TBEV感染组小鼠体重从感染后第3天开始下降,与对照组小鼠相比,小鼠体重于第5~7天明显降低(均P<0.05);1×103 PFU TBEV感染组小鼠体重从第6天开始下降,第7天、第8天持续下降,与对照组相比差异有统计学意义(均P<0.05)。由图 1B可见,在感染后第7天1×104 PFU TBEV感染组小鼠死亡4只、1×103 PFU TBEV感染组小鼠死亡3只,1×104 PFU TBEV感染组小鼠在第8天全部死亡、1×103 PFU TBEV感染组小鼠在第9天全部死亡。与对照组小鼠相比,TBEV感染的两组小鼠生存期缩短,差异有统计学意义(均P<0.01)。上述结果显示,2种剂量TBEV经腹腔注射攻毒BALB/c小鼠都出现了感染症状,小鼠的体重及生存率均降低,并且1×104 PFU TBEV致病性较1×103 PFU TBEV致病性强。
|
图 1 TBEV感染BALB/c小鼠体重及生存率的变化 Fig 1 Changes in body weight and survival rate of BALB/c mice infected with TBEV A: Changes in body weight of mice (n=5, x±s); B: Survival curve of mice (n=5). BALB/c mice were infected with 1×103 or 1×104 PFU TBEV by intraperitoneal injection. *P < 0.05, **P < 0.01 vs mock group. TBEV: Tick-borne encephalitis virus; PFU: Plaque-forming unit. |
2.2 攻毒BALB/c小鼠脑与脾病理改变
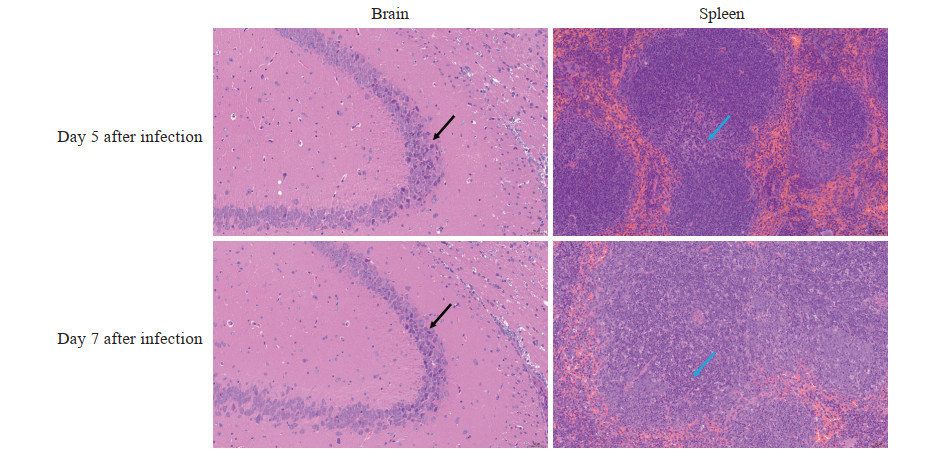
由图 2可见,1×103 PFU TBEV感染后第5天和第7天,小鼠大脑皮质仅出现少量神经元核固缩、深染,未观察到炎症细胞浸润;感染后第5天脾红髓轻度淤血、多见中性粒细胞,第7天中性粒细胞数量增多。结果显示,TBEV经腹腔注射攻毒BALB/c小鼠脾组织病理改变较明显,表现为炎症反应;脑组织仅表现为少量神经元核固缩。
|
图 2 TBEV感染BALB/c小鼠大脑皮质与脾红髓的病理改变(H-E染色,200×) Fig 2 Pathological changes in brain cortex and red pulp of spleen of TBEV-infected BALB/c mice (H-E staining, 200×) BALB/c mice were infected with 1×103 PFU TBEV by intraperitoneal injection. Black arrows indicate neuronal pyknosis and blue arrows indicate neutrophils. TBEV: Tick-borne encephalitis virus; H-E: Hematoxylin-eosin; PFU: Plaque-forming unit. |
2.3 攻毒BALB/c小鼠脑与脾中TBEV蛋白的表达
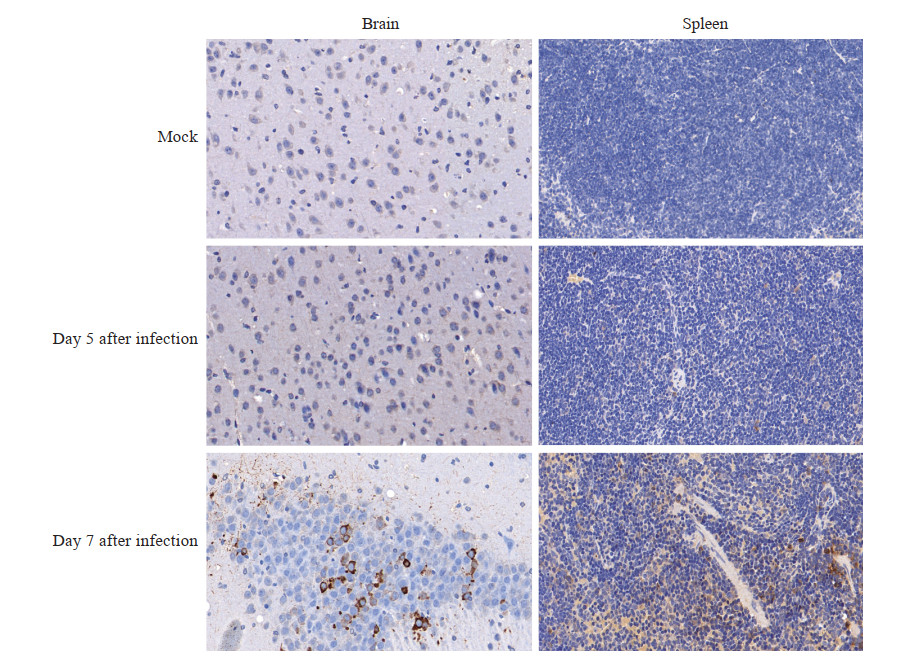
1×103 PFU TBEV感染后第5天、第7天,通过免疫组织化学染色检测病毒蛋白在BALB/c小鼠脑与脾中的表达,棕黄色为阳性信号(TBEV蛋白)。由图 3可见,对照组小鼠的脑、脾中均无TBEV蛋白的表达,免疫组织化学染色结果为阴性;TBEV感染组小鼠脑与脾中均检测到TBEV蛋白,免疫组织化学染色结果为阳性。TBEV感染后第5天,小鼠脑内仅海马区出现极少量阳性信号,且阳性信号较弱;第7天,在大脑皮质、海马、丘脑、下丘脑等部位均可检测到TBEV蛋白,且为强阳性信号。TBEV感染后第5天,小鼠脾内部分区域出现极少量阳性信号;第7天,出现阳性信号的区域增大,阳性信号增强。TBEV蛋白表达的检测结果表明,病毒在BALB/c小鼠体内建立感染,表现为TBEV蛋白在小鼠脾与脑中的表达随感染时间延长呈增强趋势。
|
图 3 TBEV感染BALB/c小鼠脑(海马区域)与脾组织中TBEV蛋白的表达(免疫组织化学染色,400×) Fig 3 Expression of TBEV protein in brain (hippocampus) and spleen of TBEV-infected BALB/c mice (immunohistochemical staining, 400×) BALB/c mice were infected with 1×103 PFU TBEV by intraperitoneal injection. TBEV: Tick-borne encephalitis virus; PFU: Plaque-forming unit. |
2.4 攻毒BALB/c小鼠脑与脾内病毒滴度的动态变化
1×103 PFU TBEV感染后第5天,小鼠脑、脾内均可检测到TBEV,但病毒滴度仅为(13±6)PFU/mL;感染后第7天,脾内病毒滴度为(1.3±0.6)×103 PFU/mL,脑内病毒滴度达(1.3±0.6)×105 PFU/mL,均高于第5天的病毒滴度(均P<0.01)。小鼠脑、脾中病毒滴度的检测结果与TBEV蛋白在2种组织中的动态表达趋势一致,即随着感染时间的延长病毒在小鼠体内的复制水平升高,结果提示攻毒后TBEV可在BALB/c小鼠脾和脑内复制增殖,并且在脑内大量增殖。
3 讨论近年来,蜱媒病原体在自然疫源地之外新的地理区域不断被发现,蜱媒传染病给人类健康带来了新的挑战,必须提高应对这种公众健康威胁疾病的监测、诊断、预防与治疗能力[9]。TBEV是黄病毒科黄病毒属病毒中最重要的蜱媒病原体,也是引起人类神经系统病毒感染性疾病最常见的病原体之一[10]。蜱媒脑炎发生的机制非常复杂,涉及宿主(免疫应答和遗传背景)和病毒(分子遗传)等多重因素,TBEV在人类宿主中的神经致病机制已在多种实验模型中被探讨[11]。目前尚无特异性针对TBEV感染的抗病毒药物。尽管有蜱媒脑炎疫苗可以应用,但许多地区疫苗接种率不高,并且有接种后无保护作用的报道[12]。合适的动物模型对于虫媒病毒疾病的疫苗与抗病毒药物研发及病毒致病机制研究尤为关键[13]。本实验通过研究1×103和1×104 PFU攻毒剂量、腹腔注射攻毒途径对TBEV病毒感染BALB/c小鼠的影响及病毒在小鼠体内的复制增殖情况与致病性,旨在为抗TBEV药物研发提供小动物模型。
小鼠的品系、性别和周龄是决定其对病毒是否易感的重要因素。BALB/c小鼠和C57BL/6小鼠均为TBEV研究常用的实验动物,并且多选用6~10周龄雌性小鼠,前者多被用于TBEV致病机制、免疫应答和抗病毒药物研发等研究[14-15],后者常被用于TBEV致病性和疫苗评估的研究[16-17]。腹腔注射、皮下注射和颅内注射是TBEV动物实验的常见攻毒方式,尤以前2种常用[16, 18-19]。TBEV攻毒剂量根据选取小鼠的品系、攻毒方式和毒株强弱确定。
小鼠感染TBEV的发病症状评分标准为:无症状(0分),竖毛(1分),活动缓慢或弓背(2分),无力或轻度瘫痪(3分),嗜睡、震颤、瘫痪(4分),死亡(5分)[15]。此外,小鼠的体重及生存情况也为常用的监测指标。本研究选择6周龄雌性BALB/c小鼠作为实验动物,采用每只小鼠1×103 PFU、1×104 PFU剂量的TBEV经腹腔注射途径攻毒。观察发现攻毒后小鼠活动迟缓,两组攻毒小鼠均先后出现弓背、后肢瘫痪等典型感染症状,且随感染时间的延长症状加重,小鼠陆续死亡;与对照组小鼠相比,感染组小鼠的体重及生存率下降。上述发现与文献报道的TBEV以腹腔注射感染BALB/c小鼠的症状[20-21]一致,表明病毒对小鼠具有致病性,高剂量TBEV攻毒组(每只小鼠1×104 PFU TBEV)小鼠感染症状出现早、体重降低快、死亡迅速,提示病毒攻毒剂量与致病性呈正相关。通过H-E染色观察TBEV感染小鼠脑、脾病理变化,发现仅脾组织呈炎症反应,脑组织只表现为神经元核固缩,这可能与TBEV毒株、攻毒剂量、攻毒方式有关。
本研究采用病毒蛋白表达与感染性病毒产量2个指标反映TBEV在BALB/c小鼠体内的复制增殖水平。通过免疫组织化学染色检测TBEV蛋白在小鼠脑、脾中的动态表达,发现感染后第5天小鼠脾、脑中有少量TBEV蛋白,至第7天TBEV蛋白表达明显增强。空斑试验结果也证实,感染后第5天TBEV滴度低,第7天滴度升高,并且脑内病毒滴度远高于脾内病毒滴度。病毒蛋白表达水平与病毒滴度升高趋势具有一致性。上述结果表明,TBEV在小鼠体内建立感染,可在脑、脾中复制增殖并具有差异性。推测攻毒后,TBEV在小鼠脾内增殖水平低,但扩散至脑并在脑内大量增殖,从而引发感染症状,这可解释感染后期小鼠出现后肢瘫痪与死亡等神经致病性症状,也进一步证实了TBEV具有嗜神经性,其感染可引起以中枢神经系统病变为特征的蜱媒脑炎。
综上所述,本研究通过对小鼠感染症状、体重及生存率变化、脑与脾病理改变、TBEV蛋白表达和病毒滴度动态变化的解析,揭示了TBEV经腹腔注射攻毒在BALB/c小鼠体内的感染症状特点和复制增殖特征。
| [1] |
LI Y, WANG D, DU X. Adaptive genetic diversifications among tick-borne encephalitis virus subtypes: a genome-wide perspective[J]. Virology, 2019, 530: 32-38. DOI:10.1016/j.virol.2019.02.006 |
| [2] |
OTT D, ULRICH K, GINSBACH P, et al. Tick-borne encephalitis virus (TBEV) prevalence in field-collected ticks (Ixodes ricinus) and phylogenetic, structural and virulence analysis in a TBE high-risk endemic area in southwestern Germany[J]. Parasit Vectors, 2020, 13(1): 303. DOI:10.1186/s13071-020-04146-7 |
| [3] |
LEMHÖFER G, CHITIMIA-DOBLER L, DOBLER G, et al. Comparison of whole genomes of tick-borne encephalitis virus from mountainous alpine regions and regions with a lower altitude[J]. Virus Genes, 2021, 57(2): 217-221. DOI:10.1007/s11262-020-01821-w |
| [4] |
RUZEK D, AVŠIČ ŽUPANC T, BORDE J, et al. Tick-borne encephalitis in Europe and Russia: review of pathogenesis, clinical features, therapy, and vaccines[J]. Antiviral Res, 2019, 164: 23-51. DOI:10.1016/j.antiviral.2019.01.014 |
| [5] |
ESTRADA-PEÑA A, DE LA FUENTE J. The ecology of ticks and epidemiology of tick-borne viral diseases[J]. Antiviral Res, 2014, 108: 104-128. DOI:10.1016/j.antiviral.2014.05.016 |
| [6] |
YANG X, QI J, PENG R, et al. Molecular basis of a protective/neutralizing monoclonal antibody targeting envelope proteins of both tick-borne encephalitis virus and louping ill virus[J]. J Virol, 2019, 93(8): e02132-18. DOI:10.1128/JVI.02132-18 |
| [7] |
FÜZIK T, FORMANOVÁ P, RŮŽEK D, et al. Structure of tick-borne encephalitis virus and its neutralization by a monoclonal antibody[J]. Nat Commun, 2018, 9(1): 436. DOI:10.1038/s41467-018-02882-0 |
| [8] |
唐万达, 赵平, 任瑞文, 等. 人肺腺癌细胞A549对蜱媒脑炎病毒的易感性分析[J]. 海军军医大学学报, 2022, 43(5): 478-483. TANG W D, ZHAO P, REN R W, et al. Susceptibility of human lung adenocarcinoma cell line A549 to tick-borne encephalitis virus[J]. Acad J Naval Med Univ, 2022, 43(5): 478-483. DOI:10.16781/j.CN31-2187/R.20210518 |
| [9] |
MADISON-ANTENUCCI S, KRAMER L D, GEBHARDT L L, et al. Emerging tick-borne diseases[J]. Clin Microbiol Rev, 2020, 33(2): e00083-18. DOI:10.1128/CMR.00083-18 |
| [10] |
MATVEEV A, MATVEEV L, STRONIN O, et al. Characterization of neutralizing monoclonal antibody against tick-borne encephalitis virus in vivo[J]. Vaccine, 2020, 38(27): 4309-4315. DOI:10.1016/j.vaccine.2020.04.051 |
| [11] |
VELAY A, PAZ M, CESBRON M, et al. Tick-borne encephalitis virus: molecular determinants of neuropathogenesis of an emerging pathogen[J]. Crit Rev Microbiol, 2019, 45(4): 472-493. DOI:10.1080/1040841X.2019.1629872 |
| [12] |
LOTRIČ-FURLAN S, BOGOVIČ P, AVŠIČ-ŽUPANC T, et al. Tick-borne encephalitis in patients vaccinated against this disease[J]. J Intern Med, 2017, 282(2): 142-155. DOI:10.1111/joim.12625 |
| [13] |
NALCA A, FELLOWS P F, WHITEHOUSE C A. Vaccines and animal models for arboviral encephalitides[J]. Antiviral Res, 2003, 60(3): 153-174. DOI:10.1016/j.antiviral.2003.08.001 |
| [14] |
EYER L, NOUGAIRÈDE A, UHLÍŘOVÁM, et al. An E460D substitution in the NS5 protein of tick-borne encephalitis virus confers resistance to the inhibitor galidesivir (BCX4430) and also attenuates the virus for mice[J]. J Virol, 2019, 93(16): e00367-19. DOI:10.1128/JVI.00367-19 |
| [15] |
EYER L, SVOBODA P, BALVAN J, et al. Broad-spectrum antiviral activity of 3'-deoxy-3'-fluoroadenosine against emerging flaviviruses[J]. Antimicrob Agents Chemother, 2021, 65(2): e01522-20. DOI:10.1128/AAC.01522-20 |
| [16] |
LINDQVIST R, ROSENDAL E, WEBER E, et al. The envelope protein of tick-borne encephalitis virus influences neuron entry, pathogenicity, and vaccine protection[J]. J Neuroinflammation, 2020, 17(1): 284. DOI:10.1186/s12974-020-01943-w |
| [17] |
PETRY M, PALUS M, LEITZEN E, et al. Immunity to TBEV related flaviviruses with reduced pathogenicity protects mice from disease but not from TBEV entry into the CNS[J]. Vaccines (Basel), 2021, 9(3): 196. DOI:10.3390/vaccines9030196 |
| [18] |
BOELKE M, PUFF C, BECKER K, et al. Enteric ganglioneuritis, a common feature in a subcutaneous TBEV murine infection model[J]. Microorganisms, 2021, 9(4): 875. DOI:10.3390/microorganisms9040875 |
| [19] |
WEBER E, FINSTERBUSCH K, LINDQUIST R, et al. Type Ⅰ interferon protects mice from fatal neurotropic infection with Langat virus by systemic and local antiviral responses[J]. J Virol, 2014, 88(21): 12202-12212. DOI:10.1128/JVI.01215-14 |
| [20] |
ERSHOVA A S, GRA O A, LYASCHUK A M, et al. Recombinant domains Ⅲ of tick-borne encephalitis virus envelope protein in combination with dextran and CpGs induce immune response and partial protectiveness against TBE virus infection in mice[J]. BMC Infect Dis, 2016, 16(1): 544. DOI:10.1186/s12879-016-1884-5 |
| [21] |
MATVEEV A L, KOZLOVA I V, STRONIN O V, et al. Post-exposure administration of chimeric antibody protects mice against European, Siberian, and Far-Eastern subtypes of tick-borne encephalitis virus[J]. PLoS One, 2019, 14(4): e0215075. DOI:10.1371/journal.pone.0215075 |
 2024, Vol. 45
2024, Vol. 45


