2. 武汉大学附属同仁医院(武汉市第三医院)泌尿外科, 武汉 430000
2. Department of Urology, Tongren Hospital of Wuhan University (Wuhan Third Hospital), Wuhan 430000, Hubei, China
睾丸扭转是一种急性泌尿系统急症,由精索扭转引起,大约每4 000名25岁以下男性中就有1例发生,其病理生理过程是精索扭转使睾丸血液供应不足,导致睾丸缺血性损伤[1-2]。临床上治疗睾丸扭转的原则是尽早将扭转的睾丸复位,以恢复血液供应,并通过后续药物调节阻止再灌注引起的进一步损伤[3]。但目前还没有有效的药物来降低再灌注引起的睾丸组织损伤。自噬是一种溶酶体介导的降解过程,在此过程中受损的蛋白质和功能失调的细胞器在细胞内降解,其产物随后可回收利用[4]。生理条件下细胞内一定水平的自噬对维持内环境稳态具有重要意义,在营养缺乏、缺氧、DNA损伤、细胞毒性制剂、生长因子缺乏等应激条件下,自噬水平会升高,以缓解应激诱导的损伤[5]。近年来,越来越多的证据表明功能失调性自噬与许多疾病有关,包括缺血再灌注损伤(ischemia/reperfusion injury,I/RI)[6-7]。自噬在睾丸扭转所致I/RI中的作用及调控机制目前尚不清楚,本研究旨在探讨自噬在大鼠睾丸扭转所致I/RI中的作用机制。
1 材料和方法 1.1 实验动物健康SPF级SD雄性大鼠购自湖南斯莱克景达实验动物有限公司[实验动物生产许可证号:SCXK(湘)2021-0002],6周龄,体重200~220 g。
1.2 实验材料戊巴比妥钠购自美国Sigma公司;雷帕霉素(rapamycin,RAPA)、3-甲基腺嘌呤(3-methyladenine,3-MA)购自美国MCE公司;伊红、RIPA(强)组织细胞快速裂解液、BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司,苏木精购自武汉赛维尔生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒购自南京建成生物工程研究所,TUNEL细胞凋亡检测试剂盒购自美国Roche公司;Beclin1抗体、p62抗体、Bcl2抗体、Bax抗体购自武汉贝茵莱生物科技有限公司,cleaved caspase 3抗体购自美国CST公司;PVDF膜、化学发光试剂购自美国Millipore公司。
1.3 动物模型建立与分组将40只大鼠随机分为假手术组、I/RI组、I/RI+RAPA组和I/RI+3-MA组,每组10只。所有大鼠适应性喂养7 d后进行实验。除假手术组外,其他3组大鼠均参考文献[8]方法构建睾丸扭转模型,具体操作如下:采用2%戊巴比妥钠(50 mg/kg)腹腔注射麻醉,通过左侧髂腹股沟切口暴露左侧睾丸,将睾丸绕精索逆时针旋转720°,在睾丸白膜与阴囊肉膜之间用4-0缝线缝合固定,保持睾丸缺血状态。1 h后拆除缝线,将睾丸绕精索顺时针旋转720°恢复供血,关闭切口。I/RI+RAPA组、I/RI+3-MA组在术前15 min分别经尾静脉注射1 mg/kg自噬激动剂RAPA、5 mg/kg自噬抑制剂3-MA。假手术组采用相同方式暴露左侧睾丸,但不进行睾丸扭转。大鼠睾丸复位12 h后,采用2%戊巴比妥钠腹腔注射麻醉,取出大鼠左侧睾丸和附睾,保存待测。
1.4 大鼠精子质量分析切除大鼠附睾尾部并在其尾部纵行切开3个裂口,然后放入装有PBS的离心管中,置于37 ℃水浴箱中让精子自由游出,水浴20 min。收集精子制备精子滤液,各取1滴精子滤液于载玻片上,统计精子活动率和精子畸形率。
1.5 大鼠睾丸组织H-E染色将大鼠睾丸组织常规脱水浸蜡包埋后连续切片,切片厚度为3 μm。水浴展片,烤片,常规脱蜡至水,苏木精染色,1%盐酸乙醇分化,再放入伊红染液中染色。脱水、透明、中性树脂封片。显微镜下观察并拍照。
1.6 大鼠睾丸组织氧化应激指标检测将大鼠睾丸组织匀浆离心后收集上清液,用比色法测定T-AOC,硫代巴比妥酸法测定MDA含量,水溶性四唑盐法测定SOD活性。按照试剂盒说明书进行实验操作。
1.7 大鼠睾丸组织TUNEL检测将大鼠睾丸组织常规脱水浸蜡包埋后连续切片,切片厚度为3 μm。65 ℃烤片,二甲苯透明,梯度乙醇水化后用蛋白酶K工作液于37 ℃孵育15 min。PBS冲洗2次,加入总量为50 μL的TUNEL反应混合液,在湿盒、暗室中加盖37 ℃孵育60 min。PBS冲洗3次,加入50 μL过氧化物酶,在湿盒中37 ℃孵育30 min。PBS清洗3次,加入50 μL DAB底物,于湿盒中37 ℃孵育10 min。PBS冲洗3次,苏木精复染,脱水,透明。显微镜下观察并拍照。
1.8 大鼠睾丸组织自噬和凋亡相关蛋白检测利用RIPA缓冲液提取大鼠睾丸组织总蛋白质。测定蛋白质浓度后,用12% SDS-PAGE分离蛋白质,然后将其转移至PVDF膜。用5%脱脂奶粉4 ℃封闭过夜,加Beclin1、p62、Bcl2、Bax、cleaved caspase 3、GAPDH抗体,室温孵育1 h。洗膜后加二抗,室温孵育1 h。洗膜后加入化学发光试剂。曝光显影后,读取蛋白质条带灰度值。
1.9 统计学处理应用SPSS 19.0软件进行统计学分析。计量资料以x±s表示,多组间比较采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 激活自噬可提高I/RI大鼠的精子质量假手术组大鼠精子活动率和精子畸形率分别为(61.29±2.93)%和(25.68±3.83)%。与假手术组比较,I/RI组大鼠精子活动率[(36.82±3.94)%]降低、精子畸形率[(59.43±1.51)%]升高(均P<0.05);与I/RI组比较,I/RI+RAPA组大鼠精子活动率[(44.31±2.50)%]升高、精子畸形率[(48.74±2.60)%]降低,I/RI+3-MA组大鼠精子活动率[(20.60±1.11)%]降低、精子畸形率[(80.69±3.30)%]升高(均P<0.05)。上述结果表明,激活自噬提高了I/RI大鼠的精子质量。
2.2 激活自噬可减轻I/RI大鼠睾丸损伤如图 1所示,假手术组大鼠睾丸曲细精管排列紧密,结构清晰,生殖细胞厚度正常;I/RI组大鼠睾丸曲细精管排列松散,正常结构被破坏,生殖细胞明显减少、脱落;I/RI+RAPA组大鼠睾丸曲细精管排列恢复正常,结构清晰;I/RI+3-MA组大鼠睾丸曲细精管排列松散,结构模糊。上述结果表明,激活自噬可减轻I/RI大鼠睾丸损伤。

|
图 1 各组大鼠睾丸组织的病理变化 Fig 1 Histopathological changes of testicular tissue of rats in each group Hematoxylin-eosin staining. I/RI: Ischemia/reperfusion injury; RAPA: Rapamycin; 3-MA: 3-methyladenine. |
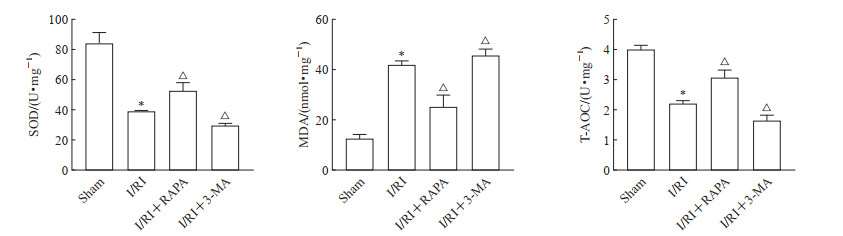
2.3 激活自噬可降低I/RI大鼠睾丸组织氧化应激水平
如图 2所示,与假手术组比较,I/RI组大鼠睾丸组织中SOD活性和T-AOC降低、MDA含量升高(均P<0.05);与I/RI组比较,I/RI+RAPA组大鼠睾丸组织中SOD活性和T-AOC升高、MDA含量降低,I/RI+3-MA组大鼠睾丸组织中SOD活性和T-AOC降低、MDA含量升高(均P<0.05)。上述结果表明,激活自噬可降低I/R大鼠睾丸组织氧化应激水平。
|
图 2 各组大鼠睾丸组织中SOD、MDA和T-AOC水平 Fig 2 Levels of SOD, MDA, and T-AOC in testicular tissue of rats in each group *P < 0.05 vs sham group; △P < 0.05 vs I/RI group. n=3, x±s. SOD: Superoxide dismutase; MDA: Malondialdehyde; T-AOC: Total antioxidant capacity; I/RI: Ischemia/reperfusion injury; RAPA: Rapamycin; 3-MA: 3-methyladenine. |
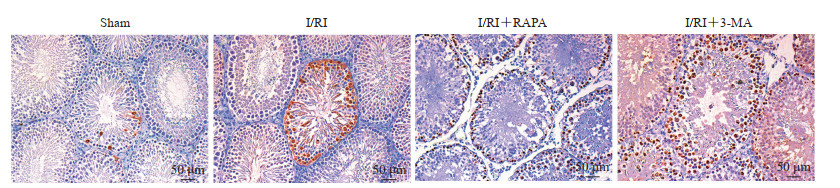
2.4 激活自噬可降低I/RI大鼠睾丸生殖细胞凋亡水平
如图 3所示,假手术组大鼠睾丸组织中可见少量生殖细胞凋亡;I/RI组大鼠睾丸组织中生殖细胞凋亡明显增多;与I/RI组比较,I/RI+RAPA组大鼠睾丸组织中生殖细胞凋亡减少,I/RI+3-MA组大鼠睾丸组织中生殖细胞凋亡增多、染色深。上述结果表明,激活自噬可降低I/RI大鼠睾丸生殖细胞凋亡水平。
|
图 3 各组大鼠睾丸生殖细胞凋亡水平 Fig 3 Apoptosis level of rat testicular germ cells in each group Terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling assay. I/RI: Ischemia/reperfusion injury; RAPA: Rapamycin; 3-MA: 3-methyladenine. |
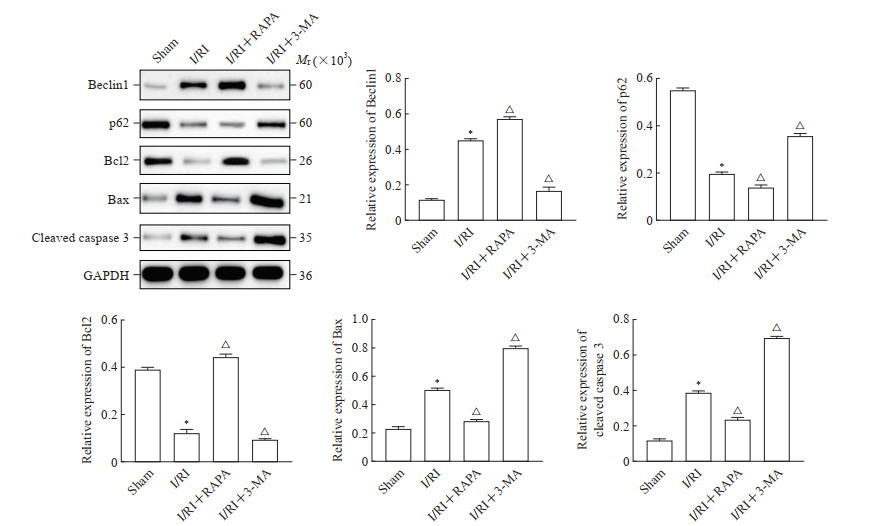
2.5 各组大鼠睾丸组织中自噬相关蛋白和凋亡相关蛋白的表达情况
如图 4所示,与假手术组比较,I/RI组大鼠睾丸组织中Beclin1、Bax和cleaved caspase 3蛋白表达水平升高,p62和Bcl2蛋白表达水平降低(均P<0.05);与I/RI组比较,I/RI+RAPA组大鼠睾丸组织中Beclin1和Bcl2蛋白表达水平升高,p62、Bax和cleaved caspase 3蛋白表达水平降低(均P<0.05);与I/RI组比较,I/RI+3-MA组大鼠睾丸组织中Beclin1和Bcl2蛋白表达水平降低,p62、Bax和cleaved caspase 3蛋白表达水平升高(均P<0.05)。
|
图 4 各组大鼠睾丸组织中自噬和凋亡相关蛋白的表达 Fig 4 Expression of autophagy- and apoptosis-related proteins in testicular tissue of rats in each group Western blotting. *P < 0.05 vs sham group; △P < 0.05 vs I/RI group. n=3, x±s. I/RI: Ischemia/reperfusion injury; RAPA: Rapamycin; 3-MA: 3-methyladenine; Bcl2: B-cell lymphoma 2; Bax: Bcl2-associated X protein; caspase 3: Cysteine aspartic acid specific protease; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
3 讨论
睾丸扭转会减少流向睾丸的血流量,导致严重的急性缺血损伤,早期诊断和扭转手术对于防止睾丸损伤和生殖细胞丢失至关重要[9]。通过睾丸减压手术恢复缺血性睾丸组织的血流可能会加剧组织损伤,即I/RI,在此过程中会产生大量活性氧,从而导致高水平的氧化应激[10-11]。此外,I/RI会引发炎症和脂质过氧化,加重组织的病理损伤[12]。因此,减轻睾丸扭转后I/RI程度的措施具有重要的临床应用价值。
自噬是细胞内分解代谢过程,研究表明,自噬与男性生殖密切相关,是睾丸发育和成熟的一个基本过程[13-14]。近期研究结果显示,睾丸扭转诱导的氧化应激导致支持细胞和整个睾丸组织的自噬增加[15]。Soltani等[16]研究表明,应用皮瓣技术对白膜进行减压可以激活自噬过程,挽救组织功能,消除睾丸扭转引起的应激。自噬在组织I/RI过程中的作用也引起了许多研究者的关注。例如在大鼠心肌I/RI的相关研究中发现,线粒体自噬相关蛋白缺氧诱导因子1α和Bcl2相互作用蛋白3(Bcl2 interacting protein 3,BNIP3)表达上调,促进I/RI损伤SD大鼠的心肌细胞和氧糖剥夺/复氧诱导的H9C2细胞自噬,在心肌缺血的早期阶段通过促进线粒体自噬对I/RI引起的损伤起到保护作用[17]。Zhang等[18]研究表明,增强自噬可通过下调细胞凋亡水平对脑I/RI神经元起到保护作用。Li等[19]通过构建肠道I/RI大鼠模型发现,NLR家族成员X1(NLR family member X1,NLRX1)可通过FUNDC1-NIPSNAP1/NIPSNAP2信号通路激活线粒体自噬,减少受损线粒体的积累和肠上皮凋亡,缓解肠道I/RI。由此推断,调控自噬作用可作为治疗睾丸组织I/RI的重要方向。
睾丸扭转后I/RI导致睾丸结构进行性损伤并降低精子质量,通常导致不孕[20]。本研究进行了精子质量参数(精子活动率和畸形率)评估,结果显示,I/RI可导致精子活动率降低、精子畸形率升高,而RAPA处理的I/RI大鼠精子活动率升高、精子畸形率降低,3-MA处理的I/RI大鼠精子活动率降低、精子畸形率升高。这表明激活自噬可提高I/RI大鼠的精子质量。
睾丸扭转后,睾丸组织的生化和形态可能会发生一些改变,再灌注过程中氧气的涌入导致次黄嘌呤被黄嘌呤氧化酶降解为尿酸,这一反应释放出高活性超氧化物阴离子,后者转化为过氧化氢和羟自由基。羟自由基产生的主要损伤后果是膜脂质过氧化,导致全身释放促炎的二十烷酸,破坏细胞的通透性,最终导致细胞死亡[21-22]。此外,再灌注还会增加细胞凋亡和组织损伤[23-24]。本研究结果显示,I/RI导致大鼠睾丸曲细精管排列松散,正常结构被破坏,生殖细胞明显减少、脱落,睾丸组织中SOD活性和T-AOC降低、MDA含量升高,凋亡生殖细胞明显增多;RAPA处理的I/RI大鼠睾丸曲细精管排列正常,睾丸组织中SOD活性和T-AOC升高、MDA含量降低,凋亡生殖细胞减少,而3-MA处理则导致相反的结果。这表明激活自噬可改善I/RI大鼠睾丸组织病理损伤,缓解氧化应激,抑制生殖细胞凋亡。
本研究还发现,I/RI导致大鼠睾丸组织中Beclin1、Bax和cleaved caspase 3蛋白表达水平升高,p62和Bcl2蛋白表达水平降低;RAPA处理的I/RI大鼠睾丸组织中Beclin1和Bcl2蛋白表达水平升高,p62、Bax和cleaved caspase 3蛋白表达水平降低。Beclin1是自噬途径中最重要的蛋白质复合物之一,在自噬体的形成和成熟过程中均发挥重要作用[25]。p62是一种泛素结合蛋白,与蛋白质的泛素化密切相关,自噬过程中p62与泛素化的蛋白质结合,再与定位于自噬小体内膜上的微管相关蛋白1轻链3Ⅱ(microtubule-associated protein 1 light chain 3Ⅱ,LC3Ⅱ)形成复合物,一同在自噬溶酶体内降解,故p62的表达变化同样可作为自噬水平检测的依据[26]。Bcl2家族在促进或抑制由线粒体功能障碍引发的内在凋亡途径方面起关键作用,是凋亡过程的关键调节因子,Bcl2/Bax/cleaved caspase 3是调节细胞凋亡和存活的信号通路[27]。
综上所述,本研究结果显示激活自噬可改善I/RI大鼠精子质量和睾丸组织病理损伤,缓解氧化应激,介导细胞凋亡相关蛋白的表达,抑制生殖细胞凋亡,但自噬在睾丸扭转所致I/RI中的具体分子机制仍需进一步探究。
| [1] |
JACOBSEN F M, RUDLANG T M, FODE M, et al. The impact of testicular torsion on testicular function[J]. World J Mens Health, 2020, 38(3): 298-307. DOI:10.5534/wjmh.190037 |
| [2] |
LAHER A, RAGAVAN S, MEHTA P, et al. Testicular torsion in the emergency room: a review of detection and management strategies[J]. Open Access Emerg Med, 2020, 12: 237-246. DOI:10.2147/OAEM.S236767 |
| [3] |
CHEN Y T, CHUANG F C, YANG C, et al. Combined melatonin-adipose derived mesenchymal stem cells therapy effectively protected the testis from testicular torsion-induced ischemia-reperfusion injury[J]. Stem Cell Res Ther, 2021, 12(1): 370. DOI:10.1186/s13287-021-02439-x |
| [4] |
KRYLATOV A, MASLOV L, TSIBULNIKOV S Y, et al. The role of reactive oxygen species, kinases, hydrogen sulfide, and nitric oxide in the regulation of autophagy and their impact on ischemia and reperfusion injury in the heart[J]. Curr Cardiol Rev, 2021, 17(4): e230421186874. DOI:10.2174/1573403x16666201014142446 |
| [5] |
ZHAO H, YANG Y, SI X, et al. The role of pyroptosis and autophagy in ischemia reperfusion injury[J]. Biomolecules, 2022, 12(7): 1010. DOI:10.3390/biom12071010 |
| [6] |
LV S, WANG Z, WANG J, et al. Exogenous hydrogen sulfide plays an important role through regulating autophagy in ischemia/reperfusion injury[J]. Front Mol Biosci, 2021, 8: 681676. DOI:10.3389/fmolb.2021.681676 |
| [7] |
RONG Y, FAN J, JI C, et al. USP11 regulates autophagy-dependent ferroptosis after spinal cord ischemia-reperfusion injury by deubiquitinating Beclin 1[J]. Cell Death Differ, 2022, 29(6): 1164-1175. DOI:10.1038/s41418-021-00907-8 |
| [8] |
SANGODELE J O, INUWA Z, LAWAL B, et al. Proxeed plus salvage rat testis from ischemia-reperfused injury by enhancing antioxidant's activities and inhibition of iNOS expression[J]. Biomed Pharmacother, 2021, 133: 111086. DOI:10.1016/j.biopha.2020.111086 |
| [9] |
KOHSAKA T, YONEDA Y, YOSHIDA T, et al. Relaxin exerts a protective effect during ischemia-reperfusion in the rat model[J]. Andrology, 2022, 10(1): 179-189. DOI:10.1111/andr.13096 |
| [10] |
KAZAZ I O, DEMIR S, KERIMOGLU G, et al. Effect of chrysin on endoplasmic reticulum stress in a rat model of testicular torsion[J]. J Investig Surg, 2022, 35(5): 1106-1111. DOI:10.1080/08941939.2021.2015489 |
| [11] |
YUKSEL S, ERGINEL B, BINGUL I, et al. The effect of hydrogen sulfide on ischemi?a/reperfusion injury in an experimental testicular torsion model[J]. J Pediatr Urol, 2022, 18(1): 16.e1-16.e7. DOI:10.1016/j.jpurol.2021.11.019 |
| [12] |
XU L Z, HE K X, NING J Z, et al. Oleuropein attenuates testicular ischemia-reperfusion by inhibiting apoptosis and inflammation[J]. Tissue Cell, 2022, 78: 101876. DOI:10.1016/j.tice.2022.101876 |
| [13] |
WANG M, ZENG L, SU P, et al. Autophagy: a multifaceted player in the fate of sperm[J]. Hum Reprod Update, 2022, 28(2): 200-231. DOI:10.1093/humupd/dmab043 |
| [14] |
YAN Q, ZHANG Y, WANG Q, et al. Autophagy: a double-edged sword in male reproduction[J]. Int J Mol Sci, 2022, 23(23): 15273. DOI:10.3390/ijms232315273 |
| [15] |
SOLTANI M, RAHMATI M, NIKRAVESH M R, et al. Evaluation of Sertoli cell autophagy associated with laminin, fibronectin, and caspase-3 proteins' alteration, following testicular torsion rat[J]. Andrologia, 2022, 54(1): e14272. DOI:10.1111/and.14272 |
| [16] |
SOLTANI M, RAHMATI M, NIKRAVESH M R, et al. Autophagy comparative after decompression of tunica albuginea in testicular torsion in mature and immature rat[J]. Surgery, 2022, 172(1): 427-435. DOI:10.1016/j.surg.2022.01.035 |
| [17] |
ZHANG Y, LIU D, HU H, et al. HIF-1α/BNIP3 signaling pathway-induced-autophagy plays protective role during myocardial ischemia-reperfusion injury[J]. Biomed Pharmacother, 2019, 120: 109464. DOI:10.1016/j.biopha.2019.109464 |
| [18] |
ZHANG Y, ZHANG Y, JIN X F, et al. The role of astragaloside Ⅳ against cerebral ischemia/reperfusion injury: suppression of apoptosis via promotion of P62-LC3-autophagy[J]. Molecules, 2019, 24(9): 1838. DOI:10.3390/molecules24091838 |
| [19] |
LI S, ZHOU Y, GU X, et al. NLRX1/FUNDC1/NIPSNAP1-2 axis regulates mitophagy and alleviates intestinal ischaemia/reperfusion injury[J]. Cell Prolif, 2021, 54(3): e12986. DOI:10.1111/cpr.12986 |
| [20] |
KAZEMI-DARABADI S, ASADPOUR R, SHAHBAZFAR A, et al. Effects of L-carnitine and betamethasone on ischemia-reperfusion injuries and sperm parameters following testicular torsion in a rat model[J]. Vet Res Forum, 2019, 10: 125-132. DOI:10.30466/vrf.2019.74767.2002 |
| [21] |
XIANG M, LU Y, XIN L, et al. Role of oxidative stress in reperfusion following myocardial ischemia and its treatments[J]. Oxidative Med Cell Longev, 2021, 2021: 6614009. DOI:10.1155/2021/6614009 |
| [22] |
BAŠKOVIĆ M, KRSNIK D, HIMELREICH PERIĆ M, et al. Astaxanthin relieves testicular ischemia-reperfusion injury-immunohistochemical and biochemical analyses[J]. J Clin Med, 2022, 11(5): 1284. DOI:10.3390/jcm11051284 |
| [23] |
SEKMENLI T, GUNDUZ M, ÖZTÜRK B, et al. The effects of melatonin and colchicine on ischemia-reperfusion injury in experimental rat testicular torsion model[J]. J Pediatr Surg, 2017, 52(4): 582-586. DOI:10.1016/j.jpedsurg.2016.11.035 |
| [24] |
AL-SALEH F, KHASHAB F, FADEL F, et al. Inhibition of NADPH oxidase alleviates germ cell apoptosis and ER stress during testicular ischemia reperfusion injury[J]. Saudi J Biol Sci, 2020, 27(8): 2174-2184. DOI:10.1016/j.sjbs.2020.04.024 |
| [25] |
LI X, YANG K B, CHEN W, et al. CUL3 (cullin 3)-mediated ubiquitination and degradation of BECN1 (beclin 1) inhibit autophagy and promote tumor progression[J]. Autophagy, 2021, 17(12): 4323-4340. DOI:10.1080/15548627.2021.1912270 |
| [26] |
TIAN Y, SONG W, XU D, et al. Autophagy induced by ROS aggravates testis oxidative damage in diabetes via breaking the feedforward loop linking p62 and Nrf2[J]. Oxid Med Cell Longev, 2020, 2020: 7156579. DOI:10.1155/2020/7156579 |
| [27] |
ZHANG Y, YANG X, GE X, et al. Puerarin attenuates neurological deficits via Bcl-2/Bax/cleaved caspase-3 and Sirt3/SOD2 apoptotic pathways in subarachnoid hemorrhage mice[J]. Biomed Pharmacother, 2019, 109: 726-733. DOI:10.1016/j.biopha.2018.10.161 |
 2024, Vol. 45
2024, Vol. 45


