2. 上海交通大学医学院附属瑞金医院消化内科, 上海 200025;
3. 苏州大学附属第二医院消化内科, 苏州 215004;
4. 同济大学附属上海市第十人民医院消化内镜中心, 上海 200072;
5. 浙江大学医学院附属金华医院消化内科, 金华 321000;
6. 安康市汉滨区第一医院消化内科, 安康 725000;
7. 上海中医药大学中医智能康复教育部工程研究中心, 上海 201203
2. Department of Gastroenterology, Ruijin Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200025, China;
3. Department of Gastroenterology, The Second Affiliated Hospital of Soochow University, Suzhou 215004, Jiangsu, China;
4. Digestive Endoscopy Center, Shanghai Tenth People's Hospital Affiliated to Tongji University, Shanghai 200072, China;
5. Department of Gastroenterology, Jinhua Hospital, Zhejiang University School of Medicine, Jinhua 321000, Zhejiang, China;
6. Department of Gastroenterology, The First Hospital of Hanbin District, Ankang 725000, Shaanxi, China;
7. Engineering Research Center of Traditional Chinese Medicine Intelligent Rehabilitation, Ministry of Education, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是一类起源于胃肠道间叶组织的肿瘤,以胃区最多见,其次是小肠和大肠[1]。GIST与胃平滑肌瘤、神经鞘瘤同属于胃间质瘤(gastric mesenchymal tumor,GMT),GIST是其中最常见的类型[2]。GIST起病隐匿,临床表现无特异性,易被误诊为胃平滑肌瘤或神经鞘瘤,但GIST是一类独立的具有非定向分化肿瘤[3]。临床上,GIST大多呈恶性且预后差,一旦发现应及时经内镜或手术切除,术后进行随访;而胃平滑肌瘤或神经鞘瘤更多为良性,只有在出现症状时才需要切除。因此,准确、无创地在GMT中区分出GIST至关重要。
GMT的影像学检查方式包括超声内镜(endoscopic ultrasound,EUS)、CT、MRI与选择性血管造影检查等。与其他方式比较,EUS是一种安全、无辐射的检测方法,并且被认为是确定GMT的大小、形态、回声等特征的最佳工具[2]。虽然EUS可以提供肿瘤的影像学信息,但GIST与胃平滑肌瘤或神经鞘瘤的影像学特征极为相似,鉴别诊断存在困难[4-6]。宁建文等[7]指出可以通过分析EUS图像下感兴趣区域(region of interest,ROI)的大小与超声回声均匀度提高鉴别GIST的准确性,但该方法对医师的要求极高。Akahoshi等[8]利用超声内镜引导下细针穿刺抽吸术(endoscopic ultrasound-guided fine-needle aspiration,EUS-FNA)和免疫组织化学结合EUS图像实现对GIST的诊断,但Levy等[9]研究发现对于直径<2 cm的病变,EUS-FNA存在操作复杂、合格标本获取率低等不足。同时,由于GIST质地脆且容易出血,对于能切除的病灶一般不推荐活检[10]。
随着医学影像人工智能技术的发展和应用,突破传统的基于形态学的影像组学和机器学习方法已被广泛应用于临床术前诊断[11-15]。将影像组学和机器学习应用于EUS图像有望提高对GIST的预测效能,为临床诊断提供更多参考。本研究基于EUS影像组学特征和机器学习算法,构建最佳特征筛选方案并建立模型,实现在GMT中对GIST与非GIST的分类预测。
1 资料和方法 1.1 资料来源本研究为回顾性研究。选取2012年1月至2021年12月在上海交通大学医学院附属瑞金医院、苏州大学附属第二医院、浙江大学医学院附属金华医院、同济大学附属上海市第十人民医院、安康市汉滨区第一医院接受术前EUS检查的435例患者。纳入标准:(1)EUS检查资料完整;(2)有经手术或内镜切除的胃肠道肿瘤标本,且经病理证实为GIST、平滑肌瘤或神经鞘瘤。排除标准:(1)基于活检标本的病理诊断,如超声内镜引导下细针穿刺抽吸/活检术(endoscopic ultrasound-guided fine-needle aspiration/biopsy,EUS-FNA/B)或黏膜切口辅助活检术(mucosal incision-assisted biopsy,MIAB)所取得的标本;(2)EUS图像中肿瘤无法清晰辨认;(3)EUS图像上无法识别周围的固有肌层。收集符合条件的GIST与非GIST的EUS图像共3 279张。
根据病理学结果,将435例患者分为GIST组(257例)和非GIST组(包括145例胃平滑肌瘤和33例神经鞘瘤)。将435例患者的3 279张EUS图像采用随机抽取方法按患者比7∶3分为训练集和测试集,训练集包括179例GIST和126例非GIST(102例胃平滑肌瘤、24例神经鞘瘤)患者的2 113张EUS图像,测试集包括78例GIST和52例非GIST(43例胃平滑肌瘤、9例神经鞘瘤)的1 166张EUS图像。本研究的模型更侧重于二维灰度图像,且GIST组和非GIST组在临床上较难准确区分,因此在临床特征中选择纳入了肿瘤的大小、位置等因素。
所有EUS图像均由具有3年以上EUS检查经验的内镜医师采集获得,使用仪器为小探头EUS(P2615-M、P2620-M,日本富士公司;UM-3R、UM-DP20-25R,日本奥林巴斯公司)或径向EUS(EG-530UR、EG-580UR,日本富士公司;GF-UM2000,日本奥林巴斯公司),以及相应的超声系统(SU7000、SU8000、SP900,日本富士公司;EU-ME1、EU-ME2、EU-ME2 plus,日本奥林巴斯公司)。根据设备特性,使用小探头EUS时频率设置为15~20 MHz,使用径向EUS时频率设置为7.5~12 MHz。
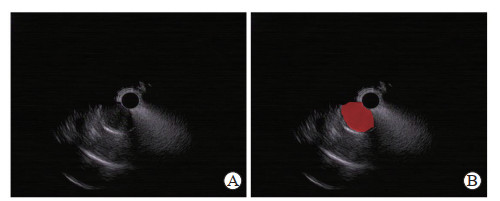
1.2 病灶分割与特征提取采用训练集的EUS图像进行特征提取和模型构建。肿瘤区域(即ROI)由1名具有5年以上工作经验的EUS医师使用LabelMe 3.0软件进行手工标注,并由1名具有10年以上工作经验的EUS医师进行评估和调整,如图 1所示。
|
图 1 EUS图像ROI分割示例 Fig 1 A case of ROI segmentation of EUS image A: Original EUS image; B: ROI segmentation according to tumor contour (red region). EUS: Endoscopic ultrasound; ROI: Region of interest. |
使用Pyradiomics软件[16]提取EUS图像ROI的一阶特征、形状特征和图像纹理特征。3类特征均在原始图像和派生图像中提取,从不同方面对超声图像的特征进行描述。一阶特征通过常用度量表示ROI像素的强度分布,包括ROI的能量、均数、中值、极值、方差、均方根、偏度、峰度等数据。形状特征独立于ROI的灰度强度分布,包括ROI的大小特征和对应圆周网格派生特征。图像纹理特征描述了ROI的纹理细节,包括ROI构建的灰度共生矩阵(gray level co-occurrence matrix,GLCM)特征、灰度大小区域矩阵(gray-level size-zone matrix,GLSZM)特征、灰度游程矩阵(gray-level run-length matrix,GLRLM)特征、相邻灰度色调差异矩阵(neighborhood gray-tone difference matrix,NGTDM)特征和灰度依赖矩阵(gray-level difference matrix,GLDM)特征。其中,GLCM描述了ROI区域二阶联合概率函数,GLSZM量化ROI中相同灰度强度像素的连通数量,GLRLM量化具有相同灰度值的连通像素游程,NGTDM衡量了灰度值之间差异水平,GLDM显示了图像中灰度间的相关性。每张图像提取1 409个高通量特征。
1.3 特征降维与筛选过多的特征会增加模型的复杂性,容易导致模型过拟合。为了降低冗余,实现对高维数据的降维和特征的稀疏,本研究选取和分析了主成分分析(principal component analysis,PCA)、最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)、极致梯度提升树(extreme gradient boosting,XGBoost)、随机森林、递归式特征消除(recursive feature elimination,RFE)5种算法进行特征降维与筛选,并选取了最优的方案用于最终分类。
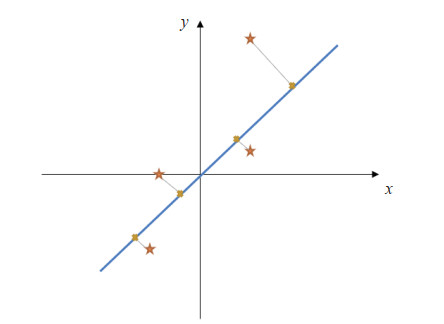
1.3.1 PCA算法在PCA算法中,将原始特征数据按维度N和数量M构成N×M矩阵,对矩阵每一行中心化,再求协方差矩阵及其特征值和特征向量,将特征向量按特征值大小排列,将原数据投影到选取的特征向量中,输出投影后的降维矩阵。PCA投影示意图如图 2所示。
|
图 2 PCA算法投影示意图 Fig 2 PCA projection diagram Red star: The original point; Yellow cross: Projection point; Grey line: Projection distance; Blue line: Feature vector. PCA: Principal component analysis. |
设M条N维数据经过PCA算法降维后的个数为K。如果K=N,即原始数据的所有变化都被保留下来。K值可以通过不等式(1)进行选择:

|
(1) |
式中,m为数据量,xi为样本值,xappri为特征投影后的值,C为与原始数据的误差。误差值越小,说明K值的选取更能还原原始数据信息。根据最大降维数和最大保留数据原始信息程度之间的关系,选择合适的K值确定最后的降维方法。
1.3.2 LASSO算法LASSO算法可以对特征进行稀疏处理[17]。LASSO回归可以构造一阶惩罚函数,对变量系数进行压缩实现稀疏。这种稀疏通过在代价函数后加入L1正则化实现,LASSO目标函数Q(β)计算方法如式(2)
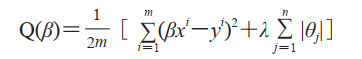
|
(2) |
式中,β为回归系数,m为数据量,n为数据维度,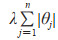
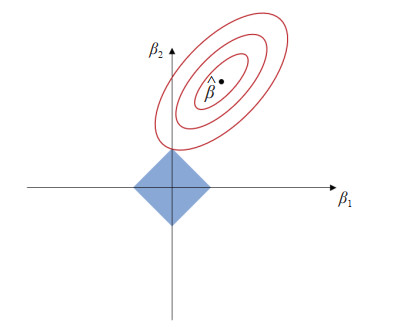
图 3中椭圆部分为代价函数等高线,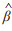
|
图 3
LASSO算法求最优解
Fig 3
LASSO algorithm for optimal solution
Red line ellipse: Contour of the cost function; Blue rectangle: The constraint domain of L1 regularization. 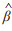 : Center point of the contour line, indicating the minimum value. Horizontal axis β1 and vertical axis β2 indicate the values of different regression coefficients. LASSO: Least absolute shrinkage and selection operator. : Center point of the contour line, indicating the minimum value. Horizontal axis β1 and vertical axis β2 indicate the values of different regression coefficients. LASSO: Least absolute shrinkage and selection operator.
|
1.3.3 XGBoost算法
XGBoost算法可以通过构建梯度增强决策树衡量特征对提升决策树构建的影响,并对特征进行筛选[18]。XGBoost采用梯度提升算法,将决策树作为弱分类器,构建梯度增强决策树[19]。算法对得到的所有特征进行重要性比较。一个特征对节点分裂改进的贡献越大其权重越高;一个特征被越多的决策树选择,说明其重要程度越大。重要性的度量采用Gini指数,表示随机样本被分错的概率,计算如式(3)
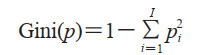
|
(3) |
式中,I为总类别数,pi为样本属于类别i的概率。Gini指数越小,代表对应特征的重要性越高[20]。将某特征在所有决策树中的重要性评分取加权平均,即得到该特征总评分。对所有特征的评分进行排序,得到对最佳特征的筛选结果。
1.3.4 随机森林算法随机森林算法同样依据特征重要性评分原理来选择最佳特征。用抽样放回方法从数据集选取K个样本集,由此构建K棵决策树。在每棵树的每个节点随机抽样特征,并找到最佳的划分特征进行节点分裂[21]。实现特征选择需要对决策树计算带外数据(out of band,OOB)误差,记为errOOB1;再随机对OOB所有样本的某一特征X加入干扰,计算OOB误差,记为errOOB2。特征X的重要性VIMOOB的计算公式如式(4)

|
(4) |
对每个特征依次计算可得特征重要性评分的排序。
1.3.5 RFE算法RFE算法由递归删除特征来反复构建模型,实现最优特征选取[22]。RFE算法首先通过原始特征集训练估计模型,采用Pearson相关系数比较每个特征的重要程度,删除重要性最低的特征。在生成的新特征集中重复训练,将新特征重要性进行排序,再继续去除其中最不重要的特征。迭代上述步骤最终输出所需的最优特征集合。
1.4 分类预测本研究基于上述特征降维与筛选方法构建新的特征选择方案。为了加强模型的拟合度,基于PCA算法对影像组学特征进行降维,再组合特征筛选方法,分析确定最终的筛选方式。提出5种筛选组合算法,分别为PCA、PCA+LASSO、PCA+XGBoost、PCA+随机森林、PCA+RFE。
将每种组合算法所选的最优特征输入到支持向量机(support vector machine,SVM)分类器,比较所选不同的特征对分类预测效果的影响,建立分类预测模型。SVM作为一种常用的机器学习分类器,可构建一个超平面使训练数据间隔最大化,提供高效的二分类。研究中采用高斯核函数,经过10倍交叉验证进行训练,最终对GIST与非GIST实现二分类。
1.5 统计学处理采用R 4.1.2软件进行统计学分析。计量资料以中位数(范围)表示,组间比较采用秩和检验;计数资料以例数和百分数表示,组间比较采用χ2检验。利用验证集中的图像数据,采用ROC曲线对基于5种组合算法筛选出的特征构建的预测模型的分类预测性能进行分析和评估,以AUC评价诊断效能,同时计算每种分类模型的灵敏度、特异度、阳性预测值、阴性预测值和准确度。检验水准(α)为0.05。
2 结果 2.1 临床资料表 1总结了患者的社会人口学信息和临床特征,χ2检验及秩和检验结果显示,训练集与测试集患者在社会人口学信息和临床特征方面差异均无统计学意义(均P>0.05)。
|
|
表 1 训练集和测试集患者的社会人口学信息和临床特征 Tab 1 Sociodemographic information and clinical characteristics of patients in training set and test set |
2.2 特征筛选结果
基于GIST与非GIST的EUS图像,采用Pyradiomics软件共提取到1 409个高通量影像组学特征。在5种筛选方案中,利用PCA算法将提取到的特征降维到150维,用LASSO算法、XGBoost算法、随机森林算法和RFE算法均统一将特征筛选到10个。单用PCA算法的筛选方案将所有降维后的特征输入分类器,其余4种组合算法的特征筛选结果所表达的影像组学特征如表 2所示。
|
|
表 2 用于鉴别GIST和非GIST的EUS影像组学特征选择结果 Tab 2 Radiomics feature selection results of EUS for identifying GIST and non-GIST |
2.3 模型测试结果
基于上述5种特征选择的算法,将特征输入SVM分类器来建立对GIST与非GIST进行自动化区分的预测模型。5种算法所对应预测模型的性能结果如表 3所示。基于PCA的特征降维后加上特征筛选可以使分类预测模型的AUC有不同程度提高,基于PCA的特征降维与LASSO算法的结合使AUC提高了49.7%,与XGBoost算法的结合使AUC提高了50.4%,与随机森林算法的结合使AUC提高了48.0%,与RFE算法的结合使AUC提高了13.8%。其中基于PCA+XGBoost算法的模型对GIST和非GIST的预测效能最好,AUC为0.874。
|
|
表 3 基于EUS影像组学的5种算法所对应分类模型鉴别GIST和非GIST的效能比较 Tab 3 Comparison of classification models of 5 algorithms based on EUS radiomics for identifying GIST and non-GIST |
3 讨论
本研究提出了一种基于肿瘤特征的影像组学和机器学习联合模型,利用EUS图像将GIST与非GIST进行分类。将GIST与非GIST患者的3 279张EUS图像按患者比7∶3划分为训练集和测试集,利用影像组学Pyradiomics软件进行特征提取。为了降低特征的冗余,本研究设计了5种特征筛选方案(PCA、PCA+LASSO、PCA+XGBoost、PCA+随机森林、PCA+RFE)选择最佳特征,并将其输入到SVM分类器中实现对GIST与非GIST的自动化区分,得到了在GMT中识别GIST的预测模型。
本研究结果表明,设计的5种EUS影像组学特征筛选方案中PCA+XGBoost效果最佳,其对应的预测模型的AUC为0.874。基于PCA的特征降维后加上特征筛选可以使分类预测模型的AUC有不同程度提高,基于PCA的特征降维与LASSO算法的结合使AUC提高了49.7%,与XGBoost算法的结合使AUC提高了50.4%,与随机森林算法的结合使AUC提高了48.0%,与RFE算法的结合使AUC提高了13.8%。可见XGBoost特征筛选算法的加入在降低特征冗余的同时,相比其他算法更能筛选出具有代表性的特征。该结果表明,合适的特征降维与筛选算法结合有助于进一步提高分类器的预测性能,所建模型能够较好地实现GIST与非GIST的分类。
在本研究最佳的特征筛选方案PCA+XGBoost中,特征选择的结果主要包括ROI本身的同质性特征和ROI与邻域强度的关系,例如归一化逆差矩(inverse difference moment normalized,IDMN)特征衡量了图像局部的均匀性,图像局部越均匀,其值越大,表明该特征与肿瘤实质存在相关性。而归一化灰度不均匀性(gray level non-uniformity normalized)特征表征了图像区域每个强度值的平方和,也是对ROI同质性特征的度量,该值越大表示同质性更大或离散强度值范围更小。差值平均值(difference average)特征表示具有相似强度值的区域和具有不同强度值的区域之间的关系。这说明该模型不仅可以通过肿瘤本身的特征作为分类依据,同时也结合了邻域的影像组学特征来辅助分类预测。有研究表明影像学检查中GIST与非GIST的实质部分存在一定差异[4],也有研究通过分析EUS图像中肿瘤的回声平均值和标准差区分GIST与非GIST[23]。本研究特征筛选方案提取到的特征中,IDMN和归一化灰度不均匀性表征了EUS图像中的回声均匀变化,这些与ROI本身均匀性相关的特征在模型预测中起到重要作用,提示这些特征有望在临床诊断中用于区分GIST与非GIST。
影像组学能够提取肿瘤的高通量生物特征,对图像进行定量分析,挖掘隐含的肿瘤表征信息,通过机器学习建立分类器,实现对数据的分类和对肿瘤的预测。在多项研究中,影像组学和机器学习模型的表现优于临床模型[12-14],影像组学与机器学习相结合的方案可以进一步辅助临床诊断,并支持临床治疗。本研究中,EUS影像组学将医学影像信息转换成大量高通量特征,基于PCA的特征降维将影像组学提取到的特征降低维度,以更少的特征数量表达原本的变化,这些新维度上的特征综合了之前多种特征的信息。而LASSO算法、XGBoost算法、随机森林算法和RFE算法对数据的要求较低,都是通过机器学习的原理实现对特征的排序与筛选。目前已有一些研究针对影像组学特征进行处理来提高机器学习分类器的预测性能。Wu等[24]在膀胱癌淋巴结转移的影像学预测研究中,将提取到的影像组学特征通过LASSO方法进行选择,并构建了列线图模型。Peng等[25]在肝内胆管细胞癌生物学行为的超声评估研究中,通过PCA算法和LASSO算法来对特征进行降维与选择,最后选择10种机器学习分类器分别实现预测,对分类器效能进行比较。Li等[26]对三阴性乳腺癌的超声特征进行分析,比较了PCA算法、LASSO算法及PCA+LASSO联合算法在选择特征中的区别,以及不同特征选择算法对于预测结果的影响。本研究结合EUS影像组学和机器学习方法建立了GIST与非GIST的分类预测模型,提出并评估了5种特征筛选方案,进一步分析了5种模型的预测表现与影像组学特征的关系,有助于确定最优预测模型,同时对特征的对比分析可以更好地在应用中提供临床解释。
本研究仍存在一定局限性。首先,本研究为回顾性研究,可能导致在样本数据的选择中存在偏差,未来将进行大规模的多中心前瞻性研究,以充分验证本研究方案的泛化能力;其次,本研究只采用SVM分类器进行最终分类预测,未与其他机器学习分类器进行比较,后期工作将进一步分析不同分类器,并联合特征筛选方法以选择最优预测方案,从而确定最适合临床应用的诊断模型;最后,本研究仅纳入了灰阶超声的二维图像特征,缺少对其他特征的纳入与分析,而这对模型的准确性有一定影响,综合考虑更多特征有望进一步提高模型预测性能。
综上所述,本研究提出的基于EUS影像组学和机器学习的模型有望准确、无创地对GIST与非GIST进行分类,从而避免不必要的活检或手术,并为患者提供个体化解决方案。
| [1] |
章士正, 方松华. 胃肠道间质瘤影像学诊断[J]. 中国医学计算机成像杂志, 2001, 7(2): 126-129. |
| [2] |
DEPREZ P H, MOONS L M G, O'TOOLE D, et al. Endoscopic management of subepithelial lesions including neuroendocrine neoplasms: European Society of Gastrointestinal Endoscopy (ESGE) guideline[J]. Endoscopy, 2022, 54(4): 412-429. DOI:10.1055/a-1751-5742 |
| [3] |
朱雄增, 侯英勇. 对胃肠道间质瘤的再认识[J]. 中华病理学杂志, 2004, 33(1): 3-5. DOI:10.3760/j.issn:0529-5807.2004.01.002 |
| [4] |
孙灿辉, 李子平, 孟悛非, 等. CT和超声内镜诊断胃肠道间质瘤的价值分析[J]. 中华放射学杂志, 2004, 38(2): 197-201. DOI:10.3760/j.issn:1005-1201.2004.02.019 |
| [5] |
KIM G H, PARK D Y, KIM S, et al. Is it possible to differentiate gastric GISTs from gastric leiomyomas by EUS?[J]. World J Gastroenterol, 2009, 15(27): 3376-3381. DOI:10.3748/wjg.15.3376 |
| [6] |
KIDA M, KAWAGUCHI Y, MIYATA E, et al. Endoscopic ultrasonography diagnosis of subepithelial lesions[J]. Dig Endosc, 2017, 29(4): 431-443. DOI:10.1111/den.12854 |
| [7] |
宁建文, 季峰, 王丽君, 等. 265例胃肠道间叶源性肿瘤的临床病理特征及超声内镜诊断价值[J]. 中华消化杂志, 2006, 26(6): 381-385. DOI:10.3760/j.issn:0254-1432.2006.06.006 |
| [8] |
AKAHOSHI K, SUMIDA Y, MATSUI N, et al. Preoperative diagnosis of gastrointestinal stromal tumor by endoscopic ultrasound-guided fine needle aspiration[J]. World J Gastroenterol, 2007, 13(14): 2077-2082. DOI:10.3748/wjg.v13.i14.2077 |
| [9] |
LEVY M J, JONDAL M L, CLAIN J, et al. Preliminary experience with an EUS-guided trucut biopsy needle compared with EUS-guided FNA[J]. Gastrointest Endosc, 2003, 57(1): 101-106. DOI:10.1067/mge.2003.49 |
| [10] |
李梦颖, 喻军, 谢扬, 等. 超声内镜鉴别胃内间质瘤和平滑肌瘤的价值[J]. 胃肠病学和肝病学杂志, 2018, 27(3): 321-324. DOI:10.3969/j.issn.1006-5709.2018.03.018 |
| [11] |
周榴, 董怡, 夏威, 等. 基于超声影像组学的原发性肝细胞癌分级预测[J]. 中国医学物理学杂志, 2020, 37(1): 59-64. DOI:10.3969/j.issn.1005-202X.2020.01.012 |
| [12] |
查海玲, 潘加珍, 刘薇, 等. 基于超声影像组学模型预测浸润性乳腺癌淋巴管血管侵犯状态[J]. 肿瘤影像学, 2021, 30(1): 6-15. DOI:10.19732/j.cnki.2096-6210.2021.01.002 |
| [13] |
YU F H, WANG J X, YE X H, et al. Ultrasound-based radiomics nomogram: a potential biomarker to predict axillary lymph node metastasis in early-stage invasive breast cancer[J]. Eur J Radiol, 2019, 119: 108658. DOI:10.1016/j.ejrad.2019.108658 |
| [14] |
LI M, JIN Y M, ZHANG Y C, et al. Radiomics for predicting perineural invasion status in rectal cancer[J]. World J Gastroenterol, 2021, 27(33): 5610-5621. DOI:10.3748/wjg.v27.i33.5610 |
| [15] |
刘贻曼, 韩啸翔, 张玉奇, 等. 深度学习在儿童心脏超声标准切面自动智能识别中的应用[J]. 海军军医大学学报, 2023, 44(7): 822-829. LIU Y, HAN X, ZHANG Y, et al. Deep learning for automatic intelligent identification of pediatric echocardiography standard views[J]. Acad J Naval Med Univ, 2023, 44(7): 822-829. DOI:10.16781/j.CN31-2187/R.20220936 |
| [16] |
VAN GRIETHUYSEN J J M, FEDOROV A, PARMAR C, et al. Computational radiomics system to decode the radiographic phenotype[J]. Cancer Res, 2017, 77(21): e104-e107. DOI:10.1158/0008-5472.CAN-17-0339 |
| [17] |
CHEN L D, LI W, XIAN M F, et al. Preoperative prediction of tumour deposits in rectal cancer by an artificial neural network-based US radiomics model[J]. Eur Radiol, 2020, 30(4): 1969-1979. DOI:10.1007/s00330-019-06558-1 |
| [18] |
CHEN T, GUESTRIN C. XGBoost: a scalable tree boosting system[C]//Proceedings of the 22nd ACM SIGKDD International Conference on Knowledge Discovery and Data Mining. August 13-17, 2016, San Francisco, California, USA. New York: ACM, 2016: 785-794. DOI: 10.1145/2939672.2939785.
|
| [19] |
FRIEDMAN J H. Greedy function approximation: a gradient boosting machine[J]. Ann Statist, 2001, 29(5): 1189-1232. DOI:10.1214/aos/1013203451 |
| [20] |
张蓥. 基于单目纹理图的深度估计算法研究[D]. 武汉: 华中科技大学, 2019.
|
| [21] |
赵子龙, 何英剑, 欧阳涛, 等. 随机森林和支持向量机在利用超声影像特征信息诊断乳腺病变性质的应用价值探索[J]. 中国卫生统计, 2018, 35(5): 684-688. |
| [22] |
尹祖钰. 基于主成分分析和递归特征消除的支持向量机分类方法研究[D]. 哈尔滨: 哈尔滨工业大学, 2016.
|
| [23] |
KIM G H, KIM K B, LEE S H, et al. Digital image analysis of endoscopic ultrasonography is helpful in diagnosing gastric mesenchymal tumors[J]. BMC Gastroenterol, 2014, 14: 7. DOI:10.1186/1471-230X-14-7 |
| [24] |
WU S, ZHENG J, LI Y, et al. A radiomics nomogram for the preoperative prediction of lymph node metastasis in bladder cancer[J]. Clin Cancer Res, 2017, 23(22): 6904-6911. DOI:10.1158/1078-0432.CCR-17-1510 |
| [25] |
PENG Y T, ZHOU C Y, LIN P, et al. Preoperative ultrasound radiomics signatures for noninvasive evaluation of biological characteristics of intrahepatic cholangiocarcinoma[J]. Acad Radiol, 2020, 27(6): 785-797. DOI:10.1016/j.acra.2019.07.029 |
| [26] |
LI J W, CAO Y C, ZHAO Z J, et al. Prediction for pathological and immunohistochemical characteristics of triple-negative invasive breast carcinomas: the performance comparison between quantitative and qualitative sonographic feature analysis[J]. Eur Radiol, 2022, 32(3): 1590-1600. DOI:10.1007/s00330-021-08224-x |
 2024, Vol. 45
2024, Vol. 45


