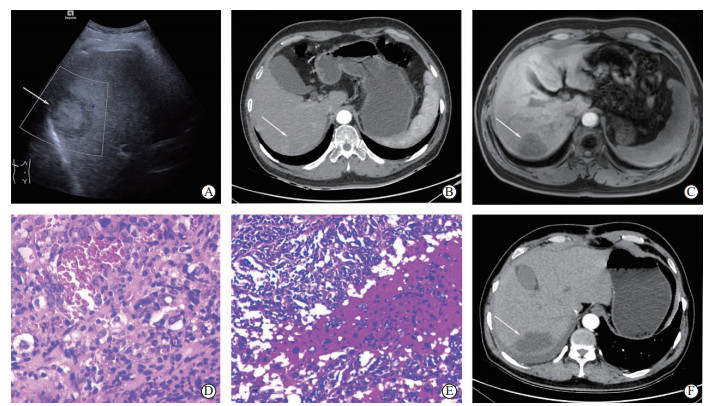
患者男,49岁,因“间断性上腹部疼痛不适10余天”于2020年7月3日入院。患者既往体健,无特殊病史,无化学毒物及放射性物质接触史。入院后,体格检查示右上腹部轻度压痛,余未见明显阳性体征。实验室检查结果示乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)、乙型肝炎表面抗体(hepatitis B surface antibody,HBsAb)、乙型肝炎e抗原(hepatitis B e antigen,HBeAg)、乙型肝炎核心抗体(hepatitis B core antibody,HBcAb)均为阳性,HBV DNA为8.14×105 IU/mL,血小板计数为146×109/L,甲胎蛋白为5.69 ng/mL,其他生化指标未见明显异常。肝脏超声检查提示肝S7段低回声病灶(大小为4.6 cm×3.4 cm,图 1A);CT检查提示肝S7段斑片状稍低密度影(大小为5.6 cm×4.1 cm),边界欠清,增强后轻中度强化,考虑炎症性改变与肿瘤性病变鉴别(图 1B);腹部MRI平扫提示肝右后叶上段占位,血管瘤可能,肝右后叶下段小囊肿;腹部增强MRI提示肝S7段占位性病变(图 1C),结合前片考虑炎症性病灶(不排除肿瘤)。2020年7月6日行超声引导下肝脏穿刺活检术,活检病理诊断提示多考虑炎症性改变(图 1D);免疫组织化学染色提示血管内皮CD31(+)、CD34(+)、弗罗德白血病病毒整合基因1(Friend leukaemia virus integration 1,FLI1)(+)、因子Ⅷ相关抗原(factor Ⅷ-related antigen,FⅧ-RAg)(±)、Ⅰ型分裂蛋白转导素样增强子(transducin-like enhancer of split 1,TLE1)(+)、E26转录因子相关基因(E26 transformation-specific related gene,ERG)(灶+),波形蛋白(+),残存肝细胞和胆管广谱细胞角蛋白(pan cytokeratin,pCK)(+),上皮膜抗原(epithelial membrane antigen,EMA)(灶+),CD68和CD163组织细胞(+),Ki-67阳性率30%。
|
图 1 患者术前、术后影像学和病理检查结果 A:肝脏超声检查示肝S7段低回声病灶(大小为4.6 cm×3.4 cm,箭头所示);B:增强CT示肝S7段病灶(大小为5.6 cm×4.1 cm,箭头所示)轻中度强化;C:腹部增强MRI示肝右后叶S7段见一类圆形占位(大小为4.3 cm×3.9 cm×3.1 cm,箭头所示);D:术前穿刺活检病理示组织由增生的纤维、肉芽和少量肝细胞组成,纤维组织玻璃样变性,肉芽中见残存的胆管、较多的炎症细胞及增生的血管内皮,另见多核样巨细胞(苏木精-伊红染色,400×);E:术后病理示肝脏(部分右肝)高度恶性肿瘤(苏木精-伊红染色,200×);F:出院后1个月复查腹部增强CT示病灶处(箭头所示)未见明显强化,腹主动脉旁周围可见明显肿大淋巴结,较大者直径约2.2 cm.CT:计算机断层扫描;MRI:磁共振成像. |
经多学科专家组讨论后患者被诊断为肝占位性病变(炎症性病变可能性大,不排除肿瘤),建议手术探查。患者于2020年7月20日在全身麻醉下行腹腔镜探查术,见肝脏表面与腹壁和膈肌广泛粘连,肝脏边缘钝,呈脂肪肝样改变,肝脏周围粘连严重,分离困难,遂中转开腹手术。术中游离肝脏,显露S7段肝脏病灶部位,可触及一大小为7 cm×6 cm×4 cm的肿物,质地较硬。遂阻断第一肝门,使用超声刀及电刀完整切除肝S7段。手术时长约2 h,出血量约200 mL,未输血。术后病理结果提示肝血管肉瘤(图 1E),免疫组织化学染色示CD31(+)、CD34(+)、FLI1(+)、FⅧ-RAg(+/-)、ERG(灶+)、波形蛋白(+)、pCK(-)、EMA(-)、精氨酸酶(-)、CD68组织细胞(+)、Ki-67阳性率50%。手术切缘距离肿瘤边缘3.0 cm。
患者术后接受常规对症治疗。查血常规、血生化及止凝血功能相关指标,结果显示血小板计数为63×109/L,丙氨酸转氨酶(alanine transaminase,ALT)为1 351 U/L,天冬氨酸转氨酶(aspartate transaminase,AST)为1 777 U/L。患者肝酶大幅升高,给予异甘草酸镁联合门冬氨酸鸟氨酸静脉滴注治疗。患者白细胞计数较低,给予注射用重组人IL-11(1 200万U)连续皮下注射3 d,复查血常规、血生化及止凝血功能相关指标示血小板计数为59×109/L,ALT为479 U/L,AST为290 U/L;口服利可君片1周后复查上述指标,血小板计数为81×109/L,ALT为122 U/L,AST为87 U/L。患者术后恢复良好,出院后1个月门诊复查CT提示腹膜后淋巴结体积明显增大(图 1F)。患者于甘肃中医药大学附属医院肿瘤内科规律行贝伐珠单抗(400 mg,静脉滴注)抗肿瘤治疗6次,2020年12月7日复查CT提示腹主动脉旁淋巴结继发转移瘤、前纵隔转移瘤。后就诊于空军军医大学唐都医院,行基因检测,对RB1、TERT、ERBB3等425个基因及特定微卫星位点进行突变检测,结果显示没有已知的突变,遂给予三线姑息化疗。化疗方案:盐酸多柔比星脂质体(40 mg,静脉滴注,第1天)、贝伐珠单抗注射液(500 mg,静脉滴注,第1天)、特瑞普利单抗注射液(240 mg,静脉滴注,第1天),每3周为1个用药周期。同时给予腹部深部热疗抗肿瘤治疗8个周期。2022年6月评估病情稳定,2022年8月开始口服安罗替尼(12 mg/d、第1~14天,3周为一个疗程)治疗,于2023年4月停药,复查病情稳定,患者一般情况可。
2 讨论原发性肝血管肉瘤(primary hepatic angiosarcoma,PHA)是一种罕见的内皮源性恶性间质细胞瘤,好发于成年人,发病高峰期为60岁,男女比例约为4∶1[1]。PHA发病率较低,在肝脏原发性恶性肿瘤中占比不到2%,但恶性程度较高,易发生转移,预后极差,中位生存期仅1~6个月[2-3]。该病病因及发病机制尚未完全明确,可能与长期接触聚乙烯、砷、二氧化钍等相关;肝纤维化也可能导致肝血管肉瘤,但两者的相关性尚未得到证实[4]。
PHA临床表现通常不典型,常导致诊断较晚[5]。患者实验室指标一般在正常参考值范围内,乳酸脱氢酶(lactate dehydrogenase,LDH)、碱性磷酸酶(alkaline phosphatase,ALP)、ALT、AST可轻度升高[6]。影像学检查作为PHA的重要术前检查手段亦缺乏特异性,目前选择性肝血管造影被认为是诊断该病最具价值的影像学检查[7],增强CT和MRI可作为重要的辅助检查手段用于鉴别及定位诊断。本例患者处于HBV复制期,仅表现为右上腹疼痛不适,实验室检查结果无特殊,各项影像学检查均考虑炎症性病变可能性大,均不能明确占位类型。这可能是因为PHA在临床上罕见,影像检查未考虑到;也可能是由于PHA的影像学表现缺乏特异性,极难与其他肝脏占位性病变鉴别,导致诊断困难。PHA确诊依靠实质组织活检,但术前穿刺存在较大争议,支持者认为穿刺活检可给出明确诊断,反对者则认为穿刺出血风险高、易导致肿瘤种植转移而不推荐使用[8]。本例患者术前难以确诊,遂在超声引导下行穿刺活检,病理回报为炎症性改变,可能与取材有限有关,也可能因肿瘤组织内出血、坏死导致穿刺活检结果不准确。PHA尚无特异肿瘤标志物,通常认为部分血管内皮标志物如CD31、CD34和FⅧ-RAg对PHA具有诊断性意义,有研究指出ERG蛋白对PHA的灵敏度优于上述标志物[9]。本例患者术前穿刺标本和术后病理标本中CD31、CD34、FⅧ-RAg、ERG蛋白均为阳性,符合PHA病理诊断。
手术切除是PHA治疗的主要手段,未经手术治疗者中位生存期约为1个月,手术后可延长至6个月余[10]。本例患者术前虽未明确诊断为PHA,但腹腔镜探查时高度怀疑肝脏肿瘤性病变,遂转开腹手术切除,给予及时治疗。对于丧失手术机会的患者可行化疗,临床多以铂类药物为基础用药联合其他药物治疗。本例患者术后规律行贝伐珠单抗抗肿瘤治疗,术后4个月肿瘤复发转移,给予盐酸多柔比星脂质体、贝伐珠单抗、特瑞普利单抗3周方案三线姑息化疗,同时给予腹部深部热疗抗肿瘤治疗,后予以口服安罗替尼抗肿瘤治疗。截至2023年12月25日,患者带瘤生存3年余,一般情况可。此外,对于肿瘤破裂或出血患者可将经动脉化疗栓塞作为姑息治疗的一种选择。该病侵袭性强,常有肺、骨、脾等部位转移,由于复发率高,不推荐肝移植[11]。
| [1] |
王钱, 孟丽嘉, 蔡少平, 等. 肝血管肉瘤1例[J]. 肝脏, 2018, 23(10): 945-947. DOI:10.14000/j.cnki.issn.1008-1704.2018.10.037 |
| [2] |
刘磊, 赵义军, 耿小平. 肝血管肉瘤的诊治进展[J]. 肝胆外科杂志, 2019, 27(5): 329-330. |
| [3] |
刘相艳, 庄莉. 肝移植手术治疗肝血管肉瘤1例[J]. 国际消化病杂志, 2020, 40(2): 91-92, 99. DOI:10.3969/j.issn.1673-534X.2020.02.006 |
| [4] |
阿不都热依木·吐尔洪, 韩铠泽, 艾达尔艾力·斯拉依丁, 等. 原发性巨大肝血管肉瘤一例并文献复习[J]. 肝胆胰外科杂志, 2019, 31(4): 238-241. DOI:10.11952/j.issn.1007-1954.2019.04.010 |
| [5] |
CHAUDHARY P, BHADANA U, SINGH R A K, et al. Primary hepatic angiosarcoma[J]. Eur J Surg Oncol EJSO, 2015, 41(9): 1137-1143. DOI:10.1016/j.ejso.2015.04.022 |
| [6] |
AVERBUKH L D, MAVILIA M G, EINSTEIN M M. Hepatic angiosarcoma: a challenging diagnosis[J]. Cureus, 2018, 10(9): e3283. DOI:10.7759/cureus.3283 |
| [7] |
BRUEGEL M, MUENZEL D, WALDT S, et al. Hepatic angiosarcoma: cross-sectional imaging findings in seven patients with emphasis on dynamic contrast-enhanced and diffusion-weighted MRI[J]. Abdom Imaging, 2013, 38(4): 745-754. DOI:10.1007/s00261-012-9967-2 |
| [8] |
HUANG N C, WANN S R, CHANG H T, et al. Arsenic, vinyl chloride, viral hepatitis, and hepatic angiosarcoma: a hospital-based study and review of literature in Taiwan[J]. BMC Gastroenterol, 2011, 11: 142. DOI:10.1186/1471-230X-11-142 |
| [9] |
袁静, 宋欣, 宋涵姝, 等. 肝血管肉瘤中ERG蛋白的表达及诊断意义[J]. 诊断病理学杂志, 2015, 22(9): 534-537. DOI:10.3969/j.issn.1007-8096.2015.09.006 |
| [10] |
GROESCHL RYAN T, MIURA JOHN T, KIYOKO O, et al. Does histology predict outcome for malignant vascular tumors of the liver?[J]. J Surg Oncol, 2014, 109(5): 483-486. DOI:10.1002/jso.23517 |
| [11] |
旦增贡色, 淮明生. 肝移植治疗肝血管源性肿瘤的研究进展[J]. 实用器官移植电子杂志, 2019, 7(1): 28-30. DOI:10.3969/j.issn.2095-5332.2019.01.008 |
 2024, Vol. 45
2024, Vol. 45


