慢性肾脏病(chronic kidney disease,CKD)是一个全球性的健康问题,患病率为8%~16%,是导致心脑血管疾病及死亡风险增加的重要因素[1]。正常情况下机体代谢产生的磷绝大部分通过肾脏排泄,随着肾功能恶化,CKD患者磷的排泄逐渐减少,从而导致血磷升高[2]。高磷血症可以引起继发性甲状旁腺功能亢进、骨形成异常、软组织钙化、心血管疾病等一系列并发症,与心血管死亡密切相关[3-4]。国外有研究表明估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)从60 mL/(min·1.73 m2)下降至20 mL/(min·1.73 m2)时,高磷血症发生率由1%增加至30%[5]。目前我国仅有单中心或多中心针对终末期肾脏疾病(血液透析/腹膜透析)患者高磷血症患病率的调查报告,尚无具有全国代表性的CKD全周期高磷血症流行病学调查数据。本研究利用美国国家健康与营养检查调查(National Health and Nutrition Examination Survey,NHANES)数据库1999-2018年的数据描述了美国成年CKD患者血磷水平及高磷血症的患病率,旨在了解不同年份、不同分期CKD患者高磷血症患病率的变化趋势,以及CKD患者临床特征与高磷血症的关系,为CKD患者高磷血症的防治提供参考。
1 资料和方法 1.1 研究对象NHANES是由美国疾病控制与预防中心下属的国家卫生统计中心开展的一项大规模、多阶段、持续、具有全国代表性的研究,抽样方法和数据收集的细节已经公布,研究方案获得美国国家卫生统计中心伦理审查委员会批准,所有研究参与者在调查时均签署知情同意书[6]。NHANES数据库是一个临床公共数据库,本研究使用了1999-2018年10个周期的NHANES数据。纳入标准:(1)年龄≥18岁;(2)诊断为CKD,诊断标准为eGFR<60 mL/(min·1.73 m2)或尿白蛋白肌酐比值(urine albumin-to-creatinine ratio,UACR)≥30 mg/g;(3)有血磷检测结果。
1.2 资料收集患者的年龄、性别、种族/民族、合并症等信息通过标准化问卷从家庭访谈中收集,体重、身高和血压从移动体检中心获得。种族/民族分为白种人、黑种人、墨西哥裔美国人或其他。参与者在入组时提供血液和尿液样本,检测基线时血磷、血肌酐、血白蛋白、尿白蛋白和尿肌酐等指标。UACR由尿白蛋白除以尿肌酐计算。eGFR采用慢性肾脏疾病流行病学协作组织开发的方程[7]计算。根据改善全球肾脏病预后组织推荐标准对CKD进行分期,eGFR≥90 mL/(min·1.73 m2)为1期,60~89 mL/(min·1.73 m2)为2期,45~59 mL/(min·1.73 m2)为3a期,30~44 mL/(min·1.73 m2)为3b期,15~29 mL/(min·1.73 m2)为4期,<15 mL/(min·1.73 m2)为5期[8]。肥胖定义为BMI≥30 kg/m2。高磷血症定义为血磷>1.45 mmol/L。糖尿病定义为自我报告的经医师诊断的糖尿病,或使用胰岛素或口服降糖药,或空腹血糖≥7.0 mmol/L,或随机血糖≥11.1 mmol/L,或糖化血红蛋白≥6.5%。高血压定义为自我报告的经医师诊断的高血压疾病,或收缩压≥140 mmHg(1 mmHg=0.133 kPa),或舒张压≥90 mmHg。基于本队列人群平均血白蛋白水平(41 g/L)及血白蛋白正常参考值下限(40 g/L),将血白蛋白<40 g/L定义为低水平白蛋白。
1.3 统计学处理使用R语言4.2.0版survey包进行统计学分析。所有分析均使用加权样本,并考虑分层和聚类设计,以得出适用于美国人口的估计值[6]。创建1个20年的权重变量样本,对1999-2002年接受抽样的每个人的4年权重取2/10,对2003-2018年接受抽样的每个人的2年权重取1/10。计量资料以x±sx或x(95% CI)表示,计数资料以例数和百分数表示。通过多因素logistic回归模型分析血磷水平和高磷血症患病率与不同CKD分期及其他临床特征之间的关系。检验水准(α)为0.05。
2 结果 2.1 一般情况共有9 363例成年参与者符合CKD诊断标准,排除52例缺失血磷检测值的参与者,最终有9 311例参与者纳入分析,相当于美国估计有3 001万人患有CKD。由表 1可见,CKD 3~5期的患者年龄较大、血白蛋白水平较低、甲状旁腺激素水平较高,合并高血压、糖尿病的患者比例较高;CKD 3~4期患者具有更高的血25羟维生素D水平;CKD 4~5期患者具有更高的血磷水平。
|
|
表 1 NHANES数据库1999-2018年9 311例成年CKD患者的基本特征 |
2.2 不同调查年份CKD患者血磷水平和高磷血症患病率的变化情况
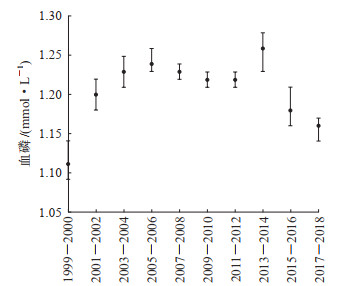
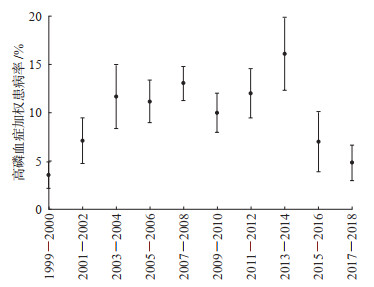
由图 1可见,1999-2006年间,CKD患者的平均血磷水平随着时间的推移而上升,其中1999-2000年CKD患者的平均血磷水平最低,为1.11(95% CI 1.09~1.14)mmol/L;此后至2012年保持相对稳定;2013-2014年CKD患者的平均血磷水平最高,为1.26(95% CI 1.23~1.28)mmol/L,此后随着时间的推移血磷水平逐渐下降。所有CKD患者高磷血症的加权患病率为9.8%,相当于美国有293万CKD患者合并高磷血症。由图 2可见,1999-2004年间,高磷血症的加权患病率随着时间的推移呈增长趋势,此后至2012年保持相对稳定,2013-2014年加权患病率最高,此后随着时间的推移逐渐下降。
|
图 1 NHANES数据库不同调查年份CKD患者血磷水平的变化 所有计量资料的计算均使用加权样本,并考虑分层和聚类设计. x(95%置信区间). NHANES:美国国家健康与营养检查调查;CKD:慢性肾脏病. |
|
图 2 NHANES数据库不同调查年份CKD患者高磷血症加权患病率的变化情况 所有患病率的计算均使用加权样本,并考虑分层和聚类设计,数据表示为加权患病率(95%置信区间). NHANES:美国国家健康与营养检查调查;CKD:慢性肾脏病. |
2.3 不同分期CKD患者血磷水平和高磷血症患病率的变化情况
由表 2可见,随着疾病分期的增加,CKD患者的平均血磷水平和高磷血症的加权患病率逐渐增加,调整性别、年龄、种族后的结果显示,与CKD 1~2期患者相比,CKD 3a期、3b期、4期、5期患者的血磷水平及高磷血症患病率均增高(P均<0.01)。
|
|
表 2 NHANES数据库不同分期CKD患者血磷水平和高磷血症患病率的变化情况 |
2.4 CKD患者患高磷血症的相关因素分析
多因素logistic回归分析结果显示,CKD患者中男性、老年人、肥胖者更倾向于较低的高磷血症患病率(P均<0.05),糖尿病、高血压、血白蛋白水平及血25羟维生素D水平与高磷血症无相关性(P均>0.05,表 3)。
|
|
表 3 NHANES数据库CKD患者患高磷血症的多因素logistic回归分析 |
3 讨论
本研究基于1999-2018年NHANES数据描述了美国全国CKD 1~5期患者血磷水平及高磷血症患病率,结果发现,美国CKD患者高磷血症加权患病率为9.8%(相当于293万人)。血磷水平及高磷血症患病率随着CKD分期的进展而增加,与CKD 1~2期的患者(高磷血症加权患病率为7.99%)相比,患者在肾功能受损的早期(即CKD 3a期)高磷血症患病率即已经显著升高(高磷血症加权患病率为8.64%)。在CKD 4期或CKD 5期患者中,高磷血症加权患病率更是分别达到21.57%和54.66%。
成人血磷水平的正常参考值范围为0.81~1.45 mmol/L,而CKD患者由于尿液中磷排泄减少、肾性骨营养不良、透析不足和处方药的使用等,都可能导致磷超载。血磷浓度是钙超载的直接指标,但钙超载的阈值目前尚无定论。研究发现即使在正常参考值范围内,较高的血磷浓度也与微血管功能恶化、冠状动脉钙化以及CKD发生率和死亡率独立相关[5, 9-11]。本研究多因素logistic回归分析结果显示,CKD患者中男性、老年人(≥65岁)、肥胖(BMI≥30 kg/m2)者更倾向于较低的高磷血症患病率。这些结果提示针对不同的人群,磷超载的阈值可能不同。未来应开展更多血磷水平与临床预后相关性的研究,以明确不同人群最合适的磷超载阈值。
NHANES数据库2013-2014年调查的CKD患者高磷血症加权患病率最高,此后随着时间的推移逐渐下降,这可能与指南的制定、饮食与药物干预有关。目前关于高磷血症患病率的研究主要集中于透析人群[12]。本研究显示血磷水平随着CKD分期升高而升高,血磷水平升高可以发生在CKD病程的早期(3a期),因此在CKD早期即应该开始加强对血磷水平的关注[13]。
NHANES是一项美国全国代表性的抽样调查研究,本研究基于NHANES数据并使用了加权统计,结论可靠。此外,既往研究主要关注CKD透析人群,而本研究的数据涵盖了整个CKD分期的患者,可以更好地观察血磷水平随病情进展的动态变化。本研究也存在局限性。首先,本研究结果基于美国的患者数据库获得,因此将这一发现推广到中国人群时应谨慎;其次,本研究对于CKD的诊断是基于eGFR或UACR的单一检测数据,这可能会将健康个体错误地分类为CKD患者而引入偏倚。此外,既往研究认为高磷血症会增加CKD患者不良临床结局的发生风险[3-4],但本研究未能收集到临床结局数据以进一步阐明这个问题。
总之,对1999-2018年NHANES数据的分析显示,美国CKD 1~5期患者高磷血症患病率估计为9.8%。CKD患者在肾功能受损的早期(CKD 3a期)高磷血症患病率即显著升高,女性、年龄<65岁和BMI<30 kg/m2的CKD患者高磷血症患病率较高,应引起重视。
| [1] |
CHEN T K, KNICELY D H, GRAMS M E. Chronic kidney disease diagnosis and management: a review[J]. JAMA, 2019, 322(13): 1294-1304. DOI:10.1001/jama.2019.14745 |
| [2] |
VERVLOET M G, VAN BALLEGOOIJEN A J. Prevention and treatment of hyperphosphatemia in chronic kidney disease[J]. Kidney Int, 2018, 93(5): 1060-1072. DOI:10.1016/j.kint.2017.11.036 |
| [3] |
BLOCK G A, KLASSEN P S, LAZARUS J M, et al. Mineral metabolism, mortality, and morbidity in maintenance hemodialysis[J]. J Am Soc Nephrol, 2004, 15(8): 2208-2218. DOI:10.1097/01.ASN.0000133041.27682.A2 |
| [4] |
国家肾脏疾病临床医学研究中心. 中国慢性肾脏病矿物质和骨异常诊治指南概要[J]. 肾脏病与透析肾移植杂志, 2019, 28(1): 52-57. DOI:10.3969/j.issn.1006-298X.2019.01.012 |
| [5] |
MORANNE O, FROISSART M, ROSSERT J, et al. Timing of onset of CKD-related metabolic complications[J]. J Am Soc Nephrol, 2009, 20(1): 164-171. DOI:10.1681/asn.2008020159 |
| [6] |
CDC. NHANES survey methods and analytic guidelines[EB/OL]. [2023-01-12]. https://wwwn.cdc.gov/Nchs/Nhanes/AnalyticGuidelines.aspx.
|
| [7] |
LEVEY A S, STEVENS L A, SCHMID C H, et al. A new equation to estimate glomerular filtration rate[J]. Ann Intern Med, 2009, 150(9): 604-612. DOI:10.7326/0003-4819-150-9-200905050-00006 |
| [8] |
Kidney Disease Improving Global Outcomes (KDIGO): KDIGO 2012 clinical practice guideline for glomerulonephritis[EB/OL]. [2023-01-12]. https://kdigo.org/wp-content/uploads/2017/02/KDIGO-2012-GN-Guideline-English.pdf.
|
| [9] |
GINSBERG C, HOUBEN A J H M, MALHOTRA R, et al. Serum phosphate and microvascular function in a population-based cohort[J]. Clin J Am Soc Nephrol, 2019, 14(11): 1626-1633. DOI:10.2215/CJN.02610319 |
| [10] |
FOLEY R N, COLLINS A J, HERZOG C A, et al. Serum phosphorus levels associate with coronary atherosclerosis in young adults[J]. J Am Soc Nephrol, 2009, 20(2): 397-404. DOI:10.1681/ASN.2008020141 |
| [11] |
O'SEAGHDHA C M, HWANG S J, MUNTNER P, et al. Serum phosphorus predicts incident chronic kidney disease and end-stage renal disease[J]. Nephrol Dial Transplant, 2011, 26(9): 2885-2890. DOI:10.1093/ndt/gfq808 |
| [12] |
JIN J J, ZHANG S L, XU J S, et al. Prevalence of chronic kidney disease-mineral bone disorder in hemodialysis patients in Hebei, China[J]. Chin Med J, 2018, 131(22): 2749-2751. DOI:10.4103/0366-6999.245264 |
| [13] |
KETTELER M, BLOCK G, EVENEPOEL P, et al. Diagnosis, evaluation, prevention, and treatment of chronic kidney disease-mineral and bone disorder: synopsis of the kidney disease: improving global outcomes 2017 clinical practice guideline update[J]. Ann Intern Med, 2018, 168(6): 422-430. DOI:10.7326/M17-2640 |
 2023, Vol. 44
2023, Vol. 44


