乳腺导管内病变病理类型多样,主要包括乳腺导管内乳头状瘤、普通导管上皮增生、导管原位癌及非典型导管增生等[1-3]。研究显示,不同种类良、恶性乳腺导管内病变在病理上存在一定的重叠,例如乳腺导管内增生性病变中周期蛋白D1的表达与浸润性癌明显相关[4]。乳腺导管内病变的机制复杂多样,临床对影像学方法的诊断要求较高、动态增强MRI虽有助于鉴别乳腺导管内乳头状瘤与其他良性病变[5],但仍存在费用成本较高,报告等待时间较长、部分人群检查禁忌等局限性。目前,常规二维超声及彩色多普勒血流显像(color Doppler flow imaging,CDFI)是乳腺疾病临床筛查的首选方法,具有无创、经济、便捷、实时等优势,但对乳腺导管内病变的诊断价值有限,且存在超声医师操作手法及经验诊断的主观性,可能造成诊断偏差[6]。近年来,超声新技术蓬勃发展,超声造影(contrast-enhanced ultrasound,CEUS)、自动乳腺全容积成像(automated breast volume scanner,ABVS)技术逐渐被应用于乳腺疾病的诊断中,使导管内乳腺恶性病变有望得到早期发现和治疗[7]。本研究拟探讨ABVS联合CEUS检查对乳腺导管内良、恶性病变的鉴别诊断价值。
1 对象和方法 1.1 研究对象纳入2021年8月至2023年3月于本院接受手术治疗的乳腺导管内病变患者110例。根据术后病理学结果,将患者分为恶性病变组60例(若患者双侧同时伴有病变,只要一侧诊断为导管内恶性病变即将其纳入恶性病变组)和良性病变组50例,其中恶性病变组患者的年龄为30~62(45.46±8.03)岁,良性病变组患者的年龄为24~58(43.52±7.76)岁。两组患者的年龄差异无统计学意义(P>0.05)。
纳入标准:(1)女性;(2)经常规超声检查存在乳腺组织增厚、乳头内陷、凹凸肿块等疑似疾病;(3)经病理学检查明确为乳腺疾病;(4)既往无乳腺疾病手术史,无乳腺癌家族史;(5)乳腺导管局部扩张且存在溢乳症状;(6)可耐受CEUS、ABVS检查;(7)临床病历信息完善。排除标准:(1)处于妊娠期、哺乳期或月经期;(2)对造影剂过敏,身体状况差,不能耐受检查;(3)病理检查结果不明确;(4)存在较严重的其他系统相关病症;(5)伴有免疫系统疾病;(6)存在凝血功能障碍;(7)伴有精神异常。本研究获得我院伦理委员会审批[(2021)年伦审(005)号]。
1.2 仪器与方法 1.2.1 ABVS检查使用的仪器为ACUSON Oxana2 ABVS超声仪(德国西门子公司),配有14L5BV探头。患者取仰卧位,系统自动配置系数,由1名经培训合格且工作5年的ABVS技师操控扫描,扫描范围包括双侧乳腺的正中位、外侧位和内侧位,乳腺体积较大者需手动扩大扫描范围。在ABVS专用工作站将扫描所获取的乳腺全容积成像信息进行上传,自动完成三维多平面重建及后台数据分析。
1.2.2 CEUS检查使用的仪器为西门子Sequoia彩色多普勒超声诊断仪(德国西门子公司),配备L10-4探头;造影剂采用意大利Bracco公司生产的声诺维(SonoVue)。造影前先将5.0 mL生理盐水注入声诺维中振荡混匀,然后抽取2.4 mL造影剂于患者的肘静脉快速注入,后注入生理盐水5~10 mL。造影期间,全程动态监测造影剂的显影、达峰及消散的全过程,重点关注病灶造影后的增强水平、均匀性、增强模式等。
1.2.3 图像分析分别由2名具有5年以上乳腺超声工作经验的主治医师对ABVS及CEUS图像进行独立诊断,当对图像的诊断意见不一致时,请1名从事乳腺超声工作10年以上的高级职称专家进行会诊明确结论。最后将所有病例的ABVS和CEUS影像特征输入电脑,建立数据库。
1.3 统计学处理应用SPSS 25.0软件进行统计学分析。采用Kolmogorov-Smirnov法进行正态分布检验,符合正态分布且方差齐的计量资料以x±s表示,组间比较采用独立样本t检验;计数资料以例数和百分数表示,组间比较采用χ2检验。分析ABVS和CEUS单独及联合检查的诊断效能,计算灵敏度、特异度和准确度。灵敏度(%)=真阳性例数/(真阳性例数+假阴性例数)×100%,特异度(%)=真阴性例数/(真阴性例数+假阳性例数)×100%;准确度(%)=(真阳性例数+真阴性例数)/总样本数×100%;约登指数=灵敏度+特异度-1。检验水准(α)为0.05。
2 结果 2.1 病理学检查结果根据术后病理学检查结果,110例乳腺导管内病变患者中恶性病变60例、良性病变50例。恶性病变包括导管原位癌11例、乳腺浸润性癌14例、乳腺黏液癌7例、导管内癌10例、乳腺黏液腺癌5例、乳腺髓样癌6例、乳腺黏液癌4例、乳腺癌肉瘤3例。良性病变包括良性叶状肿瘤11例、乳腺纤维腺瘤6例、乳腺腺病8例、导管内乳头状瘤6例、炎症8例、乳腺纤维上皮肿瘤4例、乳腺腺病伴腺瘤3例、脂肪坏死3例、其他增生性病变1例。
2.2 乳腺导管内病变的超声影像特征CEUS:良性病变多表现为造影后离心性均匀增强,极少情况下出现灌注缺损,造影后病灶的范围无显著扩增,边界相对清晰,周边无放射状增强;恶性病变多表现为向心性不均匀增强,增强水平较周围腺体高,病灶内部部分可见灌注缺损区,造影后病灶范围相较于造影前明显扩增,边界较模糊。ABVS:良性病变大多边界较清晰,无浸润征象;恶性病变在冠状面上多表现为放射状向病灶集聚的条索状中-高回声,即“汇聚征”。典型病例超声图像特征如图 1、图 2所示。
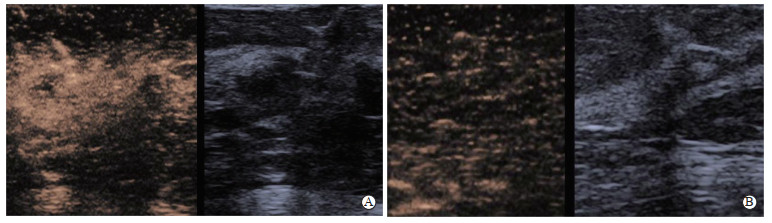
|
图 1 乳腺导管内病变患者CEUS图像特征 A:恶性病变;B:良性病变.CEUS:超声造影. |

|
图 2 乳腺导管内病变患者ABVS图像特征 A:恶性病变;B:良性病变.ABVS:自动乳腺全容积成像. |
2.3 良、恶性乳腺导管内病变患者的CEUS图像特征比较
如表 1所示,乳腺导管内恶性病变组患者与良性病变组患者的病灶回声、边缘、增强特征差异无统计学意义(P均>0.05),而两组患者病灶形态、病灶直径、造影剂达峰强度、病灶周边放射状增强、达峰增强使径线扩大等特征差异有统计学意义(P均<0.05)。
|
|
表 1 两组乳腺导管内病变患者CEUS图像特征的比较 |
2.4 良、恶性乳腺导管内病变患者的ABVS图像特征比较
如表 2所示,乳腺导管内恶性病变组患者与良性病变组患者病灶形态、回声、边缘特征差异无统计学意义(P均>0.05),而两组患者病灶位置、微钙化、伴有周边组织结构变化等特征差异有统计学意义(P均<0.05)。
|
|
表 2 两组乳腺导管内病变患者ABVS图像特征的比较 |
2.5 CEUS与ABVS对乳腺导管内良、恶性病变的诊断效能比较
如表 3所示,CEUS单独检查乳腺导管内良、恶性病变,其鉴别诊断的灵敏度为80.00%,特异度为90.00%,准确度为84.55%;ABVS单独检查乳腺导管内良、恶性病变,其鉴别诊断灵敏度为83.33%,特异度为88.00%,准确度为85.45%;CEUS和ABVS联合检查鉴别诊断乳腺导管内良、恶性病变的灵敏度和准确度较单独检查均提高,分别为95.00%和90.00%。
|
|
表 3 CEUS、ABVS单独及联合检查对乳腺导管内良、恶性病变的诊断效能比较 |
3 讨论
乳腺导管内病变通常体积较小,早期诊断较难。据报道,近20年来,中国女性乳腺导管内恶性病变特别是早期的原位癌发病率成倍增长[8],如何准确检出,使患者早治疗、早获益值得探讨。研究显示,62%~98%的乳腺导管内原位癌在钼靶上可早期发现钙化灶,但特异度低,需经其他检查或穿刺病理确诊[9];MRI相比钼靶灵敏度更高,可检出非钙化性导管内癌灶,但多表现为非肿块样强化(60%~81%)[10]。病理活检是临床上乳腺导管内病变诊断的“金标准”,但病理活检作为侵入性有创检查,部分患者无法承受,限制了其在临床的推广使用[11-13]。因此,积极找寻一项无创、灵敏、高效的影像学诊断方法用于临床鉴别乳腺导管内良、恶性病变则显得非常重要且必要。
超声检查具有可重复性好、无创、操作简单及安全性高等诸多优点,在临床上使用较广泛,《中国女性乳腺癌筛查指南(2022年版)》首次明确提出,乳腺超声是中国女性乳腺癌筛查的首选和主要手段[14]。但无论是常规二维超声、CDFI还是弹性超声等新技术,虽对于鉴别诊断乳腺良、恶性结节有一定优势,但对乳腺导管内病变的诊断价值有限,且存在超声医师操作手法及经验诊断的主观性,可能造成诊断的偏差[6]。随着超声新技术的不断发展,CEUS、ABVS成为提高乳腺疾病良、恶性鉴别诊断的重要手段,效果优于常规二维超声和CDFI[7]。
研究显示,CEUS通过从外周静脉输注造影剂,能够清晰地观察到病变周围及内部出现的微小血管,可对造影前后新生血管数量、血管形态、增强持续时长、达峰时间、血流信号强度等进行有效监测[15];相较CDFI技术可有效呈现低速血流、低流量以及灌注微血管等状况的变化,经定量分析病灶的时间-强度曲线能够反映病灶微血管灌注情况[16]。有研究发现,乳腺导管内原位癌具有较典型的恶性CEUS特征[17],因此,采用CEUS对原位癌等乳腺导管内恶性病变进行早期诊断具有一定的优势。本研究病例经CEUS检查发现,乳腺导管内良、恶性病变图像在病灶形态、病灶直径、造影剂达峰强度、病灶周边放射状增强、达峰增强使径线扩大方面差异有统计学意义(P均<0.05),CEUS鉴别诊断乳腺导管内良、恶性病变的灵敏度和特异度分别为80.00%、90.00%。从肿瘤的血管生成和微血流情况分析,CEUS对乳腺导管内恶性病变的检出有一定的优势,可为临床更好地进行早期诊治提供微循环灌注信息依据。
ABVS是一种全新三维容积成像系统,目前被认为是一种最佳的、可以覆盖全乳腺组织的扫描技术[18]。ABVS是检测和预防乳腺癌最有效的扫描工具,通过宽幅高频探头自动扫描获得乳腺的三维图像信息,可多层面、多角度显示病变,使病灶的成像更加立体、直观。通过对独有的冠状面成像可取得更加直观的诊断,可以补充解决常规二维超声筛查信息不全面及重复性差、手持式超声对操作者经验和技术要求高、切面解剖图像对外科医师的指导意义受限等不足,从而降低了漏诊率。ABVS在冠状面上所获取的“汇聚征”,能够直观地呈现出乳腺导管的走行及沿导管分布的钙化区域,对乳腺导管内原位癌具有较高的检出率[19-20]。本研究结果显示,ABVS检出的良、恶性病灶在位置、微钙化、伴有周边组织结构变化方面差异有统计学意义(P均<0.05),鉴别诊断乳腺导管内良、恶性病变的灵敏度和准确度分别为83.33%、85.45%,与CEUS联合使用后,其诊断的灵敏度和准确度提高,分别为95.00%、90.00%。
综上所述,乳腺导管内病变在ABVS和CEUS检查图像上具有特征性表现,ABVS与CEUS联合检查能够提高对乳腺导管内良、恶性病变的鉴别能力,有助于乳腺导管内病变的早期筛查和良、恶性鉴别诊断,进而提高保乳率、改善预后,值得进一步深入研究。
| [1] |
KULKA J, MADARAS L, FLORIS G, et al. Papillary lesions of the breast[J]. Virchows Arch, 2022, 480(1): 65-84. DOI:10.1007/s00428-021-03182-7 |
| [2] |
HODOROWICZ-ZANIEWSKA D, SZPOR J, BASTA P. Intraductal papilloma of the breast-management[J]. Ginekol Pol, 2019, 90(2): 100-103. DOI:10.5603/GP.2019.0017 |
| [3] |
张婵, 周鹏, 刘伟宗, 等. 超声造影定量分析乳腺导管内病变良恶性的作用分析[J]. 影像研究与医学应用, 2021, 5(21): 47-49. DOI:10.3969/j.issn.2096-3807.2021.21.022 |
| [4] |
郑国文, 王俊安, 何磊, 等. 乳腺导管内增生性病变中cyclin D1蛋白表达与浸润性癌的相关性[J]. 西部医学, 2020, 32(9): 1337-1341. DOI:10.3969/j.issn.1672-3511.2020.09.017 |
| [5] |
黎鑫乐, 李雅, 柴维敏. 动态增强MRI鉴别乳腺导管内乳头状瘤与其他良性病变[J]. 外科理论与实践, 2019, 24(4): 337-343. DOI:10.16139/j.1007-9610.2019.04.013 |
| [6] |
王剑桥, 李睿. 二维超声联合超声造影TIC参数在乳腺导管内病变良/恶性诊断中的应用价值[J]. 影像科学与光化学, 2021, 39(1): 7-11. DOI:10.7517/issn.1674-0475.200523 |
| [7] |
王媚瑜, 张一峰, 陈捷, 等. 超声造影定量分析技术在乳腺导管内病变良恶性鉴别中的应用价值[J]. 上海交通大学学报(医学版), 2020, 40(4): 514-518. DOI:10.3969/j.issn.1674-8115.2020.04.016 |
| [8] |
SI W, LI Y, HAN Y, et al. Epidemiological and clinicopathological trends of breast cancer in Chinese patients during 1993 to 2013:a retrospective study[J]. Medicine (Baltimore), 2015, 94(26): e820. DOI:10.1097/MD.0000000000000820 |
| [9] |
RAUCH G M, HOBBS B P, KUERER H M, et al. Microcalcifications in 1 657 patients with pure ductal carcinoma in situ of the breast: correlation with clinical, histopathologic, biologic features, and local recurrence[J]. Ann Surg Oncol, 2016, 23(2): 482-489. DOI:10.1245/s10434-015-4876-6 |
| [10] |
GREENWOOD H I, HELLER S L, KIM S, et al. Ductal carcinoma in situ of the breasts: review of MR imaging features[J]. Radiographics, 2013, 33(6): 1569-1588. DOI:10.1148/rg.336125055 |
| [11] |
KOKUBU Y, YAMADA K, TANABE M, et al. Evaluating the usefulness of breast strain elastography for intraductal lesions[J]. J Med Ultrason (2001), 2021, 48(1): 63-70. DOI:10.1007/s10396-020-01070-2 |
| [12] |
LI X, WANG H, SUN Z, et al. A retrospective observational study of intraductal breast papilloma and its coexisting lesions: a real-world experience[J]. Cancer Med, 2020, 9(20): 7751-7762. DOI:10.1002/cam4.3308 |
| [13] |
TOKISAWA H, ARUGA T, HONDA Y, et al. Safety and effectiveness of areola-sparing mastectomy for breast cancer with intraductal lesions[J]. Anticancer Res, 2021, 41(11): 5723-5728. DOI:10.21873/anticanres.15388 |
| [14] |
沈松杰, 孙强, 黄欣, 等. 中国女性乳腺癌筛查指南(2022年版)[J]. 中国研究型医院, 2022, 9(2): 6-13. DOI:10.19450/j.cnki.jcrh.2022.02.003 |
| [15] |
孔繁奇, 曹军英, 高越, 等. 超声造影在乳腺导管内病变中的应用价值[J]. 医学影像学杂志, 2022, 32(9): 1521-1524. |
| [16] |
宋倩, 刘景萍, 冯华梅, 等. 超声造影联合乳腺钼靶X线对乳腺导管内乳头状瘤的诊断价值[J]. 实用临床医药杂志, 2021, 25(6): 13-16. DOI:10.7619/jcmp.20210367 |
| [17] |
袁聪聪, 陈曼. 乳腺导管原位癌超声造影特征的临床研究[J]. 肿瘤影像学, 2018, 27(1): 12-16. |
| [18] |
严丽霞, 黄备建. 自动乳腺全容积扫描在乳腺疾病诊断中的应用进展[J]. 肿瘤影像学, 2012, 21(3): 227-229. DOI:10.3969/j.issn.1008-617X.2012.03.020 |
| [19] |
吴希尧, 张琼, 王娅囡, 等. 自动乳腺全容积超声成像技术对中老年妇女乳腺肿块鉴别诊断的价值[J]. 中国老年学杂志, 2022, 42(11): 2670-2672. DOI:10.3969/j.issn.1005-9202.2022.11.020 |
| [20] |
师明莉, 张希璘, 史丽群, 等. 自动乳腺全容积成像系统与手持超声对乳腺良、恶性病变诊断价值的meta分析[J]. 肿瘤研究与临床, 2022, 34(10): 774-780. DOI:10.3760/cma.j.cn115355-20220423-00244 |
 2023, Vol. 44
2023, Vol. 44


