生物气溶胶或初级生物气溶胶粒子(primary biological aerosol particle,PBAP)是颗粒直径在100 μm内、悬浮在大气中的生物物质。在自然环境中,生物气溶胶可以作为生物传播和繁衍的媒介,并参与大气降水和水文循环[1];而在人类环境中,生物气溶胶对公共健康有重要影响,可诱发过敏、哮喘、急性中毒、癌症等,还可以传播疾病[2]。近年来,造成大规模全球性流行的突发新发传染病中,大部分为经生物气溶胶传播的呼吸道疾病,如严重急性呼吸综合征(severe acute respiratory syndrome,SARS)、中东呼吸综合征(Middle East respiratory syndrome,MERS)和新型冠状病毒感染(coronavirus disease 2019,COVID-19)等[3-4]。除此之外,由于播散速度快、防御难度大、污染范围广、持续时间长,生物气溶胶也作为生物战剂的主要投放方式应用于生物恐怖事件,对人类健康造成重大威胁。因此,无论是在民用的传染病控制领域还是军用的生物安全防御领域,生物气溶胶的探测均是关键的研究课题。
生物气溶胶的常用探测手段可分为点监测(point surveillance)和远程探测(stand-off detection)[5]。生物气溶胶点监测是通过布设点监测器,以接触式方式监测环境中生物粒子的浓度、粒径和种类的方法,具有实时性、稳定性和持续性等优点。通过设置点监测网络可以对机场、地铁站、废水处理厂、垃圾处理站等重要公共场所及特定工作场景中的粒子进行实时监测与预警。随着激光、光电制造和光谱检测等技术的发展,基于激光诱导荧光雷达(laser-induced fluorescence light detection and ranging,LIF-LiDAR)技术的生物气溶胶远程探测装置已成为非接触式检测生物粒子的重要手段。激光雷达通过向目标气溶胶云团发射激光束并对返回信号的光谱、强度进行适当的运算反演,获得目标区域气溶胶的参数信息,其与传统技术相比具有检测距离远、响应时间快、分辨能力强等优点。本文就该领域的基本原理、技术类型、技术进展、应用开发等展开综述,以期阐明该领域的发展现况,为我国军民领域相关技术装备研发工作者提供借鉴。
1 生物气溶胶的检测常见的生物气溶胶包括病毒(直径0.01~0.3 μm)、细菌(直径0.1~10 μm)、真菌和植物孢子(直径1~30 μm)、花粉(直径5~100 μm)等[6],它们本身是传染病的病原体、过敏原[7],也可作为致癌物等有毒物质的载体。生物气溶胶检测的主要目的是区分其是否为生物性,其次在于鉴别其种类。显微镜观察法与免疫学方法是实验室常用的检测手段,是从形态学与免疫学角度与对粒子进行区分。光学显微镜可用于检测大于2 μm的生物气溶胶,荧光显微镜则是通过观察荧光染料标记特定功能基团后样品的荧光来获得微生物总数,在确定生物气溶胶的种类方面具有一定的选择性。然而,使用显微镜方法计数生物气溶胶中的微生物相当烦琐、耗时,并且容易出现人为错误,无法实时评估。免疫学方法(如ELISA和胶体金免疫层析法)和分子生物学方法(如核酸杂交技术、PCR技术和基因芯片)在实验室条件下表现出较好检测能力[8],但检测条件要求较高,难以应对户外条件下生物气溶胶的快速测量。
生物气溶胶远程探测技术则是检测生物基团本身的荧光特性,通过激光诱导生物分子产生荧光,对荧光谱进行分析从而分辨粒子的生物性并识别粒子种类。当紫外激光照射生物气溶胶粒子时,粒子吸收光子从基态S0跃迁至激发态(约10-15 s),激发态分子不稳定,会通过振动弛豫等非辐射过程及荧光等辐射过程回到基态,激发态分子从第一激发态S1的最低振动能级释放光子回到S0发出的光即称为荧光。荧光的特性可以用激发波长(excitation wavelength,λex)、发射波长(emission wavelength,λem)和量子产率(quantum yield)来描述。生物粒子发出的荧光是由其中的荧光团决定的,如氨基酸(色氨酸、酪氨酸、苯丙氨酸)、烟酰胺腺嘌呤二核苷酸、核黄素、维生素、纤维素、吡啶二羧酸、壳多糖等(表 1)[9]。通过荧光光谱可对气溶胶进行分类,生物气溶胶粒子的荧光光谱由其所含荧光团的荧光光谱叠加而成,其波长范围主要在280~800 nm;非生物气溶胶粒子大多只有本征散射而没有荧光光谱,一些非生物物质如类腐殖质、二次有机气溶胶、多环芳烃也可以发出荧光,但量子产率通常比生物物质小得多,因此可以忽略。生物气溶胶远程探测技术可以实现户外、远距离、复杂条件的生物气溶胶识别。
|
|
表 1 一些典型荧光团的激发-发射波长[9] |
2 生物气溶胶荧光点探测装置及应用
成熟的点监测技术是实现远程气溶胶监测的技术基础,两者原理相同。目前最常见的点监测技术装备为Hairston等[10]开发的紫外线空气动力学粒度仪(ultraviolet aerodynamic particle sizer,UV-APS)和英国赫特福德大学开发的宽频综合生物气溶胶光谱仪(wideband integrated bioaerosol sensor,WIBS)[11-12]。在WIBS的基础上,美国朗蒙特公司开发了一种具有高分辨率荧光测量强度的升级设备——光谱强度生物气溶胶传感器(spectral intensity bioaerosol sensor,SIBS)。随着我国光电制造技术的进展,一些国产生物气溶胶荧光检测装置也得到应用。下面将分别介绍这些仪器的基本原理、实验室测试与应用。
2.1 UV-APSUV-APS由Hairston等[10]开发,是第1款应用广泛的单粒子荧光实时生物气溶胶传感器,它能够测量单粒子的空气动力学直径和本征荧光强度。与传统依据米氏散射理论估计粒子光学尺寸的光学仪器不同,UV-APS通过测量加速气流中相对于空气速度的粒子速度来确定粒子的空气动力学直径。UV-APS在实验室条件下进行了许多测试。Agranovski等[13-14]用UV-APS检测不同浓度的烟酰胺腺嘌呤二核苷酸和核黄素雾化水溶液,结果表明受损细胞内存在的烟酰胺腺嘌呤二核苷酸量低于UV-APS所需的灵敏度阈值,提示UV-APS检测总生物颗粒的能力有限;他们还使用UV-APS直接检测细菌,并评估了细菌生理对其荧光信号的影响。这些早期的UV-APS研究将观察到的荧光信号视为活性生物粒子的体现。Huffman等[15]使用UV-APS测量荧光生物气溶胶粒子(fluorescent biological aerosol particle,FBAP)的浓度,提供了活性生物气溶胶粒子的估计值,这一估计值可视为FBAP实际丰度的近似下限。非生物气溶胶成分的荧光可能会影响UV-APS对细颗粒(<1 μm)的测量结果,但不会影响对粗颗粒(1~20 μm)的测量结果。
UV-APS在医院、教室等室内环境与大气检测方面应用广泛。医院环境中的支气管镜检查部门是空气传播传染病传播风险最高的部门之一,支气管镜检查会刺激患者的咳嗽反射,产生许多含有致病微生物的气溶胶,例如分枝杆菌、病毒甚至霉菌。这些微生物可以在空气中停留相当长的时间。利用UV-APS在支气管镜检查期间进行监测,发现非荧光和荧光颗粒(生物气溶胶)的浓度明显高于参考浓度,在支气管镜插入期间生物气溶胶浓度明显更高,检查结束后生物气溶胶达到参考浓度所需的时间约为15 min[16]。该研究可为支气管镜检查部门控制传染病传播风险、环境消杀与预防疾病提供重要参考。
在室内环境中,人类是空气中生物颗粒的重要来源,量化人类生物气溶胶的排放对于评估人居住的环境十分重要。在一个75 m3的模拟办公室工作条件下,人排放的生物气溶胶颗粒(2.5~10 μm)数为每人每小时(0.9±0.3)百万个,步行、衣服与皮肤摩擦都会使生物气溶胶增加[17]。Bhangar等[18]利用UV-APS在1年内对教室的生物气溶胶进行了监测,结果显示教室中荧光生物气溶胶粒子浓度的日间变化和季节变化较日内变化小,这可能与人员密度、人员活动强度和通风系统运行状态的变化有关,如下课期间人员活动增加,人均生物气溶胶粒子排放量也显著增加。这是首批应用激光诱导荧光在人活动的常见室内环境中以高时间和尺寸分辨率表征生物气溶胶的研究之一。
UV-APS结合高通量测序方法是研究大气环境中生物气溶胶颗粒及其种类的重要手段。基于此方法,有研究对中国北部城市和农村地区生物气溶胶的种类进行了检测,发现城市的人源细菌属如链球菌属、丙酸杆菌属含量较高,表明城市空气环境中的细菌排放主要来自人类;而且城市和农村的生物颗粒直径不同,这导致两地区受污染影响的人群形成的肺沉积特征也不同[19]。另有研究对北京雾霾和晴天的生物气溶胶进行了分析,霾天和晴天13个细菌属的丰度和群落结构没有显著差异,但霾天检测到的内毒素水平约为晴天的2倍[20]。这些结果有助于更好地理解大气荧光粒子动力学,尤其是环境污染情况下的空气粒子情况,有助于有针对性地提出污染防治与健康预防措施。
2.2 WIBSWIBS是一种快速响应和高灵敏度的生物气溶胶/荧光气溶胶传感器,它比UV-APS更复杂,不仅能提供粒径信息,还可通过测量散射激光信号来评估颗粒形态。WIBS通过评估前向和侧向光散射以及每个粒子在毫秒时间分辨率下的荧光强度来表征单个粒子的大小和形状,对每个粒子提供3个通道(FL1、FL2和FL3)的荧光结果。WIBS在280 nm和370 nm波长处提供2个连续的紫外光脉冲,分别激发色氨酸(280 nm)和烟酰胺腺嘌呤二核苷酸(370 nm)的最大吸收波长。在实验室测试条件下,WIBS可以较好地区分生物和非生物气溶胶。Healy等[21]对15种花粉、孢子与化学颗粒的样本进行了2 000多次单个粒子测量,发现可以通过荧光生物气溶胶粒子的特征区分化学颗粒与花粉和真菌孢子,而结合标准化荧光的三维图谱与粒子尺寸测量,可以更好地利用WIBS-4进行生物气溶胶的早期预警。Toprak等[22]研究发现,通过2个荧光通道的组合可以充分区分生物与非生物气溶胶,如使用FL1和FL3通道的组合,可以很容易地辨别出雾化的硫酸铵真菌孢子混合物。Hernandez等[23]利用WIBS-4A汇总了50多种常见生物气溶胶(细菌、真菌和花粉)样本的大小、形状和可视化的荧光发射强度,可用于识别空气中的微生物和花粉。
WIBS在高海拔山区气溶胶丰度与种类观测、阐明生物气溶胶对大气环境与气候的贡献方面发挥了重要作用[24-26]。此外,常利用WIBS在飞机上对高空中的生物气溶胶进行机载测量,可以提供大范围、不同高度的气溶胶信息,并且量化不同地理条件、不同气候环境中的生物气溶胶差异[27-28]。Perring等[28]研究发现,在美国东部高空中检测到的荧光气溶胶与实验室环境中观察到的霉菌孢子基本一致,而在西部能观察到更大尺寸的变化;沙漠西部的荧光生物气溶胶含量与墨西哥湾附近一致,表明生物气溶胶在潮湿和干旱环境中都是超微米气溶胶的重要组成部分。这为分析不同地区的气候、环境和大气状况提供了借鉴。
2.3 SIBSSIBS使用285 nm和370 nm双激发波长,并在双激发下测量16个通道中粒子的尺寸、形状和光谱分辨荧光。因此,与WIBS相比,SIBS提供的高分辨率荧光光谱信息可以提高区分和分类生物气溶胶的能力。SIBS在污水处理厂、堆肥设施、农场等空气中微生物含量高、空气质量差的场景下有许多应用[29-31]。Ferguson等[29]利用SIBS对堆肥设施的生物气溶胶观测发现,微生物类群的尺寸差异很大,芽孢杆菌较大,放线菌较小,烟曲霉中等(1.1~4.7 μm),这表明烟曲霉具有广泛的扩散潜力,一旦吸入可能会深入呼吸系统;放线菌在含量上占比>60%,提示堆肥生物气溶胶的主要健康影响可能是过敏性呼吸道致敏,而不是直接感染。这些结果提供的生物气溶胶的大小和丰度分布为堆肥设施相关的人类健康风险评估提供了可靠的信息。如前所述,SIBS的优势在于提供更多的光谱信息,解析生物荧光团信号的能力更强,从而有助于对环境生物气溶胶进行实时辨别与分类[30-31]。
2.4 国内点监测器发展情况国内荧光点监测装置发展较晚,但近年来发展迅速,已有许多科技公司、高校和研究院申请了生物气溶胶荧光探测装置的专利[32-38]。由南京先进激光技术研究院等研发的便携式RBM-5型生物气溶胶监测仪能够检测空气中0.5~10 μm的细菌、真菌与孢子,灵敏度达到每升空气50颗粒(http://www.nialt.com/product/69.html)。上海镭慎光电科技有限公司研发的RBM-E1型生物气溶胶监测仪采用1个405 nm散射光通道与2个荧光通道检测气溶胶,具备6个粒径通道,能同时显示0.5~25 μm的总粒子数和生物粒子数,该仪器已在上海世博会期间及北京大兴机场等场所应用(http://www.lasensor.com/html/18/2023022154.html)。中国检验检疫科学研究院自主研发了BIO Capturer-5内置生物气溶胶采集富集仪,该仪器已在许多医院中应用,用于空气中细菌与病毒的监测[39-41]。为进一步对荧光法生物气溶胶监测仪计数效率进行评价,许多研究通过荧光微球雾化法模拟生物气溶胶环境开展计数效率的评价[42-43],全国生物计量技术委员会在2022年发布了《荧光法生物气溶胶监测仪校准规范》[44]。
综上所述,生物气溶胶点监测装置可对人口密集的公共场所、手术室等无菌环境、生物安全实验室、大气环境的空气质量进行监测与分析,还可对有害生物气溶胶进行预警,是发现与处置生物污染的重要设备。
3 生物气溶胶远程探测装置在点监测技术装备的基础上对远程探测技术进行攻关,使检测距离大幅延长是远程气溶胶监测技术的关键。LIF-LiDAR远程探测装置通过发射脉冲激光撞击粒子→粒子吸收或发射信号→利用合适的探测器检测信号而实现远距离探测和测距,所探测的信号包括瑞利(Rayleigh)散射、米氏(Mie)散射、拉曼(Raman)散射和荧光等[45]。远程探测装置能解决点监测器易受环境、地形影响的不足,荧光的可探测距离能够达到数百米至数千米,对于较复杂的环境依然可以实现现场探测。
3.1 基本原理与构造生物气溶胶远程探测装置分为发射模块、接收模块和信号处理模块(图 1)。发射模块包括光源和发射器,用于将脉冲激光发送到目标气溶胶(生物气溶胶);接收模块包括接收望远镜、分束器、光电倍增管(photo multiplier tube,PMT)、光谱仪和增强型电耦合元件(intensified charge coupled device,ICCD)或多阳极光电倍增管(multi-anode photo multiplier tube,MAPMT)等,负责收集并聚焦散射光,对散射光进行分束与滤波;信号处理模块是整个系统的软件部分,主要负责协调激光发射、回波信号接收、光电转换、测量和存储,并进行数据处理和分析判断。远程激光雷达探测系统目前主要用于大气观测与军事生物战剂气溶胶探测,由于激光器、望远镜和信号处理终端集成度有限,各国研发的设备体积依然比较庞大,大多装载于机动车或固定设施上。
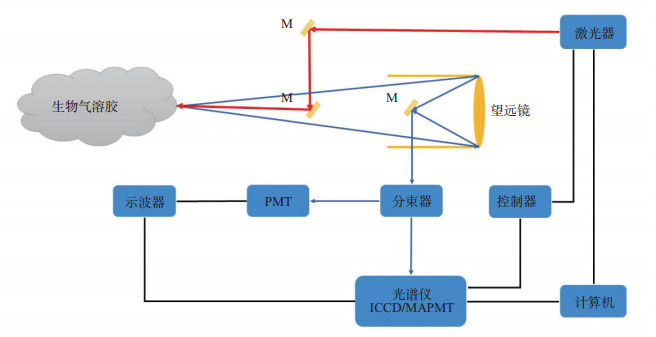
|
图 1 生物气溶胶远程探测系统结构简图 M:反光镜;PMT:光电倍增管;ICCD:增强型电耦合元件;MAPMT:多阳极光电倍增管. |
3.2 各国主要发展情况
自20世纪90年代以来,美国、加拿大、挪威、瑞典、英国、俄罗斯等国的国防机构开发出了不同的系统与装备,通过施放生物战剂模拟物气溶胶,对系统进行测试与改进。
由美国国防部资助的联合生物远程探测系统(joint biological stand-off detection system,JBSDS)可以对潜在危害性生物气溶胶云团提供预警[46-47]。JBSDS使用355 nm激光激发生物气溶胶中的荧光并使用1 047 nm红外激光进行测绘和尺寸测量。使用算法比较单个荧光带和红外弹性散射的大小,可以从干扰物质中分辨出释放的生物气溶胶。该系统利用红外光谱可探测5 km外的气溶胶云团,并能利用荧光辨别3 km外的云团是否为生物气溶胶。它相对较小,可以安装在军用高机动性多用途轮式车辆的后面[48]。
加拿大的集成化高光谱分辨率主动探测系统(stand-off integrated bioaerosol active hyperspectral detection,SINBAHD)最早建立于2000年12月,整个雷达系统(包括发射器、接收器、电子设备和冷却系统)集成在一个12 m长的改装牵引拖车内[49]。SINBAHD使用高脉冲能量的351 nm激光诱导荧光,使用直径30 cm的牛顿望远镜收集反射光,由光谱仪和ICCD采集气溶胶的370~600 nm光谱,分辨率为4.8 nm。SINBAHD能对1.4 km外的枯草芽孢杆菌和欧文氏菌气溶胶进行良好区分[50]。在现场试验中,SINBAHD可对炭疽杆菌、枯草芽孢杆菌、卵清蛋白等几种典型生物模拟物和泥土干扰物进行区分[49]。BioSense系统是SINBAHD的升级,BioSense系统使用红外扫描激光雷达进行气溶胶云团检测,并使用紫外激光诱导荧光光谱进行气溶胶分类。BioSense系统使用的1.5 μm红外和355 nm紫外传感器以及所有相关的操作控制台都安装在一辆卡车中[5]。BioSense系统对气溶胶的荧光探测距离在白天和夜晚分别可以达到0.5 km和1.4 km[51]。BioSense系统可进行自动监测,对监视下的设定区域进行红外扫描,当探测到云团时触发紫外线探测,当收集到的荧光强度高于某一阈值时启动分类,如果从荧光光谱库中识别出威胁物质则触发警报并报告云团位置信息。此外,BioSense系统识别生物气溶胶物质后可对其进行标记,以扩充荧光光谱库。
挪威国防研究机构开发的激光雷达系统使用355 nm激光激发荧光,激光器以10 Hz的脉冲重复率运行,脉冲能量高达150 mJ,脉冲长度为5 ns,散射光由直径为250 mm的牛顿望远镜收集。该系统的光谱分辨率约为7 nm,光谱范围从340 nm到680 nm[52-53]。系统经过改进,增加了294 nm激发光,对7种不同生物制剂的分析表明,在294 nm激发光下,能更好地对物质进行分类[54]。
瑞典国防研究局开发的系统采用3个不同激光雷达,其中1个利用1.57 μm弹性反向散射检测和定位气溶胶云团,另2个利用355 nm紫外激光诱导荧光光谱进行气溶胶检测和分类[55]。采用该系统对半封闭室内和户外施放的生物战剂模拟物气溶胶进行测试,结果表明在2~3 km处可使用弹性反向散射检测每升空气1 000颗粒的气溶胶云团,在1 km处可使用荧光探测生物气溶胶[51]。
英国设计了一种小型荧光激光雷达,该系统利用掺钕钇铝石榴石(Nd: YAG)激光器提供的1 064 nm红外弹性反向散射来检测和绘制云图,利用Nd: YAG激光器产生40 mJ能量、9 ns脉冲的266 nm激光激发荧光,并采用10个通道收集300~500 nm的荧光[56]。弹性散射通道可以测得2 km以外的气溶胶云团。激光雷达在美国犹他州Dugway试验场进行试验,评估其远距离生物检测能力,采用了支持向量机算法对数据进行训练,可以区分生物或非生物气溶胶[56]。
俄罗斯大气光学研究所开发了一种移动式多波长气溶胶激光雷达,用于探测大气中有机污染物[57]。该探测器使用1 064 nm基本激光谐波检测和跟踪云团,三次和四次谐波激发大气污染物质中的荧光,接收系统记录280~580 nm光谱范围内的荧光散射,光谱分辨率不低于1~10 nm。弹性散射通道的探测范围为30 km,荧光通道的探测范围为4 km。该激光雷达安装在机动车上,并且具有独立的功能系统,部署时间不到20 min,可由唯一的操作员独立控制[57]。
3.3 技术研发方向气溶胶的激光诱导荧光远程监测技术可实现对突发公共卫生事件和环境污染问题的远距离、快速响应,提高环境监测效率与能力。为实现生物气溶胶光谱的高效识别与准确分类,还有许多方面需要加大研发投入。
激光雷达探测系统主要面临的问题之一是荧光探测距离较短,这是由于荧光截面仅为相应的弹性散射截面的1/100 000~1/1 000,需要利用更高功率的光源、更灵敏的光电探测器和更有效的粒子信号收集系统。因此,开发基于ICCD和MAPMT的传感器等高性能元件非常重要。此外,合理地将长距离红外激光雷达模块与荧光激光雷达结合,可以实现更远距离的探测。
白天太阳背景光的强烈影响使荧光探测困难也是激光雷达面临的问题,高太阳辐射条件下PMT难以用于检测荧光。为了解决这一问题可以考虑使用时间门控ICCD[58-59]。Shoshanim和Baratz[59]开发的探测系统基于266 nm光源对色氨酸和卵清蛋白的光谱进行鉴定,激光雷达可以在白天远程测量环境空气中的生物气溶胶,在露天试验中,在强风和阳光充足的条件下可成功探测到2.5 km处的生物气溶胶云团。
选择正确的激发波长来远距离探测大气中的生物颗粒也十分重要。研究表明,较短的激发波长(248~294 nm)与较长的激发波长(如355 nm)相比荧光光谱更强[60],而较短的波长与较长的波长相比更容易在大气中衰减(瑞利损耗增加),权衡好两者的关系需要考虑诸多因素。例如,病毒缺乏烟酰胺腺嘌呤二核苷酸、核黄素等活性细胞拥有的辅酶,检测病毒时所用的激发和发射波长分别为248~295 nm和310~450 nm[61];而大多数微生物都含有烟酰胺腺嘌呤二核苷酸,其激发和发射波长分别为340~370 nm和440~470 nm[60]。因此,在340~370 nm和248~295 nm激发波长下探测生物气溶胶云可以获得区分病毒与细菌和真菌的光谱特征。
从生物气溶胶光谱中分辨出粒子种类需要排除许多其他粒子的干扰,如次级生物气溶胶(biogenic secondary organic aerosol,BSOA)。BSOA是由挥发性有机化合物(如右旋柠檬烯或α-蒎烯)与臭氧和自由基氧化形成,有研究发现直径为0.7 μm的BSOA可对3 μm的真菌孢子产生强烈干扰,而对直径10 μm的花粉的干扰可以忽略不计,因此建议测量时删除细颗粒数据以减少BSOA的干扰[62]。
许多激光雷达虽然能用于探测生物气溶胶,但在具体分类方面尚存在不足,因此通过荧光光谱分辨出生物种类以便及时提出预防措施的需求十分迫切,许多研究对此问题提出了一些改进方法。首先,构建实时检测、分类和识别生物气溶胶所需的激发-发射光谱数据库对于准确识别气溶胶种类至关重要。目前,对细菌、真菌和花粉的激光激发-发射光谱已经有较多研究[63-65],但对病毒的类似研究仍缺乏,应当进行不同紫外波长下病毒激发-发射光谱的试验。其次,气溶胶颗粒的荧光寿命数据(时间分辨激光诱导荧光数据)可增强激光雷达系统的特异性识别能力,将光谱数据与荧光寿命数据结合使用可以起到增益作用,这在一些生物战剂的检测、分类和鉴定中已得到证实[66]。此外,为从复杂的多波长、多通道、多光谱荧光数据中提取有效信息并进行分类识别,还需要结合多种算法与机器学习。有研究者将层次聚集聚类分析引入潜在生物气溶胶的鉴定[67]。另有研究采用支持向量机、决策树与神经网络算法对一组小RNA病毒光谱数据进行分类,识别的准确性与速度都得到提高[60]。
4 结语空气中的微生物,如细菌、真菌孢子和病毒对人类健康构成严重威胁,花粉和其他含过敏原的气溶胶以及工业、农业废气排放也是人类呼吸道相关疾病的重要来源,生物战剂造成的恐怖袭击与生物战争是人类面临的潜在威胁。及时发现、识别和定位危险气溶胶有助于采取有效措施来消除危险并减轻其不良后果,因此生物气溶胶远程实时探测装置的应用对于公共卫生安全至关重要。基于激光诱导荧光的点检测器与激光雷达可以有效检测与识别生物种类,随着监测技术、材料工程与软件工程的发展,以及人们对生物气溶胶认识的深入,未来的探测装置会更加轻便、准确,可适应更多复杂的环境条件。
| [1] |
PÖSCHL U, MARTIN S T, SINHA B, et al. Rainforest aerosols as biogenic nuclei of clouds and precipitation in the Amazon[J]. Science, 2010, 329(5998): 1513-1516. DOI:10.1126/science.1191056 |
| [2] |
DESPRÉS V R, HUFFMAN J A, BURROWS S M, et al. Primary biological aerosol particles in the atmosphere: a review[J]. Tellus B, 2012, 64(1): 15598. DOI:10.3402/tellusb.v64i0.15598 |
| [3] |
TOTURA A, LIVINGSTON V, FRICK O, et al. Small particle aerosol exposure of African green monkeys to MERS-CoV as a model for highly pathogenic coronavirus infection[J]. Emerg Infect Dis, 2020, 26(12): 2835-2843. DOI:10.3201/eid2612.201664 |
| [4] |
HILDEBRANDT R, SKUBACZ K, CHMIELEWSKA I, et al. Implementing silica nanoparticles in the study of the airborne transmission of SARS-CoV-2[J]. Molecules, 2022, 27(12): 3896. DOI:10.3390/molecules27123896 |
| [5] |
BUTEAU S, ROWSELL S. Biological material detection identification and monitoring: combining point and standoff sensors technologies[C]//SPIE Security + Defence. Proc SPIE 9995, optics and photonics for counterterrorism, crime fighting, and defence Ⅻ. Edinburgh, United Kingdom, 2016: 84-93. DOI: 10.1117/12.2241133.
|
| [6] |
PÖSCHL U, SHIRAIWA M. Multiphase chemistry at the atmosphere-biosphere interface influencing climate and public health in the anthropocene[J]. Chem Rev, 2015, 115(10): 4440-4475. DOI:10.1021/cr500487s |
| [7] |
MENDELL M J, MIRER A G, CHEUNG K, et al. Respiratory and allergic health effects of dampness, mold, and dampness-related agents: a review of the epidemiologic evidence[J]. Environ Health Perspect, 2011, 119(6): 748-756. DOI:10.1289/ehp.1002410 |
| [8] |
李鑫, 吴慧云, 黄志松, 等. 生物战剂检测技术及其研究进展[J]. 军事医学, 2014, 38(4): 312-316. DOI:10.7644/j.issn.1674-9960.2014.04.020 |
| [9] |
PÖHLKER C, HUFFMAN J A, FÖRSTER J D, et al. Autofluorescence of atmospheric bioaerosols: spectral fingerprints and taxonomic trends of pollen[J]. Atmos Meas Tech, 2013, 6(12): 3369-3392. DOI:10.5194/amt-6-3369-2013 |
| [10] |
HAIRSTON P P, HO J, QUANT F R. Design of an instrument for real-time detection of bioaerosols using simultaneous measurement of particle aerodynamic size and intrinsic fluorescence[J]. J Aerosol Sci, 1997, 28(3): 471-482. DOI:10.1016/S0021-8502(96)00448-X |
| [11] |
KAYE P H, HIRST E, FOOT V E, et al. A low-cost multichannel aerosol fluorescence sensor for networked deployment[C]//European Symposium on Optics and Photonics for Defence and Security. Proc SPIE 5617, optically based biological and chemical sensing for defence. London, United Kingdom, 2004: 388-398. DOI: 10.1117/12.578283.
|
| [12] |
KAYE P H, STANLEY W R, HIRST E, et al. Single particle multichannel bio-aerosol fluorescence sensor[J]. Opt Express, 2005, 13(10): 3583-3593. DOI:10.1364/opex.13.003583 |
| [13] |
AGRANOVSKI V, RISTOVSKI Z, HARGREAVES M, et al. Performance evaluation of the UVAPS: influence of physiological age of airborne bacteria and bacterial stress[J]. J Aerosol Sci, 2003, 34(12): 1711-1727. DOI:10.1016/S0021-8502(03)00191-5 |
| [14] |
AGRANOVSKI V, RISTOVSKI Z, HARGREAVES M, et al. Real-time measurement of bacterial aerosols with the UVAPS: performance evaluation[J]. J Aerosol Sci, 2003, 34(3): 301-317. DOI:10.1016/S0021-8502(02)00181-7 |
| [15] |
HUFFMAN J A, TREUTLEIN B, PÖSCHL U. Fluorescent biological aerosol particle concentrations and size distributions measured with an Ultraviolet Aerodynamic Particle Sizer (UV-APS) in Central Europe[J]. Atmos Chem Phys, 2010, 10(7): 3215-3233. DOI:10.5194/acp-10-3215-2010 |
| [16] |
LAVOIE J, MARCHAND G, CLOUTIER Y, et al. Evaluation of bioaerosol exposures during hospital bronchoscopy examinations[J]. Environ Sci Process Impacts, 2015, 17(2): 288-299. DOI:10.1039/c4em00359d |
| [17] |
BHANGAR S, ADAMS R I, PASUT W, et al. Chamber bioaerosol study: human emissions of size-resolved fluorescent biological aerosol particles[J]. Indoor Air, 2016, 26(2): 193-206. DOI:10.1111/ina.12195 |
| [18] |
BHANGAR S, HUFFMAN J A, NAZAROFF W W. Size-resolved fluorescent biological aerosol particle concentrations and occupant emissions in a university classroom[J]. Indoor Air, 2014, 24(6): 604-617. DOI:10.1111/ina.12111 |
| [19] |
SHEN F, ZHENG Y, NIU M, et al. Characteristics of biological particulate matters at urban and rural sites in the North China Plain[J]. Environ Pollut, 2019, 253: 569-577. DOI:10.1016/j.envpol.2019.07.033 |
| [20] |
WEI K, ZOU Z, ZHENG Y, et al. Ambient bioaerosol particle dynamics observed during haze and sunny days in Beijing[J]. Sci Total Environ, 2016, 550: 751-759. DOI:10.1016/j.scitotenv.2016.01.137 |
| [21] |
HEALY D A, O'CONNOR D J, BURKE A M, et al. A laboratory assessment of the waveband integrated bioaerosol sensor (WIBS-4) using individual samples of pollen and fungal spore material[J]. Atmos Environ, 2012, 60: 534-543. DOI:10.1016/j.atmosenv.2012.06.052 |
| [22] |
TOPRAK E, SCHNAITER M. Fluorescent biological aerosol particles measured with the Waveband Integrated Bioaerosol Sensor WIBS-4:laboratory tests combined with a one year field study[J]. Atmos Chem Phys, 2013, 13(1): 225-243. DOI:10.5194/acp-13-225-2013 |
| [23] |
HERNANDEZ M, PERRING A E, MCCABE K, et al. Chamber catalogues of optical and fluorescent signatures distinguish bioaerosol classes[J]. Atmos Meas Tech, 2016, 9(7): 3283-3292. DOI:10.5194/amt-9-3283-2016 |
| [24] |
GABEY A M, VAITILINGOM M, FRENEY E, et al. Observations of fluorescent and biological aerosol at a high-altitude site in central France[J]. Atmos Chem Phys, 2013, 13(15): 7415-7428. DOI:10.5194/acp-13-7415-2013 |
| [25] |
YUE S, REN L, SONG T, et al. Abundance and diurnal trends of fluorescent bioaerosols in the troposphere over Mt. Tai, China, in spring[J]. J Geophys Res Atmos, 2019, 124(7): 4158-4173. DOI:10.1029/2018jd029486 |
| [26] |
CRAWFORD I, LLOYD G, HERRMANN E, et al. Observations of fluorescent aerosol-cloud interactions in the free troposphere at the High-Altitude Research Station Jungfraujoch[J]. Atmos Chem Phys, 2016, 16(4): 2273-2284. DOI:10.5194/acp-16-2273-2016 |
| [27] |
ZIEMBA L D, BEYERSDORF A J, CHEN G, et al. Airborne observations of bioaerosol over the Southeast United States using a wideband integrated bioaerosol sensor[J]. J Geophys Res Atmos, 2016, 121(14): 8506-8524. DOI:10.1002/2015jd024669 |
| [28] |
PERRING A E, SCHWARZ J P, BAUMGARDNER D, et al. Airborne observations of regional variation in fluorescent aerosol across the United States[J]. J Geophys Res Atmos, 2015, 120(3): 1153-1170. DOI:10.1002/2014jd022495 |
| [29] |
FERGUSON R M W, NEATH C E E, NASIR Z A, et al. Size fractionation of bioaerosol emissions from green-waste composting[J]. Environ Int, 2021, 147: 106327. DOI:10.1016/j.envint.2020.106327 |
| [30] |
AHMAD NASIR Z, HAYES E, WILLIAMS B, et al. Scoping studies to establish the capability and utility of a real-time bioaerosol sensor to characterise emissions from environmental sources[J]. Sci Total Environ, 2019, 648: 25-32. DOI:10.1016/j.scitotenv.2018.08.120 |
| [31] |
TIAN J H, YAN C, AHMAD NASIR Z, et al. Real time detection and characterisation of bioaerosol emissions from wastewater treatment plants[J]. Sci Total Environ, 2020, 721: 137629. DOI:10.1016/j.scitotenv.2020.137629 |
| [32] |
张佩, 王光辉, 陈斌, 等. 大流量生物气溶胶本征荧光监测装置: CN216900222U[P]. 2022-07-05.
|
| [33] |
赵永凯, 熊超, 张佩, 等. 生物气溶胶实时监测装置: CN103091291B[P]. 2016-01-06.
|
| [34] |
刘毅, 刘强, 刘航, 等. 一种基于单波长多通道激发光源的生物气溶胶检测系统: CN213689388U[P]. 2021-07-13.
|
| [35] |
熊胜军, 袁丁, 夏征. 一种生物气溶胶监测设备及其监测方法: CN110873684A[P]. 2022-03-18.
|
| [36] |
兰江, 隋峰, 代胜英, 等. 一种便携式生物气溶胶监测装置: CN214794332U[P]. 2021-11-19.
|
| [37] |
张飞, 金尚忠, 赵天琦, 等. 一种便携式生物气溶胶检测装置及方法: CN112414982A[P]. 2021-02-26.
|
| [38] |
李抄, 陈盟, 陈锋, 等. 一种生物气溶胶浓度监测装置及监测方法: CN112285077A[P]. 2022-08-23.
|
| [39] |
赵可心, 王盼, 刘莹莹, 等. 自动监测生物气溶胶粒子浓度及组分[J]. 中国国境卫生检疫杂志, 2022, 45(2): 104-108. DOI:10.16408/j.1004-9770.2022.02.005 |
| [40] |
刘杨, 马雪征, 曹旸, 等. 应用生物气溶胶采集富集仪对医院空气中细菌组成的初步研究[J]. 中国国境卫生检疫杂志, 2017, 40(6): 390-393. DOI:10.16408/j.1004-9770.2017.06.002 |
| [41] |
刘杨, 马雪征, 张丽萍, 等. 生物气溶胶采集富集仪用于医院空气中甲型流感病毒的调查[J]. 中国国境卫生检疫杂志, 2018, 41(1): 5-7. DOI:10.16408/j.1004-9770.2018.01.002 |
| [42] |
潘一廷, 张国城, 霍胜伟, 等. 基于荧光法生物气溶胶监测仪计数效率评价及方法研究[J]. 计量学报, 2023, 44(2): 279-283. DOI:10.3969/j.issn.1000-1158.2023.02.18 |
| [43] |
田莹, 张国城, 吴丹, 等. 生物气溶胶监测仪生物计数评价装置的搭建和方法研究[J]. 计量学报, 2021, 42(12): 1687-1692. DOI:10.3969/j.issn.1000-1158.2021.12.21 |
| [44] |
国家市场监督管理总局. 荧光法生物气溶胶监测仪校准规范[S/OL]. (2022-10-08)[2022-10-12]. http://www.cma-cma.org.cn/weiyuanhui20/2022-10-08/1168.html.
|
| [45] |
BUTEAU S, SIMARD J R, LAHAIE P, et al. Bioaerosol standoff monitoring using intensified range-gated laser-induced fluorescence spectroscopy[M]//Advanced Environmental Monitoring. Dordrecht: Springer, 2008: 203-216.
|
| [46] |
MULLEN L J, CONTARINO V M. Hybrid LIDAR-radar: seeing through the scatter[J]. IEEE Microw Mag, 2000, 1(3): 42-48. DOI:10.1109/6668.871186 |
| [47] |
CANNALIATO V J, JEZEK B W, HYTTINEN L, et al. Short-range biological standoff detection system (SR-BSDS)[C]//AeroSense 2000. Proc SPIE 4036, chemical and biological sensing. Orlando, FL, USA, 2000: 219-223. DOI: 10.1117/12.394066.
|
| [48] |
KWON K H. Assessment of scan-only operations of lidar for the detection and discrimination of biological clouds[C]//Defense and Security Symposium. Proc SPIE 6218, chemical and biological sensing Ⅶ. Orlando (Kissimmee), Florida, USA, 2006: 130-139. DOI: 10.1117/12.665492.
|
| [49] |
BUTEAU S, SIMARD J, LAHAIE P, et al. Joint biological standoff detection system increment Ⅱ: field demonstration-SINBAHD performances[EB/OL]. (2007-10-01)[2022-10-12]. https://www.researchgate.net/publication/235059012.
|
| [50] |
SIMARD J R, ROY G, MATHIEU P, et al. Standoff sensing of bioaerosols using intensified range-gated spectral analysis of laser-induced fluorescence[J]. IEEE Trans Geosci Remote Sens, 2004, 42(4): 865-874. DOI:10.1109/TGRS.2003.823285 |
| [51] |
STEINVALL O, JONSSON P, KULLANDER F. Performance analysis for standoff biological warfare agent detection lidar[C]//Optics/Photonics in Security and Defence. Proc SPIE 6739, electro-optical remote sensing, detection, and photonic technologies and their applications. Florence, Italy, 2007: 280-293. DOI: 10.1117/12.737935.
|
| [52] |
RUSTAD G, FARSUND Ø. Standoff detection of biological aerosols by UV-laser induced fluorescence-results from Umeå trial 2006[R]. Kjeller: Norwegian Defence Research Establishment, 2008.
|
| [53] |
FARSUND Ø, RUSTAD G. Standoff detection of biological aerosols by means of UV-laser induced fluorescence: results from Umeå trial 2006[EB/OL]. (2008-12-01)[2022-10-12]. http://rapporter.ffi.no/rapporter/2008/01990.pdf.
|
| [54] |
FARSUND Ø, RUSTAD G, SKOGAN G. Standoff detection of biological agents using laser induced fluorescence-a comparison of 294 nm and 355 nm excitation wavelengths[J]. Biomed Opt Express, 2012, 3(11): 2964. DOI:10.1364/boe.3.002964 |
| [55] |
JONSSON P, ELMQVIST M, GUSTAFSSON O, et al. Evaluation of biological aerosol stand-off detection at a field trial[C]//SPIE Security + Defence. Proc SPIE 7484, optically based biological and chemical detection for defence Ⅴ, Berlin, Germany, 2009: 135-148. DOI: 10.1117/12.830401.
|
| [56] |
BAXTER K, CASTLE M, BARRINGTON S, et al. UK small scale UVLIF lidar for standoff BW detection[C]//Optics/Photonics in Security and Defence. Proc SPIE 6739, electro-optical remote sensing, detection, and photonic technologies and their applications. Florence, Italy, 2007: 247-256. DOI: 10.1117/12.737730.
|
| [57] |
GRITSUTA A N, KLIMKIN A V, KOKHANENKO G P, et al. Mobile multi-wavelength aerosol lidar[J]. Int J Remote Sens, 2018, 39(24): 9400-9414. DOI:10.1080/01431161.2018.1524609 |
| [58] |
SAITO Y, ICHIHARA K, MORISHITA K, et al. Remote detection of the fluorescence spectrum of natural pollens floating in the atmosphere using a laser-induced-fluorescence spectrum (LIFS) lidar[J]. Remote Sens, 2018, 10(10): 1533. DOI:10.3390/rs10101533 |
| [59] |
SHOSHANIM O, BARATZ A. Daytime measurements of bioaerosol simulants using a hyperspectral laser-induced fluorescence LIDAR for biosphere research[J]. J Environ Chem Eng, 2020, 8(5): 104392. DOI:10.1016/j.jece.2020.104392 |
| [60] |
BABICHENKO S, JL G, BENTAHIR M, et al. Non-contact, real-time laser-induced fluorescence detection and monitoring of microbial contaminants on solid surfaces before, during and after decontamination[J]. J Biosens Bioelectron, 2018, 9(2): 255. DOI:10.4172/2155-6210.1000255 |
| [61] |
GABBARINI V, ROSSI R, CIPARISSE J F, et al. Laser-induced fluorescence (LIF) as a smart method for fast environmental virological analyses: validation on picornaviruses[J]. Sci Rep, 2019, 9: 12598. DOI:10.1038/s41598-019-49005-3 |
| [62] |
ZHANG M, SU H, LI G, et al. High-resolution fluorescence spectra of airborne biogenic secondary organic aerosols: comparisons to primary biological aerosol particles and implications for single-particle measurements[J]. Environ Sci Technol, 2021, 55(24): 16747-16756. DOI:10.1021/acs.est.1c02536 |
| [63] |
O'CONNOR D J, IACOPINO D, HEALY D A, et al. The intrinsic fluorescence spectra of selected pollen and fungal spores[J]. Atmos Environ, 2011, 45(35): 6451-6458. DOI:10.1016/j.atmosenv.2011.07.044 |
| [64] |
PÖHLKER C, HUFFMAN J A, PÖSCHL U. Autofluorescence of atmospheric bioaerosols-fluorescent biomolecules and potential interferences[J]. Atmos Meas Tech, 2012, 5(1): 37-71. DOI:10.5194/amt-5-37-2012 |
| [65] |
DARTNELL L R, ROBERTS T A, MOORE G, et al. Fluorescence characterization of clinically-important bacteria[J]. PLoS One, 2013, 8(9): e75270. DOI:10.1371/journal.pone.0075270 |
| [66] |
FELLNER L, KRAUS M, GEBERT F, et al. Multispectral LIF-based standoff detection system for the classification of CBE hazards by spectral and temporal features[J]. Sensors (Basel), 2020, 20(9): 2524. DOI:10.3390/s20092524 |
| [67] |
MA Y, WANG Z B, YANG D S, et al. On-line measurement of fluorescent aerosols near an industrial zone in the Yangtze River Delta region using a wideband integrated bioaerosol spectrometer[J]. Sci Total Environ, 2019, 656: 447-457. DOI:10.1016/j.scitotenv.2018.11.370 |
 2023, Vol. 44
2023, Vol. 44


