胰岛素是机体降低血糖的重要激素,胰腺β细胞在内质网中可形成前胰岛素原,其信号肽被信号肽酶剪切形成另一个前体胰岛素原,经过分子伴侣及相关蛋白处理后形成具有空间结构的胰岛素原,后者被运出内质网到达高尔基体发挥作用[1-2]。当胰岛素原在内质网中发生错误折叠不能运出时,内质网的稳态被打破,错误折叠的蛋白质在其中积累可致内质网应激(endoplasmic reticulum stress,ERS)。外被蛋白Ⅱ(coat protein Ⅱ,COP-Ⅱ)可介导非选择性运输,参与内质网到高尔基体的运输[3]。分泌及Ras相关GTP酶1A(secretion associated Ras related GTPase 1A,sar-1A)是具有召集鸟苷三磷酸酶的蛋白,主要在细胞质中表达,与转运蛋白Sec23、Sec24形成二聚体后参与COP-Ⅱ的形成,当sar-1A发生化学突变后会导致COP-Ⅱ功能障碍[4]。有研究表明,当COP-Ⅱ发生功能障碍时胰岛素原从内质网输出减慢,胰岛素原的表达减少,可对内质网稳态产生影响[5]。
中医将糖尿病归属为消渴范畴,认为其发病机制与饮食不节、中焦失运或先天不足、后天失养有关。黄连化浊胶囊又名黄金胶囊,是根据浊毒理论所研制的中药复方制剂,由温胆汤转化而来,具有清热解毒、运脾化浊等功效,其可以通过降低胰岛素抵抗控制血糖[6]。本研究探讨了黄连化浊胶囊对sar-1A敲除诱导COP-Ⅱ功能障碍胰岛β细胞ERS的干预效果,以期为相关研究提供参考。
1 材料和方法 1.1 实验动物及细胞30只4周龄、体重为200~350 g的SPF级雄性SD大鼠购自济南朋悦实验动物繁育有限公司[动物生产许可证号:SCXK(鲁)20190003]。饲养条件:在相对湿度为55%、常温、模拟昼夜交替环境下,无菌饮食2周。按照《实验动物管理条例》规定进行实验,动物实验经我院伦理委员会审批,批准号为[2021]动伦审字(S742)。小鼠胰岛β细胞Min6购自通派(上海)生物科技有限公司。
1.2 药物、主要试剂与仪器黄连化浊胶囊(黄连9 g,鸡内金12 g,法半夏9 g,竹茹15 g,枳实9 g,陈皮9 g,茯苓15 g,炙甘草9 g)为甘肃中医药大学附属医院院内制剂(批准文号:甘药制字Z120110),批号171103。马来酸罗格列酮片为葛兰素史克(天津)有限公司产品(批准文号:国药准字H20020475)。
小鼠sar-1A siRNA(货号L-042764-00-0005,中国Dharmacon公司),FBS、青-链霉素、PBS、0.25%胰蛋白酶溶液(货号分别为SH30109.03、SV30010、SH30256.01、SH30042.01,美国HyClone公司),脂质体LipofectamineTM 2000(货号13778-075,中国ThermoFisher Scientific公司),Opti-MEM培养基[货号U21-08100F,攸碧艾(上海)贸易有限公司],sar-1A抗体[货号15350-1-AP,安诺伦(北京)生物科技有限公司],C/EBP同源蛋白(C/EBP homologous protein,CHOP)抗体、β-肌动蛋白抗体(货号分别为GTX112827、GTX629630,中国GeneTex公司),胰岛素原单克隆抗体(货号HZK-11647,上海沪峥生物科技有限公司),兔抗鼠真核翻译起始因子2α(eukaryotic translation initiation factor 2α,eIF2α)单克隆抗体(货号XG-K1047,上海西格生物科技有限公司),兔抗鼠X盒结合蛋白1(X-box binding protein 1,XBP1)单克隆抗体(货号YB00708,上海钰博生物科技有限公司),肌醇需求酶1(inosital-requiring enzyme 1,IRE1)单克隆抗体(货号IMX-3612,武汉艾美捷科技有限公司),兔抗鼠X盒(X-box)蛋白单克隆抗体(货号9016049,深圳子科生物科技有限公司),Prime ScriptRT Master Mix试剂盒(货号RR036A,日本TaKaRa公司),磷酸化真核翻译起始因子2α(phosphorylated eukaryotic translation initiation factor 2α,p-eIF2α)抗体(货号HK10458,上海户实医药科技有限公司),TRIzol提取试剂盒(货号YIJI10254655,上海一基实业有限公司),PCR SYBR Preme Ex Taq Ⅱ(2×)试剂盒(货号RR820A,武汉科昊佳生物科技有限公司),sec31抗体(货号ybs-4453R,上海研谨生物科技有限公司),荧光淬灭封片剂(货号LM-1058D,上海联迈生物工程有限公司),HRP标记的二抗(货号H6161S/H6161,苏州优逸兰迪生物科技有限公司),0.2% Triton X-100(货号JK-E1694,上海晶抗生物有限公司)。
DA7600实时荧光定量PCR仪(中山大学达安基因股份有限公司),伯乐ChemiDoc MP化学发光凝胶成像系统(中国Bio-Rad公司),Qilinbeier TS-1000型摇床(海门市其林贝尔仪器制造有限公司),IX71型倒置显微镜(上海赖氏电子科技有限公司),TDZ4-WS型低速离心机(上海卢湘仪离心机仪器有限公司),电泳仪(北京六一仪器厂),Smartproof 5型激光共聚焦显微镜(德国蔡司公司),蔡司Zen 4.000软件(中国Carl Zeiss显微镜有限责任公司),Image-LabTM图像分析系统(哈尔滨德远科技开发有限公司)。
1.3 Min6细胞培养及sar-1A siRNA转染Min6细胞用含有10% FBS、1% 青霉素、1% 链霉素的Opti-MEM培养基,于5% CO2、37 ℃、饱和湿度的细胞培养箱中培养,取对数生长期细胞进行后续实验。将Min6细胞分为空白组、阴性对照(negative control,NC)组及sar-1A siRNA组。转染方法:将Min6细胞接种到6孔板中,利用脂质体LipofectamineTM 2000进行转染,将sar-1A siRNA、sar-1A -NC-siRNA分别转染50% 融合的Min6细胞,转染48 h后收获细胞进行后续实验。空白组细胞不做任何干预处理。
1.4 qPCR检测Min6细胞中sar-1A mRNA表达采用TRIzol提取试剂盒提取细胞中总RNA。相关基因引物均由济南海智科技发展有限公司设计并合成。参考5×Prime ScriptRT Master Mix试剂盒说明书将RNA反转录为cDNA。PCR扩增参考SYBR Preme Ex Taq Ⅱ(2×)试剂盒说明书进行。引物序列如下:sar-1A正向引物为5' -CG-CGAATTCAATGTCTTTCATATTTGAGTGG-3',反向引物为5' -GGATCCTCAGTCAATATACTG-GGAGAGTTAGC-3';β-肌动蛋白正向引物为5' -CCGCCAGAAGATGAGTGAAAT-3',反向引物为5' -ACGCTTCACGAATTTGGGTHTC-3'。基因相对转录水平采用2-ΔΔCt法计算。
1.5 大鼠含药血清的制备30只大鼠按照随机数字表法分为空白组、黄连化浊胶囊组及罗格列酮组,每组10只。空白组不做任何干预处理。黄连化浊胶囊组灌胃2.025 g/kg的黄连化浊胶囊,罗格列酮组灌胃罗格列酮0.5 mg/kg,每日2次,连续3 d。末次灌胃结束后,采用1% 戊巴比妥钠(40 mg/kg)麻醉,取大鼠腹主动脉血2 mL,静置1 h,3 000×g离心10 min,取空白血清和含药血清于-80 ℃保存,使用前以0.22 μm微孔滤膜过滤除菌。
1.6 细胞分组及药物处理将转染sar-1A siRNA的Min6细胞分为空白血清组(用含10%大鼠空白血清的培养基培养)、5%黄连化浊胶囊组(用含5% 黄连化浊胶囊含药血清的培养基培养)、10%黄连化浊胶囊组(用含10%黄连化浊胶囊含药血清的培养基培养)、20%黄连化浊胶囊组(用含20%黄连化浊胶囊含药血清的培养基培养)及罗格列酮组(用含10%罗格列酮含药血清的培养基培养),24 h后收集细胞进行实验。
1.7 免疫荧光法检测sar-1A敲减对Min6细胞sec31蛋白表达的影响Min6细胞在37 ℃、5% CO2培养箱孵育48 h后,弃去培养基,PBS洗涤,用4%多聚甲醛溶液固定5 min,PBS洗涤3次,室温封闭1 h。按照说明书比例加入sec31抗体及0.2% Triton X-100,室温孵育1 h,DAPI染核5 min,PBS洗涤后加入适量抗荧光淬灭封片剂,在激光共聚焦显微镜下观察拍照,并用蔡司Zen 4.000软件分析各组sec31蛋白表达的平均荧光强度。
1.8 蛋白质印迹法检测sar-1A敲减对Min6细胞胰岛素原、p-eIF2α、CHOP、XBP1、IRE1、X-box蛋白表达的影响用PBS(pH 7.0)清洗细胞,添加蛋白质裂解液裂解细胞10 min,将1.5 mL样本收集至离心管中,14 170×g离心20 min,静置60 s后提取上清液,每个样本取上清液25 μL检测蛋白浓度。取50 μg蛋白进行SDS-PAGE。后继续转膜,PVDF膜从转膜槽中取出,用TBST漂洗5 min,加入稀释后的胰岛素原抗体(稀释比例为1∶150)、p-eIF2α抗体(稀释比例为1∶250)、CHOP抗体(稀释比例为1∶200)、XBP1抗体(稀释比例为1∶500)、IRE1抗体(稀释比例为1∶150)、X-box抗体(稀释比例为1∶150)及内参GAPDH抗体(稀释比例为1∶500)孵育,加入HRP标记的二抗(稀释比例为1∶1 000)孵育。避光环境下加显影液,反应60 s后,用Image-Lab图像分析系统进行成像和分析。
1.9 统计学处理应用GraphPad Prism 8软件分析,所有数据符合正态分布,以x±s表示,多组间比较采用单因素方差分析,多重比较采用最小显著性差异法。检验水准(α)为0.05。
2 结果 2.1 sar-1A siRNA转染的Min6细胞中sar-1A mRNA的表达空白组、NC组及sar-1A siRNA组Min6细胞中sar-1A mRNA表达量分别为1.00±0.00、0.97±0.04、0.42±0.07,3组间差异有统计学意义(P<0.01)。与NC组相比,sar-1A siRNA组Min6细胞中sar-1A mRNA表达降低(P<0.01)。
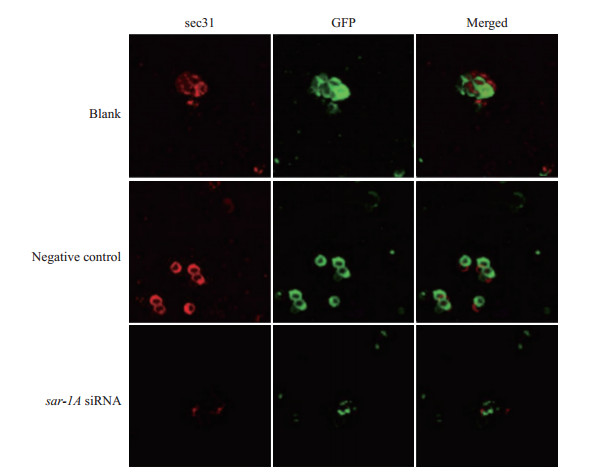
2.2 sar-1A敲减对Min6细胞sec31蛋白表达的影响空白组、NC组及sar-1A siRNA组Min6细胞中sec31蛋白的平均荧光强度分别为1.30±0.22、1.27±0.26及0.79±0.16,3组间差异有统计学意义(P<0.05)。与NC组相比,sar-1A siRNA组Min6细胞中sec31蛋白平均荧光强度降低(P<0.05)。见图 1。
|
图 1 免疫荧光法检测各组Min6细胞中sec31蛋白的表达(200×) Fig 1 Expression of sec31 in Min6 cells in each group detected by immunofluorescence (200×) GFP: Green fluorescence protein; sar-1A: Secretion associated Ras related GTPase 1A; siRNA: Small interfering RNA. |
2.3 sar-1A敲减对Min6细胞中胰岛素原、p-eIF2α、CHOP、XBP1、IRE1、X-box蛋白表达的影响
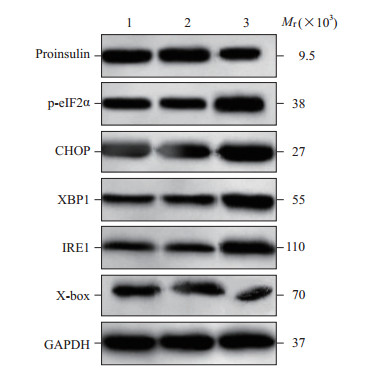
空白组与NC组Min6细胞中胰岛素原、p-eIF2α、CHOP、XBP1、IRE1、X-box蛋白表达的差异均无统计学意义(P均>0.05);与NC组相比,sar-1A siRNA组胰岛素原和X-box蛋白的表达降低(P均<0.05),p-eIF2α、CHOP、XBP1、IRE1蛋白的表达升高(P均<0.05)。见表 1、图 2。
|
|
表 1 3组Min6细胞中胰岛素原、p-eIF2α、CHOP、XBP1、IRE1、X-box蛋白的表达水平 Tab 1 Expression levels of proinsulin, p-eIF2α, CHOP, XBP1, IRE1 and X-box in Min6 cells of 3 groups |
|
图 2 蛋白质印迹法检测3组Min6细胞中胰岛素原、p-eIF2α、CHOP、XBP1、IRE1、X-box蛋白的表达 Fig 2 Expression of proinsulin, p-eIF2α, CHOP, XBP1, IRE1 and X-box in Min6 cells of 3 groups detected by Western blotting 1: Blank group; 2: Negative control group; 3: sar-1A siRNA group. p-eIF2α: Phosphorylated eukaryotic translation initiation factor 2α; CHOP: C/EBP homologous protein; IRE1: Inosital-requiring enzyme 1; XBP1: X-box binding protein 1; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; sar-1A: Secretion associated Ras related GTPase 1A; siRNA: Small interfering RNA. |
2.4 黄连化浊胶囊对Min6细胞中sar-1A mRNA表达的影响
空白血清组、5%黄连化浊胶囊组、10% 黄连化浊胶囊组、20%黄连化浊胶囊组及罗格列酮组Min6细胞中sar-1A mRNA表达水平分别为0.46±0.05、0.63±0.07、0.80±0.10、0.96±0.11、0.82±0.09,组间差异有统计学意义(P<0.001)。与空白血清组相比,其他4组sar-1A mRNA的表达均升高(P均<0.05);5%、10%、20% 黄连化浊胶囊组的sar-1A mRNA表达水平随黄连化浊胶囊浓度升高而逐渐增加,各组间差异均有统计学意义(P均<0.05);10% 黄连化浊胶囊组与罗格列酮组的sar-1A miRNA表达水平差异无统计学意义(P>0.05),5%、20%黄连化浊胶囊组与罗格列酮组的sar-1A miRNA表达水平差异均有统计学意义(P均<0.05)。
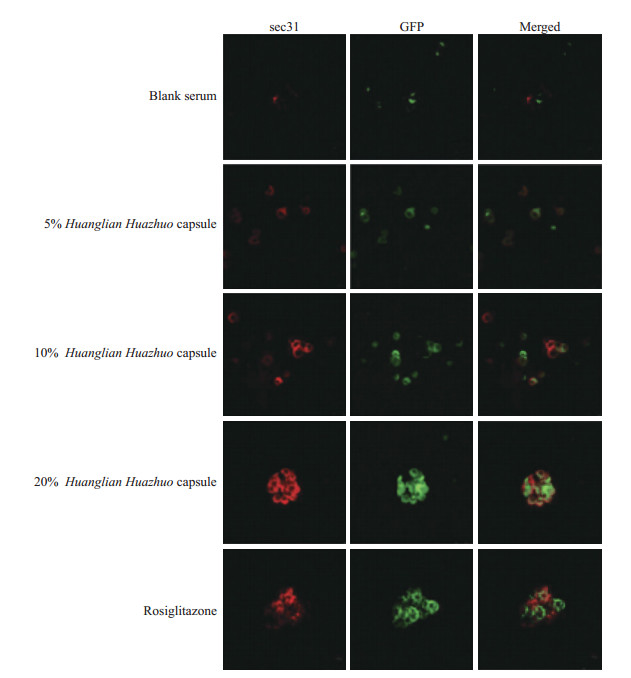
2.5 黄连化浊胶囊对Min6细胞中sec31蛋白表达的影响结果见图 3。空白血清组、5% 黄连化浊胶囊组、10% 黄连化浊胶囊组、20% 黄连化浊胶囊组及罗格列酮组Min6细胞中sec31蛋白的平均荧光强度分别为37.48±4.63、39.02±5.52、56.11±7.20、62.24±8.11和61.54±7.96,组间差异有统计学意义(P<0.001)。空白血清组及5% 黄连化浊胶囊组的Min6细胞中sec31蛋白表达差异无统计学意义(P>0.05);与5% 黄连化浊胶囊组相比,10%、20%黄连化浊胶囊组及罗格列酮组的Min6细胞中sec31蛋白表达均增加,差异有统计学意义(P均<0.05);20%黄连化浊胶囊组与罗格列酮组相比差异无统计学意义(P>0.05)。
|
图 3 免疫荧光法检测黄连化浊胶囊对Min6细胞中sec31蛋白表达的影响(200×) Fig 3 Effect of Huanglian Huazhuo capsule on sec31 expression in Min6 cells detected by immunofluorescence (200×) GFP: Green fluorescence protein. |
2.6 黄连化浊胶囊对Min6细胞中胰岛素原、p-eIF2α、CHOP、XBP1、IRE1、X-box蛋白表达的影响
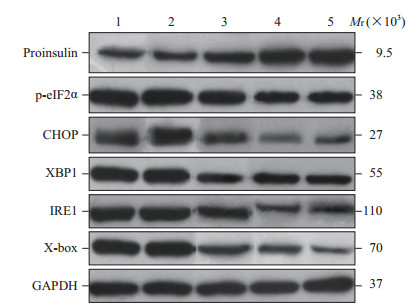
空白血清组与5%黄连化浊胶囊组Min6细胞中胰岛素原、p-eIF2α、CHOP、XBP1、IRE1、X-box蛋白表达的差异均无统计学意义(P均>0.05);与5% 黄连化浊胶囊组相比,10%、20% 黄连化浊胶囊组及罗格列酮组的Min6细胞中胰岛素原的表达均增加,p-eIF2α、CHOP、XBP1、IRE1、X-box蛋白的表达均降低(P均<0.05);20% 黄连化浊胶囊组与罗格列酮组上述蛋白的表达差异无统计学意义(P均>0.05)。见表 2、图 4。
|
|
表 2 5组Min6细胞中胰岛素原、p-eIF2α、CHOP、XBP1、IRE1、X-box蛋白的表达水平 Tab 2 Expression levels of proinsulin, p-eIF2α, CHOP, XBP1, IRE1 and X-box in Min6 cells of 5 groups |
|
图 4 蛋白质印迹法检测5组Min6细胞中胰岛素原、p-eIF2α、CHOP、XBP1、IRE1、X-box蛋白的表达 Fig 4 Expression of proinsulin, p-eIF2α, CHOP, XBP1, IRE1 and X-box in Min6 cells of 5 groups detected by Western blotting 1: Blank serum group; 2: 5% Huanglian Huazhuo capsule group; 3: 10% Huanglian Huazhuo capsule group; 4: 20% Huanglian Huazhuo capsule group; 5: Rosiglitazone group. p-eIF2α: Phosphorylated eukaryotic translation initiation factor 2α; CHOP: C/EBP homologous protein; XBP1: X-box binding protein 1; IRE1: Inosital-requiring enzyme 1; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
3 讨论
内质网是哺乳动物最重要的细胞器,发挥着蛋白质合成、转运、折叠等作用,参与细胞质合成及钙离子的贮存。内质网具有正常的生理结构及功能,当未折叠或错误折叠的蛋白质数量增加时会破坏内质网稳态,导致氧化应激反应,称为ERS。胰岛β细胞是具有分泌胰岛素功能的细胞,正常状态下含有大量成熟的高尔基体,可经过一系列程序形成胰岛素原并发挥生理作用,但是在病理状态下胰岛素会大量进入内质网导致内质网钙耗竭,引起ERS。研究证实内质网中错误折叠的蛋白质激活在糖尿病的发生、发展中具有重要作用,认为缓解ERS对于治疗糖尿病具有重要意义[7]。
本研究结果显示,敲减sar-1A可增加胰岛β细胞中COP-Ⅱ功能障碍,导致内质网输出损伤而降低胰岛素原表达,升高p-eIF2α、CHOP、XBP1、IRE1、X-box的表达,导致ERS的发生。胰岛素原运出内质网需要借助COP-Ⅱ作为载体到达高尔基复合体而发挥作用。研究表明,在胰岛β细胞中改变sar-1A表达可导致胰岛素原积累在内质网,使胰岛素合成受限,促进糖尿病的发生、发展[8]。sar-1A蛋白可募集家族成员形成异二聚体,是COP-Ⅱ主要组成部分,sar-1A在COP-Ⅱ可发挥促进囊泡分裂的作用,有利于胰岛素原的运输,降低胰岛素抵抗。为进一步证实COP-Ⅱ介导的内质网在胰岛素折叠中的作用,研究者在胰岛β细胞中转染sar-1A siRNA,降低了COP-Ⅱ相关蛋白sec31,增加胰岛素原错误重叠,导致内质网损伤并阻碍胰岛素原成熟[8]。ERS的发生过程主要依赖于内质网膜上的跨膜蛋白。IRE1是具有激酶活性及RNA酶活性的跨膜蛋白,在ERS发生过程中能够与Bip分离,并加快使其中的26个核苷酸从XBP1基因释放,最终经过转录因子到达细胞核,加快脂质代谢及炎症相关基因的表达及转录[9-10]。研究表明,当胰岛β细胞应激反应增加时可导致蛋白激酶R样内质网激酶下游因子eIF2α磷酸化,进而加快胰岛β细胞凋亡[11]。
本实验结果表明,对敲减sar-1A后的胰岛β细胞采用黄连化浊胶囊含药血清共培养,可改善其COP-Ⅱ功能障碍,并通过降低p-eIF2α、CHOP、XBP1、IRE1、X-box表达及加快胰岛素原表达,改善胰岛素抵抗。
糖尿病的病因是外感六淫,导致五脏六腑功能失调,气血运化失常,气血停滞而脉络受阻,瘀血内生而化为血浊[12]。血浊累积于肝脏,诱导肝脏ERS发生,p-eIF2α、CHOP、XBP1、IRE1、X-box表达升高,胰岛素抵抗产生,最终导致糖尿病发生、发展。
黄连化浊胶囊具有抗糖尿病的作用,从糖尿病浊毒病理机制出发,黄连性寒、味苦,归心、脾、胃、胆及大肠经,具有泻毒、清燥、除湿及止消渴的功效[13];鸡内金味甘、性平,归脾、小肠、胃及膀胱经,具有健脾、化滞及缩小便之功。两者均为君药,达到标本兼治及化浊、解毒的功效[14]。法半夏性温,味辛,归胃及脾脏,具有健脾除燥、温胃降逆的功效;竹茹微寒性,味甘,归胃经、胆经、脾经,具有开胃、清肺及除燥的作用;陈皮味辛,性温,归肺、脾经,以辛散之,以苦燥之,消痰导滞;枳实味苦,性寒,归胃、脾经,具有破气、化痰、消痞的作用。四者均为臣药,共奏健脾、化痰等功效[15]。茯苓味甘、淡,性平,无毒,归心、脾、肺、肾经,具有益脾除湿、安神生津的作用;炙甘草味甘气温,调和诸药,为使药。全方共奏清热解毒、运脾化浊之效。黄连与鸡内金配伍,黄连善清中焦湿热,善治胃火炽盛,清解浊毒之邪,对于消渴病之多食易饥尤其以脾虚痰湿型消渴病尤为适用。在糖尿病大鼠中,黄连化浊胶囊可改善ERS紊乱,减轻肝脏损伤,这与其降低eIF2α及葡萄糖调节蛋白78表达相关[16]。本研究结果表明,与5%黄连化浊胶囊组相比,10%黄连化浊胶囊组的抗ERS损伤作用显著;与10%黄连化浊胶囊组相比,20%黄连化浊胶囊组改善sar-1A缺失而降低COP-Ⅱ损伤的作用更加显著,说明随着黄连化浊胶囊药物用量的升高其抗ERS作用增强。
综上所述,sar-1A敲减后胰岛β细胞存在COP-Ⅱ功能障碍,黄连化浊胶囊可降低sar-1A敲减后胰岛β细胞的ERS水平,有望为相关疾病的治疗提供新的干预靶点。
| [1] |
BADMAEVA I N, ASTAFIEVA L I, KALININ P L, et al. [Central diabetes insipidus after resection of sellar-suprasellar tumors: prevalence and predictors of manifestation][J]. Zh Vopr Neirokhir Im N N Burdenko, 2021, 85(6): 111. DOI:10.17116/neiro202185051111 |
| [2] |
LABANDEIRA C M, FRAGA-BAU A, ARIAS RON D, et al. Diabetes, insulin and new therapeutic strategies for Parkinson's disease: focus on glucagon-like peptide-1 receptor agonists[J]. Front Neuroendocrinol, 2021, 62: 100914. DOI:10.1016/j.yfrne.2021.100914 |
| [3] |
LEGEAY S, FAUTRAT P, NORMAN J B, et al. Selective deficiency in endothelial PTP1B protects from diabetes and endoplasmic reticulum stress-associated endothelial dysfunction via preventing endothelial cell apoptosis[J]. Biomedecine Pharmacother, 2020, 127: 110200. DOI:10.1016/j.biopha.2020.110200 |
| [4] |
URAI Y, YAMAWAKI M, WATANABE N, et al. Pull down assay for GTP-bound form of Sar1a reveals its activation during morphological differentiation[J]. Biochem Biophys Res Commun, 2018, 503(3): 2047-2053. DOI:10.1016/j.bbrc.2018.07.157 |
| [5] |
克迪热亚·卡地尔, 祖力皮亚·阿布拉, 马红梅, 等. 基于PERK-ATF4-CHOP通路探讨马里苷对高糖高脂诱导胰岛β细胞损伤的影响[J]. 中南药学, 2022, 20(6): 1316-1321. DOI:10.7539/j.issn.1672-2981.2022.06.016 |
| [6] |
张瀚文. 黄金胶囊改善糖尿病大鼠胰岛素抵抗与PI-3K、GLUT-4蛋白表达的研究[D]. 兰州: 甘肃中医药大学, 2015.
|
| [7] |
张路煜, 刘玉晖, 游宇, 等. 葛根对2型糖尿病大鼠胰腺内质网应激相关蛋白GRP78、ATF6表达的影响[J]. 中国实验方剂学杂志, 2020, 26(20): 82-87. DOI:10.13422/j.cnki.syfjx.20202036 |
| [8] |
朱瑞敏. 内质网蛋白前向输出异常对胰岛素生物合成的影响[D]. 天津: 天津医科大学, 2019.
|
| [9] |
KOROVESIS D, RUFO N, DERUA R, et al. Kinase photoaffinity labeling reveals low selectivity profile of the IRE1 targeting imidazopyrazine-based KIRA6 inhibitor[J]. ACS Chem Biol, 2020, 15(12): 3106-3111. DOI:10.1021/acschembio.0c00802 |
| [10] |
王岩飞. 基于ERS介导的凋亡信号通路探讨中药治疗糖尿病心肌病的机制[D]. 北京: 北京中医药大学, 2016.
|
| [11] |
赵斌. JNK通过抑制胰岛素信号通路介导了高糖和软脂酸诱导的胰岛β细胞凋亡[D]. 上海: 上海交通大学, 2008.
|
| [12] |
康学东, 张瀚文, 余臣祖. 黄金胶囊对2型糖尿病伴胰岛素抵抗大鼠骨骼肌细胞PI-3K、GLUT4蛋白表达的影响[J]. 新中医, 2015, 47(12): 227-229. DOI:10.13457/j.cnki.jncm.2015.12.102 |
| [13] |
王苑铭, 朱瑾. 基于PI3K/AKT通路研究黄金胶囊干预2型糖尿病大鼠胰岛素抵抗的初步机制[J]. 上海中医药杂志, 2022, 56(4): 92-96. DOI:10.16305/j.1007-1334.2022.2108033 |
| [14] |
余臣祖, 安小平, 康学东, 等. 黄金胶囊对2型糖尿病大鼠胰岛素抵抗的影响[J]. 中国实验方剂学杂志, 2011, 17(3): 199-201. DOI:10.13422/j.cnki.syfjx.2011.03.065 |
| [15] |
康学东, 张瀚文, 余臣祖. 黄金胶囊对糖尿病大鼠血糖和肝细胞PI-3K、GLUT-4蛋白表达的影响[J]. 中医研究, 2016, 29(1): 50-54. |
| [16] |
余臣祖, 秦双红, 高攀, 等. 黄金胶囊对2型糖尿病大鼠肝组织eIF2α及GRP78表达的影响[J]. 中国中医药信息杂志, 2020, 27(2): 28-32. DOI:10.3969/j.issn.1005-5304.201906074 |
 2023, Vol. 44
2023, Vol. 44


