尿潴留是脊髓损伤患者的临床常见并发症,发生于骶段的脊髓损伤可引发患者骶髓排尿中枢受损或其周围神经病变,导致逼尿肌兴奋性降低,尿液排出困难,膀胱容量增大,引起尿潴留,并会继发膀胱组织病理损伤及反复尿路感染,甚至引发肾衰竭,是患者死亡的主要原因之一[1]。脊髓损伤后产生的炎症是引发膀胱功能障碍及尿潴留的重要因素,抑制炎症可减轻脊髓损伤导致的膀胱组织继发性损伤、改善尿动力学参数及尿潴留症状[2]。电针是临床常用的治疗脊髓损伤后尿潴留的方法,电针关元穴能降低逼尿肌最小收缩张力、提高自发性收缩频率,改善膀胱功能,减轻脊髓损伤引发的神经源性尿潴留症状,但其作用机制目前还未有明确阐述[3]。酪氨酸激酶受体c-kit/ERK通路在脊髓损伤及膀胱功能障碍等疾病的病理过程中起调控作用,上调c-kit表达可改善脑脊髓炎引发的尿潴留症状、促进ERK磷酸化、修复受损神经及膀胱功能、减轻神经源性膀胱功能障碍,因而c-kit/ERK通路可作为神经源性尿潴留的重要治疗靶点[4-5]。miRNA-199a是c-kit的调节因子[6],且miRNA-199a-3p可促进脊髓损伤大鼠神经修复、改善其运动功能[7]。有研究表明电针可上调c-kit表达[8],推测经miRNA-199a-3p调控c-kit/ERK通路可能是电针关元穴治疗神经源性尿潴留的作用机制,本研究构建了神经源性尿潴留大鼠模型对此进行探讨。
1 材料和方法 1.1 动物SD雄性大鼠购自上海砥石生物科技有限公司[动物生产许可证号:SCXK(沪)2021-0003],SPF级,体重210~230 g。在天津中医药大学动物房中分笼适应饲养[动物使用许可证号:SYXK(津)2020-0005],6~8只/笼,温度为22.5~25.5 ℃,相对湿度为55%~65%,光照设为明暗各12 h交替循环,1周后用于实验。本实验经天津中医药大学第一附属医院动物实验伦理委员会审批(TCM-20201108)。
1.2 主要试剂及仪器大鼠IL-18 ELISA检测试剂盒、大鼠环氧化酶2(cyclooxygenase 2,COX-2)ELISA检测试剂盒、H-E染色试剂盒、BCA蛋白浓度测定试剂盒、高效RIPA裂解液均购自北京索莱宝科技有限公司;诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)试剂盒购自南京建成生物工程研究所有限公司;miRNA-199a-3p抑制剂、miRNA-199a-3p抑制剂阴性对照购自上海吉玛制药技术有限公司;总RNA提取试剂,miRNA-199a-3p、U6、c-kit及β-肌动蛋白(β-actin)引物,一步法反转录qPCR检测试剂盒均购自生工生物工程(上海)股份有限公司;兔抗磷酸化(phosphorylated,p)-ERK1/2抗体、羊抗兔二抗、兔抗ERK1/2抗体、兔抗c-kit抗体、兔抗GAPDH抗体均购自英国Abcam公司。
SDZ-Ⅴ型电子针疗仪(苏州医疗用品厂有限公司);微量注射泵[度科工业科技(上海)有限公司];MP150-WSW型多通道生理信号记录仪(美国BIOPAC公司);qPCR仪(德国Eppendorf公司);拉力传感器(中国航天医学工程研究所);Synergy H4型全功能酶标仪(美国BioTek公司);SM2010R型切片机、EG1150型石蜡包埋机、TP1020型组织脱水机(德国Leica公司);CKX41型显微镜(日本Olympus公司);蛋白电泳仪、ChemiDoc XRS化学发光成像系统、转膜仪(美国Bio-Rad公司)。
1.3 神经源性尿潴留大鼠模型的制备与分组采用改良脊髓横断法[9]制备大鼠模型。大鼠禁食12 h后腹腔注射2%戊巴比妥钠(45 mg/kg)麻醉,待大鼠进入深度麻醉状态后将其俯卧固定在操作台上,背部脱毛、备皮、消毒;纵向切开L2~L3椎间皮肤,找到L2~L3棘突及椎板,去除椎板,并同时切断棘间韧带与脊髓,然后止血、消毒、缝合。于1 d后观察,若大鼠前肢行走正常,后肢处于拖动状态,耻骨联合上缘处膀胱明显胀大,则表示造模成功。将成功造模的60只大鼠按随机数字表法平均分为5组:模型组、电针组、miRNA-199a-3p抑制剂组、miRNA-199a-3p抑制剂阴性对照组、电针+miRNA-199a-3p抑制剂组。另选取SD大鼠12只作为假手术组,只暴露L2~L3棘突及椎板,不做其他处理。
miRNA-199a-3p抑制剂组和电针+miRNA-199a-3p抑制剂组大鼠分别尾静脉注射miRNA-199a-3p抑制剂,miRNA-199a-3p抑制剂阴性对照组大鼠尾静脉注射miRNA-199a-3p抑制剂阴性对照,剂量参照试剂说明书,每周2次;参照文献[10]的方法,电针组、电针+miRNA-199a-3p抑制剂组大鼠定位关元穴,以电子针疗仪进行治疗(1.0 mA,2 Hz),每天1次,同时每周尾静脉注射2次等剂量生理盐水;假手术组和模型组大鼠每周尾静脉注射2次等剂量生理盐水。所有大鼠均治疗3周,同时以Cred’s手法按压大鼠膀胱辅助其排尿、排便,每天2~3次。
1.4 大鼠尿动力学检测以1.3节方法麻醉大鼠,辅助其排空膀胱后将F3导管通过尿道插入膀胱,以微量注射泵灌注37 ℃生理盐水,同时连接多通道生理信号记录仪记录膀胱最大容量、膀胱基础压、漏尿点压力。
1.5 大鼠逼尿肌兴奋性检测及标本收集尿动力学检测结束后,采集大鼠颈动脉血液并静置,离心后吸出上清,移入干净离心管中,-80 ℃保存备用;排空膀胱,断头处死大鼠后解剖取出膀胱,浸没入Kreb营养液中,分离出膀胱侧壁纵行肌条(6 mm×2 mm×2 mm);以丝线扎住肌条两端,一端固定在器官槽底部,另一端连接拉力传感器的感应头,拉力传感器与多通道生理信号记录仪连接,调节微调螺旋,牵直肌条,使张力达到1.0 g固定不动,记录此时肌条自发性收缩频率,频率越高表示逼尿肌兴奋性越高。每个膀胱取3个肌条,重复测定3次。取0.4 g剩余膀胱组织,剪碎后置于高效RIPA裂解液中匀浆、离心,吸出上清,-80 ℃保存备用;再取0.4 g膀胱组织保存在液氮中备用;剩余的膀胱组织清洗、固定、脱水、透明、包埋、切片后备用。
1.6 大鼠膀胱组织病理形态观察取膀胱组织切片,脱蜡、水化、H-E染色、脱水、透明、封片,具体步骤参照H-E染色试剂盒说明书进行,于显微镜下观察并任选5个视野拍照。
1.7 大鼠血清炎症细胞因子COX-2、IL-18、iNOS的检测取血清样品,提前放在4 ℃冰箱中缓慢解冻,用试剂盒检测血清中COX-2、IL-18、iNOS的水平,具体操作参照试剂盒说明书进行。
1.8 大鼠膀胱组织miRNA-199a-3p与c-kit mRNA水平的检测取膀胱组织样品,剪碎后加入总RNA提取试剂研磨,按照说明书步骤得到总RNA,并以一步法反转录qPCR检测试剂盒进行PCR反应,反应条件参照试剂盒说明书进行设定,分别以U6作为miRNA-199a-3p的内参基因、以β-actin作为c-kit的内参基因。miRNA-199a-3p正向引物序列为5'-ACAGUAGUCUGCACA-UUGGUUA-3',反向引物序列为5'-AACCAAUGU-GCAGACUA-3';U6正向引物序列为5'-CTCGC-TTCGGCAGCACA-3',反向引物序列为5'-AACG-CTTCACGAATTTGCGT-3';c-kit正向引物序列为5'-TGGCAAAGAAGACAACGA-3',反向引物序列为5'-CACATGGAGTCCACGGAT-3';β-actin正向引物序列为5'-TCAGGTCATCACTATCGGCAAT-3',反向引物序列为5'-AAAGAAAGGGTGTAAAAC-GCA-3'。采用2-ΔΔCt法计算目的基因相对表达量。
1.9 大鼠膀胱组织c-kit/ERK通路蛋白表达的检测取膀胱组织样品液,参照BCA试剂盒说明书测定总蛋白质浓度。取含20 µg蛋白质的样品液,煮沸后上样进行电泳、湿转、封闭非特异位点,分别孵育一抗(p-ERK1/2、ERK1/2、c-kit、GAPDH抗体),洗膜,孵育羊抗兔二抗,洗膜,显色,拍照,用ImageJ软件分析结果。
1.10 统计学处理应用SPSS 24.0软件进行统计学分析。符合正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(多重比较采用SNK-q检验)。检验水准(α)为0.05。
2 结果 2.1 各组大鼠尿动力学比较与假手术组相比,模型组大鼠的膀胱最大容量、膀胱基础压、漏尿点压力均升高(P均<0.05)。与模型组、电针+miRNA-199a-3p抑制剂组相比,电针组大鼠的膀胱最大容量、膀胱基础压、漏尿点压力均降低(P均<0.05);miRNA-199a-3p抑制剂组大鼠的膀胱最大容量、膀胱基础压、漏尿点压力均升高(P均<0.05)。与模型组相比,miRNA-199a-3p抑制剂阴性对照组大鼠的膀胱最大容量、膀胱基础压、漏尿点压力差异均无统计学意义(P均>0.05)。见表 1。
|
|
表 1 各组大鼠尿动力学检测结果 Tab 1 Urodynamic test results of rats in each group |
2.2 各组大鼠逼尿肌兴奋性比较
与假手术组相比,模型组大鼠肌条自发性收缩频率降低[(1.59±0.32)min-1 vs (5.32±0.51)min-1,P<0.05]。与模型组、电针+miRNA-199a-3p抑制剂组[(1.48±0.26)min-1]相比,电针组大鼠肌条自发性收缩频率[(4.97±0.62)min-1]升高(P<0.05),miRNA-199a-3p抑制剂组大鼠肌条自发性收缩频率[(0.78±0.27)min-1]降低(P<0.05)。与模型组相比,miRNA-199a-3p抑制剂阴性对照组大鼠肌条自发性收缩频率[(1.54±0.28)min-1]差异无统计学意义(P>0.05)。
2.3 各组大鼠膀胱组织病理形态假手术组大鼠膀胱组织结构完好,无病理改变。模型组大鼠膀胱壁变薄,上皮组织脱落且层次紊乱,有大量空泡细胞出现,毛细血管扩张,黏膜层及肌层有少量白细胞渗出,并有大量中性粒细胞浸润,显示有急性炎症病理损伤。与模型组、电针+miRNA-199a-3p抑制剂组相比,电针组大鼠膀胱组织炎症病理损伤减轻,miRNA-199a-3p抑制剂组大鼠膀胱组织炎症病理损伤加重。与模型组相比,miRNA-199a-3p抑制剂阴性对照组大鼠膀胱组织炎症病理损伤无明显改变。见图 1。

|
图 1 H-E染色检测各组大鼠膀胱组织病理形态改变(200×) Fig 1 Pathological changes of bladder tissue of rats in each group detected by H-E staining (200×) A: Sham group; B: Model group; C: Electroacupuncture group; D: miRNA-199a-3p antagomir group; E: miRNA-199a-3p antagomir negative control group; F: Electroacupuncture+miRNA-199a-3p antagomir group. H-E: Hematoxylin-eosin; miRNA: MicroRNA. |
2.4 各组大鼠血清炎症细胞因子水平比较
与假手术组相比,模型组大鼠血清炎症细胞因子COX-2、IL-18、iNOS水平均升高(P均<0.05)。与模型组、电针+miRNA-199a-3p抑制剂组相比,电针组大鼠血清炎症细胞因子COX-2、IL-18、iNOS水平均降低(P均<0.05);miRNA-199a-3p抑制剂组大鼠血清炎症细胞因子COX-2、IL-18、iNOS水平均升高(P均<0.05)。与模型组相比,miRNA-199a-3p抑制剂阴性对照组大鼠血清炎症细胞因子COX-2、IL-18、iNOS水平差异无统计学意义(P均>0.05)。见表 2。
|
|
表 2 各组大鼠血清炎症细胞因子COX-2、IL-18、iNOS水平比较 Tab 2 Levels of serum inflammatory cytokines COX-2, IL-18 and iNOS in each group |
2.5 各组大鼠膀胱组织miRNA-199a-3p与c-kit mRNA表达水平比较
与假手术组相比,模型组大鼠膀胱组织miRNA-199a-3p与c-kit mRNA表达水平均降低(P均<0.05)。与模型组、电针+miRNA-199a-3p抑制剂组相比,电针组大鼠膀胱组织miRNA-199a-3p与c-kit mRNA表达水平均升高(P均<0.05);miRNA-199a-3p抑制剂组大鼠膀胱组织miRNA-199a-3p与c-kit mRNA表达水平均降低(P均<0.05)。与模型组相比,miRNA-199a-3p抑制剂阴性对照组大鼠膀胱组织miRNA-199a-3p与c-kit mRNA表达水平差异无统计学意义(P均>0.05)。见表 3。
|
|
表 3 各组大鼠膀胱组织miRNA-199a-3p与c-kit mRNA表达水平比较 Tab 3 miRNA-199a-3p and c-kit mRNA expression in bladder tissue of rats in each group |
2.6 各组大鼠膀胱组织c-kit/ERK通路蛋白表达水平比较
与假手术组相比,模型组大鼠膀胱组织c-kit/ERK通路蛋白p-ERK/ERK、c-kit表达水平均降低(P均<0.05)。与模型组、电针+miRNA-199a-3p抑制剂组相比,电针组大鼠膀胱组织p-ERK/ERK、c-kit表达水平均升高(P均<0.05);miRNA-199a-3p抑制剂组大鼠膀胱组织p-ERK/ERK、c-kit表达水平均降低(P均<0.05)。与模型组相比,miRNA-199a-3p抑制剂阴性对照组大鼠膀胱组织p-ERK/ERK、c-kit表达水平差异无统计学意义(P均>0.05)。见图 2、表 4。
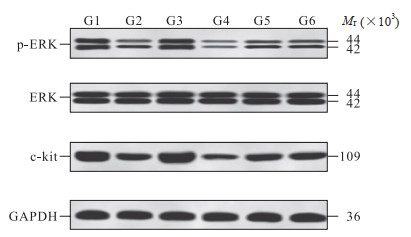
|
图 2 蛋白质印迹法检测各组大鼠膀胱组织c-kit/ERK通路蛋白的表达 Fig 2 Expression of c-kit/ERK pathway proteins in bladder tissue of rats in each group detected by Western blotting G1: Sham group; G2: Model group; G3: Electroacupuncture group; G4: miRNA-199a-3p antagomir group; G5: miRNA-199a-3p antagomir negative control group; G6: Electroacupuncture+miRNA-199a-3p antagomir group. p-ERK: Phosphorylated extracellular signal-regulated kinase; ERK: Extracellular signal-regulated kinase; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; miRNA: MicroRNA. |
|
|
表 4 各组大鼠膀胱组织c-kit/ERK通路蛋白相对表达水平比较 Tab 4 Relative expression levels of c-kit/ERK pathway proteins in bladder tissue of rats in each group |
3 讨论
脊髓损伤患者因损伤平面以下的神经功能丧失可导致终生残疾,而神经源性尿潴留是其最常见的并发症,可造成患者尿路感染、膀胱功能受损、肾积水、肾衰竭等症状,严重影响患者的身心健康,目前导尿术、膀胱神经再支配手术等用于治疗神经源性尿潴留有一定创伤和局限性,因此探寻更加有效和安全的治疗手段有很大的临床价值[1]。本研究采用改良脊髓横断法建立神经源性尿潴留大鼠模型,造模大鼠血清COX-2、IL-18及iNOS水平升高,产生明显炎症;大鼠肌条自发性收缩频率降低,膀胱最大容量、膀胱基础压、漏尿点压力升高,显示大鼠逼尿肌兴奋性降低、尿动力学异常、膀胱膨大;病理检查结果显示膀胱壁变薄,上皮组织脱落且层次紊乱,有大量空泡细胞出现,毛细血管扩张,黏膜层及肌层有少量白细胞渗出,有大量中性粒细胞浸润,显示膀胱组织出现急性炎症病理损伤,表明神经源性尿潴留模型构建成功。
作为广泛应用于临床的针灸疗法,电针可改善骶髓损伤后神经源性尿潴留大鼠的膀胱功能[9],于关元穴处电针可减弱脊髓损伤后大鼠逼尿肌的最小收缩张力、增大收缩频率、减轻尿潴留症状[3, 11],电针预处理联合诱导排尿还可改善混合痔外剥内扎术后尿潴留症状[12],但其作用机制目前尚未阐明。c-kit/ERK是参与介导脑脊髓炎、脊髓损伤、尿潴留等疾病发生和发展的重要信号,促进c-kit表达可激活ERK信号、增强组织细胞抗氧化活性、保护心功能,促进c-kit/ERK信号转导可减轻脊髓损伤、修复神经源性膀胱大鼠膀胱功能、改善排尿功能、减轻尿潴留症状[4-5, 13-14]。作为c-kit的一个调控因子,miRNA-199a-3p在脊髓缺血再灌注损伤过程中低表达[15],上调其表达可改善脊髓损伤大鼠运动功能[7]。研究显示电针可促进c-kit表达[8],通过miRNA-199a激活c-kit/ERK信号可能是电针关元穴治疗神经源性尿潴留的作用机制。本研究结果显示,电针治疗神经源性尿潴留模型大鼠可减轻其膀胱组织病理损伤、提升逼尿肌兴奋性、改善大鼠尿动力学指标及膀胱功能,显示电针对神经源性尿潴留具有很好的治疗效果。神经源性尿潴留模型大鼠膀胱组织miRNA-199a-3p与c-kit mRNA表达水平、c-kit/ERK通路蛋白p-ERK/ERK及c-kit表达水平降低,电针治疗可减轻上述改变;通过miRNA-199a-3p抑制剂下调miRNA-199a-3p表达可抑制c-kit/ERK通路激活、促使炎症反应发展、加重膀胱组织病理损伤,进一步降低逼尿肌兴奋性,促进神经源性尿潴留病情进展,减弱电针对大鼠膀胱功能障碍及尿潴留的改善作用并逆转其治疗效果。以上结果表明电针关元穴可通过上调miRNA-199a-3p表达激活c-kit/ERK信号通路,缓解膀胱组织炎症损伤,提高逼尿肌兴奋性,促使脊髓损伤大鼠尿动力学指标恢复正常,改善尿潴留症状。
总之,本研究证实了电针关元穴可通过上调miRNA-199a-3p表达而促进c-kit表达,进而增强ERK磷酸化,阻碍炎症反应进展,减轻膀胱组织病理损伤,提高逼尿肌兴奋性,最终改善神经源性尿潴留模型大鼠的尿动力学及尿潴留症状,而通过上调miRNA-199a-3p表达激活c-kit/ERK通路是电针关元穴治疗神经源性尿潴留可能的分子机制。
| [1] |
KADYKOV A S, SHVARTS P G, FEDIN P A, et al. [The study of diagnostic capabilities of somatosensory evoked potentials in patients with neurogenic urinary retention][J]. Zh Nevrol Psikhiatr Im S S Korsakova, 2019, 119(6): 60-64. DOI:10.17116/jnevro201911906160 |
| [2] |
YANG Y D, YU X, WANG X M, et al. Tanshinone ⅡA improves functional recovery in spinal cord injury-induced lower urinary tract dysfunction[J]. Neural Regen Res, 2017, 12(2): 267-275. DOI:10.4103/1673-5374.200810 |
| [3] |
FAN Q, CAVUS O, XIONG L, et al. Spinal cord injury: how could acupuncture help?[J]. J Acupunct Meridian Stud, 2018, 11(4): 124-132. DOI:10.1016/j.jams.2018.05.002 |
| [4] |
JIN Z, DING Y, XUE R, et al. Involvement of interstitial cells of Cajal in bladder dysfunction in mice with experimental autoimmune encephalomyelitis[J]. Int Urol Nephrol, 2017, 49(8): 1353-1359. DOI:10.1007/s11255-017-1597-8 |
| [5] |
ZHU G Q, JEON S H, LEE K W, et al. Engineered stem cells improve neurogenic bladder by overexpressing SDF-1 in a pelvic nerve injury rat model[J]. Cell Transplant, 2020, 29: 963689720902466. DOI:10.1177/0963689720902466 |
| [6] |
VENKATESAN N, KANWAR J, DEEPA P R, et al. Clinico-pathological association of delineated miRNAs in uveal melanoma with monosomy 3/disomy 3 chromosomal aberrations[J]. PLoS One, 2016, 11(1): e0146128. DOI:10.1371/journal.pone.0146128 |
| [7] |
WANG Y, LAI X, WU D, et al. Umbilical mesenchymal stem cell-derived exosomes facilitate spinal cord functional recovery through the miR-199a-3p/145-5p-mediated NGF/TrkA signaling pathway in rats[J]. Stem Cell Res Ther, 2021, 12(1): 117. DOI:10.1186/s13287-021-02148-5 |
| [8] |
王计雨, 康朝霞, 韩永丽, 等. 电针足三里调控SCF/c-Kit信号通路对功能性消化不良大鼠胃窦组织肌内Cajal间质细胞的作用[J]. 湖北中医杂志, 2019, 41(4): 3-8. |
| [9] |
卢壮, 黄钰岚, 阮成志, 等. 电针对骶髓损伤后神经源性膀胱尿潴留大鼠尿动力学的影响和机制研究[J]. 检验医学与临床, 2020, 17(19): 2841-2845, 2849. DOI:10.3969/j.issn.1672-9455.2020.19.026 |
| [10] |
郭义. 实验针灸学[M]. 北京: 中国中医药出版社, 2008: 417.
|
| [11] |
贾健, 魏小利, 刘亚峰, 等. 中频脉冲电刺激联合针灸治疗脑卒中后神经源性膀胱尿潴留的效果[J]. 临床医学研究与实践, 2020, 5(1): 122-123. DOI:10.19347/j.cnki.2096-1413.202001050 |
| [12] |
龙庆, 李俊, 闻永, 等. 电针预处理联合诱导排尿对混合痔外剥内扎术后尿潴留的影响[J]. 中国针灸, 2019, 39(8): 821-824. DOI:10.13703/j.0255-2930.2019.08.006 |
| [13] |
MA Y, CHEN Y, ZHENG Y, et al. SCF/c-kit signaling pathway participates in ICC damage in neurogenic bladder[J]. Cell Cycle, 2020, 19(16): 2074-2080. DOI:10.1080/15384101.2020.1793059 |
| [14] |
EBEID D E, FIROUZI F, ESQUER C Y, et al. PIM1 promotes survival of cardiomyocytes by upregulating c-Kit protein expression[J]. Cells, 2020, 9(9): 2001. DOI:10.3390/cells9092001 |
| [15] |
CHEN F, HAN J, WANG D. Identification of key microRNAs and the underlying molecular mechanism in spinal cord ischemia-reperfusion injury in rats[J]. PeerJ, 2021, 9: e11454. DOI:10.7717/peerj.11454 |
 2023, Vol. 44
2023, Vol. 44


