当前结直肠癌(colorectal cancer,CRC)的发病率呈逐年升高的趋势,已成为全球范围内最常见的消化道恶性瘤之一,2021年的统计数据显示其发病率和死亡率均居全球恶性肿瘤的前3位[1]。
远处转移是导致CRC患者死亡的主要原因,约20%的CRC患者初诊时就已经发生远处转移,未发生转移的非转移性结直肠癌(non-metastatic colorectal cancer,nmCRC)中有超过50%以上的患者会随着病情进展而出现远处转移[2]。转移性结直肠癌(metastatic colorectal cancer,mCRC)预后较差,患者5年生存率低于20%[3]。因此,寻找便捷、无创、灵敏性更佳的mCRC标志物以早期发现转移,对CRC的防治意义重大。
目前临床上主要通过影像学检查如MRI、CT、PET-CT等,以及常用的循环肿瘤标志物如癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原(carbohydrate antigen,CA)19-9和CA125等的检测[4]对CRC患者的病情进行评估,但部分转移灶因为较小或受解剖位置的影响,容易被漏诊,也不便行病理学检查。血液肿瘤标志物虽然具有无创、快速等优点,但常用的肿瘤标志物对于mCRC也缺乏特异性和灵敏性。外泌体是具有膜结构的囊泡,是人体内一种多功能的细胞间转运系统,在调节细胞间交流方面发挥着重要作用,并进一步影响着组织的平衡、免疫调节及肿瘤的发生与发展[5]。外泌体独特的脂质双层膜结构能够避免内容物的降解[6],微小的体积保证了其能够轻易通过身体组织屏障在体液中广泛存在[7]。在不同的生理病理情况下,细胞产生的外泌体内容物呈现动态差异变化,这意味着外泌体可以比较灵敏地反映患者的病理改变[8],因此,外泌体在作为标志物方面较血液中的其他物质优势显著。研究显示CA125是CRC患者的独立预后指标,预测价值优于CEA[9];碱性磷酸酶(alkaline phosphatase,ALP)与CRC的预后有关[10-12]。本研究以CRC患者为研究对象,结合患者的临床病理特征,评估血浆外泌体蛋白液泡蛋白分选蛋白37C(vacuolar protein sorting-associated protein 37C,VPS37C)联合血清CA125、ALP检测对mCRC的诊断效能。
1 材料和方法 1.1 研究对象选取2020年12月至2022年9月于上海中医药大学附属曙光医院就诊、经病理学及影像学明确诊断为CRC的患者85例作为研究对象,另选取17例同期于上海中医药大学附属曙光医院进行健康体检的志愿者作为健康对照。
CRC患者纳入标准:(1)经过细胞、组织病理学及影像学检查初次明确诊断为nmCRC或mCRC的患者;(2)未行放化疗、靶向治疗等抗肿瘤治疗的患者;(3)预计生存时间>3个月;(4)自愿接受本研究计划的观察,思维清晰、表述清楚,语言及感官反应正常;(5)了解本研究的相关情况并签署知情同意书。排除标准:(1)既往有其他恶性肿瘤病史或目前合并其他恶性肿瘤;(2)研究对象有直系亲属关系;(3)妊娠期或哺乳期妇女;(4)合并不易控制的精神障碍疾病;(5)有心、肝、肾或消化系统等严重疾病者。
健康志愿者纳入标准:(1)无恶性肿瘤病史,无心、肝、肾或消化系统等严重疾病者;(2)各项实验室检查结果均正常。排除孕产妇、HIV阳性者。
本研究获得上海中医药大学附属曙光医院伦理委员会审批(2020-852-59-01),所有研究参与者均签署了书面知情同意书。
1.2 研究方法采集所有患者及健康志愿者治疗前的血液样本5 mL,离心分离血浆/血清,然后在-80 ℃条件下储存。使用Hieff?血清/血浆外泌体快速抽提试剂盒[翌圣生物科技(上海)股份有限公司,货号41202ES30]进行血浆外泌体提取,通过对外泌体样品进行透射电子显微镜(transmission electron microscopy,TEM)拍照、蛋白质印迹法分析观察外泌体相关标志蛋白肿瘤易感基因101(tumor susceptibility gene 101,TSG101;英国Abcam公司,货号ab125011)和程序性细胞死亡蛋白6相互作用蛋白(programmed cell death protein 6 interacting protein,PDCD6IP,又称ALIX;英国Abcam公司,货号ab275377)的表达鉴定外泌体,冷冻保存在-80 ℃备用。
使用Mlbio?人VPS37C ELISA试剂盒(上海酶联生物科技有限公司,货号ML812900-2)检测血浆外泌体VPS37C浓度,使用美国雅培I2000型全自动免疫化学发光仪测定CA125水平,使用美国Beckman Coulter公司的LH780型血液分析仪进行血常规检查。正常参考值范围:VPS37C为0.156~10 ng/mL,CA125为0.00~35 U/mL,ALP为50~135 U/L。
1.3 统计学处理应用SPSS 26.0软件进行统计学分析,应用Microsoft Excel 2016软件进行参数计算,应用GraphPad Prism 9.3.1.471软件绘制柱状图。对计量资采用Kolmogorov-Smirnov检验进行正态性检验,如不符合正态分布,则对数据进行对数转换后再次进行正态性检验;如符合正态分布且方差齐,数据以x±s表示,两组间比较采用独立样本t检验,多组间比较采用方差分析,方差分析后两两比较采用Tukey-Kramer法;如转换后的数据仍不符合正态分布或方差不齐,采用非参数统计检验。计数资料以例数和百分数表示,组间比较采用χ2检验。通过多元回归分析评估诊断的灵敏度、特异度、准确度、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV)及测试蛋白ROC曲线的AUC,并通过MedCalc软件采用DeLong检验对ROC曲线进行比较。低于检测限的VPS37C浓度分析时按零值计。检验水准(α)为0.05。
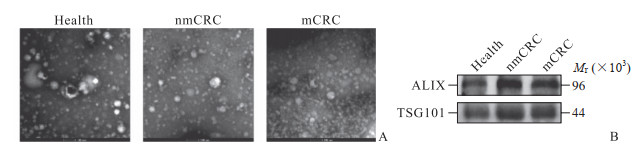
2 结果 2.1 外泌体的鉴定来自CRC患者和健康志愿者血浆的外泌物直径为40~150 nm,呈茶托状的脂质双层膜结构(图 1A)。蛋白质印迹法检测结果(图 1B)显示,健康志愿者及CRC患者的血浆外泌体均表达ALIX和TSG101这2种外泌体相关标志蛋白。
|
图 1 血浆外泌体的鉴定 Fig 1 Identification of plasma exosomes A: TEM images showed typical exosomes with bowl-shaped microvesicles (49 000×); B: Western blotting showed that plasma exosomes were positive for the 2 exosomal markers, ALIX and TSG101. TEM: Transmission electron microscopy; Health: Healthy volunteer; nmCRC: Non-metastatic colorectal cancer; mCRC: Metastatic colorectal cancer; ALIX: Programmed cell death protein 6 interacting protein; TSG101: Tumor susceptibility gene 101. |
2.2 研究对象的一般情况
17例健康志愿者中男11例、女6例,年龄51~74岁,平均年龄(58.76±5.26)岁。85例CRC患者中,nmCRC患者46例,男20例、女26例,年龄45~88岁,平均年龄(64.63±11.20)岁,TNM分期0~Ⅰ期9例、Ⅱ期15例、Ⅲ期22例;mCRC患者39例,男21例、女18例,年龄38~86岁,平均年龄(65.87±12.08)岁,均为TNM分期Ⅳ期患者。3组研究对象的性别、年龄差异均无统计学意义(P均>0.05)。
2.3 血浆外泌体VPS37C表达水平比较经对数转换后,mCRC患者血浆外泌体VPS37C的表达水平为(2.00±0.43)ng/mL,高于nmCRC患者[(1.81±0.28)ng/mL]和健康志愿者[(1.74±0.21)ng/mL],差异均有统计学意义(P均<0.05,图 2A);nmCRC患者血浆外泌体VPS37C表达水平与健康志愿者比较差异无统计学意义(P>0.05)。

|
图 2 nmCRC和mCRC患者的血浆外泌体VPS37C和血清肿瘤标志物CA125、ALP表达水平比较 Fig 2 Comparison of expression levels of plasma exosomal VPS37C and serum tumor markers CA125 and ALP between nmCRC and mCRC patients A: VPS37C; B: CA125; C: ALP. nmCRC: Non-metastatic colorectal cancer; mCRC: Metastatic colorectal cancer; VPS37C: Vacuolar protein sorting-associated protein 37C; CA125: Carbohydrate antigen 125; ALP: Alkaline phosphatase. *P < 0.05, **P < 0.01. x±s. |
2.4 nmCRC和mCRC患者肿瘤标志物比较
mCRC组患者血清CA125、ALP表达水平均高于nmCRC组,差异均有统计学意义(P均<0.01,图 2B、2C)。
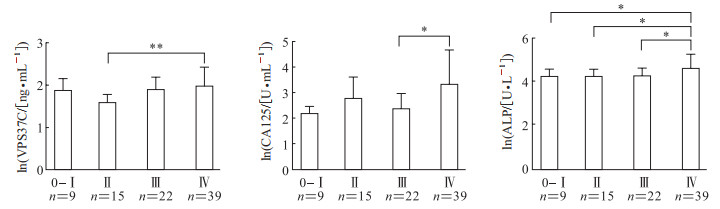
2.5 不同TNM分期CRC患者VPS37C、CA125、ALP水平比较结果见图 3。CRC TNM Ⅳ期患者血浆外泌体VPS37C水平高于Ⅱ期患者,差异有统计学意义(P<0.01),但与其他TNM分期患者比较差异无统计学意义(P>0.05)。CRC TNM Ⅳ期患者血清CA125水平高于其他分期患者,与Ⅲ期患者比较差异有统计学意义(P<0.05)。TNM Ⅳ期患者的血清ALP水平高于其他分期患者,差异均有统计学意义(P均<0.05);TNM 0~Ⅲ期患者的ALP表达水平基本一致,差异无统计学意义(P>0.05)。
|
图 3 不同TNM分期CRC患者血浆外泌体VPS37C和血清肿瘤标志物CA125、ALP表达水平比较 Fig 3 Comparison of expression levels of plasma exosomal VPS37C and serum tumor markers CA125 and ALP among CRC patients at different TNM stages CRC: Colorectal cancer; VPS37C: Vacuolar protein sorting-associated protein 37C; CA125: Carbohydrate antigen 125; ALP: Alkaline phosphatase. *P < 0.05, **P < 0.01. x±s. |
2.6 VPS37C、CA125、ALP单项及联合检测对mCRC临床诊断价值比较
血浆外泌体VPS37C和血清肿瘤标志物CA125、ALP单项检测结果显示,CA125的灵敏度和特异度优于ALP和VPS37C。将血浆外泌体VPS37C与其他2个指标联合使用,构建logistic回归模型,并对模型进行灵敏度和特异度分析,结果显示VPS37C联合CA125或ALP及3个指标联合检测mCRC的灵敏度、特异度和准确度总体均高于单项标志物的检测能力,其中3个指标联合获得的检测结果最佳,灵敏度为64.29%,特异度为90.91%,准确度为78.69%。见表 1。
|
|
表 1 血浆外泌体VPS37C和血清肿瘤标志物CA125、ALP单项及联合检测对mCRC临床诊断价值比较 Tab 1 Clinical diagnostic value of single and combined detection of plasma exosomal VPS37C and serum tumor markers CA125 and ALP in mCRC patients |
2.7 VPS37C、CA125、ALP单项及联合检测mCRC的ROC曲线分析
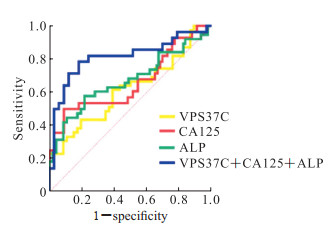
单项检测mCRC的ROC曲线分析结果显示,血浆外泌体VPS37C、血清CA125、血清ALP的AUC分别为0.618 2(95% CI 0.496 1~0.740 3,P=0.041 5),0.661 8(95% CI 0.519 3~0.804 3,P=0.030 5)和0.671 6(95% CI 0.551 2~0.792 0,P=0.007 0)。将血浆外泌体VPS37C与血清CA125和ALP联合使用,构建二元logistic回归模型,并对模型检测能力进行ROC曲线分析,结果显示3个指标联合的AUC为0.813 9(95% CI 0.697 0~0.930 7,P<0.000 1),高于各单项指标的AUC(P均<0.05)。见图 4。
|
图 4 血浆外泌体VPS37C和血清肿瘤标志物CA125、ALP单项及联合检测诊断mCRC的ROC曲线分析 Fig 4 ROC curves of plasma exosomal VPS37C and serum tumor markers CA125 and ALP for single and combined detection of mCRC VPS37C: Vacuolar protein sorting-associated protein 37C; CA125: Carbohydrate antigen 125; ALP: Alkaline phosphatase; mCRC: Metastatic colorectal cancer; ROC: Receiver operating characteristic. |
3 讨论
近年来,由于我国人民生活方式和饮食习惯的改变,CRC的发病率和死亡率呈显著上升趋势,尽管治疗方案有所进展,但CRC患者的预后仍不理想。CRC的TNM分期对CRC预后具有重要作用,早期诊断的患者更容易治愈,晚期患者则预后较差[13]。目前,血清肿瘤标志物如CEA在CRC诊断中被广泛应用[14]。然而,CEA在诊断CRC方面既不够灵敏,特异性也不强,且其水平并非总是与转移相关[15]。外泌体蛋白作为潜在的标志物,具有相对于循环标志物更大的优势,如其双层膜结构可保护其内容物不易被循环中的酶降解[7],外泌体标志物在纯化后比血液标志物浓度更高,故灵敏性更高。寻找合适的外泌体蛋白作为CRC转移的标志物,对早期发现CRC转移,改善患者预后具有重要意义[16]。
VPS37C是转运必需的内涵体分选复合物Ⅰ(endosomal sorting complex required for transport Ⅰ,ESCRT-Ⅰ)的组成部分,是囊泡转运过程的调节因子,用于将内吞的泛素化货物分类为多囊泡体,参与细胞生长和分化[17]。Chen等[18]发现VPS37C可作为急性髓系白血病的预后指标之一,其表达升高可能提示更差的预后。一项针对CRC细胞的研究发现,敲低VPS37A、VPS37B和VPS37C可导致ESCRT-Ⅰ亚基失稳,引发严重的细胞应激,表现为无菌炎症反应和细胞生长停滞,造成CRC细胞潜在脆弱性并可能更容易受到化疗和炎症反应药理调节剂的影响,提示VPS37C可能在CRC转移中发挥重要作用[19]。目前尚无对VPS37C作为CRC诊断或转移标志物的相关研究,本研究显示其可能具备作为mCRC的外泌体标志物的潜力,在区分mCRC与nmCRC方面可发挥一定作用。
CA125是常用的肿瘤血清标志物之一,可作为多种肿瘤的标志物。一项有关血清标志物与CRC临床参数相关性的研究发现,CA125异常的患者更容易发生肿瘤血管侵犯,与肿瘤低分化相关,与病理分期呈正相关[20]。有研究显示CA125是CRC患者的重要独立预后因素,与CEA、CA19-9、CA242相比,是更好的CRC预后标志物[9]。在接受原发性肿瘤切除术的mCRC患者中,术前较高的CA125水平与较低的生存率相关[21]。在预测腹膜播散方面,与CEA相比,CA125具有更高的特异度和AUC,但灵敏度较低,在区分CEA阴性CRC腹膜播散患者方面表现更好[22]。多项研究将CA125与其他标志物联合应用以提高诊断效率。Li等[23]将CA125与趋化因子(C-X-C基序)配体7[chemokine(C-X-C motif)ligand 7,CXCL7]、CEA、CA19-9联合应用,发现诊断效率明显提升,高于各标志物的单独应用。Xie等[24]将CA125与CEA、CA199、N6-甲基腺苷联合应用作为CRC诊断标志物,AUC可达0.946,高于各标志物的单独应用。本研究发现CA125在区分mCRC与nmCRC方面具有较好的表现,与既往研究[25]结果一致,将CA125与外泌体VPS37C、血清ALP联合应用,得到了相较于各标志物单独使用更高的AUC、灵敏度和特异度。
ALP在人体肝脏、骨骼、肠、肾和胎盘等组织中广泛分布,并经肝脏向肝外排出,多项研究发现ALP与CRC转移和预后密切相关。一项针对2 790例CRC患者的研究表明,ALP、CEA和CA125是CRC骨转移的独立危险因素[26]。一项针对10 800例接受手术治疗的CRC TNM Ⅰ~Ⅳ期患者的回顾性研究发现,与术前ALP水平正常的CRC患者相比,ALP水平升高患者的5年总生存率更低,提示ALP可能是CRC的不良预后因子[11]。一项针对239例mCRC患者开展的研究显示,ALP是mCRC患者总生存率的预后因素,是一线化疗患者无进展生存的预测因素[27]。一项针对105例CRC患者的回顾性研究显示,ALP水平升高与TNM分期增加有关,74%的肝转移患者ALP水平升高,最近一次就诊ALP水平升高的患者预后不良的可能性是正常水平患者的5.7倍[28]。本研究发现,血浆外泌体VPS37C和血清CA125、ALP单独区分nmCRC与mCRC时,ALP的AUC最大(0.671 6),提示其可作为区分nmCRC与mCRC的指标。
本研究发现,mCRC患者血浆外泌体VPS37C和血清CA125、ALP水平高于nmCRC患者(P<0.05,P<0.01)。在TNM分期方面,血浆外泌体VPS37C水平在CRC Ⅱ期与Ⅳ期患者间、血清CA125水平在CRC Ⅲ期与Ⅳ期患者间及血清ALP水平在CRC Ⅰ~Ⅲ期与Ⅳ期患者间的差异均有统计学意义(P<0.05,P<0.01),这与按照转移与非转移进行分组的结果基本一致。对这3个指标单独与联合应用的诊断效能分析结果显示,3个指标单独使用时AUC均大于0.5(VPS37C:AUC=0.618 2;CA125:AUC=0.661 8;ALP:AUC=0.671 6),提示这3个指标均具有一定的诊断效能;将3个指标联用时,其诊断效能明显增加,特异度达到90.91%,准确度达到78.69%,AUC显著高于指标单独使用(AUC=0.813 9,P<0.05),显示出较好的诊断效能。
本研究尚存在一定的局限性。首先,研究纳入的病例数较少,且收集的病例均来自同一家医院,存在选择偏倚;其次,本研究为横断面研究,仅研究了血浆外泌体VPS37C和血清CA125、ALP对nmCRC与mCRC的区分效能,还需进一步开展纵向研究与基础研究以确认以上指标在CRC患者临床治疗及预后中的作用和机制;最后,本研究是对外泌体VPS37C作为诊断标志物的初步验证,未通过临床研究验证基于外泌体VPS37C联合各指标初步构建诊断模型的诊断效能,今后将通过扩大临床样本进一步验证模型的诊断效能。
总之,本研究分析比较了nmCRC与mCRC患者血浆外泌体VPS37C与血清CA125、ALP水平,发现这3个指标与CRC转移之间的关系,明确了3个指标联合使用的潜在诊断价值,对于mCRC的早期诊断具有一定的临床意义。
| [1] |
SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. DOI:10.3322/caac.21654 |
| [2] |
CIARDIELLO F, CIARDIELLO D, MARTINI G, et al. Clinical management of metastatic colorectal cancer in the era of precision medicine[J]. CA Cancer J Clin, 2022, 72(4): 372-401. DOI:10.3322/caac.21728 |
| [3] |
WEINBERG B A, MARSHALL J L, SALEM M E. Trifluridine/tipiracil and regorafenib: new weapons in the war against metastatic colorectal cancer[J]. Clin Adv Hematol Oncol, 2016, 14: 630-638. |
| [4] |
BILLER L H, SCHRAG D. Diagnosis and treatment of metastatic colorectal cancer: a review[J]. JAMA, 2021, 325(7): 669-685. DOI:10.1001/jama.2021.0106 |
| [5] |
KALLURI R, LEBLEU V S. The biology, function, and biomedical applications of exosomes[J]. Science, 2020, 367(6478): eaau6977. DOI:10.1126/science.aau6977 |
| [6] |
TKACH M, THÉRY C. Communication by extracellular vesicles: where we are and where we need to go[J]. Cell, 2016, 164(6): 1226-1232. DOI:10.1016/j.cell.2016.01.043 |
| [7] |
HE M, ZENG Y. Microfluidic exosome analysis toward liquid biopsy for cancer[J]. J Lab Autom, 2016, 21(4): 599-608. DOI:10.1177/2211068216651035 |
| [8] |
SANDFELD-PAULSEN B, AGGERHOLM-PEDERSEN N, BÆK R, et al. Exosomal proteins as prognostic biomarkers in non-small cell lung cancer[J]. Mol Oncol, 2016, 10(10): 1595-1602. DOI:10.1016/j.molonc.2016.10.003 |
| [9] |
BJÖRKMAN K, MUSTONEN H, KAPRIO T, et al. CA125:a superior prognostic biomarker for colorectal cancer compared to CEA, CA19-9 or CA242[J]. Tumour Biol, 2021, 43(1): 57-70. DOI:10.3233/TUB-200069 |
| [10] |
PARK H S, CHUN Y J, KIM H S, et al. Clinical features and KRAS mutation in colorectal cancer with bone metastasis[J]. Sci Rep, 2020, 10: 21180. DOI:10.1038/s41598-020-78253-x |
| [11] |
HUNG H Y, CHEN J S, YEH C Y, et al. Preoperative alkaline phosphatase elevation was associated with poor survival in colorectal cancer patients[J]. Int J Colorectal Dis, 2017, 32(12): 1775-1778. DOI:10.1007/s00384-017-2907-4 |
| [12] |
AABO K, PEDERSEN H, KJAER M. Carcinoembryonic antigen (CEA) and alkaline phosphatase in progressive colorectal cancer with special reference to patient survival[J]. Eur J Cancer Clin Oncol, 1986, 22(2): 211-217. DOI:10.1016/0277-5379(86)90033-7 |
| [13] |
LI N, LU B, LUO C, et al. Incidence, mortality, survival, risk factor and screening of colorectal cancer: a comparison among China, Europe, and northern America[J]. Cancer Lett, 2021, 522: 255-268. DOI:10.1016/j.canlet.2021.09.034 |
| [14] |
RAO H, WU H, HUANG Q, et al. Clinical value of serum CEA, CA24-2 and CA19-9 in patients with colorectal cancer[J]. Clin Lab, 2021, 67(4). DOI:10.7754/clin.lab.2020.200828 |
| [15] |
YAN C, HU Y, ZHANG B, et al. The CEA-/lo colorectal cancer cell population harbors cancer stem cells and metastatic cells[J]. Oncotarget, 2016, 7(49): 80700-80715. DOI:10.18632/oncotarget.13029 |
| [16] |
LIU J, REN L, LI S, et al. The biology, function, and applications of exosomes in cancer[J]. Acta Pharm Sin B, 2021, 11(9): 2783-2797. DOI:10.1016/j.apsb.2021.01.001 |
| [17] |
EASTMAN S W, MARTIN-SERRANO J, CHUNG W, et al. Identification of human VPS37C, a component of endosomal sorting complex required for transport-Ⅰ important for viral budding[J]. J Biol Chem, 2005, 280(1): 628-636. DOI:10.1074/jbc.M410384200 |
| [18] |
CHEN X X, LI Z P, ZHU J H, et al. Systematic analysis of autophagy-related signature uncovers prognostic predictor for acute myeloid leukemia[J]. DNA Cell Biol, 2020, 39(9): 1595-1605. DOI:10.1089/dna.2020.5667 |
| [19] |
KOLMUS K, ERDENEBAT P, SZYMA SKA E, et al. Concurrent depletion of Vps37 proteins evokes ESCRT-Ⅰ destabilization and profound cellular stress responses[J]. J Cell Sci, 2021, 134(1): jcs250951. DOI:10.1242/jcs.250951 |
| [20] |
GAO Y, WANG J, ZHOU Y, et al. Evaluation of serum CEA, CA19-9, CA72-4, CA125 and ferritin as diagnostic markers and factors of clinical parameters for colorectal cancer[J]. Sci Rep, 2018, 8: 2732. DOI:10.1038/s41598-018-21048-y |
| [21] |
HUANG J, LIU H, HU T, et al. Elevated preoperative CA125 is associated with poor survival in patients with metastatic colorectal cancer undergoing primary tumor resection: a retrospective cohort study[J]. Gastroenterol Rep (Oxf), 2022, 10: goac020. DOI:10.1093/gastro/goac020 |
| [22] |
HUANG C J, JIANG J K, CHANG S C, et al. Serum CA125 concentration as a predictor of peritoneal dissemination of colorectal cancer in men and women[J]. Medicine, 2016, 95(47): e5177. DOI:10.1097/md.0000000000005177 |
| [23] |
LI L, ZHANG L, TIAN Y, et al. Serum chemokine CXCL7 as a diagnostic biomarker for colorectal cancer[J]. Front Oncol, 2021, 10: 599363. DOI:10.3389/fonc.2020.599363 |
| [24] |
XIE J, HUANG Z, JIANG P, et al. Elevated N6-methyladenosine RNA levels in peripheral blood immune cells: a novel predictive biomarker and therapeutic target for colorectal cancer[J]. Front Immunol, 2021, 12: 760747. DOI:10.3389/fimmu.2021.760747 |
| [25] |
XIAO Y, LI Y, YUAN Y, et al. The potential of exosomes derived from colorectal cancer as a biomarker[J]. Clin Chim Acta, 2019, 490: 186-193. DOI:10.1016/j.cca.2018.09.007 |
| [26] |
LI A A, CAO Z Y, LIU J M, et al. The risk factors for bone metastases in patients with colorectal cancer[J]. Medicine, 2018, 97(40): e12694. DOI:10.1097/md.0000000000012694 |
| [27] |
HE W Z, GUO G F, YIN C X, et al. Gamma-glutamyl transpeptidase level is a novel adverse prognostic indicator in human metastatic colorectal cancer[J]. Colorectal Dis, 2013, 15(8): e443-e452. DOI:10.1111/codi.12258 |
| [28] |
SAIF M, ALEXANDER D, WICOX C M. Serum alkaline phosphatase level as a prognostic tool in colorectal cancer: a study of 105 patients[J]. J Appl Res, 2005, 5(1): 88-95. |
 2023, Vol. 44
2023, Vol. 44


