2. 海军军医大学(第二军医大学)基础医学院病理生理学教研室, 上海 200433
2. Department of Pathophysiology, College of Basic Medical Sciences, Naval Medical University(Second Military Medical University), Shanghai 200433, China
甘露糖是葡萄糖的同分异构体,主要来源于植物和水果。正常人血液中甘露糖水平很低,约为50 μmol/L,主要参与蛋白的糖基化修饰,具有免疫调节等重要生物学功能。以肥胖、糖尿病、脂肪肝和高脂血症等为特征的代谢综合征是动脉粥样硬化与心脑血管疾病的重要独立危险因素[1-2]。随着社会经济发展和人们生活方式的转变,代谢综合征的发病率呈现快速上升趋势[3]。多组学分析发现血中甘露糖水平与肥胖患者的胰岛素抵抗和高胆固醇血症密切相关[4-5],提示甘露糖代谢异常可能参与糖脂代谢紊乱的病理生理过程。此后的干预性研究却发现,给予生长发育期的离乳后小鼠甘露糖饮水可改变其肠道菌群,从而抑制能量摄入,对成年后的高脂诱导肥胖具有保护作用;然而,仅在成年阶段进行甘露糖干预并未观察到这种代谢调节效应[6]。因此,有关甘露糖在代谢性疾病中的确切作用及其相关机制有待深入研究。载脂蛋白(apolipoprotein,Apo)E是极低密度脂蛋白(very low-density lipoprotein,VLDL)和高密度脂蛋白(high-density lipoprotein,HDL)的重要组成部分,参与肝脏对乳糜微粒和VLDL残基的摄取。ApoE基因缺陷(ApoE-/-)小鼠血胆固醇主要为VLDL中的胆固醇,自发形成高胆固醇血症。本研究利用ApoE-/-小鼠模型观察甘露糖饮水对高脂血症的影响,并探讨其相关机制。
1 材料和方法 1.1 实验动物与试剂10只6周龄的雄性ApoE-/-C57BL/6J小鼠(平均体重17 g)购于江苏集萃药康生物科技股份有限公司[动物生产许可证号:SCXK(苏)2018-0008]。所有小鼠均自由饮水、进食,饲养在天津医科大学朱宪彝纪念医院内分泌研究所SPF级实验动物中心,环境温度25 ℃,相对湿度40%~70%,12 h光照/12 h黑暗。所有实验动物研究均通过天津医科大学实验动物伦理委员会审批。甘露糖(货号G8370)购于北京索莱宝科技有限公司;甘油三酯(triglyceride,TG;货号100000220)、总胆固醇(total cholesterol,TC;货号100000180)检测试剂盒购于中生北控生物科技股份有限公司;AmplexTM Red胆固醇检测试剂盒(货号A12216)购于美国ThermoFisher公司;游离脂肪酸(free fatty acid,FFA)检测试剂盒购于美国Sigma公司(货号MAK044);总RNA提取试剂盒(TRIzol提取法)、cDNA合成试剂盒和qPCR试剂购于北京全式金生物技术有限公司;血糖仪及检测试纸均为瑞士Roche公司产品;啮齿类动物高脂高胆固醇纯化饲料(货号MD12017,含22.5%蛋白质、45%碳水化合物、20%脂肪、1.25%胆固醇、0.5%胆酸钠)购于江苏美迪森生物医药有限公司。
1.2 小鼠高脂血症模型的建立与分组10只ApoE-/-小鼠随机分为对照组和甘露糖干预组,每组5只。两组小鼠均给予高脂高胆固醇纯化饲料喂养,对照组饲喂普通饮用水,甘露糖干预组饲喂含2%(质量体积分数)甘露糖的饮用水[6],持续4周。每天记录小鼠进食量和饮水量,每周记录小鼠的体重,造模前及造模1周、造模2周时取尾尖血测随机血糖。4周后用三溴乙醇麻醉小鼠,眼眶静脉丛采血并进行抗凝处理,10 000×g离心3 min取血浆,收集肝脏和肠道组织进行后续检测。
1.3 qPCR检测相关基因的表达小鼠肝脏组织采用总RNA提取试剂盒提取总RNA,再使用cDNA合成试剂盒反转录成cDNA。反转录反应条件:37 ℃ 15 min,65 ℃ 10 min,42 ℃ 60 min。应用PubMed Primer-BLAST设计基因引物,内参基因为36B4,目的基因及相关引物序列见表 1。以cDNA为模板,加入相应引物进行qPCR扩增。qPCR反应条件:95 ℃ 15 s、60 ℃ 30 s、72 ℃ 30 s 40个循环,在延伸阶段检测荧光强度;72 ℃ 10 s。采用2-ΔΔCt法计算目的基因的相对表达量。
|
|
表 1 qPCR引物序列 Tab 1 Sequences of primers for qPCR |
1.4 脂蛋白测定及组分分离
采用快速蛋白液相色谱(fast protein liquid chromatography,FPLC)系统(日本岛津公司;泵单元:LC-20AT;进样器:SIL-20A;检测器:SPD-M20A;系统控制器:CBM-20A;工作站:LCsolution Multi-PDA),使用2根Superose 6(型号17-5172-01,10/300 GL)层析柱串联,全血肝素抗凝后离心获得血浆,将同组内5份血浆等体积混合成1份样本,进样体积100 μL,洗脱缓冲液(50 mmol/L PBS、150 mmol/L氯化钠、pH 7.4)流速为0.4 mL/min,以400 μL为1个组分分部收集洗脱液,收集时间段为洗脱31~90 min,共收集60个组分,于-20 ℃保存。根据脂蛋白粒径不同,结合280 nm处光密度值(D280)将收集的组分大致分为3段,第31~46组分为VLDL、第48~63组分为低密度脂蛋白(low-density lipoprotein,LDL)、第68~83组分为HDL。测定D280,即脂蛋白的蛋白质含量。采用AmplexTM Red胆固醇检测试剂盒测定各组分中的胆固醇水平。
1.5 蛋白质印迹法检测相关蛋白的表达将FPLC收集的各组分按4∶1的体积比加入上样缓冲液,在95 ℃金属浴中变性10 min制备蛋白质样品。干冰上取小鼠肝脏、肠道组织,加入尿素裂解液(25 mmol/L Tris-HCl,8 mol/L尿素,1% SDS,1 mmol/L EDTA,0.7 mol/L二硫苏糖醇,pH 7.4),室温匀浆,12 000×g离心10 min,收集上清液。通过SDS-PAGE分离蛋白质,然后转印至PVDF膜。用5%脱脂牛奶室温封闭1 h,分别加ApoB抗体(稀释比例1∶1 000)、ApoA1抗体(稀释比例1∶1 000)、ApoA4抗体(稀释比例1∶1 000)和β-肌动蛋白抗体(稀释比例1∶5 000,美国Proteintech公司)孵育过夜,用TBST漂洗3次后,加入HRP标记的二抗(稀释比例1∶5 000,美国Jackson公司),室温孵育1 h,再用TBST漂洗3次。加入ECL试剂(美国Pierce公司)显影后,用MiniChemi 610 plus化学发光检测仪进行曝光。
1.6 小鼠肝脏脂质提取与检测在干冰上称取30 mg小鼠肝脏组织置于匀浆管内,放入研磨珠,加500 μL5% Triton X-100溶液,用多通道匀浆仪65 Hz匀浆120 s。匀浆后取出研磨珠,将匀浆管置于水浴锅,缓慢加热,从室温升至90 ℃,并在90 ℃下持续加热5 min;自然冷却,重复加热1次。在4 ℃下以12 000×g离心3 min,吸取上清至新的1.5 mL EP管中,按照TG检测试剂盒和TC检测试剂盒说明书分别检测小鼠肝脏和血浆中的TG、TC水平,按照FFA检测试剂盒说明书检测血浆中FFA水平。
1.7 统计学处理应用GraphPad Prism 9.5.1(5.28)软件处理和分析数据。计量资料均符合正态分布,以x±s表示,组间比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 甘露糖饮水加重ApoE-/-高脂血症小鼠血脂异常采用高脂高胆固醇纯化饲料喂养ApoE-/-小鼠建立高脂血症小鼠模型,观察甘露糖暴露对高脂血症小鼠脂代谢的影响。在4周观察期内,仅在第2周观察到甘露糖干预组小鼠的体重比对照组降低(P<0.05),后又恢复至对照组水平(图 1A);甘露糖干预组小鼠的进食量[(2.19±0.19)g/d vs (2.08±0.20)]g/d、饮水量[(3.63±0.62)g/d vs (4.22±1.26)]g/d和随机血糖(图 1B)与对照组相比无明显变化(P均>0.05)。第4周时,甘露糖干预组小鼠血浆TG[(1.24±0.32)mmol/L vs(0.78±0.22)mmol/L,P<0.05]和TC[(31.96±3.77)mmol/L vs (21.67±3.95)mmol/L,P<0.01]水平与对照组相比升高,血浆FFA与对照组相比差异无统计学意义[(10.71±4.20)mmol/L vs (6.54±3.34)mmol/L,P>0.05]。通过FPLC分离小鼠血浆得到不同组分,与对照组相比,甘露糖干预组VLDL的蛋白质和胆固醇水平均升高,而HDL的蛋白质含量降低、胆固醇水平无明显差异(图 2)。上述结果表明甘露糖暴露可加重ApoE-/-小鼠的高脂血症表型。
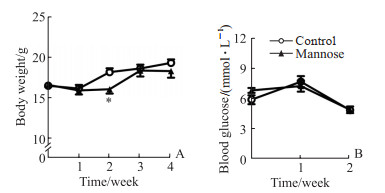
|
图 1 甘露糖饮水对高脂高胆固醇纯化饲料喂养的ApoE-/-小鼠体重和血糖的影响 Fig 1 Effects of mannose drink on body weight or blood glucose in ApoE-/- mice fed with high fat and high cholesterol purified feed A: Body weight; B: Random blood glucose. *P < 0.05 vs control group. n=5, x±s. ApoE: Apolipoprotein E. |

|
图 2 甘露糖饮水加重高脂高胆固醇纯化饲料喂养的ApoE-/-小鼠的血脂异常 Fig 2 Mannose drink aggravates hyperlipidemia in ApoE-/- mice fed with high fat and high cholesterol purified feed A: Protein of plasma fractions; B: Cholesterol of plasma fractions. ApoE: Apolipoprotein E; VLDL: Very low-density lipoprotein; LDL: Low-density lipoprotein; HDL: High-density lipoprotein; mAu: Milli absorbance unit. |
2.2 甘露糖饮水不影响ApoE-/-高脂血症小鼠肝脏的脂质含量
与对照组相比,甘露糖饮水4周后并没有导致ApoE-/-小鼠肝脏TG[(14.35±2.61)mg/gvs (14.03±4.49)mg/g]和TC[(21.80±4.14)mg/gvs (16.57±5.14)mg/g]水平的显著变化(P均>0.05)。qPCR检测结果显示,与对照组相比,甘露糖干预组小鼠肝脏脂肪酸合成相关基因固醇调节元件结合蛋白(sterol regulatory element-bindingprotein,SREBP)1c、脂肪酸合成酶(fatty acid synthase,FAS)、乙酰辅酶A羧化酶(acetyl-CoAcarboxylase,ACC),胆固醇合成相关基因SREBP2、羟甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-CoA reductase,HMGCR)和角鲨烯环氧酶(squalene epoxidase,SQLE),胆固醇外排相关基因ATP结合盒转运蛋白(ATP-binding cassette transporter,ABC)G5、ABCG8,以及胆固醇摄取相关基因CD36、低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)的mRNA表达水平均未见明显改变(P均>0.05,图 3)。这些结果提示甘露糖加重ApoE-/-高脂血症小鼠脂质代谢异常可能不是通过影响肝脏脂质合成、外排、摄取来实现的。
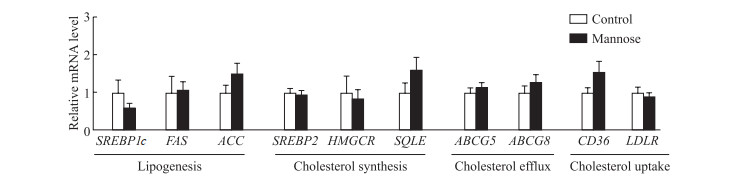
|
图 3 甘露糖饮水不影响高脂高胆固醇纯化饲料喂养的ApoE-/-小鼠肝脏脂质代谢 Fig 3 Mannose drink did not affect liver lipid metabolism in ApoE-/- mice fed with high fat and high cholesterol purified feed The mRNA expression levels in liver detected by quantitative polymerase chain reaction. n=5, x±s. ApoE: Apolipoprotein E; SREBP1c: Sterol regulatory element-binding protein 1c; FAS: Fatty acid synthase; ACC: Acetyl-CoA carboxylase; SREBP2: Sterol regulatory element-binding protein 2; HMGCR: 3-hydroxy-3-methylglutaryl-CoA reductase; SQLE: Squalene epoxidase; ABCG5: Adenosine triphosphate (ATP)-binding cassette subfamily G member 5; ABCG8: ATP-binding cassette subfamily G member 8; LDLR: Low-density lipoprotein receptor. |
2.3 甘露糖饮水加重ApoE-/-高脂血症小鼠脂蛋白的代谢紊乱
蛋白质印迹法检测结果显示,与对照组相比,甘露糖干预组小鼠血浆脂蛋白在对应于VLDL的第35~37组分中ApoB100蛋白水平明显增加(图 4A),而在对应于HDL的第73~77组分中ApoA1和ApoA4蛋白水平明显降低(图 4B)。肝脏和肠道是Apo合成的主要场所,本研究进一步检测了ApoE-/-小鼠肝脏VLDL合成与组装基因ApoB和微粒体甘油三酯转运蛋白(microsomal triglyceride transfer protein,MTTP)的mRNA和蛋白水平,结果显示两组之间没有明显差异(图 4C、4D)。甘露糖干预组小鼠肝脏ApoA1和ApoA4的mRNA水平与对照组相比无明显变化,但ApoA1蛋白水平降低(图 4C、4D);同时肠道ApoB和ApoA4的mRNA水平较对照组降低(P均<0.05,图 4E),但ApoB48蛋白水平与对照组相比无明显差异,而ApoA1和ApoA4蛋白水平均较对照组降低(图 4F)。上述结果提示甘露糖暴露导致血中ApoA1蛋白水平降低可能是其在肠道和肝脏中表达水平下调的结果,而血中ApoA4蛋白水平降低可能是该Apo在肠道中表达水平下调的结果。
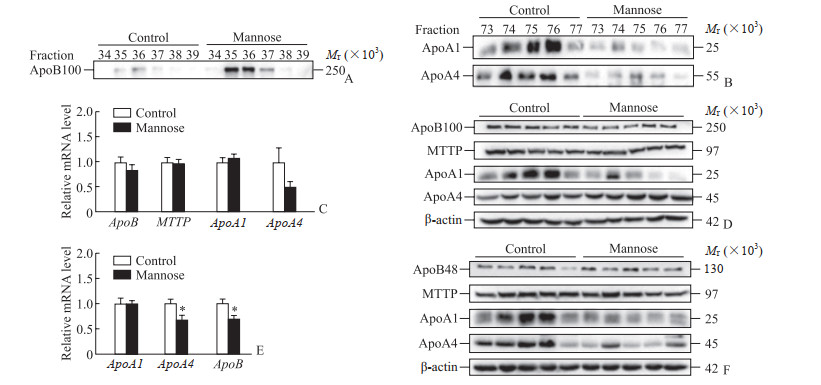
|
图 4 甘露糖饮水对高脂高胆固醇纯化饲料喂养的ApoE-/-小鼠脂蛋白代谢的影响 Fig 4 Effect of mannose drink on lipoprotein metabolism in ApoE-/- mice fed with high fat and high cholesterol purified feed A: The ApoB100 protein levels in plasma fractions detected by Western blotting; B: The ApoA1 and ApoA4 protein levels in plasma fractions detected by Western blotting; C: The mRNA levels of genes encoding Apos in liver detected by quantitative polymerase chain reaction; D: The protein levels in liver detected by Western blotting; E: The mRNA levels of Apo genes in jejunum detected by quantitative polymerase chain reaction; F: The protein levels in jejunum detected by Western blotting. *P < 0.05 vs control group. n=5, x±s. Apo: Apolipoprotein; MTTP: Microsomal triglyceride transfer protein. |
3 讨论
本研究结果显示甘露糖饮水在不影响进食量的情况下,加重ApoE-/-小鼠的高甘油三酯血症和高胆固醇血症,而肝脏甘油三酯和胆固醇水平并没有明显变化,同时伴有血浆脂蛋白代谢的显著改变,VLDL中ApoB100蛋白水平增加,而HDL中ApoA1和ApoA4蛋白水平减少。ApoE缺陷导致肝脏对乳糜微粒和VLDL残基的摄取障碍,引发高脂血症。甘露糖暴露进一步升高ApoE-/-小鼠VLDL中TG、TC和ApoB水平,提示甘露糖加重了VLDL的代谢障碍。鉴于肝脏TG和胆固醇水平没有明显变化,推测甘露糖可能通过肝脏以外的组织加重ApoE-/-小鼠的VLDL代谢障碍,包括肝外组织对TG的水解和摄取等。由于ApoE-/-小鼠HDL胆固醇水平甚微,其ApoA1和ApoA4水平减少的病理学意义尚不清楚。这2种脂蛋白主要在肝脏和小肠合成,分泌入血。其中,ApoA1主要参与胆固醇的反向转运,将游离胆固醇从外周组织运送到肝脏[7],而ApoA4参与脂质吸收和代谢,具有抗动脉粥样硬化等生理功能[8]。本研究发现甘露糖暴露导致ApoE-/-小鼠肝脏和肠道组织中ApoA1蛋白表达均下调,而ApoA4的蛋白下调仅见于肠道。有意思的是,甘露糖暴露并不影响肝脏和肠道中ApoA1的mRNA水平,而ApoA4 mRNA水平降低仅见于肝脏,提示这2种Apo在肝脏和肠道中的表达调节机制不尽相同,可能存在组织特异性,但相关机制有待深入研究。ApoE-/-小鼠经甘露糖暴露后,ApoA1和ApoA4在mRNA没有变化或变化有限的情况下,蛋白质水平明显下调,可能是转录后或翻译后机制作用的结果,包括miRNA或蛋白质降解等。
本研究结果为甘露糖暴露参与脂代谢紊乱的病理生理过程提供了直接的实验证据。基于人群的多组学分析显示,肥胖和高胆固醇血症患者的血甘露糖水平显著升高,并与胰岛素抵抗呈正相关[4-5]。本研究结果显示甘露糖饮水可加重ApoE-/-小鼠的高脂血症,是对上述人群研究的支持。然而,既往的研究报道显示,正常成年小鼠经2%甘露糖饮水暴露后并未出现明显的代谢异常;而给予离乳后的生长发育期幼鼠甘露糖饮水则对高脂饮食诱导的肥胖具有保护作用,其机制与改善肠道菌群有关[6]。这些结果提示甘露糖对脂代谢的影响非常复杂,可能与机体的生理和病理生理状态等因素有关。甘露糖饮水不能缓解高脂饮食诱导的成年小鼠脂代谢异常[6],却加重ApoE-/-小鼠的高脂血症,提示可能存在甘露糖调节脂蛋白代谢的ApoE非依赖途径。在正常小鼠体内,甘露糖诱导的ApoE非依赖性脂蛋白代谢途径的障碍可能被ApoE途径所代偿,而在ApoE-/-小鼠中这种障碍却完全展现出来。具体机制还有待后续深入研究。
机体胆固醇来自食物及体内合成2个途径,血浆中的胆固醇主要由肝脏及小肠合成。小肠合成的乳糜微粒入血液后,甘露糖可能是通过脂蛋白脂肪酶抑制乳糜微粒中TG的水解;也可能通过作用于肝细胞膜上识别乳糜微粒的受体,抑制肝细胞摄取乳糜微粒,从而升高血脂[9]。临床上,高脂血症通常是遗传因素与环境因素共同作用的结果。因此,甘露糖暴露在高脂饮食诱导的高脂血症中的作用是个值得深入研究的课题。鉴于高脂血症是动脉粥样硬化的独立危险因素[10],甘露糖暴露是否会影响动脉粥样硬化的病理进程也值得进一步观察。
甘露糖主要在肝脏中代谢,首先在己糖激酶的催化下转变为甘露糖-6-磷酸,然后在甘露糖磷酸异构酶催化下转化为果糖-6-磷酸,参与糖酵解;少部分可被磷酸甘露糖变位酶2异构化,参与蛋白质的糖基化修饰。近年研究发现,甘露糖可诱导调节性T细胞产生[11],抑制巨噬细胞产生IL-1β,延缓实验性溃疡性结肠炎的进展[12];此外,甘露糖还可抑制肿瘤生长[13]。这些研究显示甘露糖在免疫和炎症等相关疾病的防治中具有潜在应用价值。鉴于炎症在动脉粥样硬化中的重要作用,因此推测甘露糖也可能通过调节炎症反应影响动脉粥样硬化的病理过程。
总之,本研究揭示了甘露糖暴露对ApoE-/-小鼠脂蛋白代谢的病理学效应,为解析甘露糖与代谢性疾病的关系提供了重要实验依据,同时也为阐释甘露糖暴露对动脉粥样硬化的影响奠定了基础。
| [1] |
HERMAN M A, BIRNBAUM M J. Molecular aspects of fructose metabolism and metabolic disease[J]. Cell Metab, 2021, 33(12): 2329-2354. DOI:10.1016/j.cmet.2021.09.010 |
| [2] |
SHI Y N, LIU Y J, XIE Z F, et al. Fructose and metabolic diseases: too much to be good[J]. Chin Med J (Engl), 2021, 134(11): 1276-1285. DOI:10.1097/CM9.0000000000001545 |
| [3] |
高玙, 孟舒. 心肺运动试验在代谢综合征患者中的应用[J]. 海军军医大学学报, 2022, 43(10): 1120-1125. GAO Y, MENG S. Application of cardiopulmonary exercise test in patients with metabolic syndrome[J]. Acad J Naval Med Univ, 2022, 43(10): 1120-1125. DOI:10.16781/j.CN31-2187/R.20211113 |
| [4] |
LEE S, ZHANG C, KILICARSLAN M, et al. Integrated network analysis reveals an association between plasma mannose levels and insulin resistance[J]. Cell Metab, 2016, 24(1): 172-184. DOI:10.1016/j.cmet.2016.05.026 |
| [5] |
BAI L, LI Q W, LI L M, et al. Plasma high-mannose and complex/hybrid N-glycans are associated with hypercholesterolemia in humans and rabbits[J]. PLoS One, 2016, 11(3): e0146982. DOI:10.1371/journal.pone.0146982 |
| [6] |
SHARMA V, SMOLIN J, NAYAK J, et al. Mannose alters gut microbiome, prevents diet-induced obesity, and improves host metabolism[J]. Cell Rep, 2018, 24(12): 3087-3098. DOI:10.1016/j.celrep.2018.08.064 |
| [7] |
CHYU K Y, SHAH P K. HDL/ApoA-1 infusion and ApoA-1 gene therapy in atherosclerosis[J]. Front Pharmacol, 2015, 6: 187. DOI:10.3389/fphar.2015.00187 |
| [8] |
QU J, KO C W, TSO P, et al. Apolipoprotein A-Ⅳ: a multifunctional protein involved in protection against atherosclerosis and diabetes[J]. Cells, 2019, 8(4): 319. DOI:10.3390/cells8040319 |
| [9] |
LI H, LIU G, WAN X Q, et al. The zinc finger and BTB domain containing protein ZBTB20 regulates plasma triglyceride metabolism by repressing lipoprotein lipase gene transcription in hepatocytes[J]. Hepatology, 2022, 75(5): 1169-1180. DOI:10.1002/hep.32176 |
| [10] |
SANDESARA P B, VIRANI S S, FAZIO S, et al. The forgotten lipids: triglycerides, remnant cholesterol, and atherosclerotic cardiovascular disease risk[J]. Endocr Rev, 2019, 40(2): 537-557. DOI:10.1210/er.2018-00184 |
| [11] |
ZHANG D F, CHIA C, JIAO X, et al. D-mannose induces regulatory T cells and suppresses immunopathology[J]. Nat Med, 2017, 23(9): 1036-1045. DOI:10.1038/nm.4375 |
| [12] |
TORRETTA S, SCAGLIOLA A, RICCI L, et al. D-mannose suppresses macrophage IL-1β production[J]. Nat Commun, 2020, 11(1): 6343. DOI:10.1038/s41467-020-20164-6 |
| [13] |
GONZALEZ P S, O'PREY J, CARDACI S, et al. Mannose impairs tumour growth and enhances chemotherapy[J]. Nature, 2018, 563(7733): 719-723. DOI:10.1038/s41586-018-0729-3 |
 2023, Vol. 44
2023, Vol. 44


