腰椎退变性疾病(lumbar degenerative disease,LDD)多发生于中老年人群,是引起下腰痛和下肢神经功能障碍的常见原因[1-2]。常见的LDD主要包括腰椎间盘突出、腰椎管狭窄、腰椎滑脱等疾病,严重影响着中老年人群的生活质量[3-4]。非手术治疗是LDD治疗的重要手段,其可通过减轻病变部位的炎症、充血和水肿反应缓解神经组织的压迫症状,并逐步恢复腰椎的正常生物力学特性[5-7]。对于经保守治疗后无明显改善的LDD患者,可以考虑手术治疗[8-9]。
手术治疗可以通过减压、植骨融合和重建脊柱平衡恢复LDD患者的神经功能,改善生活质量[10-13]。许多研究证实,与保守治疗相比,手术治疗LDD能够更好地缓解疼痛和降低患者的致残率,促进患者神经功能的康复,因此也被认为是治疗LDD的标准方案[9, 14]。LDD的诊断主要依靠影像学检查和临床症状,不同类型的LDD可能会对手术方法的选择和效果产生影响。然而,目前LDD的临床分类主要基于患者的影像学表现,如腰椎间盘突出症、腰椎管狭窄症、腰椎滑脱症等,而这些分类并不能反映神经组织本身所处的功能状态。因此,目前的LDD的分类标准对于患者手术策略的选择存在局限性,制约了手术疗效的提高。我们基于既往的临床实践和研究,根据LDD患者神经组织受累的特点和程度,提出了一种新的分类方法,即LDD的神经功能分型(neurological function classification,NFC)。本研究回顾分析了应用NFC分型的LDD患者的临床数据,验证该分型方法的有效性,以期为LDD的外科治疗提供临床参考。
1 资料和方法 1.1 临床资料回顾性分析2019年3月至2020年12月海军军医大学(第二军医大学)第二附属医院骨科收治的LDD患者的临床资料。纳入标准:(1)有不同程度的下腰痛或下肢神经症状,术前MRI检查提示存在有多节段的腰椎退变性改变;(2)经6个月保守治疗后症状均无明显改善;(3)采用同一术式,且根据NFC分型采取相应的手术应对策略。排除标准:(1)有腰椎手术史或退行性腰椎侧弯、其他脊柱疾病(如感染性疾病、强直性脊柱炎、脊柱肿瘤、骨折或神经系统疾病);(2)有心理障碍者;(3)有外科医师认为不适合参与当前研究的其他疾病。本研究获得海军军医大学(第二军医大学)第二附属医院伦理委员会审批。
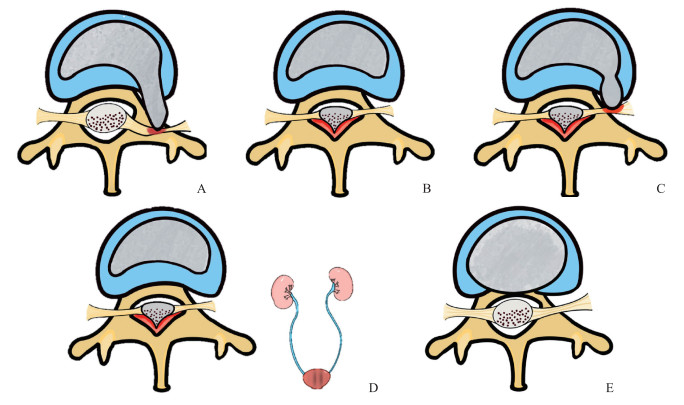
1.2 LDD的NFC及其诊断标准根据LDD患者的神经功能状态,将NFC分为以下5种类型(图 1):神经根型、脊髓马尾型、混合型、马尾综合征型和局灶型。NFC各型的诊断标准如表 1所示。
|
图 1 LDD的NFC示意图 Fig 1 Schematic diagrams of NFC for LDD A: Radicular type; B: Spinal cord and cauda equina type; C: Mixed type; D: Cauda equina syndrome type; E: Focal type. LDD: Lumbar degenerative disease; NFC: Neurological function classification. |
|
|
表 1 LDD的NFC诊断标准 Tab 1 Diagnostic criteria of NFC for LDD |
1.3 手术方法
本研究病例均采用改良经椎间孔入路腰椎椎体间融合术(transforaminal lumbar interbody fusion,TLIF),所有手术均由同一位医师完成。步骤如下:(1)患者麻醉成功后取俯卧位。(2)显露手术节段双侧关节突关节和椎板,完成双侧椎弓根螺钉(山东康盛医疗器械有限公司或大博医疗科技股份有限公司生产)的植入。(3)将融合侧关节突关节切除后植入合适大小的融合器。如该节段不存在椎间盘退变或不稳则不进行融合处理,如对侧无症状则不处理,如存在神经压迫症状则进行开窗减压。(4)经术中X线透视确认螺钉和融合器位置无误后放置引流管,冲洗后关闭切口。所有患者均于术后5~7 d下地活动,配戴腰围8~12周。
1.4 不同NFC类型LDD手术应对策略对于神经根型LDD,仅对症状侧进行单侧减压,而对侧无症状不需要处理。对于脊髓马尾型、混合型和马尾综合征型LDD,由于双侧均存在神经压迫症状,因此需要双侧减压,我们的策略是在症状重的一侧进行融合,症状轻的一侧仅进行开窗减压处理。对于局灶型LDD,根据术者的习惯可选择任意一侧进行融合处理。手术的原则是在确保解除神经压迫的同时,最大限度地保留棘突、棘间韧带和椎板等脊柱后柱结构。
1.5 NFC判断一致性分析选择3名住院医师进行LDD的NFC培训,向每位住院医师详细解释每种类型LDD的特定诊断标准。培训后,先测试每位医师对于NFC的掌握情况并进行修正。通过测试后,3名医师独立对符合条件的病例进行分型。3个月后,所有患者数据被随机排列并打乱顺序,然后再次进行分型。由1位独立的医师记录所有结果,用于一致性分析。
1.6 统计学处理应用SPSS26.0软件进行统计学分析。计量资料以x±s表示,组间比较采用方差分析;计数资料以例数和百分数表示,组间比较采用Fisher确切概率法。一致性比较采用Kappa检验,Kappa值≤0.2为一致性较差,0.21~0.4为一致性一般,0.41~0.6为一致性中等,0.61~0.8为高度一致,0.81~1.0为几乎完全一致[15-16]。通常认为Kappa值>0.6的一致性是良好的,而Kappa值≤0.4则意味着一致性很差[17]。检验水准(α)为0.05。
2 结果 2.1 患者的临床资料本组病例共163例,男92例、女71例,年龄24~84岁,平均年龄(63.4±12.2)岁。其中神经根型、脊髓马尾型、混合型、马尾综合征型和局灶型分别占比30.67%(50例)、25.77%(42例)、23.31%(38例)、4.29%(7例)和15.95%(26例)。手术单节段70例,双节段59例,3个节段及以上34例。163例患者术后均获得随访,随访时间为(19.92±4.95)个月。
2.2 手术情况所有病例手术均获成功,神经根型平均手术时间为(136.14±23.37)min,平均出血量为(189.22±35.67)mL,平均住院时间为(11.64±3.02)d;脊髓马尾型平均手术时间为(186.90±24.45)min,平均出血量为(358.81±47.28)mL,平均住院时间为(12.26±2.82)d;混合型平均手术时间为(173.84±24.07)min,平均出血量为(407.45±50.57)mL,平均住院时间为(11.97±2.84)d;马尾综合征型平均手术时间为(195.71±10.36)min,平均出血量为(369.71±60.90)mL,平均住院时间为(13.71±2.14)d;局灶型平均手术时间为(148.46±19.64)min,平均出血量为(191.73±51.58)mL,平均住院时间为(11.12±2.29)d。以上各指标组间比较差异均无统计学意义(P均>0.05)。
根据Nakai评定标准,优68例(41.72%)、良82例(50.31%)、可8例(4.91%)、差5例(3.07%),优良率为92.02%(表 2)。Fisher确切概率法表明各类型组手术效果的差异有统计学意义(P=0.001),其中马尾综合征类型的患者中手术效果差的患者比例高于其他各类型组,差异有统计学意义(P均<0.05),其余各类型组间比较差异均无统计学意义(P均>0.05)。
|
|
表 2 根据Nakai标准评价LDD不同NFC分型患者的手术效果 Tab 2 Evaluation of surgical effects for LDD patients with various types of NFC according to Nakai criteria |
2.3 术后并发症
术后并发脑脊液漏3例,深部感染2例,融合器移位1例,尿路感染2例,术后谵妄1例,肺部感染2例,下肢血栓1例,其中2例经二次手术后痊愈,余均经对症治疗后好转,患者均顺利出院,随访期间未再复发。不同NFC类型LDD患者术后并发症情况见表 3,Fisher确切概率法结果显示各类型间并发症的发生率差异无统计学意义(P>0.05)。
|
|
表 3 不同NFC类型LDD患者的术后并发症 Tab 3 Postoperative complications of LDD patients with various types of NFC |
2.4 NFC判断一致性
住院医师A、B和C的观察者内Kappa值分别为0.984、0.951和0.968。在第1次分型测试中,住院医师A与B之间的观察者间Kappa值为0.871,住院医师A与C之间的相应值为0.879,住院医师B与C之间的相应值为0.838。在第2次分型测试中,住院医师A与B之间的观察者间Kappa值为0.894,住院医师A与C之间的相应值为0.886,住院医师B与C之间的相应值为0.837。上述结果表明该分型的判断一致性良好,容易掌握。
3 讨论LDD进展过程中主要出现退行性改变的结构包括腰椎关节突关节、黄韧带、后纵韧带、椎间盘、软骨终板、椎体后缘等[18-20]。这些退变的组织可能会引起严重的神经压迫症状,包括下肢感觉异常、疼痛、行走困难,甚至出现鞍区感觉障碍和大小便异常等[21-24]。对于此类患者,保守治疗后可能会获得短期的症状缓解,而从长期来看,症状还会反复发作,可能逐渐进展。因此,通过手术治疗解除神经组织的压迫往往是LDD患者首选的治疗方法[25-27]。
在LDD的外科治疗中,通常按照疾病的病因进行分类从而选择相应手术方案,如腰椎椎间盘病、腰椎椎管狭窄及腰椎退变性滑脱等。依据病因分类固然有助于使手术医师理解LDD的发病机制和临床特点,但我们认为其对于手术方式的选择以及手术操作的指导意义存在局限性,并不能反映手术要解决的核心要素即受压神经组织本身的功能状态。这可能造成手术创伤的增加,相应并发症的增多,进而影响手术的疗效和患者的预后。
考虑到既往LDD病因学分类的不足,我们在长期临床实践的基础上提出了一种基于腰椎神经组织功能状态的新的临床分类标准,即NFC。对于神经根型LDD患者,由于神经组织受压的部位主要位于腰椎椎管侧方,致压原因多为向一侧突出的椎间盘组织、侧隐窝狭窄、关节突关节增生等,而这些病理因素主要影响了神经根走行的路径,因此患者主要表现为下肢神经根性症状。临床上多见于侧方型和极外侧型腰椎间盘突出患者。手术方式的选择可以根据具体致压物的性质选择TLIF、微创经椎间孔入路腰椎椎体间融合术(minimally invasive transforaminal lumbar interbody fusion,misTLIF)、椎间孔镜手术等方式,主要减压范围应围绕神经根走行的部位,而对于无症状的对侧和椎管中央后部结构包括棘突、椎板等应予以保留,在确保手术疗效的同时可以有效减少手术并发症。
脊髓马尾型LDD受压部位主要位于椎管中央,圆锥以上主要受压的是脊髓组织,圆锥以下受压的则是马尾神经。临床上常见的是腰椎椎管狭窄、中央型腰椎间盘突出症患者。主要临床表现为椎管中央神经组织受压所致的间歇性跛行症状。手术方式的选择我们采用TLIF或后路腰椎椎体间融合术(posterior lumbar interbody fusion,PLIF),术中通常进行双侧开窗减压,而椎管中央后部结构通常予以保留以减少手术创伤。混合型LDD则兼有前述2种类型LDD的临床特点,致压物的来源呈多样化,临床上多见于老年长节段LDD患者,此类患者通常存在腰椎多个节段受累,合并退变导致的腰椎管狭窄和椎间盘突出,即有椎管中央部位的神经组织压迫,同时亦存在侧方神经根通路受累引起的下肢根性症状。此类患者由于年龄大,手术节段长,往往存在基础疾病,因此手术并发症发生率相对较高。我们对此类患者的手术策略是对每个手术节段进行细分,如为神经根型,则进行症状侧减压,如为脊髓马尾型,则进行双侧开窗减压,如两者兼而有之,则在神经根受压的一侧扩大减压范围,需确保神经根袖部位获得彻底的松解。
马尾综合征型是LDD的一种特殊类型,通常见于严重的腰椎间盘脱出或腰椎椎管狭窄患者。由于神经组织损害严重,患者表现为大小便功能障碍,即临床上俗称的马尾综合征。此类患者通常需要采用TLIF或PLIF进行彻底的神经组织减压,术中应仔细探查有无神经组织的粘连,避免医源性损伤。本研究纳入的马尾综合征型手术病例中,按照Nakai评定标淮,有42.86%(3/7)的患者手术效果欠佳,其比例显著高于其他各型患者(P<0.05)。这可能与马尾综合征型患者病程时间较长且神经压迫程度较重有关。临床上值得关注的是此类患者通常需要急诊尽早手术,如果神经组织出现不可逆损伤,通常预后较差。
局灶型LDD患者表现为腰痛,通常无下肢神经压迫症状。此类患者影像学检查神经组织无明显累及,可有腰椎局部节段不稳,椎间盘磁共振成像T2信号减低、纤维环撕裂等表现。临床上常见于盘源性腰痛、腰椎峡部裂、滑脱、腰椎不稳的患者。我们认为对于反复性腰痛发作,保守治疗半年以上无明显改善,严重影响生活质量的局灶型LDD患者应进行手术治疗,手术方式应根据致病因素的特点选择,包括腰椎固定融合或微创手术等。
在本研究中,我们基于长期的临床实践提出了一种新的腰椎神经功能分型,即NFC。NFC有助于手术医师根据患者神经组织所处的功能状态,更加科学地选择合适的手术方法,从既往关注LDD的病因转变为更多关注受压神经组织本身所处的状态,从而更好地提高手术方式选择的针对性,提高手术疗效。
本研究仍存在一定的局限性,研究对象随访期较短、病例数较少,这可能会对研究结果造成一定的偏倚。为了更准确地评估NFC的应用效果,今后需要进行更大规模的研究并延长随访时间。本研究为单中心研究,这可能存在样本选择偏倚和地域差异等问题,今后将开展多中心研究,进一步验证LDD的NFC分型的有效性。
| [1] |
王福根. 腰椎间盘突出症临床治疗新理念[J]. 保健医苑, 2014(4): 26-29. |
| [2] |
RAVINDRA V M, SENGLAUB S S, RATTANI A, et al. Degenerative lumbar spine disease: estimating global incidence and worldwide volume[J]. Global Spine J, 2018, 8(8): 784-794. DOI:10.1177/2192568218770769 |
| [3] |
FÖRSTH P, ÓLAFSSON G, CARLSSON T, et al. A randomized, controlled trial of fusion surgery for lumbar spinal stenosis[J]. N Engl J Med, 2016, 374(15): 1413-1423. DOI:10.1056/NEJMoa1513721 |
| [4] |
KIRNAZ S, CAPADONA C, WONG T, et al. Fundamentals of intervertebral disc degeneration[J]. World Neurosurg, 2022, 157: 264-273. DOI:10.1016/j.wneu.2021.09.066 |
| [5] |
ZAINA F, TOMKINS-LANE C, CARRAGEE E, et al. Surgical versus non-surgical treatment for lumbar spinal stenosis[J]. Cochrane Database Syst Rev, 2016, 2016(1): CD010264. DOI:10.1002/14651858.CD010264.pub2 |
| [6] |
ALEEM I S, DREW B. Cochrane in CORR®: surgical versus non-surgical treatment for lumbar spinal stenosis[J]. Clin Orthop Relat Res, 2017, 475(11): 2632-2637. DOI:10.1007/s11999-017-5452-0 |
| [7] |
郭贵宏, 杨物鹏. 腰椎退行性疾病与椎旁肌相关性的研究[J]. 医学信息, 2021, 34(13): 38-40, 59. DOI:10.3969/j.issn.1006-1959.2021.13.010 |
| [8] |
MADIGAN L, VACCARO A R, SPECTOR L R, et al. Management of symptomatic lumbar degenerative disk disease[J]. J Am Acad Orthop Surg, 2009, 17(2): 102-111. DOI:10.5435/00124635-200902000-00006 |
| [9] |
MA X L, ZHAO X W, MA J X, et al. Effectiveness of surgery versus conservative treatment for lumbar spinal stenosis: a system review and meta-analysis of randomized controlled trials[J]. Int J Surg, 2017, 44: 329-338. DOI:10.1016/j.ijsu.2017.07.032 |
| [10] |
赵斌修, 陈晓亮, 王坤正, 等. 156例退变性腰椎疾患手术治疗疗效分析[J]. 颈腰痛杂志, 2008, 29(3): 243-246. DOI:10.3969/j.issn.1005-7234.2008.03.019 |
| [11] |
MACHADO G C, FERREIRA P H, HARRIS I A, et al. Effectiveness of surgery for lumbar spinal stenosis: a systematic review and meta-analysis[J]. PLoS One, 2015, 10(3): e0122800. DOI:10.1371/journal.pone.0122800 |
| [12] |
MUMMANENI P V, DHALL S S, ECK J C, et al. Guideline update for the performance of fusion procedures for degenerative disease of the lumbar spine. Part 11:Interbody techniques for lumbar fusion[J]. J Neurosurg, 2014, 21(1): 67-74. DOI:10.3171/2014.4.spine14276 |
| [13] |
FRITZELL P, HÄGG O, WESSBERG P, et al. 2001 Volvo Award winner in clinical studies: lumbar fusion versus nonsurgical treatment for chronic low back pain[J]. Spine, 2001, 26(23): 2521-2532. DOI:10.1097/00007632-200112010-00002 |
| [14] |
TOSTESON A N A, TOSTESON T D, LURIE J D, et al. Comparative effectiveness evidence from the spine patient outcomes research trial: surgical versus nonoperative care for spinal stenosis, degenerative spondylolisthesis, and intervertebral disc herniation[J]. Spine (Phila Pa 1976), 2011, 36(24): 2061-2068. DOI:10.1097/BRS.0b013e318235457b |
| [15] |
BAETHGE C, FRANKLIN J, MERTENS S. Substantial agreement of referee recommendations at a general medical journal-a peer review evaluation at Deutsches Ärzteblatt International[J]. PLoS One, 2013, 8(5): e61401. DOI:10.1371/journal.pone.0061401 |
| [16] |
LANDIS J R, KOCH G G. The measurement of observer agreement for categorical data[J]. Biometrics, 1977, 33(1): 159-174. DOI:10.2307/2529310 |
| [17] |
徐黎, 李凯, 过哲, 等. 膝关节骨关节炎全关节磁共振成像评分观察者间一致性评价[J]. 骨科临床与研究杂志, 2021, 6(2): 106-111. DOI:10.19548/j.2096-269x.2021.02.009 |
| [18] |
NAKASHIMA H, ISHIKAWA Y, KANEMURA T, et al. Neurological function following early versus delayed decompression surgery for drop foot caused by lumbar degenerative diseases[J]. J Clin Neurosci, 2020, 72: 39-42. DOI:10.1016/j.jocn.2020.01.039 |
| [19] |
BATTIÉ M C, JOSHI A B, GIBBONS L E. Degenerative disc disease: what is in a name?[J]. Spine (Phila Pa 1976), 2019, 44(21): 1523-1529. DOI:10.1097/BRS.0000000000003103 |
| [20] |
王一, 戴国钢, 黄雷, 等. 腰椎退行性疾病矢状面失衡及结构因素研究[J]. 华西医学, 2017, 32(4): 529-533. DOI:10.7507/1002-0179.201507157 |
| [21] |
RADWANSKI R E, KORTZ M W, ROTHBAUM M, et al. Qualitative methodology for planning and executing in-person and virtual neurosurgery educational opportunities for medical students: lessons learned from five years of medical student neurosurgery training center initiatives[J]. World Neurosurg, 2022, 163: 164-170. DOI:10.1016/j.wneu.2022.03.009 |
| [22] |
SHEIN D, SHUE J, GIRARDI F. Evaluation of Aesculap Implant Systems activl Artificial Disc for the treatment of degenerative disc disease[J]. Expert Rev Med Devices, 2016, 13(12): 1069-1072. DOI:10.1080/17434440.2016.1256771 |
| [23] |
CHIRCHIGLIA D, CHIRCHIGLIA P, MURRONE D, et al. Clinical-neurophysiological-neuroradiological discordance in lumbar degenerative disc disease: should the neurosurgeon have the last word?[J]. J Neurosurg Sci, 2020, 64(3): 307-308. DOI:10.23736/s0390-5616.18.04508-3 |
| [24] |
吴巷, 李勤, 张晋. 加速康复外科理念在腰椎退变性疾病围手术期中的应用[J]. 医学信息, 2020, 33(10): 48-50, 54. DOI:10.3969/j.issn.1006-1959.2020.10.014 |
| [25] |
REID P C, MORR S, KAISER M G. State of the union: a review of lumbar fusion indications and techniques for degenerative spine disease[J]. J Neurosurg, 2019, 31(1): 1-14. DOI:10.3171/2019.4.spine18915 |
| [26] |
TRENT C G. The surgical treatment of lumbar degenerative disc disease[J]. J S C Med Assoc, 2000, 96(11): 454-458. |
| [27] |
AHN Y. Endoscopic spine discectomy: indications and outcomes[J]. Int Orthop, 2019, 43(4): 909-916. DOI:10.1007/s00264-018-04283-w |
 2023, Vol. 44
2023, Vol. 44


