随着年龄的增长,动脉粥样硬化性心脑血管疾病(atherosclerotic cardio-cerebrovascular disease,ASCCVD)的患病率明显升高,已成为严重威胁老年人生存和生活质量的主要疾病。血脂异常是ASCCVD发病的主要原因,故老年人群应特别注重血脂调控。他汀类药物是血脂异常的首选降脂药,目前多数血脂异常的老年人正在接受他汀类药物的治疗,以降低低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平。在LDL-C降至目标水平时,超过50%的患者仍然会出现突发的心血管事件[1]。因此,我们还将面临新的挑战,须持续重视动脉粥样硬化的治疗,应对心血管意外事件的发生[2]。颈动脉斑块不稳定性是引发急性脑缺血及急性脑梗死的危险因素。本研究拟探讨LDL-C<3.40 mmol/L(1 300 mg/L)[3]的老年人群颈动脉粥样硬化与血清学的相关性,以期为ASCCVD的临床治疗提供客观指标。
1 资料和方法 1.1 研究对象回顾性分析2021年5月至2022年5月来我院就诊的188例年龄≥65岁的颈动脉粥样硬化患者的临床资料。纳入标准:(1)血脂、血糖、肾功能等资料完整;(2)年龄≥65岁;(3)超声检查提示颈动脉内膜增厚或颈动脉存在斑块;(4)接受他汀类药物治疗至少2个月,且LDL-C<3.40 mmol/L。排除标准:(1)超声图像质量差,模糊、不清晰者;(2)颈动脉支架或内膜剥脱术后患者。
1.2 仪器与方法 1.2.1 仪器检查仪器为具有超微血管成像(superbmicro-vascular imaging,SMI)功能的Aplio 900彩色超声诊断仪(日本东芝公司),探头频率为4~9 MHz。
1.2.2 方法颈动脉超声常规检查:要求患者取仰卧位、头部放松,颈部略向扫查侧的对向倾斜。动态扫查颈总动脉起始段、中段、球部以及颈内、颈外动脉起始段至远端,对这些部位的颈动脉内膜厚度、斑块位置与厚度、斑块回声及是否存在溃疡进行观察并测量。根据颈动脉粥样硬化诊断标准[4]将患者分为斑块组和无斑块组。
SMI检查:在二维声像图中选择1枚最厚斑块,取其最大切面,然后启动灰阶模式SMI和彩色模式SMI,调整图像的深度与增益,多层面、多角度观察斑块内有无点线状增强回声及数目,并记录SMI分级。根据超声SMI检查结果,将斑块组进一步分为新生血管组和无新生血管组。
1.3 诊断及SMI分级标准颈动脉粥样硬化诊断标准[4]:颈动脉内-中膜光滑完整,内-中膜厚度(intima-media thickness,IMT)<1.0 mm为正常,IMT≥1.0 mm为内-中膜增厚。局部隆起、增厚,向管腔内突出,IMT≥1.5 mm,或彩色多普勒超声显示管腔某处彩色血流缺损,则为颈动脉硬化斑块形成。
SMI及超声造影的微血管信号均表现为点线状增强回声,故2种检查方法可采用同一分级标准。根据颈动脉超声造影分级标准[5]分级如下:SMI 0级,斑块内无显著血流信号;SMI 1级,斑块肩部或基底部可见点状或短线状血流信号;SMI 2级,斑块肩部和基底部可见线状血流信号。
1.4 统计学处理应用SPSS 26.0软件进行统计学分析。呈正态分布的计量资料以x±s表示,多组间比较采用方差分析;呈偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,多组间比较采用Kruskal-Wallis H检验。计数资料以例数表示,组间比较采用χ2检验。采用Spearman秩相关分析评估各指标与斑块组SMI分级的相关性。采用多元线性回归评估影响斑块组SMI分级的血清学危险因素。所有检验均为双侧检验,检验水准(α)为0.05。
2 结果 2.1 患者一般临床资料比较188例患者中无斑块组57例,年龄为74.0(71.5,79.5)岁;斑块组131例,年龄为76.5(71.0,82.0)岁。根据超声SMI检查结果,进一步将斑块组分为新生血管组(即不稳定斑块组)和无新生血管组(即稳定斑块组),新生血管组77例,年龄为77.0(72.5,82.0)岁;无新生血管组54例,年龄为75.5(71.8,82.0)岁。所有患者均服用降血脂他汀类药物至少2个月并且LDL-C<3.40 mmol/L。无斑块组、无新生血管组、新生血管组患者的年龄、性别、LDL-C、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、血糖、尿酸、肌酐、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)/高密度脂蛋白胆固醇(high-density lipoproteincholesterol,HDL-C)比值差异均无统计学意义(P均>0.05)。3组间HDL-C、TG/HDL-C比值、小而密低密度脂蛋白胆固醇(small and dense low-density lipoprotein cholesterol,sdLDL-C)差异均有统计学意义(P均<0.05)。见表 1。
|
|
表 1 颈动脉粥样硬化患者一般临床资料比较 |
2.2 斑块组不同SMI分级患者各指标比较
典型病例颈动脉斑块SMI影像图见图 1。
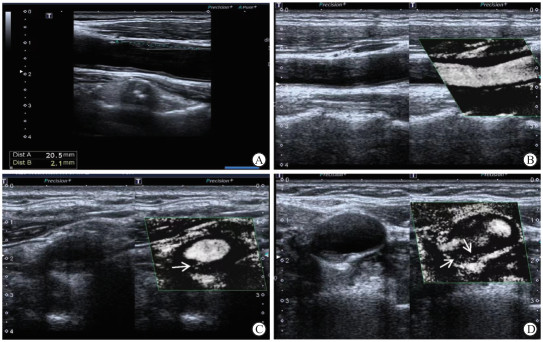
|
图 1 典型病例颈动脉斑块SMI影像图 A:患者1(女,70岁,sdLDL-C水平为1.42 mmol/L),颈动脉内膜不均匀增厚,前壁见低回声斑块,斑块厚度2.1 mm;B:患者1,斑块SMI分级0级,斑块内无显著的血流信号;C:患者2(男,66岁,sdLDL-C水平为1.86 mmol/L),斑块厚度2.3 mm,斑块SMI分级1级(箭头示斑块肩部短线状增强回声);D:患者3(男,77岁,sdLDL-C水平为2.02 mmol/L),斑块厚度2.5 mm,斑块SMI分级2级(箭头示斑块肩部及基底部线状增强回声).SMI:超微血管成像;sdLDL-C:小而密低密度脂蛋白胆固醇. |
如表 2所示,斑块组SMI 0级、SMI 1级、SMI 2级患者的颈动脉斑块厚度和sdLDL-C水平依次升高,在3个SMI分级间的差异均有统计学意义(P均<0.01);LDL-C/HDL-C比值、TG/HDL-C比值在3个SMI分级间的差异均无统计学意义(P均>0.05)。
|
|
表 2 斑块组不同SMI分级的颈动脉粥样硬化患者各项指标比较 |
2.3 斑块组各指标与SMI分级的相关性
Spearman秩相关分析结果显示,斑块厚度、sdLDL-C水平与SMI分级之间呈正相关(r=0.758,P<0.01;r=0.676,P<0.05),LDL-C/HDL-C比值、TG/HDL-C比值与SMI分级无关(P均>0.05)。
2.4 影响斑块组SMI分级的危险因素采取逐步回归的方式对多元回归的自变量进行筛选。将斑块厚度、sdLDL-C、LDL-C/HDL-C比值、TG/HDL-C比值作为自变量,将SMI分级作为因变量进行线性回归分析,结果显示斑块厚度、sdLDL-C水平是影响斑块SMI分级的危险因素(R2=0.608,调整R2=0.595,F(4, 126)=48.773,P<0.001,D-W值为2.301)。见表 3。
|
|
表 3 LDL-C水平正常的老年人颈动脉斑块SMI分级危险因素的线性回归分析 |
3 讨论
在过去50年间,世界人口老龄化一直在持续。预计在未来50年内,全球60岁及以上人口数将达到20亿[6]。到2050年,中国60岁以上人口将突破4亿,占总人口的30%以上[6]。因此老年人健康是全社会应该关注和重视的问题,老年人心脑血管疾病的发生是近年来中国面临的最大挑战。近年来,国内外大量的临床研究表明,降脂疗法可显著降低心血管病的发生率和死亡率,LDL-C会导致动脉粥样硬化,是降脂治疗的主要靶点[7-9]。因此,正确认识和掌握老年人群的血脂异常状况,并采取相应的健康管理措施来有效地控制其血脂异常,对于促进老年人群的健康有着十分重要的作用。
本研究应用SMI技术检测颈动脉斑块内的新生血管来判定斑块的稳定性,并进一步研究LDL-C水平正常的老年人颈动脉硬化斑块的形成及稳定性与血脂指标的关系,以期指导临床判定与规范用药。超声SMI技术不需要使用造影剂辅助,空间分辨率高,运动伪象少,成像帧率高。SMI技术可以对混乱的运动信号进行智能分析,利用新的自适应算法识别和去除组织的移动,从而显示真正的血液流动。因此,应用SMI技术可以检测出常规多普勒技术无法检测到的速度较慢的血液流动,量化新生血管数目。与超声造影相比,SMI技术有可重复操作、敏感性高等独特优势[10],现已广泛应用于甲状腺、乳腺、妇科、关节、胎儿等的检查中。本研究以二维灰阶超声为基础,通过观察斑块的厚度、形状、边缘是否规则以及斑块回声是否均匀等多种特征再结合SMI技术综合判定斑块的稳定性,这样才不会对新生血管的判断造成漏诊或者误诊,为临床早诊断、早干预、早治疗提供依据。SMI不但对新生血管的检出及分级与超声造影结果具有高度的一致性,对新生血管部位、形态的显示与超声造影结果也高度一致。SMI技术检测颈动脉斑块内新生血管数目与斑块内新生血管的病理组织学密度高度一致[11]。由此可见,通过SMI技术结合二维灰阶超声图像为斑块内新生血管的判定提供了新的无创检查方法。
血脂异常是一种常见的心脑血管疾病风险因子[12]。血脂异常与颈动脉斑块发生的危险性增高有关,在有3种以上血脂异常患者中出现颈动脉斑块的危险性更高[13]。既往学者普遍认为LDL-C是导致动脉粥样硬化和心血管疾病的重要因素,LDL-C达到一定的控制标准是预防心血管疾病的第一要务,但是老年人心脑血管事件一直在发生[14]。本研究纳入的病例均为年龄≥65岁、LDL-C<3.40 mmol/L的老年人群,分为斑块组、无斑块组,根据超声SMI结果又进一步将斑块组分为新生血管组和无新生血管组,即不稳定斑块组和稳定斑块组。本研究结果显示HDL-C、TG/HDL-C比值、sdLDL-C水平在无斑块组、无新生血管组、新生血管组间具有差异性,可能成为评估LDL-C水平正常的老年人动脉硬化斑块形成及斑块是否稳定的指标,但并未显示老年人动脉硬化血清学指标LDL-C、LDL-C/HDL-C比值存在差异。斑块形成的重要指标HDL-C具有抗动脉粥样硬化及神经保护的作用,可降低脑梗死的损伤程度[15]。HDL-C通过诱导逆向胆固醇转运发挥抗动脉粥样硬化功能,高水平的HDL-C可以保护血管,减少动脉硬化斑块的形成[16]。因此HDL-C水平越高对血管壁越具有保护作用。TG和HDL-C是2个相互独立的ASCCVD危险因素,但如果患者同时伴有高水平的TG和低水平的HDL-C,则具有显著的致动脉粥样硬化作用。既往研究表明,TG/HDL-C比值与高血压发病风险关系密切[17]。较高水平的TG/HDL-C比值可以预测冠状动脉慢血流现象的存在,灵敏度为72%、特异度为71%[18]。据报道TG/HDL-C比值已作为西班牙裔和非洲裔美国人胰岛素抵抗、β细胞功能受损和糖尿病的预测指标[19]。而一项前瞻性研究提出,在中国人群中,较高的TG/HDL-C比值与主要心血管事件的风险增加相关,TG/HDL-C比值较LDL-C具有更高的预测价值[20]。与低TG/HDL-C比值的参与者相比,高TG/HDL-C比值参与者的主要心血管风险增加了26%[20]。TG/HDL-C比值可能有助于评估一种新的贝特类药物的效果,与目前使用的传统贝特类药物相比,其能更有效地降低TG水平和增加HDL-C水平[21]。综上所述,TG/HDL-C比值被认为是血浆动脉粥样硬化、胰岛素抵抗及药物治疗指数的新替代指标[22-24]。分析其原因,TG/HDL-C能更可靠地反映低密度脂蛋白颗粒的大小,TG/HDL-C比值越高,低密度脂蛋白颗粒越小,小颗粒低密度脂蛋白容易被氧化和浸润内皮细胞,更容易引起动脉硬化[25]。在临床上通常把LDL-C作为降血脂治疗的重点,并以它为血脂异常调节的基石,常常忽略了TG与HDL-C的达标同样十分重要,因此通过综合干预心血管病多重危险因素,全面控制混合性血脂异常,不但要使老年人LDL-C水平达标,更要重视降低TG水平和升高HDL-C水平。本研究结果显示,TG/HDL-C比值能更为敏感地反映LDL-C水平正常的老年人动脉硬化的程度,可以成为老年人心血管疾病风险的关键预测指标。
sdLDL-C是预测动脉粥样硬化的最佳指标,是动脉硬化的定量危险标志物。sdLDL-C与不同炎症细胞如白细胞、中性粒细胞和淋巴细胞计数之间存在显著相关性,与单核细胞计数之间呈弱正相关[26]。因此,sdLDL-C可能与动脉粥样硬化的炎症过程密切相关。sdLDL-C与炎症标志物超敏CRP亦存在密切联系[27]。有研究表明sdLDL-C能引起颈动脉斑块的不稳定,是急性脑梗死发病的独立危险因素,可能是该病的早期血清标志物[28]。本研究结果显示斑块组SMI 0级、1级、2级患者随着新生血管数目的增加,斑块厚度、sdLDL-C水平也逐渐增加。斑块厚度、sdLDL-C指标会对新生血管数目分级产生显著的正向影响,表明斑块厚度、sdLDL-C指标是影响斑块内新生血管形成和斑块稳定性的危险因素。sdLDL-C参与动脉硬化及动脉硬化斑块内炎症反应过程,动脉内膜受到损伤,发生炎症反应时,大量的细胞因子会使单核细胞附着到内皮细胞上,经过芽生、迁移、增殖、基质重构等过程,导致新的血管生成[29]。斑块中的新生血管是导致斑块不稳定的重要原因。当斑块内新生血管数目增加,血管壁变脆,斑块脱落,形成血栓的风险增加。颈动脉斑块的不稳定性也可进一步增加缺血性脑卒中的风险。动脉粥样硬化斑块及斑块内新生血管存在相互作用,动脉内膜增厚受损、斑块内炎性作用、血管壁氧弥散能力的减低等一系列原因造成新生血管的形成,而新生血管由于结构的原因容易破裂及渗入毒性物质及炎性血浆,导致斑块不断增厚、增大。
本研究结果显示斑块厚度、sdLDL-C可作为LDL-C水平正常老年人动脉硬化斑块内新生血管和斑块不稳定的危险因素,为临床提供了客观依据。本研究存在以下局限性:(1)入组病例数较少,且均为年龄≥65岁、LDL-C<3.40 mmol/L的老年人群。(2)主要关注血清学指标,并未涉及其他因素的考虑。希望今后能扩大样本量,拓展探讨老年人动脉硬化与血清学指标的关系。
| [1] |
XIAO C T, DASH S, MORGANTINI C, et al. Pharmacological targeting of the atherogenic dyslipidemia complex: the next frontier in CVD prevention beyond lowering LDL cholesterol[J]. Diabetes, 2016, 65: 1767-1778. DOI:10.2337/db16-0046 |
| [2] |
ALKHALIL M. Mechanistic insights to target atherosclerosis residual risk[J]. Curr Probl Cardiol, 2021, 46: 100432. DOI:10.1016/j.cpcardiol.2019.06.004 |
| [3] |
MACH F, BAIGENT C, CATAPANO A L, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk[J]. Eur Heart J, 2020, 41: 111-188. DOI:10.1093/eurheartj/ehz455 |
| [4] |
TOUBOUL P J, HENNERICI M G, MEAIRS S, et al. Mannheim carotid intima-media thickness consensus (2004-2006). An update on behalf of the Advisory Board of the 3rd and 4th Watching the Risk Symposium, 13th and 15th European Stroke Conferences, Mannheim, Germany, 2004, and Brussels, Belgium, 2006[J]. Cerebrovasc Dis, 2007, 23: 75-80. DOI:10.1159/000097034 |
| [5] |
张雪松, 李晶, 石光煜, 等. 超微血管成像评价半夏白术天麻汤改善高血压痰湿壅盛型颈动脉硬化斑块稳定性的效果[J]. 第二军医大学学报, 2021, 42(7): 823-829. ZHANG X S, LI J, SHI G Y, et al. Superb micro-vascular imaging for evaluation of Banxia Baizhu Tianma decoction in improving stability of carotid atherosclerotic plaque of hypertension with phlegm dampness obstruction[J]. Acad J Sec Mil Med Univ, 2021, 42(7): 823-829. DOI:10.16781/j.0258-879x.2021.07.0823 |
| [6] |
健康界. 中国老龄化发展的进程和认识误区[EB/OL]. (2022-05-05)[2022-10-09] https://www.cn-healthcare.com/articlewm/20220504/content-1348861.html.
|
| [7] |
吕军, 薛刚. 软肝降脂胶囊治疗痰瘀痹阻型稳定性心绞痛合并颈动脉硬化斑块疗效观察[J]. 河北中医, 2020, 42(2): 214-217. |
| [8] |
曾莉梅. 抗氧化、抗血小板和降脂三联疗法治疗脑梗死患者颈动脉粥样硬化斑块的临床研究[J]. 中西医结合心血管病电子杂志, 2017, 5(29): 52. DOI:10.16282/j.cnki.cn11-9336/r.2017.29.038 |
| [9] |
National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel Ⅲ). Third report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel Ⅲ) final report[J]. Circulation, 2002, 106: 3143-3421. |
| [10] |
ZHOU Y, WANG C. Superb microvascular imaging for detecting neovascularization of carotid plaque compared with contrast-enhanced ultrasound: a protocol for systematic review and meta analysis[J]. Medicine (Baltimore), 2020, 99(35): e21907. DOI:10.1097/MD.0000000000021907 |
| [11] |
CHEN X, WANG H, JIANG Y, et al. Neovascularization in carotid atherosclerotic plaques can be effectively evaluated by superb microvascular imaging (SMI): initial experience[J]. Vasc Med, 2020, 25(4): 328-333. DOI:10.1177/1358863X20909992 |
| [12] |
LIU H H, LI J J. Aging and dyslipidemia: a review of potential mechanisms[J]. Ageing Res Rev, 2015, 19: 43-52. DOI:10.1016/j.arr.2014.12.001 |
| [13] |
刘俭, 马学华, 闫乐媛, 等. 某科研人群血脂异常与颈动脉斑块发病关系的前瞻性队列研究[J]. 中华流行病学杂志, 2019, 40(3): 341-345. DOI:10.3760/cma.j.issn.0254-6450.2019.03.016 |
| [14] |
YANG Y Y, YAN B Y, FU M D, et al. Relationship between plasma lipid concentrations and HDL subclasses[J]. Clin Chimica Acta, 2005, 354: 49-58. DOI:10.1016/j.cccn.2004.11.015 |
| [15] |
VAN CAPELLEVEEN J C, BOCHEM A E, MOTAZACKER M M, et al. Genetics of HDL-C: a causal link to atherosclerosis?[J]. Curr Atheroscler Rep, 2013, 15: 326. DOI:10.1007/s11883-013-0326-8 |
| [16] |
NASR H, TORSNEY E, POSTON R N, et al. Investigating the effect of a single infusion of reconstituted high-density lipoprotein in patients with symptomatic carotid plaques[J]. Ann Vasc Surg, 2015, 29: 1380-1391. DOI:10.1016/j.avsg.2015.04.084 |
| [17] |
LIU D C, GUAN L, ZHAO Y, et al. Association of triglycerides to high-density lipoprotein-cholesterol ratio with risk of incident hypertension[J]. Hypertens Res, 2020, 43: 948-955. DOI:10.1038/s41440-020-0439-8 |
| [18] |
ACIKSARI G, CETINKAL G, KOCAK M, et al. The relationship between triglyceride/high-density lipoprotein cholesterol ratio and coronary slow-flow phenomenon[J]. Int J Cardiovasc Imaging, 2022, 38: 5-13. DOI:10.1007/s10554-021-02387-w |
| [19] |
YOUNG K A, MATURU A, LORENZO C, et al. The triglyceride to high-density lipoprotein cholesterol (TG/HDL-C) ratio as a predictor of insulin resistance, β-cell function, and diabetes in Hispanics and African Americans[J]. J Diabetes Complicat, 2019, 33: 118-122. DOI:10.1016/j.jdiacomp.2018.10.018 |
| [20] |
CHEN Z K, CHEN G Z, QIN H L, et al. Higher triglyceride to high-density lipoprotein cholesterol ratio increases cardiovascular risk: 10-year prospective study in a cohort of Chinese adults[J]. J Diabetes Investig, 2020, 11: 475-481. DOI:10.1111/jdi.13118 |
| [21] |
TANI S. The ratio of triglyceride to high-density lipoprotein cholesterol as an indicator of risk stratification for atherosclerotic cardiovascular disease in a clinical setting[J]. Intern Med, 2020, 59: 2639-2640. DOI:10.2169/internalmedicine.5344-20 |
| [22] |
CHEN Y X, CHANG Z G, LIU Y J, et al. Triglyceride to high-density lipoprotein cholesterol ratio and cardiovascular events in the general population: a systematic review and meta-analysis of cohort studies[J]. Nutr Metab Cardiovasc Dis, 2022, 32: 318-329. DOI:10.1016/j.numecd.2021.11.005 |
| [23] |
VAN LINTHOUT S, SPILLMANN F, SCHULTHEISS H P, et al. High-density lipoprotein at the interface of type 2 diabetes mellitus and cardiovascular disorders[J]. Curr Pharm Des, 2010, 16: 1504-1516. DOI:10.2174/138161210791051031 |
| [24] |
MURGUÍA-ROMERO M, JIMÉNEZ-FLORES J R, SIGRIST-FLORES S C, et al. Plasma triglyceride/HDL-cholesterol ratio, insulin resistance, and cardiometabolic risk in young adults[J]. J Lipid Res, 2013, 54: 2795-2799. DOI:10.1194/jlr.M040584 |
| [25] |
YOKOYAMA K, TANI S, MATSUO R, et al. Increased triglyceride/high-density lipoprotein cholesterol ratio may be associated with reduction in the low-density lipoprotein particle size: assessment of atherosclerotic cardiovascular disease risk[J]. Heart Vessels, 2019, 34: 227-236. DOI:10.1007/s00380-018-1247-9 |
| [26] |
HSU S H J, JANG M H, TORNG P L, et al. Positive association between small dense low-density lipoprotein cholesterol concentration and biomarkers of inflammation, thrombosis, and prediabetes in non-diabetic adults[J]. J Atheroscler Thromb, 2019, 26: 624-635. DOI:10.5551/jat.43968 |
| [27] |
IZUMIDA T, NAKAMURA Y, HINO Y, et al. Combined effect of small dense low-density lipoprotein cholesterol (sdLDL-C) and remnant-like particle cholesterol (RLP-C) on low-grade inflammation[J]. J Atheroscler Thromb, 2020, 27: 319-330. DOI:10.5551/jat.49528 |
| [28] |
XUE Q Z, MENG A G, WANG T, et al. Correlation between of small dense low-density lipoprotein cholesterol with acute cerebral infarction and carotid atherosclerotic plaque stability[J]. J Clin Lab Anal, 2019, 33: e22891. DOI:10.1002/jcla.22891 |
| [29] |
LYU Q, TIAN X J, DING Y F, et al. Evaluation of carotid plaque rupture and neovascularization by contrast-enhanced ultrasound imaging: an exploratory study based on histopathology[J]. Transl Stroke Res, 2021, 12: 49-56. DOI:10.1007/s12975-020-00825-w |
 2023, Vol. 44
2023, Vol. 44


