2. 海军军医大学(第二军医大学)海军特色医学中心航空医学研究室, 上海 200433
2. Department of Aviation Medicine, Naval Medical Center, Naval Medical University(Second Military Medical University), Shanghai 200433, China
患者男,23岁,某部直升机飞行员,既往体健,近一年无影响飞行事件发生,空中生活适应,因“体检发现转氨酶升高3个多月”于2019年4月10日入住空军杭州特勤疗养中心。入院时无腹胀、腹痛,无乏力、厌食等不适主诉。入院体格检查:发育良好,神志清楚,全身皮肤、巩膜未见黄染。心肺腹未及阳性体征。入院后查尿常规、血糖、血脂、感染八项、血沉、癌胚抗原、甲胎蛋白均无明显异常,大便常规隐血阳性。白细胞计数3.7×109/L(偏低),丙氨酸转氨酶68.2 U/L(偏高),抗链球菌溶血素O 569 IU/mL(偏高),类风湿因子35.3(偏高)。自身抗体谱示抗核抗体(antinuclear antibody,ANA)、抗SS-A、抗SS-B、抗RO-52阳性,其他均正常;Epstein-Barr(EB)病毒壳抗原IgA、IgG阳性;巨细胞病Ig抗体阳性;EB病毒DNA、呼吸道九联检测均正常。血液免疫指标示:IgG 16.3 g/L(升高),IgA 2.63 g/L,IgM 0.71 g/L,IgE 34.9 g/L,IgG4 1 360 mg/L,补体C3 0.894 g/L(降低),补体C4 0.157 g/L。心电图示窦性心动过缓,心率58 min-1。腹部超声示肝、胆、胰、脾、双肾未见明显异常,双侧输尿管未见扩张,盆腔未见积液。心脏彩色多普勒超声检查示心脏各腔室大小正常,左心功能正常。腹部超声、胸部CT检查未见异常。24 h动态心电图示窦性心律,正常范围心电图。活动平板负荷试验阴性。
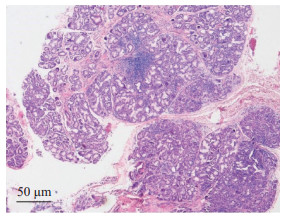
患者入院后,嘱其注意休息,避免熬夜,避免受凉,予保肝治疗后复查肝功能未见异常。复查风湿三项结果示抗链球菌溶血素O、类风湿因子偏高,自身抗体谱示ANA、抗SS-A、抗SS-B、抗RO-52阳性,无口干、眼干,无腹痛、黄疸等症状,排除病毒性肝炎、药物性肝损伤、饮酒等其他病因。唇部腺体活检示腺小叶腺泡内可见淋巴浆细胞浸润,部分区域每灶淋巴细胞>50个(图 1)。风湿免疫科诊断其为干燥综合征,予白芍总苷胶囊、复方甘草酸苷片、硫酸羟氯喹片口服治疗。2019年5月5日复查,抗链球菌溶血素O为429 IU/mL、类风湿因子为31.9,予以出院。认为暂时飞行不合格,地面观察1个月。出院医嘱:规律作息,避免熬夜;继续服用白芍总苷胶囊0.6 g(口服,每天3次),硫酸羟氯喹片0.1 g(口服,每天2次),复方甘草酸苷片150 mg(口服,每天3次);2周后复查肝功能,如有不适,随时就诊。
|
图 1 唇部腺体活检结果 苏木精-伊红染色.唇腺组织有多个淋巴细胞浸润灶,呈现明显的淋巴细胞聚集. |
2019年5月31日,该飞行员返院复查,抗链球菌溶血素O为486 IU/mL,类风湿因子为34.2,自身抗体谱示ANA、抗SS-A、抗AMA-M2、抗CENP-B、抗核糖体P蛋白抗体、抗RO-52阳性,其余均阴性。建议其继续服用白芍总苷胶囊、复方甘草酸苷片及硫酸羟氯喹片,1个月后复查。2019年6月下旬在医师建议下停服药物,7月9日复查抗链球菌溶血素O偏高(356 IU/mL),血常规、肝肾功能均无异常。飞行结论为飞行合格。嘱患者出院后定期复查。2019年11月7日入院复查,抗链球菌溶血素O降为305 IU/mL,类风湿因子降为25.2。
2 讨论干燥综合征是最常见的自身免疫疾病之一,可作为原发性综合征或继发性综合征存在[1-2]。干燥综合征的特征性症状包括眼干、口干、疲劳、肌肉骨骼疼痛和主要唾液腺肿胀。在某些情况下,外分泌腺的逐渐进行性损伤和功能障碍会导致全身干燥。由于外分泌腺遍布全身,其并发症可能包括皮肤干燥、慢性瘙痒、干眼症、鼻出血、耳干、耳痒、口眼干涩、咳嗽、干燥性阴道炎和性交困难[3]。约25%的干燥综合征患者发生内脏受累,非霍奇金B细胞淋巴瘤是本病的主要并发症[4]。干燥综合征是仅次于类风湿关节炎的第二大最常见的自身免疫性风湿性疾病,但其发病率在中国较低[5]。与大多数自身免疫病一样,干燥综合征在女性中多见,男女发病比例为1∶9。发病高峰出现在40~55岁,典型患者通常为围绝经期女性[6]。本文报道了1例较为罕见的以转氨酶升高为首发表现的年轻男性飞行员干燥综合征的诊治过程及后续体检鉴定工作,总结了干燥综合征的临床表现、治疗方案及体检鉴定工作。
由于干燥综合征起病隐匿,进展缓慢,能引起全身多器官免疫性损伤,早期诊断和治疗存在较多困难,常导致病情迁延难愈,累及各器官系统并造成功能损害,可能影响到飞行员的飞行安全。全面的康复指导、细心的病情观察是预防并发症、决定患者预后的关键。由于我军飞行员患干燥综合征较为少见,我国的各类航空人员体格检查标准及指南中均未对干燥综合征的医学鉴定做出明确规定[7]。医学鉴定委员会应根据医学鉴定的基本原则,结合飞行员实际病情做出飞行合格与否的结论。飞行合格与否,主要取决于干燥综合征的继发症状是否影响飞行安全。干燥综合征的继发症状主要包括口腔及眼睛症状[8]、皮肤表现(皮肤干燥、雷诺现象、皮肤血管炎和环状红斑)[9]、胃肠道表现(食道吞咽困难、胃食管反流、胃不适、慢性腹泻、便秘)[10-11]、呼吸系统症状(咳嗽和呼吸困难)[12-14]、神经系统疾病(轴突感觉/感觉运动性多发性神经病、小纤维感觉神经病、感觉性共济失调性神经病、颅神经病变、神经根神经病、自主神经病变、慢性炎性脱髓鞘性多发性神经病和多发性单神经炎)[15-16]。
该患者既往健康,2019年4月因体检发现转氨酶升高入院,白细胞计数偏低、肝功能受损、抗链球菌溶血素O偏高、类风湿因子偏高。自身抗体谱示ANA、抗SS-A、抗SS-B、抗RO-52阳性,EB病毒壳抗原IgA、IgG阳性,巨细胞病Ig抗体阳性。本例干燥综合征患者无口干、眼干等症状,较为罕见,容易误诊误治。结合唇腺活检结果(腺小叶腺泡内可见淋巴浆细胞浸润),明确诊断为干燥综合征。由于现役飞行员医学鉴定的基本要求为身体健康状况能满足飞行工作的需要,该飞行员的继发症状可能会影响飞行安全,且继续飞行可能会加重症状,医院给予“暂时飞行不合格,地面观察1个月”的结论,住院进行积极治疗,并进行各系统检查以确定是否存在其他器官损伤。本例患者经过白芍总苷胶囊、复方甘草酸苷片和硫酸羟氯喹片口服治疗后,抗链球菌溶血素O及类风湿因子降低,血液指标恢复正常,肝功能恢复正常,说明患者对治疗反应较好。规范治疗和健康指导3个月后,复查抗链球菌溶血素O虽仍偏高,但血常规、肝肾功能均无异常。考虑其为青年男性、既往体健、飞行意愿强烈,无口干眼干、无腹痛黄疸等症状,无任何不适,饮食、睡眠、精神、耐力均正常,不会发生空中失能,因此给予“飞行合格”结论。相关诊疗科室建立年度随访登记,持续予以系统性健康教育。出院后,患者严格按照医嘱进行服药,定期复查肝肾功能,每年行1~2次专科复查,检测类风湿因子、补体C3、补体C4以及冷球蛋白等指标,不适随诊。近期该飞行员复查肝肾功能未见明显异常,按计划参加各项工作任务,无明显不适。该例干燥综合征飞行员成功放飞,为今后相关疾病的体检鉴定提供了经验。经规范治疗和健康指导后,若复查血常规、肝肾功能均无异常,无特异性症状,可予“飞行合格”结论。
| [1] |
BRITO-ZERÓN P, BALDINI C, BOOTSMA H, et al. Sjögren syndrome[J]. Nat Rev Dis Primers, 2016, 2: 16047. DOI:10.1038/nrdp.2016.47 |
| [2] |
MAVRAGANI C P, MOUTSOPOULOS H M. Sjögren's syndrome[J]. Annu Rev Pathol, 2014, 9: 273-285. DOI:10.1146/annurev-pathol-012513-104728 |
| [3] |
VAN NIMWEGEN J F, ARENDS S, VAN ZUIDEN G S, et al. The impact of primary Sjögren's syndrome on female sexual function[J]. Rheumatology (Oxford), 2015, 54(7): 1286-1293. DOI:10.1093/rheumatology/keu522 |
| [4] |
VOULGARELIS M, GIANNOULI S, ANAGNOSTOU D, et al. Combined therapy with rituximab plus cyclophosphamide/doxorubicin/vincristine/prednisone (CHOP) for Sjögren's syndrome-associated B-cell aggressive non-Hodgkin's lymphomas[J]. Rheumatology (Oxford), 2004, 43(8): 1050-1053. DOI:10.1093/rheumatology/keh248 |
| [5] |
QIN B, WANG J, YANG Z, et al. Epidemiology of primary Sjögren's syndrome: a systematic review and meta-analysis[J]. Ann Rheum Dis, 2015, 74(11): 1983-1989. DOI:10.1136/annrheumdis-2014-205375 |
| [6] |
VIVINO F B. Sjogren's syndrome: clinical aspects[J]. Clin Immunol, 2017, 182: 48-54. DOI:10.1016/j.clim.2017.04.005 |
| [7] |
杨崇格, 赵永军, 熊婧, 等. 飞行员干燥综合征一例[J]. 中华航空航天医学杂志, 2019, 30(1): 62-63. DOI:10.3760/cma.j.issn.1007-6239.2019.01.013 |
| [8] |
CHANG C S, LIAO C H, MUO C H, et al. Increased risk of concurrent gastroesophageal reflux disease among patients with Sjögren's syndrome: a nationwide population-based study[J]. Eur J Intern Med, 2016, 31: 73-78. DOI:10.1016/j.ejim.2016.01.014 |
| [9] |
JHORAR P, TORRE K, LU J. Cutaneous features and diagnosis of primary Sjögren syndrome: an update and review[J]. J Am Acad Dermatol, 2018, 79(4): 736-745. DOI:10.1016/j.jaad.2018.05.021 |
| [10] |
MELCHOR S, SÁNCHEZ-PIEDRA C, FERNÁNDEZ CASTRO M, et al. Digestive involvement in primary Sjögren's syndrome: analysis from the Sjögrenser registry[J]. Clin Exp Rheumatol, 2020, 38 Suppl 126(4): 110-115. |
| [11] |
EBERT E C. Gastrointestinal and hepatic manifestations of Sjogren syndrome[J]. J Clin Gastroenterol, 2012, 46(1): 25-30. DOI:10.1097/MCG.0b013e3182329d9c |
| [12] |
KAMPOLIS C F, FRAGKIOUDAKI S, MAVRAGANI C P, et al. Prevalence and spectrum of symptomatic pulmonary involvement in primary Sjogren's syndrome[J]. Clin Exp Rheumatol, 2018, 36 Suppl 112(3): 94-101. |
| [13] |
FLAMENT T, BIGOT A, CHAIGNE B, et al. Pulmonary manifestations of Sjögren's syndrome[J]. Eur Respir Rev, 2016, 25(140): 110-123. DOI:10.1183/16000617.0011-2016 |
| [14] |
ROCA F, DOMINIQUE S, SCHMIDT J, et al. Interstitial lung disease in primary Sjögren's syndrome[J]. AutoimmunRev, 2017, 16(1): 48-54. DOI:10.1016/j.autrev.2016.09.017 |
| [15] |
MCCOY S S, BAER A N. Neurological complications of Sjögren's syndrome: diagnosis and management[J]. Curr Treatm Opt Rheumatol, 2017, 3(4): 275-288. DOI:10.1007/s40674-017-0076-9 |
| [16] |
PERZYŃSKA-MAZAN J, MAŚLIŃSKA M, GASIK R. Neurological manifestations of primary Sjögren's syndrome[J]. Rheumatologia, 2018, 56(2): 99-105. DOI:10.5114/reum.2018.75521 |
 2023, Vol. 44
2023, Vol. 44


