引用本文

刘文武, 方以群, 刘霞, 钟伟杰, 俞旭华, 徐佳骏, 文宇坤, 李慈. 模拟半闭式潜水装具潜水后快速出水对大鼠肺功能、血气指标和炎症因子的影响[J]. 海军军医大学学报, 2023, 44(8): 932-937

LIU Wenwu, FANG Yiqun, LIU Xia, ZHONG Weijie, YU Xuhua, XU Jiajun, WEN Yukun, LI Ci. Effects of fast ascent after simulated diving with semi-closed circuit rebreather on lung function, blood gas indicators and inflammatory factors in rats[J]. Academic Journal of Naval Medical University, 2023, 44(8): 932-937 (in Chinese with English abstract)

模拟半闭式潜水装具潜水后快速出水对大鼠肺功能、血气指标和炎症因子的影响
刘文武
1
, 方以群
1, 刘霞
1, 钟伟杰
2, 俞旭华
1, 徐佳骏
1, 文宇坤
1, 李慈
1

1. 海军军医大学(第二军医大学)海军特色医学中心潜水与高气压医学研究室, 上海 200433;
2. 上海交通大学医学院附属第九人民医院神经外科, 上海 200011
收稿日期: 2022-03-18 接受日期: 2022-12-22
基金项目: 国家自然科学基金(81772015, 81901912), 国防科技创新特区项目(19-163-16-ZD-020-008-01, 19-163-16-ZD-020-008-03).
摘要: 目的 研究32%氧-68%氮混合气不同方式暴露后快速减压出水对大鼠肺功能、血气指标和炎症指标的影响。方法 30只雄性SD大鼠随机分为5组(每组6只):正常对照组;实验1组,于40 m深度下呼吸32%氧-68%氮混合气4 h后快速减压出舱,出舱后即刻、3 h和24 h时检测肺功能;实验2组,高气压暴露方案与实验1组相同,出舱后即刻处死,取血进行血气分析,并检测炎症指标IL-1β、TNF-α、TGF-β和氧化应激指标4-羟基壬烯醛(4-HNE);实验3组,高气压暴露方案与实验1组相同,出舱后常压下呼吸100%纯氧30 min,检测肺功能后处死,取血进行血气分析及检测炎症指标和氧化应激指标;实验4组,于7 m深度下呼吸100%纯氧30 min,再于15 m深度下呼吸32%氧-68%氮混合气3 h,然后加压至40 m深度呼吸相同混合气10 min后快速减压,出舱后检测肺功能,处死后取血进行血气分析,并检测炎症指标和氧化应激指标。采用全身体积描记系统检测大鼠的肺功能,采用血气分析仪进行血气指标分析,采用试剂盒检测大鼠血液炎症指标和氧化应激指标。结果 高气压暴露后快速减压,大鼠呼吸频率增加,吸气和呼气时间缩短,最大吸气和呼气流速增加,每分钟通气量增加。出水后吸氧能改善上述呼吸功能变化,但仍存在一定的呼气阻力增加。入水后浅深度吸氧,逐步增加潜水深度,快速减压仍能导致一定程度肺损伤,主要表现为呼气和吸气阻力增加。结论 采用半闭式潜水装具潜水时,初始阶段浅深度呼吸纯氧或快速出水后常压呼吸纯氧对快速减压导致的肺不良影响具有一定的防治作用,但作用有限。
关键词:
半闭式潜水装具 快速上升 肺功能 血气分析 炎症细胞因子
Effects of fast ascent after simulated diving with semi-closed circuit rebreather on lung function, blood gas indicators and inflammatory factors in rats
LIU Wenwu
1
, FANG Yiqun
1, LIU Xia
1, ZHONG Weijie
2, YU Xuhua
1, XU Jiajun
1, WEN Yukun
1, LI Ci
1

1. Department of Diving and Hyperbaric Medical Research, Naval Medical Center, Naval Medical University(Second Military Medical University), Shanghai 200433, China;
2. Department of Neurosurgery, Shanghai Ninth People's Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200011, China
Supported by National Natural Science Foundation of China (81772015, 81901912) and National Defense Science and Technology Innovation Special Zone Project (19-163-16-ZD-020-008-01, 19-163-16-ZD-020-008-03).
Abstract: Objective To investigate the effects of exposure to 32% oxygen-68% nitrogen (mixed gas) with different protocols on the lung function, blood gas indicators and inflammatory factors in rats undergoing fast ascent. Methods Thirty male SD rats were randomly divided into 5 groups (n=6): normal control group, group 1 (rats were pressured with mixed gas at 40 m for 4 h, followed by rapid decompression, and lung function was detected at 0, 3 and 24 h after decompression), group 2 (the hyperbaric exposure protocol was the same as that in group 1, but rats were sacrificed immediately after decompression, and then blood was collected for detection of the blood gas indicators, inflammatory factors [interleukin 1β, tumor necrosis factor α, and transforming growth factor β] and oxidative stress indicator [4-hydroxynonenal]), group 3 (the hyperbaric exposure protocol was the same as that in group 1, but rats were exposed to normobaric 100% oxygen for 30 min after decompression. After the examination of the lung function, rats were sacrificed, and blood was collected for the examination of the blood gas indicators, inflammatory factors and oxidative stress indicator), and group 4 (rats were exposed to 100% oxygen at 7 m for 30 min, then to mixed gas at 15 m for 3 h and finally to mixed gas at 40 m for 10 min, followed by rapid decompression. After the examination of the lung function, rats were sacrificed, and blood was collected for the examination of the blood gas indicators, inflammatory factors and oxidative stress indicator). The lung function of the rats was examined by a whole body plethysmography system, blood gas analysis was performed by a blood gas analyzer, and the blood inflammatory factors and oxidative stress indicator of the rats were detected by kits. Results Fast ascent after hyperbaric exposure increased the respiratory rate, shortened the time of inspiration and expiration, increased the peak inspiratory and expiratory flow rates, and elevated the minute ventilation. Normobaric oxygen exposure after fast ascent improved the lung dysfunction, but the respiratory resistance was still increased as compared to baseline level. Fast ascent after hyperbaric exposure with oxygen inhalation at shallower water and increase of depth step by step could also cause damage to the lung function, which was characterized by the increase of expiratory and inspiratory resistance. Conclusion In the diving with semi-closed circuit rebreather, fast ascent may cause damage to the lung, which may be improved to a limited extent by short-term oxygen breathing in initial shallow water or normobaric 100% oxygen afetr fast ascent.
Key words:
semi-closed circuit rebreather fast ascent lung function blood gas analysis inflammatory cytokines
采用半闭式潜水装具进行潜水前需根据潜水计划选定相应的氮氧混合气。常用的氮氧混合气氧浓度为32%或36%,是15~40 m深度范围内潜水较适宜的呼吸混合气[1]。而在较浅的深度潜水时,通常采用呼吸纯氧的方式,通过置换较深处停留时体内吸收的惰性气体,减少减压时间,预防减压病的发生。
与开放式潜水装具相比,闭式或半闭式潜水装具在水下使用时的安全风险增加,潜水员可能出现氧中毒、缺氧或二氧化碳中毒等情况[2-3]。水下环境、海洋生物等因素也会对潜水员的人身安全造成威胁。因此,采用闭式或半闭式潜水装具进行潜水的潜水员在某些情况下会突发紧急上升出水的情况,而紧急情况下的快速减压出水会增加减压病和肺气压伤的发生风险。有研究显示,潜水前吸氧可降低潜水减压病的发生率[4-5],但这种方式的吸氧是在潜水员入水之前,而在潜水过程中,通过调整气体的呼吸顺序或时间是否有助于预防减压或肺气压伤对机体的影响,目前尚未见相关报道。
潜水员警示网组织潜水领域专家商讨形成的《有关减压性疾病院前救治的专家意见》推荐:常压氧(水面氧尽可能接近100%)对于减压性疾病的治疗是有益的,出现症状之后应尽快给予常压氧治疗[6]。然而,目前对于采用闭式或半闭式潜水装具的潜水员紧急出水后的现场救治尚未有一致意见。因此,探讨闭式或半闭式潜水装具进行潜水时水下和出水后呼吸气体的使用,对于降低紧急状态出水后潜水员的生命和健康风险至关重要。本研究以大鼠为研究对象,观察32%氧-68%氮混合气不同方式暴露后快速减压出水对大鼠肺功能、血气指标、炎症指标等的影响。
1 材料和方法
1.1 动物与分组
30只雄性SD大鼠,体重(266±17)g,购于上海斯莱克实验动物有限责任公司,实验动物生产许可证号为SCXK(沪)2018-0006,实验动物使用许可证号为SYXK(沪)2017-0004。将大鼠随机分为5组(n=6):正常对照组、实验1组、实验2组、实验3组、实验4组,动物实验前均在22~25 ℃、50%~70%相对湿度和每天12 h光照环境下适应性饲养1周。本研究获得海军军医大学(第二军医大学)实验动物伦理委员会批准,实验过程中对动物的处置符合国家科学技术委员会发布的《实验动物管理条例》。
1.2 动物处理
正常对照组大鼠不做任何处理。实验1组大鼠于40 m深度下呼吸32%氧-68%氮混合气4 h,在最后1 min内快速减压出舱,于出舱后0(即刻)、3和24 h时检测肺功能。实验2组大鼠的高气压暴露方案与实验1组相同,出舱后即刻麻醉后处死,取血检测。实验3组大鼠的高气压暴露方案与实验1组相同,出舱后于常压下呼吸100%纯氧30 min,检测肺功能,然后麻醉后处死,取血检测。实验4组大鼠于7 m深度下呼吸100%纯氧30 min,于15 m深度下呼吸32%氧-68%氮混合气3 h,随后加压至40 m深度,呼吸相同的混合气10 min,最后1 min内快速减压出舱。出舱后检测肺功能,麻醉后处死,取血检测。实验2、3、4组大鼠均为腹腔注射3%戊巴比妥钠(30 mg/kg)麻醉后处死,经左心取血,进行血气分析及炎症指标、氧化应激指标检测。
1.3 检测指标
各组大鼠进舱前和实验结束时均采用全身体积描记系统(上海塔望智能科技有限公司)检测肺功能。将大鼠放置于检测仪器内,待检测指标包括吸气时间、呼气时间、最大吸气流速(peak inspiratory flow rate,PIFR)、最大呼气流速(peak expiratory flow rate,PEFR)、吸气时间/呼气时间(inspiratory time/expiratory time,Volbal)、呼吸频率、潮气量、每分钟通气量(minute ventilation,Mv)、呼出50%气量时对应的呼气流速(expiratory flow at 50% volume,EF50)。采用美国雅培i-STAT300型血气分析仪进行血气分析,血气指标包括pH值、二氧化碳分压(partial pressure of carbon dioxide,PCO2)、氧分压(partial pressure of oxygen,PO2)、细胞外液碱剩余(extracellular fluid base excess,BEecf)、碳酸氢根(HCO3-)、二氧化碳总量(total carbon dioxide,TCO2)、氧饱和度(oxygen saturation,SO2)和乳酸。采用IL-1β、TNF-α、TGF-β和4-羟基壬烯醛(4-hydroxynonenal,4-HNE)试剂盒(南京建成生物工程研究所)分别检测血液炎症指标IL-1β、TNF-α、TGF-β和氧化应激指标4-HNE的含量。
1.4 统计学处理
应用SPSS 16.0软件进行统计学分析。计量资料以x±s表示。实验1组高气压暴露前后的肺功能比较采用重复测量方差分析,其余组高气压暴露前后肺功能比较采用配对t检验。组间血气分析、炎症指标、氧化应激指标的比较采用独立样本t检验或单因素方差分析。检验水准(α)为0.05。
2 结果
2.1 一般情况
实验1、2、3、4组和正常对照组大鼠的体重分别为(264±11)、(260±6)、(271±13)、(276±13)和(266±9)g,各组大鼠的体重差异无统计学意义(P>0.05)。各实验组大鼠出舱后未观察到活动异常、肢体瘫痪、饮食异常等表现,研究过程中无大鼠死亡。
2.2 高气压暴露前后各组大鼠肺功能的变化
实验1组大鼠在40 m深度停留4 h后出舱,出舱后随着时间的延长,吸气时间、呼气时间呈现先下降后升高的趋势,而PIFR、PEFR、Volbal、呼吸频率、潮气量、Mv、EF50呈现先升高后下降的趋势。出舱后即刻(0 h)的PEFR、呼吸频率、Mv和EF50高于高气压暴露前,呼气时间低于高气压暴露前,差异均有统计学意义(P均<0.05)。出舱后24 h,各肺功能指标基本恢复至实验前水平,与实验前相比差异均无统计学意义(P均>0.05)。见表 1。
表 1
(Tab 1)
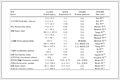
表 1 高气压暴露前后各组大鼠肺功能指标的变化
Tab 1 Changes in lung function indicators of rats in each group before and after hyperbaric exposure
| n=6, x±s |
| Group |
Ti/s |
Te/s |
PIFR/(mL·s-1) |
PEFR/(mL·s-1) |
Volbal |
| Group 1 |
|
|
|
|
|
| Before |
0.200±0.034 |
0.318±0.053 |
5.048±0.976 |
3.215±0.219 |
0.392±0.013 |
| After |
|
|
|
|
|
| 0 h |
0.175±0.044 |
0.220±0.022* |
6.445±1.680 |
4.957±0.605* |
0.448±0.022 |
| 3 h |
0.210±0.021 |
0.252±0.031 |
5.220±1.368 |
4.580±0.358* |
0.457±0.021* |
| 24 h |
0.200±0.028 |
0.310±0.050△ |
5.605±1.192 |
3.537±0.108▲ |
0.400±0.016 |
| Group 3 |
|
|
|
|
|
| Before |
0.223±0.059 |
0.325±0.127 |
5.047±0.526 |
3.725±0.942 |
0.420±0.020 |
| After |
0.290±0.029 |
0.360±0.055 |
4.175±0.634* |
3.877±0.578 |
0.448±0.032 |
| Group 4 |
|
|
|
|
|
| Before |
0.213±0.045 |
0.308±0.089 |
4.738±1.105 |
3.570±0.569 |
0.418±0.026 |
| After |
0.238±0.013 |
0.303±0.017 |
5.052±0.992* |
3.898±0.759 |
0.443±0.022 |
|
|
| Group |
RF/min-1 |
Vt/mL |
Mv/mL |
EF50/(mL·s-1) |
| Group 1 |
|
|
|
|
| Before |
117.185±16.941 |
0.603±0.063 |
72.195±11.968 |
2.772±0.337 |
| After |
|
|
|
|
| 0 h |
155.070±22.940* |
0.677±0.099 |
106.677±23.534* |
4.647±0.770* |
| 3 h |
130.717±14.760 |
0.730±0.194 |
94.552±18.659 |
4.012±0.471 |
| 24 h |
118.980±16.855△ |
0.677±0.109 |
82.737±16.875△ |
3.103±0.312△▲ |
| Group 3 |
|
|
|
|
| Before |
117.960±32.268 |
0.627±0.050 |
76.330±16.652 |
3.233±0.642 |
| After |
93.090±9.633 |
0.792±0.119 |
74.752±13.196 |
3.410±0.633* |
| Group 4 |
|
|
|
|
| Before |
123.177±37.446 |
0.621±0.056 |
76.083±19.433 |
3.138±0.851 |
| After |
111.898±3.413 |
0.790±0.203 |
88.347±20.122* |
3.615±0.852* |
| *P<0.05 vs before exposure; △P<0.05 vs 0 h; ▲P<0.05 vs 3 h. Group 1: Rats were pressured with mixed gas (32% oxygen-68% nitrogen) at 40 m for 4 h and then subjected to rapid decompression, and lung function was detected at 0, 3 and 24 h after decompression; Group 3: Rats were pressured at 40 m for 4 h and then subjected to rapid decompression, followed by normobaric 100% oxygen exposure for 30 min, and the lung function was detected immediately; Group 4: Rats were exposed to 100% oxygen at 7 m for 30 min, to mixed gas at 15 m for 3 h and then to mixed gas at 40 m for 10 min, followed by rapid decompression, and the lung function was detected immediately. Ti: Inspiratory time; Te: Expiratory time; PIFR: Peak inspiratory flow rate; PEFR: Peak expiratory flow rate; Volbal: Inspiratory time/expiratory time; RF: Respiratory frequency; Vt: Tidal volume; Mv: Minute ventilation; EF50: Expiratory flow at 50% volume. |
|
表 1 高气压暴露前后各组大鼠肺功能指标的变化
Tab 1 Changes in lung function indicators of rats in each group before and after hyperbaric exposure
|
如表 1所示,实验3组大鼠快速减压后常压呼吸纯氧30 min,吸气时间、呼气时间、PEFR、Volbal、潮气量和EF50升高,而PIFR、呼吸频率、Mv下降,其中PIFR和EF50与高气压暴露前相比差异有统计学意义(P均<0.05)。实验4组大鼠在高气压暴露后,吸气时间、PIFR、PEFR、Volbal、潮气量、Mv、EF50升高,呼气时间和呼吸频率下降,其中PIFR、Mv和EF50与高气压暴露前相比差异有统计学意义(P均<0.05)。
2.3 各组大鼠血气指标的比较
如表 2所示,实验3组大鼠的pH值高于正常对照组(P<0.05),而其余各组间的pH值差异无统计学意义(P>0.05)。各组间PCO2差异无统计学意义(P>0.05)。实验2组大鼠的PO2与正常对照组比较差异无统计学意义(P>0.05);实验3组大鼠的PO2低于正常对照组,实验4组大鼠的PO2高于实验2组和实验3组(P均<0.05)。实验2组和实验3组大鼠的SO2低于正常对照组(P均<0.05);实验4组大鼠的SO2高于实验2组和实验3组(P均<0.05),但与正常对照组比较差异无统计学意义(P>0.05)。实验2组和实验3组大鼠的BEecf高于正常对照组(P均<0.05),实验4组大鼠的BEecf高于其他各组(P均<0.05)。实验4组大鼠的HCO3-高于其他各组(P均<0.05),而其余各组间HCO3-差异无统计学意义(P>0.05)。实验4组大鼠的TCO2高于其他各组(P均<0.05),而其余各组间的TCO2差异无统计学意义(P>0.05)。实验2组和实验3组的LAC均高于正常对照组(P均<0.05),实验4组的LAC低于其他各组(P均<0.05)。
表 2
(Tab 2)

表 2 高气压暴露后各组大鼠血气指标的比较
Tab 2 Comparison of blood gas indicators of rats among groups after hyperbaric exposure
| n=6, x±s |
| Group |
pH |
PCO2/mmHg |
PO2/mmHg |
BEecf/(mmol·L-1) |
HCO3-/(mmol·L-1) |
TCO2/(mmol·L-1) |
SO2/% |
LAC/(mmol·L-1) |
| NC |
7.381±0.026 |
58.18±4.91 |
41.0±5.8 |
7.3±1.5 |
32.5±1.6 |
34.2±1.6 |
72.2±8.4 |
0.69±0.10 |
| Group 2 |
7.401±0.045 |
55.11±6.98 |
34.3±5.4 |
9.5±2.1* |
34.3±2.1 |
36.0±2.4 |
59.8±15.0* |
1.10±0.22* |
| Group 3 |
7.412±0.020* |
54.18±2.40 |
31.7±5.7* |
9.7±1.2* |
34.5±0.8 |
36.2±1.0 |
58.7±13.0* |
0.91±0.18* |
| Group 4 |
7.449±0.092 |
53.58±8.85 |
39.8±4.8△▲ |
12.8±2.9*△▲ |
36.8±1.4*△▲ |
38.3±1.3*△▲ |
75.3±1.7△▲ |
0.54±0.06*△▲ |
| 1 mmHg=0.133 kPa. *P<0.05 vs NC group; △P<0.05 vs group 2; ▲P<0.05 vs group 3. Group 2: Rats were pressured with mixed gas (32% oxygen-68% nitrogen) at 40 m for 4 h and then subjected to rapid decompression, and blood gas analysis was performed; Group 3: Rats were pressured at 40 m for 4 h and then subjected to rapid decompression, followed by normobaric 100% oxygen exposure for 30 min, and then blood gas analysis was performed; Group 4: Rats were exposed to 100% oxygen at 7 m for 30 min, to mixed gas at 15 m for 3 h and then to mixed gas at 40 m for 10 min, followed by rapid decompression, and blood gas analysis was performed. NC: Normal control; PCO2: Partial pressure of carbon dioxide; PO2: Partial pressure of oxygen; BEecf: Extracellular fluid base excess; TCO2: Total carbon dioxide; SO2: Oxygen saturation; LAC: Lactic acid. |
|
表 2 高气压暴露后各组大鼠血气指标的比较
Tab 2 Comparison of blood gas indicators of rats among groups after hyperbaric exposure
|
2.4 各组大鼠炎症和氧化应激指标的比较
如表 3所示,炎症指标IL-1β、TGF-β、TNF-α和氧化应激指标4-HNE在4组大鼠间差异均有统计学意义(P均<0.01)。实验2、3组的IL-1β及实验2、3、4组的TGF-β、TNF-α和4-HNE水平均高于正常对照组(P均<0.05)。各实验组中,上述4个指标的检测水平均是实验2组>实验3组>实验4组(P均<0.05)。
表 3
(Tab 3)

表 3 高气压暴露后各组大鼠炎症和氧化应激指标的比较
Tab 3 Comparison of inflammatory and oxidative stress indicators of rats among groups after hyperbaric exposure
| (ng·L-1), n=6, x±s |
| Group |
IL-1β |
TGF-β |
TNF-α |
4-HNE |
| NC |
8.27±0.78 |
679.39±84.33 |
219.32±27.14 |
320.63±13.29 |
| Group 2 |
20.89±1.36* |
1 706.34±80.96* |
967.45±123.97* |
653.89±45.91* |
| Group 3 |
15.30±2.68*△ |
1 033.76±252.23*△ |
553.62±31.47*△ |
467.45±20.63*△ |
| Group 4 |
9.84±0.95△▲ |
848.44±41.39*△▲ |
292.41±12.55*△▲ |
409.76±19.34*△▲ |
| *P<0.05 vs NC group; △P<0.05 vs group 2; ▲P<0.05 vs group 3. Group 2: Rats were pressured with mixed gas (32% oxygen-68% nitrogen) at 40 m for 4 h and then subjected to rapid decompression, and blood was collected; Group 3: Rats were pressured at 40 m for 4 h and then subjected to rapid decompression, followed by normobaric 100% oxygen exposure for 30 min, and then blood was collected; Group 4: Rats were exposed to 100% oxygen at 7 m for 30 min, to mixed gas at 15 m for 3 h and then to mixed gas at 40 m for 10 min, followed by rapid decompression, and blood was collected. NC: Normal control; IL-1β: Interleukin 1β; TNF-α: Tumor necrosis factor α; TGF-β: Transforming growth factor β; 4-HNE: 4-hydroxynonenal. |
|
表 3 高气压暴露后各组大鼠炎症和氧化应激指标的比较
Tab 3 Comparison of inflammatory and oxidative stress indicators of rats among groups after hyperbaric exposure
|
3 讨论
采用闭式或半闭式潜水装具进行潜水时,水下风险明显增加。一项针对休闲潜水潜水员的研究显示,采用闭式潜水装具导致的死亡率是开放式潜水装具的10倍,故障发生率是开放式装具的25倍[7]。采用闭式潜水装具潜水的中枢神经系统氧中毒发生率从157 930次潜水发生1例到约3.5%不等[8]。因此,采用闭式或半闭式潜水装具潜水时,若发生紧急状况,可能需要紧急自行或救援出水[9]。潜水员在紧急自行或救援出水时,即使不发生肺气压伤,体内也会产生一定量的气泡[10]。该气泡主要位于静脉系统,并最终通过腔静脉回流至右心系统,进入到肺,因而肺部是减压后受气泡影响的靶器官[11]。本研究采用半闭式潜水装具常用的纯氧和32%氧-68%氮混合气作为呼吸气体,探究2种潜水模式下快速出水对大鼠肺功能、血气指标和炎症指标等的影响,同时观察出水后常压吸氧的保护作用。
本研究中,快速减压后实验1组大鼠的吸气时间和呼气时间缩短,说明大鼠存在呼吸急促的表现,与呼吸频率增加一致;PIFR和PEFR增加,说明大鼠存在气道狭窄的表现,与EF50增加一致;由于潮气量增加、呼吸频率增加,导致Mv也增加。这些指标的变化均表明大鼠存在呼吸功能异常。随着时间的延长,出舱后24 h,大鼠的肺功能指标基本与高气压暴露前的水平一致。本研究结果表明,在未发生减压病和肺气压伤的情况下,快速出水对大鼠肺部具有一定的不良影响,这种影响在24 h内会因机体的代偿而逐渐恢复。
快速出水后常压呼吸纯氧的实验3组大鼠的吸气时间和呼气时间较高气压暴露前延长,说明大鼠并未出现呼吸急促的表现,且呼吸频率下降。虽然潮气量有所增加(可能与吸气时间和呼气时间延长相一致),但Mv下降。PIFR下降,说明大鼠吸气的阻力未增加,反而有下降;PEFR稍有增加,而EF50明显增加,说明大鼠呼气的阻力有所增加。这些结果表明,快速出水后的吸氧对大鼠肺功能有一定改善作用,但对呼气阻力的改善有限。从大鼠的血液学指标也可以看出,出舱后吸氧能一定程度上降低炎症因子IL-1β、TGF-β、TNF-α和氧化应激指标4-HNE的水平,但仍高于正常对照组。
下潜初期吸纯氧的实验4组大鼠的吸气时间稍有增加,呼气时间无显著变化,说明大鼠未出现呼吸急促的表现。虽然呼吸频率有所下降,但由于潮气量有所增加,Mv显著增加。PIFR显著增加,PEFR有所增加,EF50也显著增加,说明大鼠也存在一定程度的吸气和呼气的阻力增加。因此,这种潜水方式对大鼠肺部也有不良影响。从大鼠的血液学指标也能看出,炎症因子和氧化应激指标较实验2组有所下降,但仍然显著高于正常对照组。
血气分析结果显示,与正常对照组相比,实验2组大鼠的SO2和PO2、PCO2均下降(PCO2下降可能与呼吸频率和Mv增加有关),而HCO3-和TCO2升高,说明大鼠存在呼吸性碱中毒和代谢性碱中毒的趋势;乳酸的显著增加可能与PO2下降有关,无氧代谢的上升会促进乳酸的产生。而快速减压后常压吸氧30 min,对于大鼠的SO2、PO2、PCO2和乳酸的产生无明显改善作用。与实验2组和实验3组相比,实验4组下潜初始呼吸30 min纯氧,一定程度上升高血液的PO2、SO2,同时进一步降低PCO2(可能与呼吸频率和Mv增加有关)和乳酸的产生,HCO3-和TCO2进一步升高。PO2、SO2的升高是否可以通过下潜初始呼吸纯氧导致体内氧储量增加来解释尚不清楚,但与正常对照组相比差异无统计学意义;PO2、SO2的升高可能与乳酸水平的下降有关。PCO2的下降和HCO3-、TCO2的升高表明大鼠存在呼吸性碱中毒和代谢性碱中毒趋势,且BEecf显著升高。大鼠血气指标的变化基本与呼吸功能变化相吻合。
总之,本研究结果表明,采用半闭式潜水装具潜水,水下遇到风险需要紧急上升时,在没有发生减压病和肺气压伤的情况下,也会对肺造成不良影响,这种影响随着时间的延长可逐渐恢复。出水后在水面呼吸常压纯氧,对减压造成的肺不良影响有一定的改善作用。潜水的初始阶段,浅深度呼吸一段时间的纯氧也有助于预防快速减压造成的肺不良影响。
本研究也存在一定的不足。首先,本研究的样本量较小。其次,在研究过程中需要剪开大鼠胸腔后从左心室取血,但因受到呼吸的影响,检测结果不能完全代替动脉血的结果。此外,本研究未进行大鼠肺的组织病理学观察,未能明确肺损伤及其严重程度。
参考文献
| [1] |
胡霈, 刘文武. 半闭式氮氧混合气潜水[M]//徐伟刚. 中国海军潜水手册. 北京: 海潮出版社, 2020: 11-13.
|
| [2] | |
| [3] |
徐伟刚. 潜水医学技士手册[M]. 上海: 第二军医大学出版社, 2019: 152-169.
|
| [4] |
QING L, YI H J, WANG Y W, et al. Benefits of hyperbaric oxygen pretreatment for decompression sickness in Bama pigs[J]. J Exp Biol, 2018, 221(Pt 5): jeb171066. DOI:10.1242/jeb.171066 |
| [5] |
KATSENELSON K, ARIELI Y, ABRAMOVICH A, et al. Hyperbaric oxygen pretreatment reduces the incidence of decompression sickness in rats[J]. Eur J Appl Physiol, 2007, 101(5): 571-576. DOI:10.1007/s00421-007-0528-2 |
| [6] | |
| [7] |
FOCK ANDREW W. Analysis of recreational closed-circuit rebreather deaths 1998-2010[J]. Diving Hyperb Med, 2013, 43(2): 78-85. |
| [8] |
WINGELAAR T T, VAN OOIJ P J A M, VAN HULST R A. Oxygen toxicity and special operations forces diving: hidden and dangerous[J]. Front Psychol, 2017, 8: 1263. DOI:10.3389/fpsyg.2017.01263 |
| [9] |
RISBERG J, PHILLIPS S. Rescue of a submerged convulsing diver[J]. Undersea Hyperb Med, 2019, 46(2): 153-157. |
| [10] |
俞旭华, 李慈, 徐佳骏, 等. 超声气泡检测在潜水减压研究中的应用[J]. 第二军医大学学报, 2021, 42(1): 81-84. YU X H, LI C, XU J J, et al. Application of ultrasonic bubble detection in diving decompression[J]. Acad J Sec Mil Med Univ, 2021, 42(1): 81-84. DOI:10.16781/j.0258-879x.2021.01.0081 |
| [11] | |
 2023, Vol. 44
2023, Vol. 44


