2. 海军军医大学(第二军医大学)转化医学研究中心干细胞与再生医学研究室, 上海 200433
2. Laboratory of Stem Cell and Regenerative Medicine, Center of Translational Medicine, Naval Medical University(Second Military Medical University), Shanghai 200433, China
脑卒中是世界上第二大致死和致残疾病,给患者及社会带来了极大的负担,其中缺血性脑卒中(ischemic stroke,IS)大约占所有脑卒中亚型的75%~80%[1]。大脑结构的复杂性和细胞类型的多样性阻碍了人们对IS发生、发展过程中分子基础的理解。组织层面的转录组学测序一定程度掩盖了敏感细胞亚群基因表达谱的决定性改变[2],而新兴的单细胞测序技术有效规避了这一不足[3]。以前对IS的单细胞转录组测序研究通常集中在IS后24 h,模糊了整个疾病过程中细胞亚群的动态改变[4]。因此,识别细胞类型及其亚群的传统方法可能不足以揭示IS引起的单细胞转录谱动态的复杂性。
星形胶质细胞是中枢神经系统中的一种胶质细胞,在健康和疾病状态下发挥着不同的功能。星形胶质细胞功能障碍见于多种疾病,包括多发性硬化症、阿尔茨海默病、帕金森病、亨廷顿病和神经精神障碍等。星形胶质细胞调节谷氨酸和离子稳态、胆固醇和鞘脂代谢,并对环境因素作出反应,这些都与神经系统疾病有关。星形胶质细胞也表现出明显的异质性,可由发育程序和刺激特异性细胞反应等驱动[5]。目前,在病理条件下对星形胶质细胞的分类是有争议的,对IS后反应中星形胶质细胞异质性的理解也有限[6-7],尚缺少对IS后星形胶质细胞功能动态改变的分析报道。
1 材料和方法 1.1 数据收集从基因表达汇编(Gene Expression Omnibus,GEO)数据库中下载IS单细胞测序数据集GSE227651,GSE227651包括短暂大脑中动脉闭塞(transient middle cerebral artery occlusion,tMCAO)后的第1、3、7天和健侧对照4个小鼠样本[8]。
1.2 单细胞数据分析使用Seurat包对4个样本测序数据通过典型关联分析(canonical correlation analysis,CCA)方法进行整合,去除批次效应;通过t-分布随机近邻嵌入(t-distributed stochastic neighbor embedding,tSNE)聚类降维分析获取不同的组织细胞亚群,利用SingleR包对细胞亚群进行注释,选取注释为星形胶质细胞的细胞群进行下一步分析;再次通过tSNE聚类降维分析将星形胶质细胞进一步分类,并分析不同星形胶质细胞亚群在IS后不同时间点的占比及功能动态改变;利用Monocle包对不同亚群细胞的发育阶段进行分析,明确不同发育阶段星形胶质细胞在IS后的动态改变;利用CellChat包探讨星形胶质细胞与其他类型细胞之间的配体-受体相互作用情况。
1.3 基因富集分析利用ClusterProfiler软件包或Metascape在线工具(https://metascape.org/gp/index.html)进行基因本体(Gene Ontology,GO)富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析。
1.4 动物模型制作及免疫荧光检测采用线栓法建立小鼠tMCAO模型,分别在造模后的第1、3、7天麻醉处死小鼠获取脑组织,制作冰冻切片。免疫荧光染色:切片用3%的牛血清白蛋白(bovine serum albumin,BSA)封闭30 min,加入一抗4℃孵育过夜,加入二抗室温孵育2 h,用含DAPI的防荧光淬灭封片剂进行封片,拍照观察,统计胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)阳性信号与DAPI阳性信号的比例。9只C57小鼠购自上海吉辉实验动物饲养有限公司[实验动物生产许可证号为SCXK(沪)2022-0009]。线栓(型号1620A4)购于北京西浓科技有限公司,BSA(货号ST023-50g)、DAPI(货号C1005)购于上海碧云天生物技术有限公司,GFAP抗体(货号ab7260)和荧光二抗(货号ab150077)为英国Abcam公司产品。本研究通过海军军医大学(第二军医大学)伦理委员会审批。
1.5 统计学处理应用SPSS 26.0软件对数据进行统计分析,采用独立样本t检验比较组间差异,检验水准(α)为0.05。
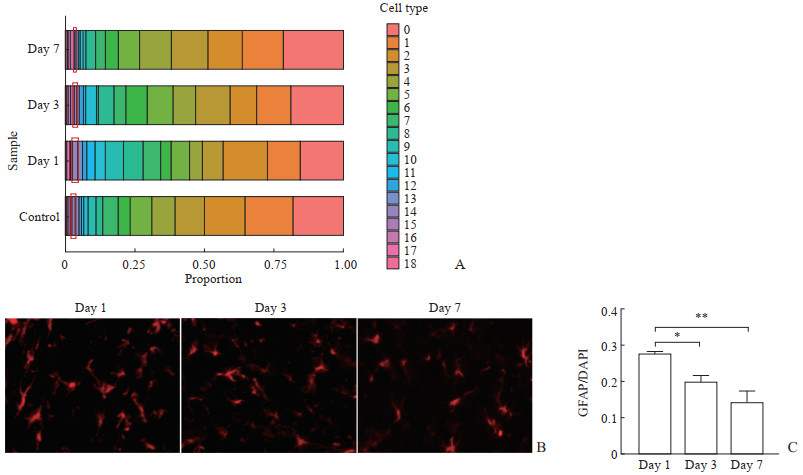
2 结果 2.1 星形胶质细胞在整个小鼠缺血脑半球细胞谱中的数量动态变化tSNE聚类结果可视化显示,来自健侧半球对照和tMCAO小鼠缺血损伤后第1、3、7天患侧半球的脑组织细胞聚类为19个亚群(电子材料图 1A)。使用Seurat包对4个样本测序数据以CCA法整合后,4个样本的细胞均匀的分布在19个不同的细胞亚群中(电子材料图 1B),去除了不同样本间的批次效应。根据细胞的不同标记基因,利用SingleR包对19个细胞亚群的细胞进行注释,共注释出神经元、小胶质细胞、星形胶质细胞、少突胶质细胞、单核细胞、自然杀伤(natural killer,NK)细胞、内皮细胞、上皮细胞、T细胞等16种脑组织中常见的细胞类型(电子材料图 1C),其中细胞亚群14对应星形胶质细胞。对不同类型的细胞占比进行统计分析,发现星形胶质细胞在IS后第1天数量占比达到最高,在IS后第3和第7天数量占比降低(图 1A)。利用星形胶质细胞的标记蛋白GFAP,通过免疫荧光检测证实了在tMCAO后皮质缺血半暗带中星形胶质细胞的数量改变也符合这种动态变化,即IS后的第3和第7天星形胶质细胞的数量相较于第1天减少(图 1B、1C)。
|
图 1 tMCAO后不同时间小鼠脑组织各亚群细胞占比 Fig 1 Proportion of subsets of brain tissue cells at different time points after tMCAO A: The proportion of different subsets of cells in all cells (the subsets of cells in the red box were astrocytes); B: GFAP immunofluorescence results (40×) in ischemic penumbra area of posterior cortex after tMCAO; C: Statistical results of immunofluorescence. n=3, x±s, *P < 0.05, **P < 0.01. tSNE: t-distributed stochastic neighbor embedding; tMCAO: Transient middle cerebral artery occlusion; GFAP: Glial fibrillary acidic protein; DAPI: 4', 6-diamidino-2-phenylindole. |
2.2 星形胶质细胞亚群异型性分析
对星形胶质细胞进行亚群细分,进一步分为6个亚群(电子材料图 2A)。分析6个细胞亚群在不同样本中的细胞数目百分比,发现亚群0和亚群3在IS后的第1天数目占比相较于健侧对照降低,在IS后的第3和第7天占比逐渐升高;而亚群2和亚群5在IS后的第1天数目占比相较于健侧对照升高,在IS后的第3和第7天逐渐降低;亚群1和亚群4在IS后不同的时间点变化不大,提示星形胶质细胞不同亚群在IS后不同时间点数量占比存在异质性(电子材料图 2B)。分析6个星形胶质细胞亚群的标记基因显示,细胞亚群0基因细胞毒性T细胞相关蛋白2α (cytotoxic T cell associated protein 2α,Ctla2α)、G蛋白亚基γ转导蛋白2(G protein subunit γ transducin 2,Gngt2)等高表达,亚群1基因血红蛋白β成人t链、流感病毒NS1A结合蛋白等高表达,亚群2基因糖蛋白M6B(glycoprotein M6B,Gpm6b)、束缚和伸长蛋白ζ1(fasciculation and elongation protein ζ 1,Fez1)等高表达,亚群3基因肌球蛋白轻链9、原肌球蛋白2等高表达,亚群4基因钙调蛋白样4、金属硫蛋白3等高表达,亚群5基因补充C1q B链、补充C1q C链等高表达(电子材料图 2C)。对每个细胞亚群的标记基因进行了GO功能富集分析,结果显示亚群2和亚群5主要富集在胶质生成、胶质细胞的分化、白细胞的迁移、免疫反应介导的细胞激活和白细胞的趋化作用等急性炎症反应过程;亚群0和亚群3主要富集在DNA模板转录在应激反应中的调节、细胞对拓扑错误蛋白的反应、创伤愈合和对外部刺激信号的阳性调节等生物过程;而在IS后占比不发生明显变化的亚群1和亚群4,主要参与氧气运输、过氧化氢分解代谢、微管运动等基本的生物学过程(电子材料图 2D)。因此定义亚群2和亚群5为反应性星形胶质细胞,定义亚群0和亚群3为修复性星形胶质细胞,定义亚群1和亚群4为静息性星形胶质细胞。在IS后反应性星形胶质细胞主要在缺血损伤后的第1天活化,而在IS后的第3和第7天反应性星形胶质细胞数量减少,修复性星形胶质细胞数量逐渐增多;静息性星形胶质细胞在整个IS后不同时间点数量占比变化不大,推测主要存在于未损伤的脑组织区域。
|
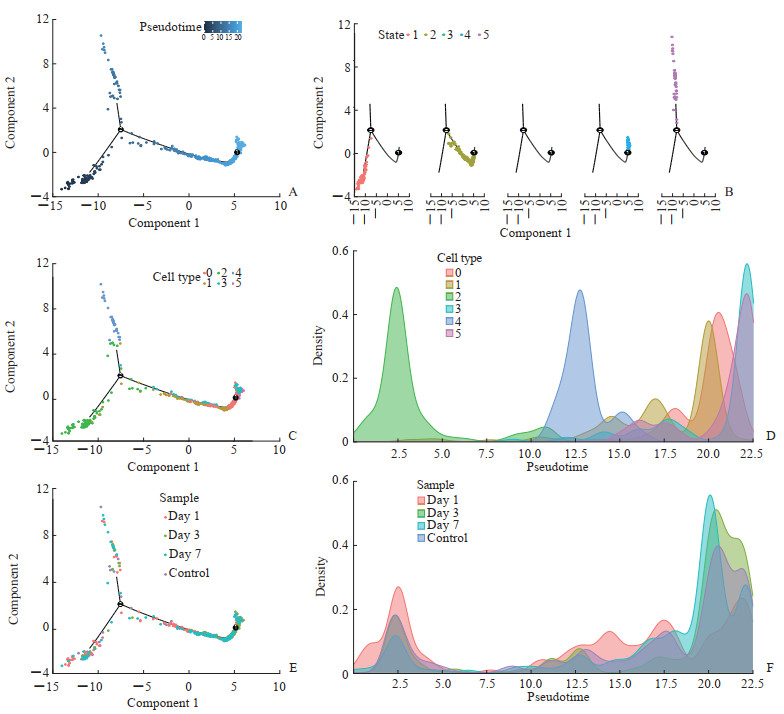
图 2 tMCAO后星形胶质细胞Monocle拟时序分析结果 Fig 2 Monocle pseudotime analysis results of astrocytes after tMCAO A: The developmental timeline of astrocyte subsets; B: The astrocyte subsets can be divided into 5 distinct developmental stages; C, D: The developmental stage (C) and density (D) of different astrocyte subsets; E, F: The developmental stage (E) and density (F) of astrocytes in different samples. tMCAO: Transient middle cerebral artery occlusion. |
2.3 星形胶质细胞亚群演化的规律分析
应用Monocle软件包进行拟时序分析,结果显示6个星形胶质细胞亚群可分为2个分化阶段,图 2A为细胞发育的时间轴,颜色越深代表发育阶段越早,共5个不同的发育阶段状态(图 2B)。图 2C为星形胶质细胞各亚群所处的发育阶段,亚群2处于发育的最早期阶段,此后依次为亚群4、亚群1、亚群0、亚群3和亚群5(图 2D)。图 2E是不同样本中星形胶质细胞所处的发育阶段,IS后第1天患侧脑半球中处于发育早期阶段的细胞占比最高,而IS后第3和第7天处于发育较晚期阶段的细胞占比相对较高(图 2F)。
推测在IS后第1天,脑组织中分裂产生大量原始的急性反应性星形胶质细胞,这些细胞在IS后第3和第7天逐渐分化为损伤后修复性星形胶质细胞或转化为静息性星形胶质细胞。处于发育最晚期阶段的反应性星形胶质细胞亚群5和修复性细胞亚群3,细胞分化较为成熟,推测只参与维持正常脑组织的功能稳态。据此进一步将星形胶质细胞亚群2定义为急性反应性星形胶质细胞,亚群0定义为缺血损伤后修复性星形胶质细胞。
对星形胶质细胞亚群之间的命运转化调控途径进行分析,分别获取分化阶段2节点和分化阶段1节点的拟时相关基因(校正P<0.01),绘制基因热图并对拟时相关基因进行功能富集分析(电子材料图 3)。富集分析结果显示,分化阶段2节点拟时相关基因主要与胶质细胞的分化和激活、神经元的死亡调节等生物学过程相关,分化阶段1节点拟时相关基因主要富集在炎症反应、细胞迁移的阳性调节和局部黏附等生物学过程。
|
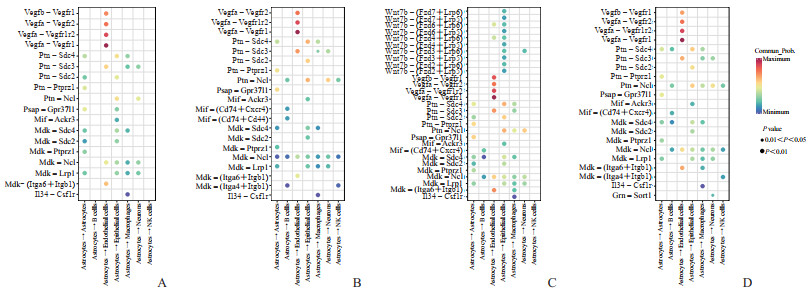
图 3 tMCAO后不同时间样本中星形胶质细胞与其他细胞配体-受体交互情况 Fig 3 Ligand-receptor interactions between astrocytes and other cells in samples at different time points after tMCAO A: Control; B: Day 1 after tMCAO; C: Day 3 after tMCAO; D: Day 7 after tMCAO. tMCAO: Transient middle cerebral artery occlusion. |
2.4 星形胶质细胞的细胞间通信网络分析
应用CellChat软件包对不同样本中细胞间的配体-受体相互作用进行分析,结果显示健侧对照样本及IS后第1、第3、第7天中配体-受体对数量分别为1 041、1 393、1 093和1 244,配体-受体之间的相互作用强度分别为0.104、0.087、0.067和0.088。通过热图展示样本间各细胞亚群之间配体-受体交互的数量差异和强度差异情况,结果显示相较于健侧对照,IS后第1天星形胶质细胞与B细胞、NK细胞之间的配体-受体交互数量增多,而星形胶质细胞与内皮细胞之间的配体-受体交互数量和强度降低(电子材料图 4A)。相较于IS后第1天,IS后第3天的星形胶质细胞与星形胶质细胞、内皮细胞、上皮细胞、巨噬细胞和单核细胞之间的配体-受体交互数量增多,而与B细胞和NK细胞之间的配体-受体交互数量下降,整体的信号交互强度没有改变(电子材料图 4B)。相较于IS后第3天,IS后的第7天星形胶质细胞与神经元的配体-受体交互数量增加,与内皮细胞的配体-受体交互数量减少,但与内皮细胞间的配体-受体交互强度增加(电子材料图 4C)。
进一步分析不同样本中星形胶质细胞与星形胶质细胞、B细胞、内皮细胞、上皮细胞、巨噬细胞、神经元和NK细胞之间的配体-受体对变化详细情况。结果显示,正常脑组织中星形胶质细胞与B细胞和NK细胞之间不建立联系,而在缺血性损伤后通过Ptn-Ncl、Mdk-Ncl和Mdk-(Itga4+Itgb1)信号途径建立联系,这些联系在IS后第3天减弱;在IS后的第3天,星形胶质细胞与上皮细胞之间建立广泛的Wnt7b信号通路联系;在IS后第1天,星形胶质细胞与内皮细胞之间的Vegfb-Vegfr1信号对消失,又在IS后的第3天恢复;在IS后第3天,星形胶质细胞与神经元之间建立了Wnt7b-(Fzd3+Lrp6)信号通路(图 3)。
3 讨论脑卒中是一种死亡率和发病率均较高的神经血管性疾病,随着人口老龄化逐渐加重和生活水平的提高,“三高”等风险因素增加,脑卒中的发病率及其对社会和个人造成的负担不断增加[9]。IS后脑缺血损伤区域可以划分为坏死核心区和周围的半暗带[10],其中坏死核心区的细胞迅速坏死,而周围半暗带细胞缺血程度较低,仅表现为细胞功能的降低[11]。目前对IS的治疗策略主要集中在及早挽救缺血半暗带。星形胶质细胞是中枢神经系统的主要组成部分,在中枢神经系统的生理病理过程中发挥着重要作用,IS后星形胶质细胞一方面可以通过支持和营养作用促进神经元的存活,另一方面星形胶质细胞的过度增殖和胶质瘢痕的形成会阻碍神经功能的恢复[12]。目前神经元、毛细血管和星形胶质细胞共同组成的神经血管单元日益受到关注,挽救整个神经血管单元成为IS治疗的新策略[13],因此了解IS后星形胶质细胞的异质性改变对于寻找新的治疗靶点以更好地服务于IS患者有着重要意义。
基于单细胞测序数据,本研究揭示了IS后星形胶质细胞数量的动态变化情况,并且星形胶质细胞特异性标志蛋白GFAP免疫荧光实验结果也证实了这种动态变化。本研究发现在IS后的第1天,缺血损伤脑组织中会产生大量处于发育早期阶段的急性反应性星形胶质细胞(Gpm6b、Fez1高表达),这些细胞亚群可能通过自身或与NK细胞、B细胞间的信号交互介导脑缺血损伤后的急性炎症反应[14],对于这类急性反应性星形胶质细胞亚群介导的炎症反应在IS中的意义还有待进一步的实验验证。IS后第3天开始这些处于发育早期阶段的急性反应性星形胶质细胞亚群的比例降低,而处于发育中期阶段缺血损伤后修复性星形胶质细胞(Ctla2a、Gngt2高表达)亚群的比例升高,该修复性星形胶质细胞亚群可能通过与神经元、血管内皮细胞等功能细胞建立广泛的细胞间联系,如与内皮细胞之间的Vegfb-Vegfr1信号对(促进血管形成、增加毛细血管密度)和与神经元之间Wnt7b-(Fzd3+Lrp6)信号通路的建立(有助于神经元的突触重塑)等[15-16],有效促进IS后神经血管功能的重建,提示通过加强这类修复性星形胶质细胞亚群的作用有助于促进IS后神经功能的恢复。
通过单细胞测序数据对IS后星形胶质细胞异质性的动态分析,解析星形胶质细胞在脑组织发生缺血性损伤后功能的动态改变规律,有助于更好地理解星形胶质细胞在IS发生、发展过程中的作用。不同功能状态下星形胶质细胞与其他细胞之间的细胞交互差异也是值得关注的重点,有效调节或抑制这些细胞间通信有望成为潜在的IS治疗策略。
本文中的电子材料可在《海军军医大学学报》网站(http://xuebao.smmu.edu.cn)“文章检索”版块检索本文标题后免费查阅和下载。
| [1] |
WANG W, JIANG B, SUN H, et al. Prevalence, incidence, and mortality of stroke in China: results from a nationwide population-based survey of 480687 adults[J]. Circulation, 2017, 135(8): 759-771. DOI:10.1161/CIRCULATIONAHA.116.025250 |
| [2] |
DERGUNOVA L V, FILIPPENKOV I B, STAVCHANSKY V V, et al. Genome-wide transcriptome analysis using RNA-seq reveals a large number of differentially expressed genes in a transient MCAO rat model[J]. BMC Genomics, 2018, 19(1): 655. DOI:10.1186/s12864-018-5039-5 |
| [3] |
SHI L, SUN Z, SU W, et al. Treg cell-derived osteopontin promotes microglia-mediated white matter repair after ischemic stroke[J]. Immunity, 2021, 54(7): 1527-1542.e8. DOI:10.1016/j.immuni.2021.04.022 |
| [4] |
ZHENG K, LIN L, JIANG W, et al. Single-cell RNA-seq reveals the transcriptional landscape in ischemic stroke[J]. J Cereb Blood Flow Metab, 2022, 42(1): 56-73. DOI:10.1177/0271678x211026770 |
| [5] |
LEE H G, WHEELER M A, QUINTANA F J. Function and therapeutic value of astrocytes in neurological diseases[J]. Nat Rev Drug Discov, 2022, 21(5): 339-358. DOI:10.1038/s41573-022-00390-x |
| [6] |
LIDDELOW S A, GUTTENPLAN K A, CLARKE L E, et al. Neurotoxic reactive astrocytes are induced by activated microglia[J]. Nature, 2017, 541(7638): 481-487. DOI:10.1038/nature21029 |
| [7] |
ESCARTIN C, GALEA E, LAKATOS A, et al. Reactive astrocyte nomenclature, definitions, and future directions[J]. Nat Neurosci, 2021, 24(3): 312-325. DOI:10.1038/s41593-020-00783-4 |
| [8] |
ZENG F, CAO J, HONG Z, et al. Single-cell analyses reveal the dynamic functions of Itgb2+ microglia subclusters at different stages of cerebral ischemia-reperfusion injury in transient middle cerebral occlusion mice model[J]. Front Immunol, 2023, 14: 1114663. DOI:10.3389/fimmu.2023.1114663 |
| [9] |
GBD 2017 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2018, 392(10159): 1789-1858. DOI: 10.1016/S0140-6736(18)32279-7
.
|
| [10] |
QU M, LIN Q, HUANG L, et al. Dopamine-loaded blood exosomes targeted to brain for better treatment of Parkinson's disease[J]. J Control Release, 2018, 287: 156-166. DOI:10.1016/j.jconrel.2018.08.035 |
| [11] |
FRICKER M, TOLKOVSKY A M, BORUTAITE V, et al. Neuronal cell death[J]. Physiol Rev, 2018, 98(2): 813-880. DOI:10.1152/physrev.00011.2017 |
| [12] |
SHI X, LUO L, WANG J, et al. Stroke subtype-dependent synapse elimination by reactive gliosis in mice[J]. Nat Commun, 2021, 12(1): 6943. DOI:10.1038/s41467-021-27248-x |
| [13] |
YAO D, ZHANG R, XIE M, et al. Updated understanding of the glial-vascular unit in central nervous system disorders[J]. Neurosci Bull, 2023, 39(3): 503-518. DOI:10.1007/s12264-022-00977-9 |
| [14] |
TAO X, ZHANG R, DU R, et al. EP3 enhances adhesion and cytotoxicity of NK cells toward hepatic stellate cells in a murine liver fibrosis model[J]. J Exp Med, 2022, 219(5): e20212414. DOI:10.1084/jem.20212414 |
| [15] |
ROBCIUC M R, KIVELÄ R, WILLIAMS I M, et al. VEGFB/VEGFR1-induced expansion of adipose vasculature counteracts obesity and related metabolic complications[J]. Cell Metab, 2016, 23(4): 712-724. DOI:10.1016/j.cmet.2016.03.004 |
| [16] |
SUGIE A, HAKEDA-SUZUKI S, SUZUKI E, et al. Molecular remodeling of the presynaptic active zone of Drosophila photoreceptors via activity-dependent feedback[J]. Neuron, 2015, 86(3): 711-725. DOI:10.1016/j.neuron.2015.03.046 |
 2023, Vol. 44
2023, Vol. 44


