2. 海军军医大学(第二军医大学)第一附属医院全科医学科,上海 200433;
3. 海军军医大学(第二军医大学)第一附属医院感染控制科,上海 200433
2. Department of General Practice, The First Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200433, China;
3. Department of Infection Control, The First Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200433, China
随着介入肺脏病学的不断发展,各种的软式支气管镜不断涌现。传统的支气管镜设备需配备专门的主机及显示器,体积大、移动困难,主要安装在专业的气管镜操作室内,用于诊断和治疗性操作,而在重症患者床边开展的如吸痰、肺泡灌洗、引导插管等操作常需使用便携式支气管镜。既往的便携式支气管镜均需外接光源或电池,且多在目镜处进行观察,缺乏良好的视野。随着技术的不断发展,目前的便携式支气管镜已将光源及显像集成为主机,更利于临床操作及图像的显示。在全球新型冠状病毒感染疫情蔓延期间,新型冠状病毒感染危重症患者在治疗时亦迫切需要行床边支气管镜检查,但可重复使用的便携式支气管镜在清洗过程中会因病毒气溶胶而造成疫情播散,故可抛弃便携式支气管镜应运而生。
目前已有国内外多家公司生产的可抛弃便携式支气管镜上市,其小巧轻便、成像清晰、镜身插入部远端可操作范围广,能高质量完成床边支气管镜相关的检查及操作。可抛弃便携式支气管镜在临床上除用于新型冠状病毒感染患者外还用于广泛耐药菌感染、活动性肺结核、艾滋病等危重症患者,其单次费用在3 000元以上。而上述患者在实际的临床救治过程中常需要反复多次进行气管镜检查与治疗,若将可抛弃便携式支气管镜仅一次性使用后丢弃无疑增加了医疗费用及医疗垃圾,因此能否利用高效低毒的消毒剂对可抛弃便携式支气管镜进行高水平消毒,达到同一患者有限次数重复使用的目的,是一个值得探讨的问题。
笔者曾将2根使用过的湖南华芯医疗器械有限公司生产的BCV1-W2-L型可抛弃便携式支气管镜的插入部分别浸泡于次氯酸及过氧乙酸消毒液中,60 min后取出并彻底干燥,经资深呼吸治疗师确认其图像质量、插入部远端弯曲度、负压吸引力等性能指标仍满足使用要求,由此可见BCV1-W2-L型可抛弃便携式支气管能在较长时间内耐受消毒剂的处理,有进行重复消毒及使用的可行性。但可抛弃便携式气管镜操作部与插入部连接处未覆盖防水涂层,采用传统的完全浸泡式洗消方法会造成短路及电路板腐蚀,影响重复使用。故笔者根据《软式内镜清洗消毒技术规范WS507-2016》[1]对消毒流程进行适当调整,将支气管镜予以非浸泡式处理,选择不同的消毒方法手工洗消,旨在研究适合于可抛弃便携式支气管镜的消毒方法,同时探索ATP生物荧光法在可抛弃便携式支气管镜清洗消毒效果评价中的应用价值。
1 材料和方法 1.1 仪器与材料全新BCV1-W2-L型可抛弃便携式支气管镜(湖南华芯医疗器械有限公司)10根,由1名资深呼吸治疗师检查确认其图像质量、插入部远端弯曲度、负压吸引力均符合使用要求。佳姆巴医疗器械消毒液(有效氯含量180~220 mg/L,上海日洁环境科技有限公司),舒安美®复合过氧乙酸消毒液(过氧乙酸含量0.12%~0.16%,德国舒美公司),低温等离子消毒器(STERRAD 100NX,美国强生公司),鲁沃夫内镜专用多酶清洗剂(美国Rohof公司),ATP荧光检测仪(3MTM Clean-TraceTM,美国3M公司),医用透明敷料(MDSA-V01,美国3M公司),无菌滤膜、无菌滤膜过滤器(浙江泰林生物技术股份有限公司),含中和剂(0.1%硫代硫酸钠)采样液、R2A琼脂培养基(青岛高科技工业园海博生物技术有限公司),无菌移液枪(北京东南信诚科技有限公司),一次性注射器(山东威高集团医用高分子制品股份有限公司)。
1.2 支气管镜预处理及非完全浸泡式洗消将自制两通阀连接器(长度约5 cm的橡胶管,塑料止水夹套于橡胶管中部)的一头连接于负压吸引装置的负压吸引口,另一头连接一次性注射器,拔除负压吸引调节处阀门,用MDSA-V01医用透明敷料紧密覆盖该端口,拔出活检口阀门并嵌入一次性注射器(图 1A)。支气管镜预处理后当需进行酶洗液及消毒液浸泡时可将支气管镜的插入部完全浸没于液体中,分别抽吸活检口及负压吸引口处连接的注射器,当注射器内均有液体流入时(图 1B),即可实现支气管镜管腔内部完全填充液体达成清洗消毒的目的。
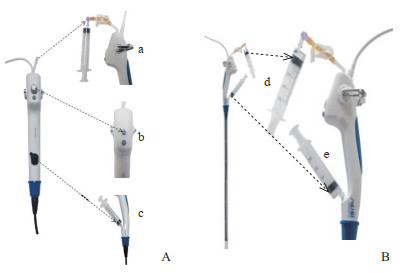
|
图 1 可抛弃便携式支气管镜预处理(A)及非完全浸泡式消毒(B)示意图 a:用自制两通阀连接器(长度约5 cm的橡胶管,塑料止水夹套于橡胶管中部)的两头分别连接支气管镜负压吸引装置的负压吸引口和一次性注射器;b:拔除负压吸引调节处阀门并用MDSA-V01医用透明敷料紧密覆盖;c:拔出活检口阀门并嵌入一次性注射器;d:负压吸引口末端连接的注射器见液体吸入;e:活检口连接的注射器见液体吸入. |
1.3 消毒方法及实验分组、轮次
将10根可抛弃便携式支气管镜随机分为对照组(n=1)及次氯酸组(n=3)、过氧乙酸组(n=3)、低温等离子组(n=3)。综合目前临床上常用的内镜消毒方法及查阅相关文献,选取次氯酸浸泡消毒法、过氧乙酸浸泡消毒法及低温等离子灭菌消毒法分别对次氯酸组、过氧乙酸组、低温等离子组可抛弃便携式支气管镜进行消毒。对照组不做任何处理。因本研究目的为探索可抛弃便携式支气管镜重复使用的可行性,而不是其重复使用的寿命,故实验轮次初步设定为5轮次。
1.4 洗消流程各实验组支气管镜按设定的消毒方法及步骤进行洗消(图 2)。次氯酸、过氧乙酸浸泡消毒法步骤如下:(1)模拟临床操作。将次氯酸组、过氧乙酸组可抛弃便携式支气管镜连接负压模拟床边吸痰操作,吸取经微生物检验明确含有多重耐药菌(多重耐药铜绿假单胞菌、多重耐药鲍曼不动杆菌、耐甲氧西林金黄色葡萄球菌)的痰液,直至管腔全程充满并持续3 s以上。
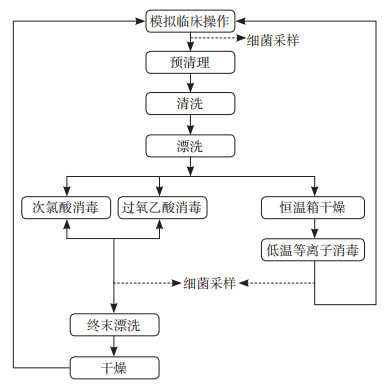
|
图 2 次氯酸组、过氧乙酸组、低温等离子组可抛弃便携式支气管镜洗消流程图 |
(2)预清理。模拟临床操作后用含酶洗液(多酶清洗剂与水按1∶270比例配置)的纱布擦除表面污物,将支气管镜的插入部前端置于装有酶洗液的容器中,启动吸引功能,吸取酶洗液10 s。
(3)清洗。将支气管镜进行预处理后采用非完全浸泡,整个插入部完全浸没于酶洗液中,用质地柔软的擦拭布反复擦洗整个插入部;用一次性注射器抽取酶洗液,通过负压吸引口连接器末端及活检口分别进行内腔灌注2次,每次使用酶洗液50 mL,持续10 s以上;用支气管镜专用刷刷洗所有管道,刷洗时应两头见刷头,反复刷洗至无可见污染物;完成上述步骤后,抽吸活检口处及负压连接口末端处的注射器,当见注射器内有酶洗液流入时,夹闭自制两通阀连接器,此时支气管镜管腔内部即充满酶洗液,浸泡3 min后再次刷洗。
(4)漂洗。流动水下将支气管镜插入部酶洗液冲洗干净,压力水枪冲洗管腔至无酶洗液残留,高压气枪冲干管腔水分,擦拭布擦干外表面。
(5)消毒。将支气管镜插入部完全置入消毒液中,抽吸活检口处及负压连接口末端处注射器,见注射器内均有消毒液流入后夹闭自制两通阀连接器。浸泡时间根据产品说明书设定,次氯酸组次氯酸消毒时间为3 min,过氧乙酸组过氧乙酸消毒时间为5 min。
(6)终末漂洗。将支气管镜从消毒液中取出,置于流动的灭菌水下冲洗管腔及插入部外表面。用浸泡了75%乙醇的无菌纱布对支气管镜操作部进行充分的擦拭消毒。
(7)干燥。使用75%乙醇冲洗各管道,高压气枪向各管道充气至其完全干燥,并用无菌纱布及高压气枪干燥支气管镜外表面。
低温等离子灭菌法消毒步骤如下:低温等离子组可抛弃便携式支气管镜完成模拟临床操作、预清理、清洗、漂洗过程后送入恒温箱中烘干水分,按照低温等离子消毒器的参数设置消毒时间为45 min。
1.5 ATP生物荧光检测及细菌培养(1)预清理前:抽取40 mL无菌注射用水从支气管镜活检口注入,使用无菌收集瓶收集支气管镜插入部远端流出的液体,在清洁环境下,将收集瓶中采样液摇匀后吸取100 μL浸润ATP拭子后放置于ATP荧光检测仪中,记录读数,剩余液体2 h内送检微生物室进行细菌培养。(2)消毒后:再次用40 mL无菌注射用水从活检口注入管腔,将收集到的液体取100 μL行ATP检测,具体方法同前。检测后立即将剩余液体倒入含有中和剂的无菌容器中,2 h内送检微生物室进行细菌培养。
细菌培养:将采样液震荡均匀后用无菌过滤膜滤过,使用无菌镊子夹取滤膜置于R2A琼脂培养基上,放入36 ℃恒温箱中培养48 h,进行菌落计数。
1.6 消毒效果及支气管镜性能检测根据《软式内镜清洗消毒技术规范WS 507-2016》[1],将细菌培养总菌落数≤20 cfu/件(cfu为菌落形成单位),ATP生物荧光检测法按照设备参考值,相对发光单位(relative luminous units,RLU)≤200定为支气管镜消毒合格。每完成1轮洗消后均由资深呼吸治疗师检查支气管镜图像质量、插入部远端弯曲度和负压吸引力(通过同一负压吸引装置、相同负压大小,开启负压吸引3 s的吸引量),与对照组进行比较无明显差异则表明性能合格,可再次使用。
2 结果 2.1 ATP生物荧光检测结果次氯酸组、过氧乙酸组、低温等离子组支气管镜每轮预清理前均进行ATP检测,其RLU中位值(最小值~最大值)分别为5 514(3 567~25 568)、6 210(3 148~15 230)、7 151(4 342~15 343)。次氯酸组、过氧乙酸组消毒后支气管镜管腔的RLU值为16~179,均<200,消毒合格率均为100%。低温等离子组消毒后支气管镜管腔的RLU值为675~4 532,均>200,合格率为0。见表 1。
|
|
表 1 预清理前及消毒后可抛弃便携式支气管镜管腔采样液的三磷酸腺苷生物荧光检测结果 |
2.2 细菌培养法检测结果
次氯酸组、过氧乙酸组、低温等离子组每轮预清理前支气管镜管腔采样液的细菌培养结果均显示菌落布满滤膜,无法计数。次氯酸组、过氧乙酸组支气管镜每轮消毒后采样液的细菌培养结果显示菌落计数为0~6 cfu/件,消毒合格率均为100%;低温等离子组支气管镜每轮消毒后采样液的细菌培养结果显示菌落计数均>20 cfu/件,消毒合格率为0。各组预清理前、消毒后细菌培养结果见图 3。
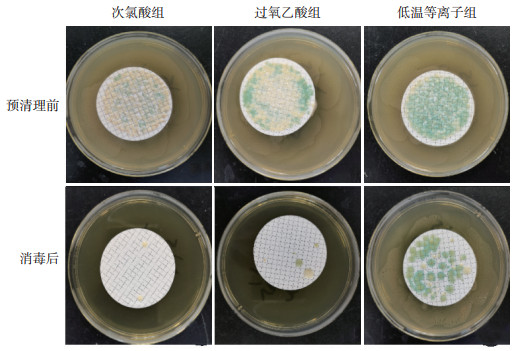
|
图 3 预清理前及消毒后各实验组可抛弃便携式支气管镜管腔采样液的细菌培养结果 |
2.3 性能评价
次氯酸组、过氧乙酸组、低温等离子组支气管镜每轮次洗消后均由1名资深呼吸治疗师检查其图像质量、插入部远端弯曲度及负压吸引力,经与对照组比较均无明显差异。
3 讨论本研究旨在探索适合可抛弃便携式支气管镜的消毒方法,选择目前应用较为普遍的BCV1-W2-L型可抛弃便携式支气管镜作为研究对象。基于该类支气管镜镜体的构造特点,将洗消流程根据《软式内镜清洗消毒技术规范WS 507-2016》进行适当调整(减少测漏步骤),在洗消前对镜身进行预处理,以期在达到高水平消毒目的的同时实现有限次数重复使用。本研究结果表明采用次氯酸浸泡消毒法和过氧乙酸浸泡消毒法进行5轮次洗消,每轮次均能使该类型支气管镜达到高水平消毒的标准,而采用低温等离子灭菌消毒法则不能达标。采用非完全浸泡方式进行有限轮次洗消后,3种消毒方式均不会对支气管镜的性能指标造成影响。
曾有学者选用丹麦生产的Ambu® aScopeTM 3Slim可抛弃便携式支气管镜为研究对象进行了消毒方法研究,该产品插入部和操作部连接处与本研究对象相同,均未覆盖防水涂层,将整个镜身完全浸泡于2%戊二醛中后发现成像画面为灰白色,无法继续使用[2]。为解决这一问题,笔者对BCV1-W2-L型可抛弃便携式支气管镜进行预处理并采用非完全浸泡方式进行洗消,结果显示可达到预期的消毒效果且不影响支气管镜的性能指标。
次氯酸浸泡消毒法、过氧乙酸浸泡消毒法及低温等离子灭菌消毒法均是目前常用的软式支气管镜消毒方法。次氯酸及过氧乙酸消毒剂具有低毒、快速、高效的特点,是理想的消毒剂选择。次氯酸本身是人体内体液和组织液杀菌消炎的重要物质,是人体免疫机制的一部分,适量使用时无不良反应[3]。次氯酸消毒液是一种无色、透明、无异味、对人体无明显刺激性的消毒剂,对通风环境及洗消设备的要求较低[4]。次氯酸消毒剂作用3 min即可有效杀灭纤维支气管镜污染的细菌,达到高水平消毒的效果[5]。对耐药铜绿假单胞菌有较强的抑制效果[6],对耐碳青霉烯类鲍曼不动杆菌也有很好的杀灭效果[7]。使用过氧乙酸消毒剂浸泡5 min即可使软式内镜达到高水平消毒的效果[1],对包括分枝杆菌及芽孢在内的大部分微生物均有杀灭效果。本研究中,可抛弃便携式支气管镜吸取的是经微生物检测后明确含有铜绿假单胞菌、鲍曼不动杆菌等多重耐药菌的痰液,结果表明采用次氯酸及过氧乙酸浸泡消毒法均能满足高水平消毒需求。
过氧化氢低温等离子灭菌消毒法主要应用于不耐湿热的软式内镜及附件的灭菌[8]。景欣等[2]报道,将丹麦Ambu® aScopeTM 3Slim支气管镜进行单次低温等离子灭菌消毒后,经检测其性能指标符合再使用要求,但未对消毒后的支气管镜进行细菌采样及检测。本研究中,将BCV1-W2-L型可抛弃便携式支气管镜使用低温等离子灭菌消毒后进行采样,其即时ATP检测及48 h后细菌培养均提示未能达到高水平消毒标准,推测其原因可能是该类型的支气管镜材质、管腔直径及长度等因素不能与低温等离子消毒设备兼容。
ATP生物荧光检测法是基于萤火虫发光原理开发的快速检测技术,通过一系列氧化反应,使ATP的含量以RLU值的形式表现出来,即RLU值与微生物的数量正相关,已作为一种快速的现场检测方法被广泛用于医务人员手卫生、环境卫生消毒及医疗器械清洗效果的评价[9-10]。近年来,有研究表明可以使用ATP生物荧光检测法评估软式内镜消毒效果[11-12],其与细菌菌落计数法的结果具有良好的相关性[13],在一定的细菌菌落计数范围内可以用ATP生物荧光检测法测定的RLU值代替细菌计数,其数值基本能反映软式内镜洗消前后的细菌负荷[14]。
本研究对3组支气管镜每轮次洗消前后均进行采样,并分别使用ATP生物荧光检测法及细菌菌落计数评价清洗消毒效果,结果提示RLU值与菌落计数结果具有良好的一致性。在次氯酸组、过氧乙酸组中,支气管镜每轮次洗消前现场ATP检测RLU值均明显>200,48 h细菌培养皿中可见菌落布满滤膜表面;洗消后现场检测RLU值均<200,菌落计数为0~6 cfu/件。而低温等离子组支气管镜第1轮洗消后现场ATP检测RLU值仍明显>200,提示使用低温等离子法灭菌消毒后未达到高水平消毒标准,48 h细菌培养结果显示菌落计数虽较洗消前有所减少,但仍>20 cfu/件,证实低温等离子灭菌法消毒效果不佳。因低温等离子组第2轮洗消后的检测结果与第1轮一致,所以未继续后续轮次的洗消。这一结果也充分体现了ATP生物荧光检测法快速、准确的优势。传统的细菌培养检测结果虽是衡量消毒效果的金标准,但需要恒温培养48 h才能获得,而ATP生物荧光检测法能即时进行消毒效果筛查,能满足紧急情况下的需求。
本研究中,对BCV1-W2-L型可抛弃便携式支气管镜每轮次消毒大约需要200 mL消毒剂、20 mL多酶清洗液以及少量价格低廉的辅助工具。经测算,因2种消毒剂的价格差异,每根支气管镜的单次消毒成本约为50元或90元。若某患者进行了6次支气管镜检查且均为一次性使用,则总物资费用约为18 000元,而按本研究方法进行重复消毒后使用则总物资费用约为3 250元或3 450元。相较之下,将可抛弃便携式支气管镜高水平消毒后进行重复的单人单用明显减少了患者的医疗费用。根据本研究结果,笔者将非完全浸泡消毒方式及消毒所需耗材进行优化整合,并申请了专利“便携式支气管镜手工洗消套装”(专利号202223330632.3),现已被国家知识产权局授权。
综上所述,本研究中BCV1-W2-L型可抛弃便携式支气管镜经非完全浸泡式处理后使用次氯酸(3 min)及过氧乙酸(5 min)消毒剂完成5轮次洗消流程,均能达到高水平消毒的效果,支气管镜的性能指标也未受影响,能满足临床使用要求,且消毒流程简便易行、消毒成本下降,故在临床工作中该型号的可抛弃便携式支气管镜针对同一患者进行有限次数的重复使用是切实可行的。在紧急情况下使用可抛弃便携式支气管镜时,ATP生物荧光检测法能快速给出检测结果,起到消毒效果筛查的作用,满足特定环境下快速检测的需求。因此,在未来的战场环境、群体性灾难等需要反复、大量进行支气管镜检查与治疗的场景下,可抛弃便携式支气管镜的重复使用也将发挥重要的作用。
本研究也存在一定的局限性,仅对单一品牌单一型号的可抛弃便携式支气管镜进行了有限次数洗消的探索,未来将纳入更多品牌及型号的可抛弃便携式支气管镜进行研究,以期能更好地指导临床应用。
| [1] |
刘运喜, 邢玉斌, 巩玉秀, 等. 软式内镜清洗消毒技术规范WS 507-2016[J]. 中国感染控制杂志, 2017, 16(6): 587-592. DOI:10.3969/j.issn.1671-9638.2017.06.024 |
| [2] |
景欣, 朱正方, 秦欣, 等. 可抛弃式便携式支气管镜的消毒方法探索[J]. 生物医学工程与临床, 2019, 23(6): 719-722. DOI:10.13339/j.cnki.sglc.20191108.020 |
| [3] |
ANDRÉS C M C, PÉREZ DE LA LASTRA J M, JUAN C A, et al. Hypochlorous acid chemistry in mammalian cells-influence on infection and role in various pathologies[J]. Int J MolSci, 2022, 23(18): 10735. DOI:10.3390/ijms231810735 |
| [4] |
高晓东, 胡必杰, 鲍容. 次氯酸消毒液对皮肤软组织感染常见病原体体外杀菌试验效果分析[J]. 中华医院感染学杂志, 2017, 27(8): 1714-1716. DOI:10.11816/cn.ni.2017-170421 |
| [5] |
钱麟, 史庆丰, 许华, 等. 一种新型次氯酸消毒剂对纤维支气管镜的消毒效果[J]. 中国感染控制杂志, 2020, 19(7): 662-665. DOI:10.12138/j.issn.1671-9638.20205081 |
| [6] |
KOVACS B J, APRECIO R M, KETTERING J D, et al. Efficacy of various disinfectants in killing a resistant strain of Pseudomonas aeruginosa by comparing zones of inhibition: implications for endoscopic equipment reprocessing[J]. Am J Gastroenterol, 1998, 93(11): 2057-2059. DOI:10.1111/j.1572-0241.1998.00591.x |
| [7] |
付大仁, 曾家慧, 韩坤, 等. 次氯酸钠消毒液对携带NDM-1基因的鲍曼不动杆菌杀灭效果的观察[J]. 中国消毒学杂志, 2013, 30(1): 13-14, 17. |
| [8] |
徐东平, 潘勤勤, 肖玲, 等. 软式内镜消毒灭菌方法进展[J]. 中华医院感染学杂志, 2021, 31(6): 957-960. DOI:10.11816/cn.ni.2021-202718 |
| [9] |
RUTALA W A, WEBER D J, Healthcare Infection Control Practices Advisory Committee (HICPAC). Guideline for disinfection and sterilization in healthcare facilities (2008)[R/OL]. (2019-05-24)[2022-11-20]. https://www.cdc.gov/infectioncontrol/pdf/guidelines/disinfection-guidelines-H.pdf.
|
| [10] |
MOORE G, SMYTH D, SINGLETON J, et al. The use of adenosine triphosphate bioluminescence to assess the efficacy of a modified cleaning program implemented within an intensive care setting[J]. Am J Infect Control, 2010, 38(8): 617-622. DOI:10.1016/j.ajic.2010.02.011 |
| [11] |
ALFA M J, FATIMA I, OLSON N. Validation of adenosine triphosphate to audit manual cleaning of flexible endoscope channels[J]. Am J Infect Control, 2013, 41(3): 245-248. DOI:10.1016/j.ajic.2012.03.018 |
| [12] |
GILLESPIE E, SIEVERT W, SWAN M, et al. Adenosine triphosphate bioluminescence to validate decontamination of endoscopes[J]. J Hosp Infect, 2017, 97(4): 353-356. DOI:10.1016/j.jhin.2017.05.020 |
| [13] |
王绍鑫, 周艳琴, 罗剑峰, 等. ATP荧光检测法与细菌定量检测法现场细菌污染检测相关性研究[J]. 中国消毒学杂志, 2014, 31(12): 1285-1287. |
| [14] |
邢书霞, 马玲, 王志, 等. ATP生物荧光法评价医疗器械清洗质量[J]. 中国消毒学杂志, 2008, 25(3): 245-248. DOI:10.3969/j.issn.1001-7658.2008.03.006 |
 2023, Vol. 44
2023, Vol. 44


