2. 中山大学肿瘤防治中心, 影像介入中心, 广州 510060
2. Diagnostic Imaging and Intervening Center, Cancer Center, Sun Yat-sen University, Guangzhou 510060, Guangdong, China
乳腺癌发病率呈逐年上升趋势,其中乳腺导管原位癌(ductal carcinoma in situ,DCIS)的发病率增长更为明显[1]。DCIS作为早期肿瘤内导管性病变,其不同于浸润性乳腺癌,具有相对独特的生物学行为及更好的预后,因此早期检测与准确识别对于乳腺癌的防治和改善预后具有重大意义[2]。由于钙化是DCIS最常见甚至是唯一征象,对钙化灵敏的乳腺X线检查成为目前公认的早期无创诊断DCIS的首选方法,但受DCIS的钙化灶非常微小、分布和形态各异等特点,以及医师的经验不足、致密型乳腺背景等因素的影响,DCIS的漏诊率和误诊率均较高[3]。近年来高速发展的计算机图像处理技术成为解决这一难题的主要研究方向[4],其中基于深度学习的新型方法在多个领域的检测和诊断效能优于传统机器学习算法,成为了乳腺癌研究的热点[5-6]。然而对于治疗和预后均区别于浸润性乳腺癌的DCIS,如何应用深度学习模型检测和识别特征性钙化灶以提高其检出率的研究在国内外尚属空白。本团队前期在新型深度学习模型应用于乳腺癌领域、传统算法应用于DCIS的研究中获得了关键性进展:(1)深度学习模型通过识别乳腺X线图像上钙化灶对乳腺癌具有较高的诊断价值[7];(2)基于传统算法的计算机辅助分析技术有助于提高DCIS的检出率[8-10]。结合前期研究结果,本研究拟基于深度学习算法建立DCIS的钙化特征检测和识别模型,并将其诊断效能与独立特征参数和传统机器学习算法模型进行对比,探讨该模型对于DCIS的诊断价值。
1 资料和方法 1.1 一般资料回顾性分析2016年1月至2022年12月经南方医科大学深圳医院或中山大学肿瘤防治中心乳腺钼靶X线检查发现钙化的832例患者的影像学资料。纳入标准:(1)行乳腺X线检查并在3个月内经手术或病理活检确诊;(2)依据乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)描述,由2名放射科副主任医师经协商一致确认乳腺钼靶X线图像上存在钙化。入组患者按病理结果分为两组:良性病变组569例(纤维腺瘤202例、纤维囊性增生351例、错构瘤3例、硬化性乳腺病5例、浆细胞性乳腺炎4例、非特异性乳腺炎4例),DCIS组263例。入组患者均为女性,年龄20~76岁,平均年龄(38.4±4.0)岁。随机选取入组患者中的75%为训练样本(共624例,435例良性病变、189例DCIS)用于建立诊断模型;余208例(134例良性病变、74例DCIS)为测试样本,用于测试模型的分类识别效能。
1.2 检查方法与深度学习模型乳腺钼靶X线检查采用德国SIMENS公司生产的全数字化平板乳腺X线机(型号MAMMOMAT Inspiration),所有病例均行常规标准头足位和侧斜位摄片,设备电压22~49 kV,电流小焦点40 mA,大焦点100 mA。获得的乳腺X线片经数字化处理后,通过深度学习算法建立的模型进行钙化检测和识别。综合计算机辅助分析技术检测乳腺癌钙化灶的研究结果[7-10],提取反映每例患者图像上所有钙化灶的形态学、统计学、纹理、分布4类特征的共计20个定量参数。(1)形态学特征:圆度及圆度比例(近似圆形钙化灶的数目及占总数的比例)、线样分支状钙化数(近似直线和/或有分叉的长径<0.5 mm的钙化灶个数)、细颗粒状钙化数(细颗粒状、长径<0.5 mm的微钙化灶个数)、轴比(钙化分布区域的长轴与短轴之比)、容积率(钙化灶面积与乳腺面积之比)、毛刺(边缘不规则呈毛刺状的钙化灶数目)。(2)统计学特征:钙化密度(每例患者所有钙化灶的平均密度)、面积(每例患者钙化灶分布面积的总和)、平均直径(每例患者所有钙化灶直径的平均值)、个数(每例患者钙化灶的总数)。(3)纹理特征:平均灰度(每例患者所有钙化灶的平均亮度)、对比度(钙化灶最亮区域与乳腺图像的亮度层级差异)、相关性(钙化区域纹理与乳腺图像纹理层级的相关值)、实体性(内部密度呈实体的钙化灶数目)。(4)分布特征:簇状分布率、段样分布率、散在分布率、区域型分布率(分别表示每例患者各种分布类型的钙化灶数目与总分布类型数目之比)及种群密度(每平方厘米内钙化灶的个数)。
采用典型关联分析通过类似于主成分分析的方法对差异有统计学意义的传统特征X与深度特征Y进行降维聚合成2个成分组X*、Y*,即X*=WXTX、Y*=WyTY,通过调整每个特征的权重使两组特征降维后的2个成分组间关联系数最大,即形成完整表达最有利于DCIS诊断的钙化特征拟合
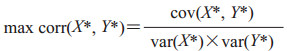
|
采用卷积神经网络中的卷积方式建立深度学习模型,卷积过程可表示为
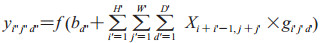
|
其中,y为输出的特征集,b为偏置,i"输出张量(tensor)的横坐标下标,j"输出张量的纵坐标下标,d"输出张量的通道维度上的下标,x表示输入张量,d'表示输入张量及卷积核的通道维度上的下标,i表示输入张量的横坐标维度上的初始下标,j表示输入张量的纵坐标维度上的初始下标,g表示卷积核,i'表示卷积核的横坐标位置的下标,j'表示卷积核的纵坐标位置的下标,H'、W'、D'分别代表卷积核的长、宽和维度。
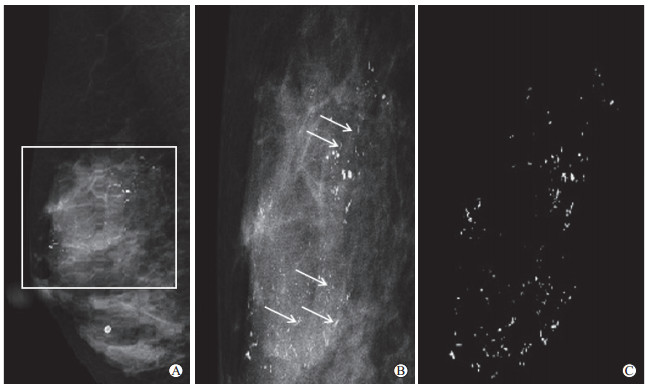
图 1所示为基于深度学习模型的图像处理软件对病变钙化的检测和提取工作界面,深度学习模型可有效分割钙化灶并达到高清显示的效果。
|
图 1 基于深度学习模型的图像处理软件对病变钙化的检测和提取工作界面 60岁女性乳腺导管原位癌患者.A:右侧乳腺斜位片.矩形框为经医师确认可疑恶性钙化区域,包括颗粒状、线样分支状形态并呈段样分布.B:基于深度学习模型的软件自动化分割钙化的感兴趣区域.多发线样分支状微钙化(箭头所示)和细颗粒状微钙化显示较前清楚,整体呈段样分布.C:钙化灶的分割效果和特征提取结果,可见钙化的形状、分布特征显示清晰. |
1.3 病理学检查
病理诊断参照2019年WHO颁布的第5版乳腺肿瘤组织学分类标准[11]。由2名有经验的病理科医师独立做出诊断,并最终达成一致诊断。
1.4 统计学处理应用SPSS 17.0软件进行统计学分析。经Shapiro-Wilk法检验,所有特征参数数据均不符合正态分布,均以中位数表示,两组间比较采用Mann-Whitney U检验。检验水准α为0.05。采用ROC曲线分析差异有统计学意义的特征参数对DCIS的诊断价值,同时评价基于特征集合建立的深度学习分类识别模型对于DICS的诊断价值,并与独立特征参数和传统机器学习模型支持向量机(support vector machine,SVM)、K-邻近算法(K-nearest neighbor,KNN)、线性判别分析(linear discriminant analysis,LDA)、logistic回归的诊断价值进行对比,计算AUC值、灵敏度、特异度。
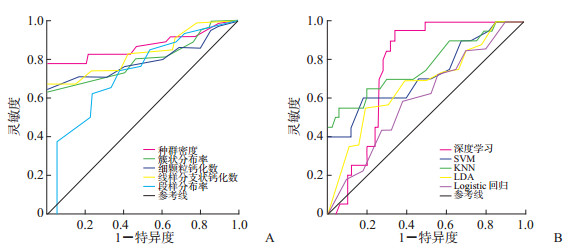
2 结果20个特征参数中仅线样分支状钙化数、细颗粒状钙化数、段样分布率、簇状分布率、种群密度在良性病变组和DCIS组比较差异有统计学意义,以DCIS组数值较高(P均<0.05,表 1)。线样分支状钙化数、细颗粒状钙化数、段样分布率、簇状分布率、种群密度识别DCIS的ROC AUC值分别是0.762、0.732、0.725、0.757、0.810,灵敏度分别为81.2%、85.9%、80.1%、87.8%、86.4%,特异度分别为76.0%、71.6%、70.3%、73.4%、63.7%(图 2A)。基于上述5个特征参数拟合的深度学习分类模型识别DCIS的AUC值、灵敏度、特异度分别为0.823、89.3%、77.3%,较各项独立特征参数均有不同程度的提高。4个传统机器学习模型SVM、KNN、LDA、logistic回归模型识别DCIS的AUC值分别为0.771、0.801、0.765、0.734,灵敏度分别为79.7%、80.9%、77.8%、74.4%,特异度分别为57.8%、62.9%、56.6%、47.9%,均低于深度学习分类模型(图 2B)。
|
|
表 1 两组病变微钙化灶的20个特征参数比较 |
|
图 2 5项特征参数(A)及拟合深度学习模型和4种传统机器学习模型(B)诊断乳腺DCIS的ROC曲线 DCIS:导管原位癌;ROC:接受者操作特征;SVM:支持向量机;KNN:K-邻近算法;LDA:线性判别分析. |
3 讨论
依据BI-RADS描述,乳腺癌2个最重要诊断依据是钙化和肿块,其中钙化形态、大小、数量和密集度的相对特征性表现可反映良恶性病变性质[12]。DCIS作为乳腺癌的早期阶段,微钙化是其最常见甚至是唯一的X线征象,分析DCIS钙化特征以提高早期诊断率对于乳腺癌防治工作的开展有重要意义[13]。
根据国内外研究报道和BI-RADS对于恶性钙化的描述,普遍认为长径<0.5 mm、密集(每平方厘米钙化数≥15个)、段样分布、簇状分布、泥沙样、线样分支状是恶性钙化的相对特异性表现[13-15]。本研究引入20个特征参数阐述上述钙化影像学特征,结果表明DCIS组的线样分支状钙化数、细颗粒状钙化数、段样分布率、簇状分布率、种群密度均高于良性病变组(P均<0.05),提示DCIS呈现出恶性钙化的普遍特征,即线样分支状、簇状分布、段样分布、细小、密集分布,这表明本研究中的定量特征参数能可靠地反映BI-RADS描述的恶性钙化特征。文献报道线样分支状、导管样或段样分布是DCIS的相对特异性表现[14-15],本研究通过计算机图像处理技术得到相同结论,并给出了诊断临界值,这是对此类研究的重要补充。
不同于乳腺癌钙化特征研究的相关结论(数目多、钙化长径<0.5 mm提示恶性风险)[14-15],本研究结果显示钙化个数、钙化平均直径在DCIS和良性病变组之间的差异无统计学意义,钙化的纹理特征和其余分布、统计学特征差异也无统计学意义,推测原因主要在于:(1)研究对象不同。既往研究对象多为肿瘤细胞坏死更为广泛的浸润性乳腺癌患者[16],而本研究对象为基底膜完整、细胞恶变坏死局限的DCIS患者。DCIS这种独特的病理学基础和生物学行为导致其钙化灶与浸润性乳腺癌不同,从而其钙化特征呈现一定特殊性,使钙化总数、平均直径,以及其余分布特征、统计学特征参数不一定适用于DCIS的钙化分析。(2)病例构成不同。本研究中良性病变组病例数明显多于DCIS组,且纤维囊性增生患者占比较大,而文献报道纤维囊性增生的乳腺实质容易出现弥漫散在的细小钙化灶(长径<0.5 mm)[17],所以良性病变组也可能出现较大的钙化总数、细小的钙化形态并散在分布。这影响了描述此类特征的参数在组间的统计学分析结果,甚至导致研究结果偏倚。与前期研究结果不同的是,本研究中差异有统计学意义的钙化特征参数较前增多,这与本研究扩大病例规模并引进新型的特征检测算法直接相关,新算法根据更大规模病例资料训练提取特征参数,能发掘更多有意义的特征参数,最终影响其判别效能,本研究结论可为针对DCIS钙化特征的检测研究提供重要参考。
ROC曲线分析结果显示,5个特征参数的诊断价值并不相同:种群密度>线样分支状钙化数>簇状分布率>细颗粒状钙化数>段样分布率,代表钙化密集度的种群密度虽然诊断效能较高但特异度低于其余特征参数,线样分支状钙化数的特异度高于其他参数但诊断效能不够理想。这提示在实际工作中,分析钙化形态和分布时应重点关注和加深对上述5个特征参数的判别和认识,在作出最终诊断意见的过程中给予钙化特征不同关注度的同时也需要注意各类特征的局限性,综合多种有价值的影像学特征和临床信息才能避免漏诊和误诊。本团队前期研究中发现基于深度学习的分类识别模型对乳腺癌钙化的判别效能高于独立特征参数[7],本研究以DCIS患者为研究对象得到了相同的结论,说明深度学习通过调节有意义特征的诊断权重、优化拟合特征组合的方法来提高诊断效能并且不受改变研究对象的影响,能较好地弥补单项特征判别分析的局限性,对提高DCIS钙化判别的灵敏度和准确度具有重要意义。近年来深度学习模型因其较高的诊断效能成为开发计算机辅助乳腺癌诊断技术的研究热点[6-7],本研究创新性地将其应用于DCIS识别领域并与传统机器学习方法的诊断价值进行对比分析,发现深度学习模型的诊断效能仍优于传统算法,充分证明深度学习模型在乳腺疾病中有较高的应用价值。
本研究也存在不足之处,一方面,本研究病例构成的不均衡在一定程度上影响统计学分析结果。另一方面,本研究中挖掘的有意义的特征参数有限,拟合的深度学习模型识别DCIS的准确度、特异度尚不够理想。下一步研究将致力于解决这些问题,扩大病例规模、均衡病例构成的同时挖掘更多有意义的特征参数,得到更可靠的统计学分析结果,以达到全面、如实反映DCIS钙化影像学特征的效果并建立更理想的分类识别模型。
综上所述,通过深度学习模型检测和定量提取良性病变和DCIS的钙化特征,发现DCIS更容易出现较高的线样分支状钙化数、细颗粒状钙化数、段样分布率、簇状分布率、种群密度,在实际工作中需加深对此类特征的综合分析。基于以上5个特征参数拟合的深度学习模型对DCIS的诊断效能高于独立特征参数和传统机器学习算法,表明优化特征组合有助于提高诊断效能,在早期乳腺癌诊断识别领域有应用价值。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
BADVE S S, GÖKMEN-POLAR Y. Ductal carcinoma in situ of breast: update 2019[J]. Pathology, 2019, 51(6): 563-569. DOI:10.1016/j.pathol.2019.07.005 |
| [3] |
PETERS G, JONES C M, DANIELS K. Why is microcalcification missed on mammography?[J]. J Med Imaging Radiat Oncol, 2013, 57(1): 32-37. DOI:10.1111/1754-9485.12011 |
| [4] |
CHAN H P, SAMALA R K, HADJIISKI L M. CAD and AI for breast cancer-recent development and challenges[J]. Br J Radiol, 2020, 93(1108): 20190580. DOI:10.1259/bjr.20190580 |
| [5] |
LECUN Y, BENGIO Y, HINTON G. Deep learning[J]. Nature, 2015, 521(7553): 436-444. DOI:10.1038/nature14539 |
| [6] |
OU W C, POLAT D, DOGAN B E. Deep learning in breast radiology: current progress and future directions[J]. Eur Radiol, 2021, 31(7): 4872-4885. DOI:10.1007/s00330-020-07640-9 |
| [7] |
WANG J, YANG X, CAI H, et al. Discrimination of breast cancer with microcalcifications on mammography by deep learning[J]. Sci Rep, 2016, 6: 27327. DOI:10.1038/srep27327 |
| [8] |
谭婉嫦, 王金花, 蔡洪明, 等. 基于微钙化检测的计算机辅助诊断系统对于乳腺导管原位癌的诊断价值[J]. 临床放射学杂志, 2016, 35(9): 1352-1356. DOI:10.13437/j.cnki.jcr.2016.09.017 |
| [9] |
张奕昭, 王金花, 谭婉嫦, 等. 微钙化的计算机辅助分析对乳腺导管原位癌及微浸润的诊断价值[J]. 放射学实践, 2016, 31(12): 1196-1200. DOI:10.13609/j.cnki.1000-0313.2016.12.020 |
| [10] |
王金花, 谭婉嫦, 刘立志, 等. 微钙化的计算机辅助检测对乳腺癌的诊断价值[J]. 放射学实践, 2013, 28(8): 857-860. DOI:10.13609/j.cnki.1000-0313.2013.08.025 |
| [11] |
WHO Classification of Tumors Editorial Board. WHO classification of tumors, 5th edition—breast tumors[M]. Lyon: IARC Press, 2019: 23-56.
|
| [12] |
American College of Radiology. Breast imaging reporting & data system (BI-RADS®)[EB/OL]. [2022-03-18]. https://www.acr.org/Clinical-Resources/Reporting-and-Data-Systems/Bi-Rads.
|
| [13] |
RAUCH G M, HOBBS B P, KUERER H M, et al. Microcalcifications in 1657 patients with pure ductal carcinoma in situ of the breast: correlation with clinical, histopathologic, biologic features, and local recurrence[J]. Ann Surg Oncol, 2016, 23(2): 482-489. DOI:10.1245/s10434-015-4876-6 |
| [14] |
DERSHAW D D, ABRAMSON A, KINNE D W. Ductal carcinoma in situ: mammographic findings and clinical implications[J]. Radiology, 1989, 170(2): 411-415. DOI:10.1148/radiology.170.2.2536185 |
| [15] |
顾雅佳, 王玖华, 涂小予, 等. 乳腺导管原位癌的钼靶X线表现与病理对照研究[J]. 中华放射学杂志, 2002, 36(3): 240-244. DOI:10.3760/j.issn:1005-1201.2002.03.012 |
| [16] |
BURNSIDE E S, OCHSNER J E, FOWLER K J, et al. Use of microcalcification descriptors in BI-RADS 4th edition to stratify risk of malignancy[J]. Radiology, 2007, 242(2): 388-395. DOI:10.1148/radiol.2422052130 |
| [17] |
TSE G M, TAN P H, PANG A L M, et al. Calcification in breast lesions: pathologists' perspective[J]. J Clin Pathol, 2007, 61(2): 145-151. DOI:10.1136/jcp.2006.046201 |
 2023, Vol. 44
2023, Vol. 44


