患者男,24岁,未婚未育,因“男性性功能低下1年”于2019年2月26日入住我科。患者1年前自觉性欲减退,勃起困难,胡须、阴毛、腋毛稀疏。近3年出现颜面部色素沉着,乏力,体重无变化,二便如常,嗅觉及色觉无异常。既往史:否认肝炎病史,否认输血及外伤史,否认家族性遗传病史。入院后体格检查:身高177 cm,体重74 kg,BMI 23.63 kg/m2,身高上部量79 cm、下部量98 cm,指间距184 cm,颜面皮肤、双手手背色素沉着,胡须稀疏,喉结清晰偏小,腋毛稀疏,心肺腹无阳性体征,阴毛量少(Tanner Ⅳ期)。阴茎4~5 cm(牵长测量法)。双侧阴囊内扪及睾丸,双侧睾丸8~10 mL(Prader睾丸体积测量计测量),较正常略小,质地偏软,左侧精索增粗。性腺激素:睾酮0.22 ng/mL、黄体生成素0.31 IU/L、卵泡刺激素0.39 IU/L、雌二醇1 pg/mL。甲状腺功能、血浆皮质醇昼夜节律正常。血常规:血小板计数109×109/L。血生化:葡萄糖7.1 mmol/L,天冬氨酸转氨酶59 U/L,丙氨酸转氨酶79 U/L。血清铁48.2 μmol/L,铁蛋白>2 000 ng/mL。口服葡萄糖耐量试验即刻血糖6.7 mmol/L,2 h血糖13.5 mmol/L。肝纤四项、肝炎全套、自身免疫性肝病抗体、甲胎蛋白未见异常。促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)兴奋试验与GnRH兴奋延迟试验提示垂体反应水平低下(表 1)。
|
|
表 1 GnRH兴奋试验及GnRH兴奋延迟试验结果 |
胸部X线片未见异常。骨密度:腰椎Z值最低为-2.33,髋关节Z值最低为-4.23。肾上腺CT平扫无异常。阴囊超声:双侧睾丸实质内点状高回声,左侧精索静脉曲张。心电图:窦性心动过缓,逆钟向转位。心脏彩超:射血分数为68%。MRI平扫+增强:垂体变扁,垂体柄居中;T2加权成像(T2 weighted imaging,T2WI)示垂体信号明显减低(图 1A、1B)。腹部CT平扫+增强(图 1C):肝实质密度不均,CT值约93 HU,左外叶体积增大,比例失调;增强后肝脏密度稍均匀。肝脏MRI(图 1D):肝左叶稍肥大,T2WI肝实质呈弥漫性明显低信号。胰腺T1加权成像(T1 weighted imaging,T1WI)及T2WI亦呈明显低信号(图 1E)。肝穿刺活检病理(图 1F)形态符合含铁血黄素沉着症(血色病)。
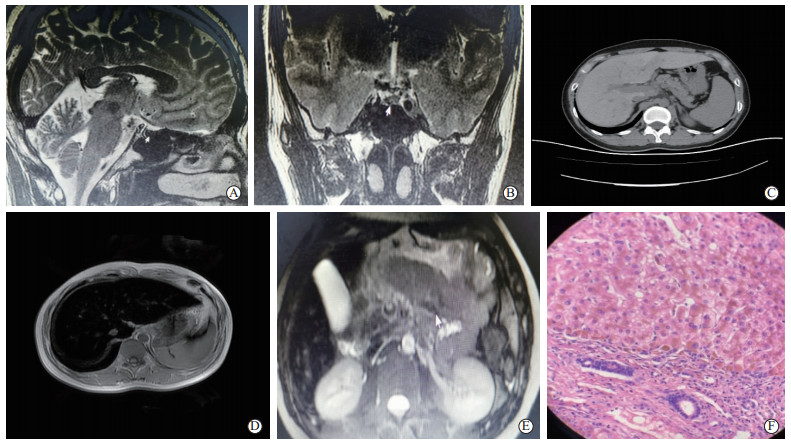
|
图 1 患者影像学检查结果和肝组织病理学表现 A:MRI检查示垂体变扁(矢状面,箭头所示). B:MRI检查示垂体柄居中,T2加权成像示垂体信号明显减低(冠状面,箭头所示). C:CT检查示肝实质密度不均,比例失调,密度增高,右后叶低密度影,“白肝征”,增强后呈轻度持续性强化(箭头所示).D:MRI检查,肝实质呈弥漫性明显低信号(横断面). E:MRI检查示胰腺呈明显低信号(箭头所示). F:苏木精-伊红染色(400×)示肝细胞内弥漫性含铁血黄素沉积,以汇管区周围肝细胞为著;汇管区小胆管增生,部分胆管上皮内也可见含铁血黄素沉积,间质结缔组织少数肝细胞可见灶状脂肪变性;间质结缔组织增生,慢性炎症细胞浸润,局部分隔肝细胞团,呈微小结节性肝硬化改变. |
基因检测结果:铁调素调节蛋白(hemojuvelin,HJV)基因1~4号外显子杂合缺失,染色体位置1q21.1,Gln6His、Cys321*杂合突变。诊断为遗传性血色病ⅡA型。积极给予铁螯合剂(地拉罗司)治疗,同时限制外源性铁的摄入。给予十一酸睾酮替代及保肝、补钙+活性维生素D等治疗。患者治疗1个月后乏力症状较前改善,偶有晨勃,于2019年3月25日出院。出院后继续予十一酸睾酮治疗,3个月后随访时患者自诉有晨勃、有射精、有精液,复查性腺激素示睾酮1.42 ng/mL、黄体生成素0.16 IU/L、卵泡刺激素0.29 IU/L、雌二醇1 pg/mL。
2 讨论原发性血色病又称特发性或遗传性血色病(hereditary hemochromatosis,HH)[1],是一种罕见的遗传性铁代谢性疾病,在我国人群中的发病率较低,约为0.10‰~0.25‰[2]。HH根据基因突变位点及表型的不同可分为Ⅰ型(第6号染色体血色病基因)、Ⅱ型[青少年血色病,含ⅡA型(HJV)和ⅡB型(铁调素抗菌肽基因)]、Ⅲ型(转铁蛋白受体2基因)和Ⅳ型(膜铁转运蛋白基因),我国主要以青少年型血色病为主[3],它是HH中最严重的一种类型,一般在30岁前发病。国内报道较多的基因突变是Cys321*[4],本例患者为Cys321*、Gln6His杂合突变,临床意义需进一步探索。
根据基因突变的类型不同,HH临床表现可从仅生化结果异常到严重的器官损伤性疾病。HH最常见的非糖尿病的内分泌并发症是性腺功能减退。本例患者行GnRH兴奋试验,黄体生成素水平在注射戈那瑞林后30 min达高峰,较注射戈那瑞林前15 min升高,是其3.77倍,与低促性腺激素性性腺激素减退症实验室检查结果相符。该患者GnRH兴奋延迟试验中,黄体生成素水平高峰也在注射戈那瑞林后30 min,较注射戈那瑞林前15 min升高,是其3.80倍。考虑垂体受损可能性大。铁过载对下丘脑-垂体-性腺轴的影响是逐渐发生的,性腺功能减退状态可被认为是疾病晚期的一种表现。不同的是,Ⅱ型HH患者可能早期就出现低促性腺激素性性腺功能减退症的临床表现和血生化证据,有时比心肌病和肝脏疾病的发生早很多年[1]。
在青少年型HH中,糖耐量减低的患病率较高,为58%[5]。HH导致的糖代谢异常可能与性腺功能减退有内在联系。有研究表明,在男性HH患者中,性腺功能减退所致的低性激素结合蛋白和低雄激素与腹型肥胖、高胰岛素血症、胰岛素抵抗有关[6],而胰岛素抵抗正是2型糖尿病发病的中心环节。本例患者同时存在空腹血糖受损和糖耐量异常,考虑为过量铁沉积和低促性腺激素性性腺功能减退症共同作用所致。
肝脏作为人体主要的储铁器官,是机体最先表现出铁过载的器官。肝脏穿刺活检组织学检查是诊断血色病的金标准。肝过量铁沉积症在CT上有其特征性的影像学表现,当铁沉积>10 g时,CT表现为密度弥漫性的增高,甚至似增强后肝脏的表现,称为“白肝征”,CT值可达75~130 HU。本例患者为24岁青年男性,肝酶略升高,肝脏CT值明显增高(93 HU),肝脏CT呈现典型的“白肝征”,考虑其肝脏实质内铁含量应>150 μmol/g,与青少年型血色病发病年龄轻、病情重、累及肝脏相符。血色病在MRI上也有特征性的表现,铁沉积在肝脏,肝MRI T1WI、T2WI信号明显降低,形成全肝低信号的“黑肝”。过量的铁也可沉积于垂体,垂体MRI显示T2WI信号明显减低[7]。本例患者垂体MRI可见垂体变扁,T2WI信号明显减低。肝脏MRI T2WI弥漫性低信号,肝脏CT表现为“白肝征”,胰腺于T1WI及T2WI亦呈明显低信号,这些特征性表现可作为血色病诊断的突破点,有助于影像科和内科医师及时识别血色病,减少漏诊、误诊。
血色病的治疗目标是尽快去除体内过量的铁,并根据铁负荷造成各器官损害的症状进行对症治疗。病因治疗方面首先要减少饮食中铁的摄入,减少维生素C的摄入;其次可采用静脉放血疗法,目标是使血清铁蛋白维持在50~100 ng/mL。贫血严重不适宜放血者,可用铁螯合剂(去铁胺、地拉罗司)行去铁治疗。并发症治疗方面,对性腺功能减退者的治疗主要是补充外源性雄激素以维持男性第二性征及性功能,对于有生育需求的HH患者,可给予GnRH或黄体生成素及卵泡刺激素替代治疗。本例患者行GnRH兴奋试验和兴奋延迟试验提示GnRH兴奋后垂体反应差,应用GnRH泵脉冲治疗效果差,故给予十一酸睾酮口服替代改善第二性征。随访时患者性腺功能较前改善,复查睾酮水平较前升高。
综上所述,HH初期临床症状不典型,易误诊和漏诊,特别是Ⅱ型HH,其病情进展快,病死率高。通常以性腺功能减退为首发症状,起病较隐匿。对于性腺功能减退、肝功能异常的患者,除完成常见原因的检查外,需进一步筛查遗传代谢性疾病,完善血清铁、铁蛋白等检查,尤其关注肝脏、胰腺、垂体的CT和MRI表现,必要时应进行肝穿刺病理组织学检查或/和基因测序,早期诊断和治疗,延缓病情进展及改善预后。
| [1] |
PIETRANGELO A. Hereditary hemochromatosis: pathogenesis, diagnosis, and treatment[J]. Gastroenterology, 2010, 139: 393-408, 408.e1-2. DOI:10.1053/j.gastro.2010.06.013 |
| [2] |
陈灏珠, 林果为. 实用内科学[M]. 13版. 北京: 人民卫生出版社, 2009: 1110-1112.
|
| [3] |
赵新颜, 何志颖, 刘立伟, 等. 45例原发性与继发性血色病临床病理特点对比研究[J]. 传染病信息, 2019, 32: 127-131. DOI:10.3969/j.issn.1007-8134.2019.02.007 |
| [4] |
李元丰, 张红星, 张海涛, 等. 一个中国遗传性血色病家系致病基因的突变分析[J]. 遗传, 2014, 36: 1152-1158. DOI:10.3724/SP.J.1005.2014.1152 |
| [5] |
DE GOBBI M, ROETTO A, PIPERNO A, et al. Natural history of juvenile haemochromatosis[J]. Br J Haematol, 2002, 117: 973-979. DOI:10.1046/j.1365-2141.2002.03509.x |
| [6] |
CORONA G, MANNUCCI E, PETRONE L, et al. Association of hypogonadism and type Ⅱ diabetes in men attending an outpatient erectile dysfunction clinic[J]. Int J Impot Res, 2006, 18: 190-197. DOI:10.1038/sj.ijir.3901391 |
| [7] |
ANGELOPOULOS N G, GOULA A, DIMITRIOU E, et al. Reversibility of hypogonadotropichypogonadism in a patient with the juvenile form of hemochromatosis[J]. FertilSteril, 2005, 84: 1744. DOI:10.1016/j.fertnstert.2005.05.070 |
 2023, Vol. 44
2023, Vol. 44


