2. 海军青岛特勤疗养中心疗养五科, 青岛 266071;
3. 海军军医大学(第二军医大学)基础医学院学员四大队, 上海 200433
2. Department of Recuperation(Ⅴ), Qingdao Special Servicemen Recuperation Center of PLA Navy, Qingdao 266071, Shandong, China;
3. The Fourth Student Team, College of Basic Medical Sciences, Naval Medical University(Second Military Medical University), Shanghai 200433, China
叶酸是一种重要的水溶性B族维生素,在体内酶的催化下生成有活性的四氢叶酸,四氢叶酸作为一碳单位代谢的甲基供体参与碱基合成、氨基酸相互转化及甲基化修饰等过程,对细胞分裂及组织生长具有极其重要的作用。人体自身不能合成叶酸,只能从食物中摄取[1-3]。大量研究显示,叶酸是胎儿生长发育的必需物质[4-5]。基于叶酸在预防神经管缺损等多种出生缺陷方面的作用[4-6],全世界范围内有超过50个国家强制要求育龄妇女在妊娠前及妊娠前3个月增补叶酸[7],我国也将围妊娠期增补叶酸作为一项优生优育的政策在育龄人群中推广[8]。目前,临床上对于存在胎儿神经管缺损高风险的孕妇推荐叶酸补充量为4~8 mg/d,远远超过非孕妇推荐补充剂量(180~200 μg/d)和普通孕妇推荐补充剂量(400 μg/d)[9]。
由于遗传背景等因素的作用,不同个体的叶酸生物利用度差异巨大[10]。对于生物利用度较高或饮食中并不缺乏叶酸的围妊娠期女性,无差别地依据指南增补叶酸可能会导致体内叶酸水平超过所需[11]。最新研究显示,围妊娠期过量增补叶酸在某些个体会引起叶酸水平剧烈升高,并对孕妇本身或其后代发育带来不良影响,导致不良妊娠结局[12-14]。因此,深入研究围妊娠期增补叶酸与母体叶酸水平及后代发育的相关性,对于指导临床叶酸增补具有非常重要的意义。目前大量研究局限于流行病学调查,且不同研究团队的结果并不一致甚至相互矛盾。对22项围妊娠期增补叶酸与后代先天性心脏病(以下简称先心病)的相关性研究进行总结发现,其中12项研究结果显示增补叶酸可降低先心病的发病风险,7项研究认为增补叶酸与先心病的发病风险无关,3项研究结果提示服用叶酸补充剂会增加先心病的发病风险[12-13, 15-16]。目前叶酸的可耐受摄入量上限尚不明确且缺乏剂量反应数据[10-11]。以往研究通常将常规饲料喂养的小鼠叶酸水平作为基线,通过改变饲料中的叶酸含量(高叶酸含量饲料一般设置为普通饲料叶酸含量的4~10倍)来探讨叶酸过量增补的效应[14-15, 17-18],但这种方法无法消除个体叶酸生物利用度差异对研究结果的干扰[10, 14, 19-20]。本研究利用高叶酸含量的配方饲料喂养结合血清叶酸水平检测的方法,建立围妊娠期增补叶酸导致血清叶酸水平升高的雌性小鼠模型,并利用该模型探讨围妊娠期母体高血清叶酸水平下胎鼠的心脏发育情况,揭示围妊娠期叶酸水平升高对后代心脏发育的影响。
1 材料和方法 1.1 实验动物用于造模的30只3周龄雌性BALB/c小鼠和用于传代的12只6周龄雄性BALB/c小鼠均购自上海吉辉实验动物饲养有限公司[实验动物生产许可证号为SCXK(沪)2022-0009]。小鼠饲养于海军军医大学(第二军医大学)实验动物中心SPF级环境中,饲养过程严格按标准进行,保证12 h/12 h昼夜循环。本研究的动物实验方案经海军军医大学(第二军医大学)实验动物伦理委员会审批。
1.2 配方饲料的设计与合成配方饲料中除叶酸外其他营养成分及含量与AIN-93G-D10012G普通饲料[21]一致。普通饲料中叶酸含量约为2.0 mg/kg[21],因此将含有2.0 mg/kg叶酸的配方饲料作为正常叶酸饲料(FAN);同时根据临床实际和既往研究设计了3组高叶酸配方饲料,其叶酸含量分别为FAN的5倍(FA5,10.0 mg/kg)、10倍(FA10,20.0 mg/kg)和20倍(FA20,40.0 mg/kg)[9, 14, 18]。不同叶酸含量的配方饲料均委托无锡帆泊生物技术有限公司合成。
1.3 动物模型的构建与分组模拟临床上围妊娠期增补叶酸的时机和方式,3周龄雌性BALB/c小鼠离乳后,首先使用普通饲料喂养至性成熟(6周龄),然后随机分为5组,每组6只。其中1组继续使用普通饲料喂养,其余4组分别用FAN、FA5、FA10、FA20配方饲料喂养。配方饲料喂养2周后,通过眼眶后静脉丛采血法获取全血(60~80 μL/只),4 ℃放置过夜后,1 000×g离心10 min分离上层血清。通过ELISA检测血清叶酸水平,每只小鼠测定3个复孔,相关检测委托上海西唐生物科技有限公司完成。
为了排除个体叶酸生物利用度的差异对后续围妊娠期高血清叶酸作用研究的影响,将普通饲料喂养雌鼠的血清叶酸水平(<2 000 pg/mL)作为基线,按照血清叶酸水平对4组用配方饲料喂养的雌鼠重新分组:正常血清叶酸组(血清叶酸水平<2 000 pg/mL,n=7)、高血清叶酸组(2 000 pg/mL≤血清叶酸水平<3 000 pg/mL,n=710)、超高血清叶酸组(血清叶酸水平≥3 000 pg/mL,n=77),重新分组后雌鼠仍使用原配方饲料喂养。
6周龄雄性BALB/c小鼠用普通饲料喂养2周后,与4组用配方饲料喂养的雌鼠按1∶2合笼。合笼于当日18点开始,次日上午8点前检查阴道栓,发现阴道栓当日记为孕0.5 d(E0.5)。
1.4 不同孕龄胎鼠心脏组织标本的采集分别于孕10.5 d(E10.5)、11.5 d(E11.5)或13.5 d(E13.5),随机选择正常、超高血清叶酸组2、2、3只与高血清叶酸组3、3、4只孕鼠处死,采集胎鼠心脏样本。使用颈部脱臼法处死孕鼠后,打开腹腔,分离腹腔黏膜,在腹腔中找到“ Y ”型输卵管三端,分离并转移至盛有PBS的平皿中。使用注射器向输卵管中缓慢注射PBS,小心冲出胚胎。由于E10.5、E11.5和E13.5的胎鼠个体过小,为提高样品检测结果的准确性,将胚胎整体置于4%多聚甲醛固定液中固定。
1.5 胎鼠心脏组织样本的组织学分析固定24 h以上的胎鼠心脏组织样本修切后放于脱水盒内,于脱水机内进行梯度乙醇脱水并浸蜡(65 ℃融化石蜡浸放3次,每次1 h)。将浸好蜡的组织用包埋机进行包埋,于-20 ℃环境中冷却。蜡块凝固、稍事修整后于石蜡切片机切片(厚度为4 μm)。切片漂浮于温水(40 ℃)上铺平,用载玻片从底部捞起组织,于烘箱(60 ℃)内烤片3 h。包埋、制片等步骤委托武汉赛维尔生物科技有限公司完成。心脏组织切片经H-E染色后进行镜检。
1.6 胎鼠心脏组织样本的免疫组织化学分析对胎鼠心脏组织切片中的心肌细胞有丝分裂指标——磷酸化组蛋白H3(phosphorylated histone H3,pHH3)进行免疫组织化学分析,一抗使用pHH3抗体(货号#9701,美国CST公司,稀释比例为1∶200),二抗使用HRP标记的羊抗兔IgG(货号#7074,美国CST公司,稀释比例为1∶1 000),经DAB显色后阳性细胞呈棕黄色。用苏木精复染细胞核,苏木精返蓝液处理后细胞核为蓝色。免疫组织化学分析委托武汉赛维尔生物科技有限公司完成。使用组织切片数字扫描仪和图像系统分析并计算pHH3阳性率。
1.7 统计学处理应用SPSS27.0软件进行统计学分析。数据以x或x±s表示。以组内相关系数评价平行样本检测的一致性;用Kruskal-Wallis H检验分析多组资料的差异,用Wilcoxon秩和检验进行两两比较。检验水准(α)为0.05。
2 结果 2.1 动物模型的构建情况用于建模的雌鼠状态良好,进食、进水正常,无意外死亡。孕鼠处死后平均每只获得胚胎(6.37±1.13)枚,普通饲料、FAN及FA5、FA10、FA20配方饲料喂养的孕鼠处死后获得的胚胎数分别为(5.83±1.33)、(6.17±1.17)、(7.00±1.10)、(6.33±1.03)、(6.50±1.05)枚,差异无统计学意义(P=0.464)。
血清叶酸水平检测结果显示,30只雌鼠3个复孔测定结果的组内相关系数为0.988~0.997,平均为0.993(P均<0.001),具有高度一致性,故取平均值作为该雌鼠的血清叶酸水平值(表 1)。普通饲料喂养雌鼠的血清叶酸水平均<2 000 pg/mL;相较于FAN组[(1 690.02±682.20)pg/mL],FA5、FA10、FA20组血清叶酸水平表现出升高的趋势,分别为(2 320.61±1 017.95)、(2 613.38±782.47)、(2 840.07±1 000.54)pg/mL,但组间差异无统计学意义(P=0.163)。
|
|
表 1 不同叶酸含量配方饲料喂养2周后雌鼠的血清叶酸水平 Tab 1 Serum folate levels of female mice after 2 weeks of feeding with different folate formula feeds |
2.2 围妊娠期雌鼠血清叶酸水平升高导致后代心脏发育异常 2.2.1 E10.5
正常血清叶酸组(图 1A)和高血清叶酸组(图 1B)中,胎鼠心脏组织心外膜贴合紧密,心尖处可见已经形成和正在形成中的心肌细胞,胞质较疏松,增生活跃;可见成团的间叶结缔组织,间叶细胞丰富。超高血清叶酸组(图 1C)中,胎鼠心脏组织局部心外膜可见隆起;心肌细胞较少,增生不够活跃;心房壁可见明显变薄;未见明显间叶组织。上述结果提示,E10.5时超高血清叶酸组胎鼠心脏发育不良。
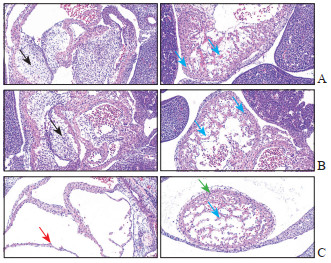
|
图 1 孕10.5 d不同血清叶酸水平组中胎鼠心脏发育情况的苏木精-伊红染色分析(20×) Fig 1 Hematoxylin-eosin staining analysis of cardiac development of fetal mice in different serum folate groups at 10.5 d of pregnancy (20×) A: Normal serum folate group; B: High serum folate group; C: Ultra-high serum folate group. The left and right columns correspond to different typical lesion sites of the same sample, respectively. Black arrows indicate mesenchymal cells, blue arrows indicate cardiomyocytes, red arrow indicates atrial wall, and green arrow indicates epicardium. |
2.2.2 E11.5
如图 2所示,正常血清叶酸组胎鼠的右心房壁厚度为(28.25±4.85)μm,左心房壁厚度为(30.28±3.44)μm,右心室壁厚度为(48.12±6.58)μm,左心室壁厚度为(55.24±5.83)μm;高血清叶酸组胎鼠的右心房壁厚度为(27.93±3.20)μm,左心房壁厚度为(31.15±3.64)μm,右心室壁厚度为(49.97±4.40)μm,左心室壁厚度为(58.91±5.33)μm;超高血清叶酸组胎鼠的右心房壁厚度为(16.66±4.05)μm,左心房壁厚度为(18.02±5.96)μm,右心室壁厚度为(29.06±7.07)μm,左心室壁厚度为(32.20±6.85)μm。超高血清叶酸组胎鼠的心房与心室壁厚度均小于正常血清叶酸组和高血清叶酸组(P均<0.001),正常血清叶酸组与高血清叶酸组胎鼠心房与心室壁厚度比较差异均无统计学意义(P均>0.05)。
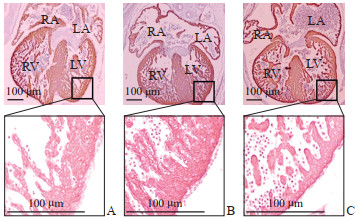
|
图 2 孕11.5 d不同血清叶酸水平组胎鼠心房、心室壁厚度的苏木精-伊红染色分析 Fig 2 Hematoxylin-eosin staining analysis of atrial and ventricular wall thickness of fetal mice in different serum folate groups at 11.5 d of pregnancy A: Normal serum folate group; B: High serum folate group; C: Ultra-high serum folate group. RA: Right atrium; LA: Left atrium; RV: Right ventricle; LV: Left ventricle. |
如图 3所示,免疫组织化学染色显示,与正常血清叶酸组[(15.40±2.48)%]和高血清叶酸组[(16.15±1.82)%]相比,超高血清叶酸组胎鼠心内膜垫pHH3阳性率降低[(9.72±2.28)%,P均<0.001]。正常血清叶酸组与高血清叶酸组pHH3阳性率比较差异无统计学意义(P=0.505)。
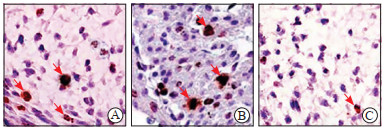
|
图 3 免疫组织化学染色检测孕11.5 d不同血清叶酸水平组胎鼠心内膜垫pHH3表达(200×) Fig 3 Expression of pHH3 in endocardial cushion of fetal mice in different serum folate groups at 11.5 d of pregnancy detected by immunohistochemical staining (200×) A: Normal serum folate group; B: High serum folate group; C: Ultra-high serum folate group. Arrows indicate pHH3 positive staining cells. pHH3: Phosphorylated histone H3. |
2.2.3 E13.5
如图 4所示,与正常血清叶酸组和高血清叶酸组相比,超高血清叶酸组胎鼠心脏有明显的背侧间充质突出缺失、右心耳和心室流出道结构异常及原发孔型房间隔缺损等房室间隔缺损表现。

|
图 4 孕13.5 d不同血清叶酸水平组胎鼠心脏发育情况的苏木精-伊红染色分析(10×) Fig 4 Hematoxylin-eosin staining analysis of heart development of fetal mice in different serum folate groups at 13.5 d of pregnancy (10×) A: Normal serum folate group; B: High serum folate group; C: Ultra-high serum folate group. RA: Right atrium; LA: Left atrium; RV: Right ventricle; LV: Left ventricle; DMP: Dorsal mesenchymal protrusion; PAS: Primary atrial septum; AVSD: Atrioventricular septal defect. |
3 讨论
本研究用不同叶酸含量饲料喂养雌鼠发现,虽然随着饲料中叶酸含量的增加雌鼠血清叶酸水平表现出升高的趋势,但是组内不同雌鼠血清叶酸水平变异较大,某些高叶酸饲料喂养的小鼠(FA20组小鼠5、FA10组小鼠3、FA5组小鼠2和6)的血清叶酸水平甚至低于普通饲料喂养雌鼠的平均血清叶酸水平,导致不同组间的差异并没有统计学意义。仅仅使用不同叶酸含量的配方饲料喂养小鼠的方法构建模型,忽视了不同个体在叶酸生物利用度上的差异,可能是不同研究[12-13, 15-16]得到矛盾结果的重要原因。本课题组在使用不同叶酸含量的配方饲料喂养的基础上,对实验小鼠进行血清叶酸水平检测,然后将普通饲料喂养小鼠的血清叶酸水平作为基线,根据小鼠的实际血清叶酸水平将实验动物重新分为3组,进一步分析母鼠血清叶酸水平与后代心脏发育的相关性,结果显示超高血清叶酸水平与后代心脏发育不良相关,证明本研究构建模型的方法是可行、有效的。本研究的模型构建方法能够排除不同个体叶酸生物利用度差异的影响,揭示围妊娠期增补叶酸导致的母鼠血清叶酸水平升高对雌鼠本身及后代发育的影响。该模型也可用于探索增补叶酸的安全上限、揭示叶酸调控生长发育的调控网络等相关研究。
体内的高叶酸水平与小鼠心室壁变薄等心脏发育异常相关[15-16, 22-23]。正常情况下,小鼠胚胎在孕9.5 d至E11.5时心肌细胞迅速发育;E10.5时心脏内部开始出现分隔;E11.5时房间隔形成,心室中心肌层发育;E13.5时房室结区出现;孕14.5 d时心肌间充质网络结构发育完成;孕15.5 d时心脏组织基本结构发育完成[24]。本研究结果显示,围妊娠期增补叶酸导致母体血清叶酸水平剧烈升高(≥3 000 pg/mL)时,后代会出现心肌细胞分裂增殖水平降低、发育延迟,心肌变薄、房室隔缺损等心脏结构异常,而母体血清叶酸水平轻度升高(2 000~<3 000 pg/mL)并不会对心脏发育造成不良影响。本研究结果提示,对于叶酸生物利用度较高的个体无差别增补叶酸可能导致个体血清叶酸水平剧烈升高,引起后代发育异常等不良妊娠结局。在后续的工作中,利用本研究构建的动物模型,通过对叶酸水平进行更加细致的分组,明确围妊娠期母体叶酸水平与妊娠高血压、妊娠糖尿病及后代发育异常等不良妊娠结局的剂量效应数据,以及围妊娠期增补叶酸的安全标准,对于指导临床增补叶酸具有非常重要的意义。
本研究构建了围妊娠期增补叶酸导致血清叶酸水平升高的小鼠模型,揭示了围妊娠期增补叶酸导致的血清叶酸水平剧烈升高与后代心脏发育异常相关,但是具体的量效关系及分子机制仍需要深入探究。本研究所设计的模型构建方法及构建的动物模型为后续进一步揭示剂量效应关系、明确叶酸参与相关调控的具体机制、制订更为科学的临床围妊娠期增补叶酸方案打下了良好的基础。
| [1] |
VAN GOOL J D, HIRCHE H, LAX H, DE SCHAEPDRIJVER L. Folic acid and primary prevention of neural tube defects: a review[J]. Reprod Toxicol, 2018, 80: 73-84. DOI:10.1016/j.reprotox.2018.05.004 |
| [2] |
FIELD M S, STOVER P J. Safety of folic acid[J]. Ann N Y Acad Sci, 2018, 1414: 59-71. DOI:10.1111/nyas.13499 |
| [3] |
SHULPEKOVA Y, NECHAEV V, KARDASHEVA S, SEDOVA A, KURBATOVA A, BUEVEROVA E, et al. The concept of folic acid in health and disease[J/OL]. Molecules, 2021, 26: 3731. DOI: 10.3390/molecules26123731.
|
| [4] |
PANNIA E, HAMMOUD R, SIMONIAN R, KUBANT R, ANDERSON G H. Folate dose and form during pregnancy may program maternal and fetal health and disease risk[J]. Nutr Rev, 2022, 80: 2178-2197. DOI:10.1093/nutrit/nuac025 |
| [5] |
JANKOVIC-KARASOULOS T, FURNESS D L, LEEMAQZ S Y, DEKKER G A, GRZESKOWIAK L E, GRIEGER J A, et al. Maternal folate, one-carbon metabolism and pregnancy outcomes[J/OL]. Matern Child Nutr, 2021, 17: e13064. DOI: 10.1111/mcn.13064.
|
| [6] |
CRIDER K S, QI Y P, YEUNG L F, MAI C T, HEAD ZAUCHE L, WANG A, et al. Folic acid and the prevention of birth defects: 30 years of opportunity and controversies[J]. Annu Rev Nutr, 2022, 42: 423-452. DOI:10.1146/annurev-nutr-043020-091647 |
| [7] |
TALAULIKAR V S, ARULKUMARAN S. Folic acid in obstetric practice: a review[J]. Obstet Gynecol Surv, 2011, 66: 240-247. DOI:10.1097/OGX.0b013e318223614c |
| [8] |
中国营养学会. 中国居民膳食指南: 2016[M]. 北京: 人民卫生出版社, 2016: 169-176.
|
| [9] |
BURDGE G C, LILLYCROP K A. Folic acid supplementation in pregnancy: are there devils in the detail?[J]. Br J Nutr, 2012, 108: 1924-1930. DOI:10.1017/S0007114512003765 |
| [10] |
CAUDILL M A. Folate bioavailability: implications for establishing dietary recommendations and optimizing status[J]. Am J Clin Nutr, 2010, 91: 1455S-1460S. DOI:10.3945/ajcn.2010.28674E |
| [11] |
MARUVADA P, STOVER P J, MASON J B, BAILEY R L, DAVIS C D, FIELD M S, et al. Knowledge gaps in understanding the metabolic and clinical effects of excess folates/folic acid: a summary, and perspectives, from an NIH workshop[J]. Am J Clin Nutr, 2020, 112: 1390-1403. DOI:10.1093/ajcn/nqaa259 |
| [12] |
苗卉, 薛赓, 孙树汉. 母体叶酸水平与子代生长发育状况相关性的研究进展[J]. 中华生殖与避孕杂志, 2017, 37: 423-428. |
| [13] |
王安妮, 丁新, 冯欣. 孕期叶酸水平对子代生长发育影响的研究进展[J]. 中国药学杂志, 2020, 55: 1138-1142. |
| [14] |
LUAN Y, COSÍ N-TOMÁ S M, LECLERC D, MALYSHEVA O V, CAUDILL M A, ROZEN R. Moderate folic acid supplementation in pregnant mice results in altered sex-specific gene expression in brain of young mice and embryos[J/OL]. Nutrients, 2022, 14: 1051. DOI: 10.3390/nu14051051.
|
| [15] |
LIAN Z L, WU Z B, GU R, WANG Y R, WU C H, CHENG Z P, et al. Evaluation of cardiovascular toxicity of folic acid and 6S-5-methyltetrahydrofolate-calcium in early embryonic development[J/OL]. Cells, 2022, 11: 3946. DOI: 10.3390/cells11243946.
|
| [16] |
HAN X H, WANG B Q, JIN D X, LIU K, WANG H J, CHEN L B, et al. Precise dose of folic acid supplementation is essential for embryonic heart development in zebrafish[J/OL]. Biology, 2021, 11: 28. DOI: 10.3390/biology11010028.
|
| [17] |
CHAN D, LY L, REBOLLEDO E M D, MARTEL J, LANDRY M, SCOTT-BOYER M P, et al. Transgenerational impact of grand-paternal lifetime exposures to both folic acid deficiency and supplementation on genome-wide DNA methylation in male germ cells[J/OL]. Andrology, 2023, 11: 927-942. DOI: 10.1111/andr.13399.
|
| [18] |
IHIRWE R G, MARTEL J, RAHIMI S, TRASLER J. Protective and sex-specific effects of moderate dose folic acid supplementation on the placenta following assisted reproduction in mice[J/OL]. FASEB J, 2023, 37: e22677. DOI: 10.1096/fj.202201428R.
|
| [19] |
OBEID R, WARNKE I, WITTKE A, BENDIK I, TROESCH B, SCHOOP R, et al. Infant blood concentrations of folate markers and catabolites are modified by 5, 10-methylenetetrahydrofolate reductase C677T genotype and dietary folate source[J]. Am J Clin Nutr, 2023, 117: 509-517. DOI:10.1016/j.ajcnut.2022.09.002 |
| [20] |
ZHONG T W, SONG X L, LIU Y P, SUN M T, ZHANG S M, CHEN L T, et al. Association of methylenetetrahydrofolate reductase gene polymorphisms and maternal folic acid use with the risk of congenital heart disease[J/OL]. Arch Endocrinol Metab, 2022, 10: 939119. DOI: 10.3389/fped.2022.939119.
|
| [21] |
REEVES P G. Components of the AIN-93 diets as improvements in the AIN-76A diet[J]. J Nutr, 1997, 127(5 Suppl): 838S-841S. |
| [22] |
LEIRGUL E, GILDESTAD T, NILSEN R M, FOMINA T, BRODWALL K, GREVE G, et al. Periconceptional folic acid supplementation and infant risk of congenital heart defects in Norway 1999-2009[J]. Paediatr Perinat Epidemiol, 2015, 29: 391-400. DOI:10.1111/ppe.12212 |
| [23] |
CHENG Z P, GU R, LIAN Z L, GU H F. Evaluation of the association between maternal folic acid supplementation and the risk of congenital heart disease: a systematic review and meta-analysis[J/OL]. Nutr J, 2022, 21: 20. DOI: 10.1186/s12937-022-00772-2.
|
| [24] |
唐娟, 刘艳, 杨光, 王文冬, 尹海林. 小鼠心脏发育的形态学研究[J]. 四川动物, 2009, 28: 403-406, 封2. |
 2023, Vol. 44
2023, Vol. 44


