2. 海军军医大学(第二军医大学)基础医学院, 上海 200433
2. College of Basic Medical Sciences, Naval Medical University(Second Military Medical University), Shanghai 200433, China
战创伤出血是战伤死亡的主要原因之一。与平时创伤相比,由于战场救治条件简陋,战创伤创面出血一般以止血敷料为主。止血敷料如沸石敷料止血时会有产热反应,易灼伤组织、引发炎症[1];而明胶海绵敷料具有体内吸收慢、黏附性差、易脱落等缺点,且易引起过敏反应、增加伤口感染率[2]。现有大部分敷料功能单一,并不适合在复杂战场环境下使用。理想的战创伤敷料除应该具有良好的创面保护及控制出血、防治感染、促进创面愈合等性能外,还应具有较好的组织相容性,且可自体吸收、无需更换,以防止伤口发生二次损伤[3]。
白及多糖(Bletilla striata polysaccharide)是临床常用止血中药白及的主要药效成分,具有促进凝血、抑菌、抗氧化、促创面修复等多种药理作用,但由于力学性能和成膜性能较差,一定程度上限制了其在止血敷料方面的应用[4-5]。羧甲基壳聚糖(carboxymethyl chitosan,CMC)是壳聚糖衍生物,无毒无害,具有良好的抗菌性、生物降解性、生物相容性和止血作用,广泛应用于各类止血敷料的研发,但其伤口修复能力较为不足[6-7]。本研究将上述2种多糖充分混合进行交联反应,成膜性和黏附性良好,无须添加其他支架材料及黏附成分即可成膜;在此基础上添加具有广谱抗菌作用的黄连素,采用真空冷冻干燥法制备了黄连素-白及多糖-羧甲基壳聚糖复合敷料(berberine-Bletilla striata polysaccharide-carboxymethyl chitosan composite dressing,BBCCD),该敷料不仅能有效止血,还兼具抗菌及促愈合功能,适合在战场及野外等环境中使用,可为新型多功能复合敷料的开发提供参考。
1 材料和方法 1.1 仪器与试剂分析天平(美国OHAUS公司);超纯水机(型号PALL Cascada Ⅰ,美国PALL公司);真空冷冻干燥机(型号YTLG-10A,上海叶拓科技有限公司);酶标仪(美国ThermoFisher公司);显微镜(德国Leica公司);扫描电子显微镜(英国Oxford公司);紫外分光光度计(型号UH5300,日本日立仪器有限公司)。医用纱布[海氏海诺倍适威医疗用品(青岛)有限公司];黄连素(大连美仑生物技术有限公司);白及多糖(上海融禾医药科技发展有限公司);CMC(上海麦克林生化科技股份有限公司);吸收性医用明胶海绵(江西祥恩医疗科技发展有限公司);壳聚糖敷料(湖北保泰生物科技有限公司);L929小鼠成纤维细胞(上海雷根生物科技有限公司);日本同仁化学CCK-8试剂盒(上海复申生物科技有限公司);大鼠IL-1β(货号ml003057)、TNF-α(货号ml002859)和IL-10(货号ml002813)ELISA检测试剂盒(上海酶联生物科技有限公司);大肠埃希菌(ATCC25922)和金黄色葡萄球菌(ATCC25923)(上海雷根生物科技有限公司);其他试剂均为国产分析纯。
1.2 实验动物与分组SD大鼠,126只,雌雄各半,6~7周,体重(180±10)g,购自斯贝福(北京)生物技术有限公司,动物生产许可证号为SCXK(京)2019-0010。新西兰兔,3只,雄性,8~9个月,体重(2.8±0.2)kg,购自上海甲干生物科技有限公司,动物生产许可证号为SCXK(沪)2020-0006。选取72只大鼠随机分为医用纱布组、明胶海绵组和BBCCD组,每组24只,用于股静脉、肝脏及断尾止血实验。将剩余54只大鼠随机分为空白组、壳聚糖敷料组和BBCCD组,每组18只,用于皮肤创面修复实验。新西兰兔多次采集血液样本,分为医用纱布组、明胶海绵组和BBCCD组,每组6个血液样本,用于体外凝血实验。
1.3 敷料成分比例的筛选与制备配制5 mg/mL黄连素储备液。在保持混合物总量不变及黄连素的终浓度为2.5 mg/mL的基础上,将5%白及多糖溶液和5% CMC溶液以不同的比例(体积比分别为5∶1、3∶1、1∶1、1∶3、1∶5)混合,置于55 ℃水浴中充分交联30 min,搅拌至无气泡。将交联后的混合胶液倒于24孔板,每孔加液0.6 mL,冷却至室温;将24孔板预冷冻,然后真空冷冻干燥,获得不同处方配比的BBCCD。将以上样品分别取5个批次的BBCCD材料,进行孔隙率、吸水率、透气率测定,并计算平均值,筛选其最佳比例[8]。
1.4 微观结构观察分析在扫描电子显微镜下对BBCCD的结构进行观察。
1.5 敷料中黄连素含量的测定采用紫外分光光度法[9]测定黄连素含量。方法学考察参照2020年版《中华人民共和国药典》[10]规定,对线性、精密度、重复性、稳定性及加样回收率进行考察,最终测定敷料中黄连素含量。
1.6 体外抑菌实验采用抑菌圈法[11-12]观察BBCCD对大肠埃希菌、金黄色葡萄球菌的抑菌效果。将上述菌种活化、纯化后,取150 μL菌悬液接种到固体溶菌肉汤培养基中。用无菌镊子分别夹取经裁剪并灭菌后直径为6 mm的BBCCD,均匀贴在含菌平板中。盖上平板盖后将其放入生化培养箱内37 ℃培养24 h,实验重复3次,观察是否有抑菌环生成。
1.7 细胞毒性实验称取适量灭菌后的BBCCD样品,置于DMEM完全培养基中制备成10 mg/mL的BBCCD提取液,浸泡24 h使其完全溶解,再用DMEM完全培养基梯度稀释为不同质量浓度(0.1、1、10、100、1 000 μg/mL)的BBCCD提取液。将培育好的L929小鼠成纤维细胞接种于96孔板,每孔约7 000个细胞,总体积100 μL,每个样本设置4个复孔。随后向96孔板中分别加入不同质量浓度的BBCCD提取液,孵育24 h后,按照试剂盒说明书于每孔细胞加入10 μL CCK-8试剂,在避光条件下孵育30 min,用酶标仪测定450 nm波长处的光密度(D)值[8, 11]。
1.8 体外凝血实验将医用纱布、明胶海绵、BBCCD均剪裁成0.3 cm×0.3 cm大小,各取10 mg分别置于离心管中,其中空白对照组不加任何样品。将上述离心管于37 ℃预热5 min,每管加入新鲜抗凝兔血0.45 mL,随后再快速加入50 μL的0.2 mol/L氯化钙溶液,再次于37 ℃预热5 min,随后分别加入40 mL双蒸水,37 ℃恒温振摇20 min。采用酶标仪测定各样品的上清液在540 nm波长处的D值(D样品),不加样品的空白对照组其D值为D对照。通过公式计算凝血指数:凝血指数(%)=D样品/D对照×100%。一般认为,凝血指数越小说明该敷料的止血效果越好[8, 11]。
1.9 大鼠股静脉止血实验医用纱布组、明胶海绵组和BBCCD组各取8只大鼠,先将各组敷料进行称重,然后将大鼠麻醉后,予大腿部脱毛消毒处理。用手术刀切开皮肤暴露股静脉,快速划穿股静脉及附近组织,深度为0.5 cm,让其自由流血2 s后分别用不同敷料覆盖伤口,同时在敷料上放置10 g砝码进行按压,并开始记录时间。待50 s时轻轻取下敷料,观察伤口情况,如有继续出血则重复覆盖敷料并按压,随后每隔约15 s观察1次,重复以上操作直至伤口无活动性出血,记录不同敷料的止血时间[13]。
1.10 大鼠肝脏止血实验医用纱布组、明胶海绵组和BBCCD组各取8只大鼠,将大鼠麻醉后固定在手术台上,予腹部脱毛消毒处理。用手术剪在大鼠腹部剑突下剪开长约3 cm的开口,暴露肝脏。取医用纱布垫于肝脏下方,然后用手术刀在肝脏表面做长度为1 cm、深度为0.5 cm的切口,让其自由流血2 s后立即取不同的敷料进行贴敷止血[14]。止血时间的测量方法同1.9节。
1.11 大鼠断尾止血实验医用纱布组、明胶海绵组和BBCCD组各取8只大鼠,将大鼠麻醉后,在距其尾部约2 cm处用手术刀片切断鼠尾,建立大鼠断尾出血模型,立即给予各止血材料并施加固定压力[14],止血时间的测量方法同1.9节。
1.12 大鼠背部皮肤创面修复实验空白组、壳聚糖敷料组和BBCCD组每组18只大鼠均予以麻醉,然后予背部脱毛消毒处理。用1 cm的皮肤打孔器在大鼠的背部制作4个圆形全皮层切除创面,创面位置以脊柱为对称,左右各2个,分别靠近肩脚骨和尾脚骨,每个创面损伤至肌筋膜深层。用生理盐水冲洗创面后,壳聚糖敷料组和BBCCD组大鼠分别贴敷相应敷料,空白组不予任何处理。每只大鼠单笼饲养,每天更换1次敷料,每组随机选取6个创面,在第1、3、5、7、14天用相机拍摄创面,使用ImageJ Pro软件测量创面面积,并按公式计算愈合率:愈合率(%)=(S1-Sn)/S1×100%,其中S1为手术结束后当天即第1天测量的创面面积,Sn为手术结束后第n天所测量的创面面积。每组分别于创伤后第1、7、14天各处死4只大鼠,取血清,按照ELISA检测试剂盒说明书方法测定各组大鼠血清IL-1β、TNF-α和IL-10水平。每组分别在创伤后第3、7、14、21天各处死1只大鼠,对创面及周围的皮肤和组织进行切片制作及常规H-E染色,观察创面病理学变化,评价敷料的促愈合作用[11-12]。
1.13 统计学处理运用GraphPad Prism 6.0软件进行统计学分析。计量资料以x±s表示,多组间比较采用单因素方差分析,两样本的比较采用独立样本t检验。检验水准(α)为0.05。
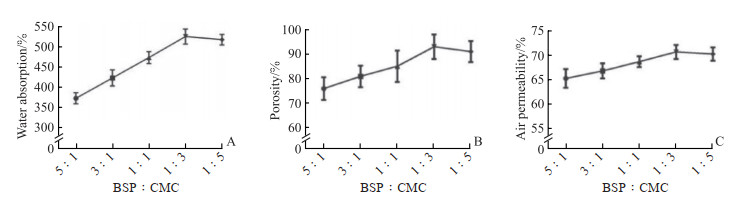
2 结果 2.1 BBCCD的制备及最佳处方配比筛选BBCCD的吸水率随着CMC的比例增加逐渐上升,在5%白及多糖溶液与5% CMC溶液的配比为1∶3时BBCCD的吸水率达到最高,为(524.78±18.46)%(图 1A)。BBCCD的孔隙率随着CMC的比例增加先升高后降低,当白及多糖与CMC的配比为1∶3时孔隙率最高,为(92.91±4.93)%(图 1B)。各处方配比的BBCCD平均透气率均超过65%,其变化趋势与孔隙率相似(图 1C)。综合评价认为,BBCCD中5%白及多糖溶液与5% CMC溶液的最佳配比为1∶3。
|
图 1 不同配比的BBCCD吸水率(A)、孔隙率(B)和透气率(C) Fig 1 Water absorption (A), porosity (B) and air permeability (C) of different BBCCD n=5, x±s. BBCCD: Berberine-Bletilla striata polysaccharide-carboxymethyl chitosan composite dressing; BSP: Bletilla striata polysaccharide; CMC: Carboxymethyl chitosan. |
2.2 BBCCD中黄连素含量分析
方法学考察结果显示,检测浓度线性范围为12.92~64.6 μg/mL(R2=0.999 7),精密度、稳定性、重复性实验的RSD分别为1.3%、1.4%、2.4%,加样回收率为102.61%(RSD为2.77%),表明该方法可靠、稳定。制备的BBCCD中黄连素的含量平均值为(52.39±0.87)mg/g。
2.3 BBCCD的外观及微观结构观察分析按照上述最佳处方配比制备BBCCD,得到高度约为5 mm、直径约15 mm的圆柱形海绵状敷料(图 2)。其外观色泽淡黄,整体均匀、光滑、平整且无裂缝,弹性和柔韧性良好。

|
图 2 BBCCD成品外观 Fig 2 View of BBCCD A: An overhead view of BBCCD; B: A flat view of BBCCD. BBCCD: Berberine-Bletilla striata polysaccharide-carboxymethyl chitosan composite dressing. |
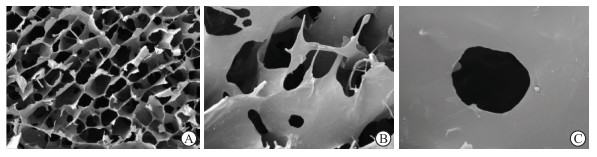
在扫描电子显微镜下,BBCCD材料呈蜂窝多孔洞网络状,并且结构清晰、排列规则、空隙分布致密均匀,单个孔径大小为100~150 μm,同时孔壁光滑均匀,没有出现相分离现象(图 3),说明3种原料之间相容性良好。
|
图 3 扫描电子显微镜观察BBCCD微观结构 Fig 3 Microstructure of BBCCD analyzed by scanning electron microscope A: 200×; B: 1 000×; C: 5 000×. BBCCD: Berberine-Bletilla striata polysaccharide-carboxymethyl chitosan composite dressing. |
2.4 BBCCD的体外抑菌效果分析
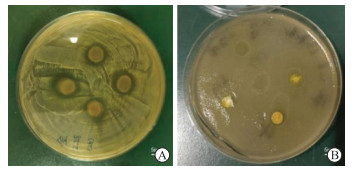
BBCCD在金黄色葡萄球菌和大肠埃希菌的培养皿中逐渐分解吸收,出现抑菌环,直径均>7 mm(图 4),说明BBCCD具有较好的抑菌作用。
|
图 4 BBCCD的抑菌效果 Fig 4 Bacteriostatic effect of BBCCD A: Bacteriostatic effect on Staphylococcus aureus; B: Bacteriostatic effect on Escherichia coli. BBCCD: Berberine-Bletilla striata polysaccharide-carboxymethyl chitosan composite dressing. |
2.5 BBCCD的细胞毒性分析
加入不同质量浓度(0.1、1、10、100、1 000 μg/mL)的BBCCD提取液孵育24 h后,L929小鼠成纤维细胞的细胞活力值分别为(114.25±3.09)%、(102.74±6.20)%、(101.52±2.79)%、(95.61±4.14)%、(88.67±1.66)%,均高于85%,且各组之间差异无统计学意义(P>0.05),表明BBCCD无明显细胞毒性。
2.6 BBCCD的体外凝血效果分析医用纱布组、明胶海绵组及BBCCD组的凝血指数分别为(89.67±4.21)%、(57.83±4.60)%、(39.46±9.31)%。BBCCD组的凝血指数低于医用纱布组和明胶海绵组(P均<0.01),表明BBCCD的体外凝血效果优于医用纱布和明胶海绵。
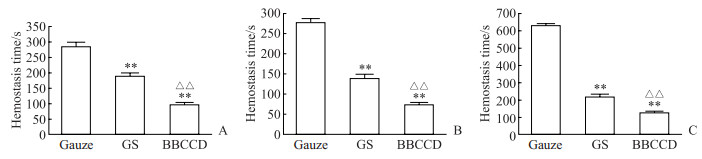
2.7 BBCCD的止血时间分析在大鼠股静脉止血实验、肝脏止血实验、断尾止血实验中,BBCCD组的止血时间均短于医用纱布组及明胶海绵组,差异均有统计学意义(P均<0.01,图 5)。
|
图 5 不同敷料对大鼠股静脉(A)、肝脏(B)、断尾(C)创伤的止血效果 Fig 5 Hemostatic effect of different dressings on wounds of femoral vein (A), liver (B) and tail amputation (C) in rats **P < 0.01 vs gauze group; △△P < 0.01 vs GS group. n=8, x±s. GS: Gelatin sponge; BBCCD: Berberine-Bletilla striata polysaccharide-carboxymethyl chitosan composite dressing. |
2.8 BBCCD的促愈合效果分析
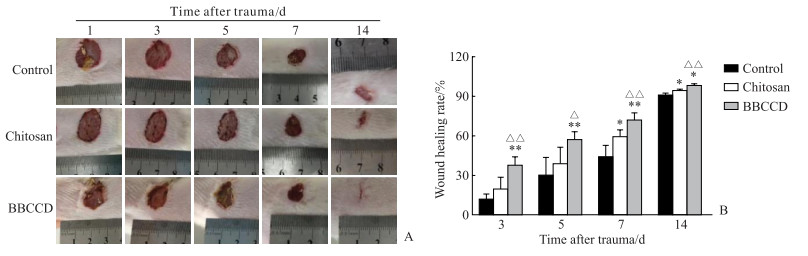
大鼠背部皮肤创面修复实验中,在皮肤创面修复的第3、5天时,壳聚糖敷料组的伤口愈合率与空白组相比差异无统计学意义(P>0.05),而BBCCD组的伤口愈合率均高于同时期空白组和壳聚糖敷料组(P均<0.05),说明BBCCD在创面修复前期具有很好的促愈合作用。在皮肤创面修复的第7、14天时,壳聚糖敷料组的伤口愈合率均高于空白组(P均<0.05),BBCCD组的伤口愈合率均高于壳聚糖敷料和空白组(P均<0.05),同时BBCCD组的创面愈合平整、瘢痕较小。见图 6。
|
图 6 各组大鼠皮肤创面的愈合情况(A)和不同时间点伤口愈合率分析(B) Fig 6 Healing status (A) and wound healing rates (B) at different time points of rats in each group *P < 0.05, **P < 0.01 vs control group; △P < 0.05, △△P < 0.01 vs chitosan group. n=6, x±s. BBCCD: Berberine-Bletilla striata polysaccharide-carboxymethyl chitosan composite dressing. |
2.9 BBCCD抑制创面炎症因子释放
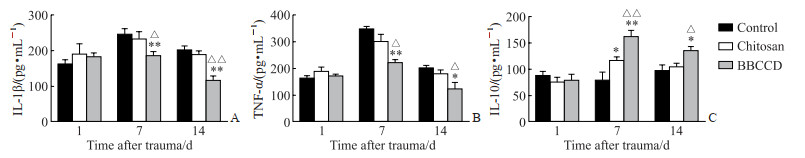
皮肤创伤后的第1天,各组大鼠的血清IL-1β、TNF-α和IL-10水平差异无统计学意义(P>0.05)。在皮肤创伤后第7、14天,与空白组和壳聚糖敷料组相比,BBCCD组大鼠的血清IL-1β、TNF-α水平均降低(P<0.05),IL-10水平均增高(P均<0.05)。见图 7。结果表明BBCCD能更有效地抑制促炎因子的释放,控制创面的炎症反应。
|
图 7 ELISA测定各组大鼠血清IL-1β(A)、TNF-α(B)、IL-10(C)含量 Fig 7 Levels of IL-1β (A), TNF-α (B) and IL-10 (C) in sera of rats in each group determined by ELISA *P < 0.05, **P < 0.01 vs control group; △P < 0.05, △△P < 0.01 vs chitosan group. n=4, x±s. ELISA: Enzyme-linked immunosorbent assay; IL: Interleukin; TNF-α: Tumor necrosis factor α; BBCCD: Berberine-Bletilla striata polysaccharide-carboxymethyl chitosan composite dressing. |
2.10 BBCCD促愈合的组织病理学分析
在皮肤创面修复的第3天,空白组、壳聚糖敷料组和BBCCD组的创面组织均有较多炎症细胞浸润。在第7天时,各组均可见新增生的成纤维细胞,但空白组仍有较多的中性粒细胞等炎症细胞浸润,炎症细胞浸润程度以BBCCD组、壳聚糖敷料组、空白组的顺序依次升高,此外BBCCD组的成纤维细胞排列较为紧密,与新生毛细血管和胶原形成肉芽组织,创面先开始结痂,并完整覆盖创面。在第14天时,各组创面均有新生的表皮层,BBCCD组只有轻微的炎症细胞浸润,还具有丰富的胶原纤维及新形成的毛囊,并且瘢痕最少,伤口愈合最好;壳聚糖敷料组和空白组仍可见明显的炎症细胞浸润,说明炎症虽局限但未完全消失,其中壳聚糖敷料组的上皮修复程度好于空白组,且新生表皮更为致密,而空白组的真皮层未完全愈合。在第21天时,相较于其他两组,BBCCD组所形成的肉芽组织和毛囊结构基本完整,已基本愈合。结果表明BBCCD可通过减轻伤口的炎症反应、加速创面表皮重建等途径促进伤口愈合。见图 8。

|
图 8 各组大鼠皮肤创伤后不同时间点创面组织的H-E染色图像(200×) Fig 8 H-E staining images of wound tissue of rats in each group at different time points after skin trauma (200×) H-E: Hematoxylin-eosin; BBCCD: Berberine-Bletilla striata polysaccharide-carboxymethyl chitosan composite dressing. |
3 讨论
随着新材料的发现和新技术的进步,理想敷料向多能化、复合化方向发展。具有止血、抗感染、促愈合、吸收渗液、缓解疼痛、保湿性、透气性、组织相容性、价格低廉等特征的新型多功能敷料是目前研究的趋势。
中医药用于战创伤的治疗有着悠久的历史和丰富的经验,但传统给药剂型通常是膏散外敷或煎汤外洗,使用不便,也根本不能满足现代战争环境下的使用。有收敛止血、消肿生肌功效的中药白及在临床上被广泛用于内外出血和创面修复,具有极强的黏附性,可直接黏附创面使用。白及多糖是白及发挥止血、促创面修复作用的主要活性成分[15],还具有良好的生物相容性、天然黏附性及吸湿透气的物理性质。本研究选用白及多糖与水溶性的CMC、广谱抗菌的黄连素构建了具有止血、抗感染、促进创面修复等多重功效,兼有生物相容性好、无需胶带固定、无需更换等特点的BBCCD。
本实验所研制的BBCCD具有良好的吸水性、高孔隙率等特性,能够快速充分地吸收血液,从而降低体外凝血指数,为其发挥快速、高效的止血作用奠定了基础。药效学结果证实,BBCCD的体外凝血、在体止血效果均优于医用纱布和明胶海绵;促创面愈合作用优于壳聚糖敷料,且创面愈合更加平整,瘢痕更少。组织病理学结果显示,BBCCD能减轻创面炎症反应、加速表皮重建,其机制可能与下调促炎因子IL-1β、TNF-α的表达及上调抗炎因子IL-10的表达有关。本研究结果还证实,含有黄连素的BBCCD对大肠埃希菌和金黄色葡萄球菌具有较好抑菌作用。
本实验所研制的BBCCD还具有良好的细胞相容性。其不仅可以自体吸收降解,而且湿润后黏性自动变强,对渗出液较多的创面可以直接贴敷,一方面可以吸收多余的渗液或渗血,另一方面吸收渗液或渗血后黏附性增强,不易脱落,有利于黏附封闭伤口,无须借助其他化学黏附材料及医用绷带固定,降低了发生过敏反应的可能性及因更换敷料带来的创面二次伤害。另外,制备BBCCD所用原料价廉易得,制备工艺简单,适合批量生产。
本研究制备的BBCCD不仅能满足战创伤止血修复保护创面的需求,亦可用于常见的烧伤、烫伤、切割伤、皮肤溃疡等的治疗及术后创面修复,在多功能新型敷料开发和应用上具有广阔的前景,有望成为一种理想的战场等复杂环境下使用的急救创面敷料。
| [1] |
CHEN H, SHANG X Q, YU L S, XIAO L P, FAN J. Safety evaluation of a low-heat producing zeolite granular hemostatic dressing in a rabbit femoral artery hemorrhage model[J]. J Biomater Appl, 2020, 34: 988-997. DOI:10.1177/0885328219888626 |
| [2] |
WEI W, LIU J, PENG Z B, LIANG M, WANG Y S, WANG X Q. Gellable silk fibroin-polyethylene sponge for hemostasis[J]. Artif Cells Nanomed Biotechnol, 2020, 48: 28-36. DOI:10.1080/21691401.2019.1699805 |
| [3] |
ZHANG K X, BAI X F, YUAN Z P, CAO X T, JIAO X Y, LI Y S, et al. Layered nanofiber sponge with an improved capacity for promoting blood coagulation and wound healing[J]. Biomaterials, 2019, 204: 70-79. DOI:10.1016/j.biomaterials.2019.03.008 |
| [4] |
GOU K, LI Y, QU Y, LI H, ZENG R. Advances and prospects of Bletilla striata polysaccharide as promising multifunctional biomedical materials[J/OL]. Mater Design, 2022, 223: 111198. DOI: 10.1016/j.matdes.2022.111198.
|
| [5] |
王坤堂. 白及多糖基水凝胶的制备、性能研究及在创面修复中的应用[D]. 天津: 天津中医药大学, 2022.
|
| [6] |
张莉弘, 窦信, 邱鹏, 刘通, 勾东霞, 赵珺. 载刺五加/桂皮紫萁海藻酸钠/羧甲基壳聚糖水凝胶伤口敷料的制备及其性能研究[J]. 化学试剂, 2022, 44: 1577-1584. |
| [7] |
LIN P J, LIU L L, HE G H, ZHANG T, YANG M, CAI J Z, et al. Preparation and properties of carboxymethyl chitosan/oxidized hydroxyethyl cellulose hydrogel[J]. Int J Biol Macromol, 2020, 162: 1692-1698. DOI:10.1016/j.ijbiomac.2020.07.282 |
| [8] |
WANG C, LUO W F, LI P W, LI S D, YANG Z M, HU Z, et al. Preparation and evaluation of chitosan/alginate porous microspheres/Bletilla striata polysaccharide composite hemostatic sponges[J]. Carbohydr Polym, 2017, 174: 432-442. DOI:10.1016/j.carbpol.2017.06.112 |
| [9] |
钱茂升. 从黄连下脚料中"酶解-超声"联合提取黄连素研究[D]. 洛阳: 河南科技大学, 2022.
|
| [10] |
中华人民共和国国家药典委员会. 中华人民共和国药典: 2020年版[M]. 3部. 北京: 中国医药科技出版社, 2020: 682-684.
|
| [11] |
ZHAO H Q, XU Y G, WANG S S, LI P, WANG T, ZHANG F, et al. "Jianbing" styling multifunctional electrospinning composite membranes for wound healing[J/OL]. Front Bioeng Biotechnol, 2022, 10: 943695. DOI: 10.3389/fbioe.2022.943695.
|
| [12] |
DENG L W, LU H D, TU C X, ZHOU T, CAO W B, GAO C Y. A tough synthetic hydrogel with excellent post-loading of drugs for promoting the healing of infected wounds in vivo[J/OL]. Biomater Adv, 2022, 134: 112577. DOI: 10.1016/j.msec.2021.112577.
|
| [13] |
LENG F, CHEN F X, JIANG X L. Modified porous carboxymethyl chitin microspheres by an organic solvent-free process for rapid hemostasis[J/OL]. Carbohydr Polym, 2021, 270: 118348. DOI: 10.1016/j.carbpol.2021.118348.
|
| [14] |
ZHAO X, GUO B L, WU H, LIANG Y P, MA P X. Injectable antibacterial conductive nanocomposite cryogels with rapid shape recovery for noncompressible hemorrhage and wound healing[J/OL]. Nat Commun, 2018, 9: 2784. DOI: 10.1038/s41467-018-04998-9.
|
| [15] |
MA X X, TANG K H, TANG Z H, DONG A W, MENG Y J, WANG P. Organ-specific, integrated omics data-based study on the metabolic pathways of the medicinal plant Bletilla striata (Orchidaceae)[J/OL]. BMC Plant Biol, 2021, 21: 504. DOI: 10.1186/s12870-021-03288-9.
|
 2023, Vol. 44
2023, Vol. 44


