肝上皮样血管内皮瘤(epithelioid hemangio-endothelioma,EHE)是一种较为罕见的与血管内皮细胞增殖相关的低度恶性病变,生物学特征介于血管瘤与血管肉瘤之间,以多发病灶较为常见,仅15%的肝EHE表现为肝内单发病灶[1-2]。其具有侵袭性,临床表现缺乏特异性,不易早期诊断[3]。本研究回顾性分析了11例肝EHE患者的临床资料和CT、MRI表现,旨在提高对肝EHE的诊断准确性,减少误诊。
1 资料和方法 1.1 病例资料收集我院2015年2月至2021年12月经手术或穿刺病理证实为肝EHE的11例患者的临床及影像学资料。男5例、女6例,年龄为25~63岁,平均年龄为(47.27±11.24)岁。临床表现包括健康体检发现肝脏占位9例,无不适主诉;上腹部不适2例。2例患者有慢性乙型肝炎病史,1例合并肝硬化。1例患者的糖类抗原(carbohydrate antigen,CA)19-9为45.3 U/mL,1例CA125为156.0 U/mL,其余9例患者的肿瘤标志物无异常升高。11例患者术前均于我院行CT或MRI平扫+增强检查。
1.2 影像学检查CT检查采用美国GE公司Discovery CT 750 HD CT扫描仪,扫描参数:电压为120 kV,电流为250~280 mA,矩阵为512×512,扫描层厚为5 mm,层间距为5 mm。经肘静脉注入碘海醇(剂量为1.5 mL/kg,注射速率为2.5~3.5 mL/s)后进行动脉期(23~26 s)、门静脉期(50~60 s)、延迟期(120~160 s)增强扫描。
MRI检查采用美国GE公司Optima MR360 1.5 T磁共振扫描仪,平扫采用水平面T1加权成像(T1 weighted imaging,T1WI)双回波序列、T2加权成像(T2 weighted imaging,T2WI)快速恢复快速自旋回波序列加脂肪抑制序列、冠状面T2WI及水平面弥散加权成像(diffusion weighted imaging,DWI),增强扫描采用快速扰相梯度回波屏气加脂肪抑制序列。扫描参数:层厚为6 mm,层间隔为2 mm。经肘静脉注入造影剂钆喷酸葡胺,剂量为0.1 mmol/kg,注射速率为2.0~3.0 mL/s,随即等速率注入等量的生理盐水,分别于动脉期(25 s)、门静脉期(55~65 s)、延迟期(120~160 s)进行三期增强扫描。
1.3 图像分析由2名以上未知病理诊断结果的阅片经验丰富的医学影像科主治医师阅片,对病灶的影像学特征进行分析,观察病灶的位置、数目、大小、形态、信号或密度、病灶强化特点与血管的关系等。
1.4 组织病理学诊断11例患者均行手术切除或穿刺活检。将手术切除标本或穿刺活检标本制成病理切片,行H-E染色和免疫组织化学染色。由1名经验丰富的病理科医师审阅,记录大体所见及镜下病理结果。
2 结果 2.1 病灶数目、位置、形态和大小11例肝EHE患者中仅1例表现为肝内单发病灶,其余均为多发病灶,共计78个病灶,其中58个(74.36%)病灶位于肝右叶,19个(24.36%)位于肝左叶,1个(1.28%)位于尾状叶。病灶呈类圆形或块状,9例肝内病灶边界清晰,2例病灶边界欠清晰,病灶最小为1.2 cm×0.9 cm,最大为7.3 cm×5.1 cm。
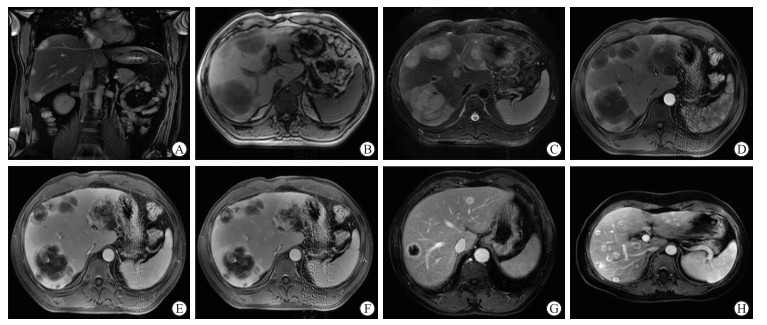
2.2 影像学表现11例患者均行MRI检查,2例患者行CT检查。肝EHE单发结节型1例,病灶位于尾状叶,呈类圆形,大小约1.2 cm×0.9 cm;多发结节型10例(77个结节),52.56%(41/78)的病灶位于肝包膜下(图 1A)。
|
图 1 肝EHE患者的MRI表现 A:患者女,46岁.冠状面MRI检查见肝包膜下多发病灶.B-F:患者男,48岁. MRI平扫示病灶T1WI呈低信号,中心呈更低信号(B);T2WI呈高信号,中心呈更高信号,即晕征,边界清楚(C). MRI增强检查动脉期病灶边缘轻度强化(D);延迟期病灶呈环形渐进性强化(E),血管止于病灶边缘(F).G:患者男,56岁. MRI增强检查动脉晚期肝右叶病灶内见血管穿行,即瘤内血管征.H:患者女,45岁. MRI增强检查门静脉期见棒棒糖征.EHE:上皮样血管内皮瘤;MRI:磁共振成像;T1WI:T1加权成像;T2WI:T2加权成像. |
CT平扫示肝内病灶为低密度,密度不均匀,多数病灶中心见更低密度影,CT值为30~50 HU,其中1例患者肝内结节可见点状钙化。CT增强检查动脉期病灶呈环形强化,CT值为40~65 HU,门静脉期及延迟期呈持续强化,逐渐向中央区域强化,CT值为75~90 HU。
MRI平扫检查示病灶在T1WI表现为稍低信号,T2WI表现为稍高信号,DWI呈高信号。MRI增强检查示9例呈环形持续强化,延迟期呈向心性强化;2例呈云絮状渐进性强化。于MRI图像上,7例见肝包膜皱缩征,5例出现多发结节互相融合,9例患者T2WI出现晕征(图 1B~1F),2例T2WI呈不均匀稍高信号,6例病灶内可见血管穿行(图 1G),7例增强检查门静脉期出现棒棒糖征(图 1H)。
2.3 术前影像学诊断结果11例肝EHE患者中,术前误诊7例,其中4例误诊为肝转移瘤,1例误诊为肝内胆管细胞癌,1例误诊为血管瘤,1例误诊为良性病灶。
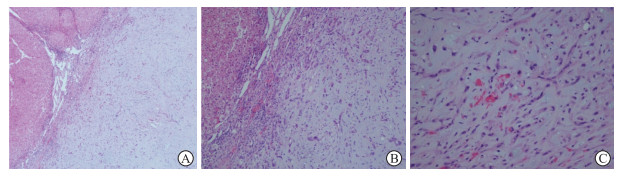
2.4 组织病理学表现H-E染色(图 2)示肿瘤组织内见大片胶原结缔组织,并可见散在分布的含小管腔的印戒样细胞,腔内可见红细胞,核偏位,部分区域肿瘤细胞呈条索状伴丰富的黏液性基质,肿瘤组织内见少量残留肝细胞索和小胆管,周边无明显包膜,可伴邻近肝窦侵犯。免疫组织化学染色示血管内皮标志物有特异性染色,尤其是CD34、CD31及F8多呈阳性染色。
|
图 2 肝EHE组织苏木精-伊红染色结果 A:肝脏肿瘤组织内见大片胶原结缔组织(100×);B:肝脏肿瘤组织内细胞稀少,可见散在分布的印戒样细胞(200×);C:肿瘤细胞异型性明显,部分细胞质内见空泡征,个别空泡内见红细胞(400×).EHE:上皮样血管内皮瘤. |
3 讨论
肝EHE是一种较为罕见的血管源性肿瘤,临床治疗首选手术切除[3]。单发病灶患者的预后较好,而多发病灶患者术后易复发,肝移植是其最优选择[4]。肝EHE多见于中年女性,临床表现缺乏特异性,发病机制尚不明确,可能与口服避孕药、酒精性肝炎、病毒性肝炎及接触聚氯乙烯、石棉等化学物质有关[5]。肝EHE患者多由健康体检时偶然发现,部分患者可出现腹痛、腹水、肿瘤标志物(CA19-9、CA125或癌胚抗原)轻度升高[6]。本组病例中,1例患者CA19-9轻度升高,1例患者CA125明显升高。该CA125明显升高患者腹腔镜探查见肝缘韧带、镰状韧带、上腹壁、侧腹壁及大网膜多发粟粒样大小不等结节,术后证实(腹腔转移灶)EHE;其余9例患者的肿瘤标志物无异常升高。
肝EHE早期影像学多表现为肝内单发或多发的结节灶,随着疾病的进展,肝内的多发结节可融合成团片状[7-8],影像学表现与肿瘤细胞及纤维间质的分布、血管的成熟度有关。结节以包膜下分布为主;CT平扫表现为低密度结节,多数结节的中心可见更低密度影,呈晕征,本组病例中9例出现晕征;部分结节内可见钙化,本组2例行CT检查的患者中即有1例患者肝内结节可见点状钙化。MRI T1WI上结节呈稍低信号,T2WI上呈稍高信号,病灶中央区T1WI为更低信号、T2WI为更高信号,增强后肿瘤组织明显强化。如病灶中央区多囊变或坏死、间质黏液变,则表现为中央无强化;如病灶中央区域以纤维间质为主,则表现为中央区渐进且持续强化。本组患者增强后病灶为环形持续强化或云絮状渐进性强化。病灶结节中央区域缺血、坏死且受周围纤维瘢痕的牵拉则会形成包膜皱缩征,本组中有7例患者出现此征,该征象的出现可与肝转移性肿瘤包膜局限性膨出鉴别。本组6例患者增强MRI检查示肝内结节可见细小血管分支穿行(瘤内血管征),7例出现棒棒糖征,即肝静脉、门静脉的分支逐渐变细,最后止于病灶边缘所形成。肝EHE病灶内血管走行自然,与恶性肿瘤的血管突然截断和僵直不同[9],增强后病灶内血管的特点对诊断肝EHE有重要的提示意义。
肝EHE因其临床症状及影像学表现不典型,故不易诊断[10],需与其他肝脏原发性肿瘤(如肝细胞癌、肝内胆管细胞癌、肝血管瘤)及肝转移瘤等鉴别。肝细胞癌患者多有乙型肝炎和/或肝硬化病史,增强检查见肿瘤呈“快进快出”的强化特点。肝内胆管细胞癌常伴远端肝内胆管扩张、肝门部淋巴结肿大等特点。肝转移瘤的影像学表现多样,主要与原发肿瘤的组织学特点有关,增强后可有环形强化或非特异性强化,很少侵犯肝内血管,若无明确的原发性肿瘤病史,较难与肝EHE鉴别。肝血管瘤的典型特征为T2WI亮灯征,增强检查多表现为“快进慢出”的强化特点,病灶中央通常无大范围的坏死区,较易与肝EHE鉴别。
本组中4例患者术前误诊为肝转移瘤。肝转移瘤、肝EHE均多表现为肝内多发病灶。EHE肝内病灶数较多者病灶的晕征、包膜皱缩征及棒棒糖征、瘤内血管征较常见,而这些影像学表现在单发病灶或肝内病灶较少的患者中少见。这可能与疾病的发展阶段有关。此外,肝EHE强化表现不典型,亦增加了与肝转移瘤的鉴别难度。
本组中1例患者术前误诊为肝内胆管细胞癌,因该患者肝内结节病灶互相融合成较大病灶,增强扫描后病灶边缘呈持续渐进性强化,从而导致误诊。但该患者病灶边界相对较清,分布于肝脏边缘且不伴肝内胆管扩张,这些表现则有助于肝EHE的诊断。
本组中1例患者术前误诊为血管瘤,该患者首诊时MRI检查病灶于T1WI呈低信号,于T2WI呈均匀一致极高信号,增强后呈充填式强化,而在2年后随诊时发现原病灶的大小和信号及强化方式均发生改变,病灶缩小,T1WI和T2WI呈混杂信号影,增强后病灶内可见结节样持续强化影。本例提示肝EHE在缓慢进展过程中,各向生长呈现不均匀性。另有1例误诊为良性病灶,误诊原因是忽视了肝内多发占位均位于肝包膜下的特征性表现。
综上所述,肝内多发占位近肝包膜分布、邻近包膜皱缩、平扫T2WI出现晕征、增强后门静脉期见棒棒糖征及瘤内血管征等影像学表现,有利于肝EHE的诊断。
| [1] |
李长波, 王斌杰, 肖新广, 周彦汝, 张岚. 肝脏上皮样血管内皮瘤的钆塞酸二钠增强MRI表现[J]. 临床放射学杂志, 2021, 40: 722-726. |
| [2] |
SANDUZZI-ZAMPARELLI M, RIMOLA J, MONTIRONI C, NUNES V, ALVES V A F, SAPENA V, et al. Hepatic epithelioid hemangioendothelioma: an international multicenter study[J]. Dig Liver Dis, 2020, 52: 1041-1046. DOI:10.1016/j.dld.2020.05.003 |
| [3] |
王旋, 戴炳华, 杨诚, 杨甲梅. 肝上皮样血管内皮瘤的诊断与治疗[J]. 中华肝胆外科杂志, 2017, 23: 222-224. |
| [4] |
CARDINAL J, DE VERA M E, MARSH J W, STEEL J L, GELLER D A, FONTES P, et al. Treatment of hepatic epithelioid hemangioendothelioma: a single-institution experience with 25 cases[J]. Arch Surg, 2009, 144: 1035-1039. DOI:10.1001/archsurg.2009.121 |
| [5] |
STUDER L L, SELBY D M. Hepatic epithelioid hemangioendothelioma[J]. Arch Pathol Lab Med, 2018, 142: 263-267. DOI:10.5858/arpa.2016-0171-RS |
| [6] |
刘露, 鲁亚, 刘曦娇, 伍兵. 肝上皮样血管内皮细胞瘤的影像学表现[J]. 中国普外基础与临床杂志, 2018, 25: 229-234. |
| [7] |
朱璐珑, 曹代荣, 王明亮, 曾蒙苏. 肝脏上皮样血管内皮瘤MRI征象[J]. 中国医学影像技术, 2018, 34: 1046-1049. |
| [8] |
陆伦, 郑魏, 潘兴朋, 李贺林, 贾宁阳, 霍雷. 肝血管源性恶性肿瘤的CT和MRI诊断[J]. 放射学实践, 2018, 33: 907-912. |
| [9] |
陈芳, 毛丹丹, 吴海, 项剑瑜, 陈耀孟, 邱乾德. 肝上皮样血管内皮瘤的MRI表现与病理特征[J]. 医学影像学杂志, 2020, 30: 235-238, 291. |
| [10] |
杨旭, 孙文兵, 高君. 肝脏血管源性肿瘤的诊断和治疗[J]. 临床肝胆病杂志, 2020, 36: 2569-2573. |
 2023, Vol. 44
2023, Vol. 44


