2. 海军军医大学(第二军医大学)第三附属医院药剂科, 上海 200438
2. Department of Pharmacy, The Third Affiliated Hospital of Naval Medical University(Second Military Medical University), Shanghai 200438, China
白念珠菌(Candida albicans)是一种常见的条件致病菌,近年来被用作研究真菌基础生物学的模型。研究表明白念珠菌在一定条件下可形成生物被膜,使其耐药性和致病性增强,导致感染持续难愈和死亡率增加[1-2]。白念珠菌生物被膜形成主要包括3个关键步骤:黏附(0~3 h)、微克隆和菌丝形成(3~6 h)及生物被膜成熟(24~48 h),这3个步骤连续发生且存在重叠现象[3-4]。群体感应是微生物间通过释放一些特定的化学信号,即群体感应分子(quorum sensing molecule,QSM),并感知其浓度变化,来监测菌群密度和调控自身的某些生理行为,从而适应周围环境的一种信号交流机制。QSM是影响生物被膜形成的重要因素之一。在白念珠菌中发现QSM法尼醇是真核生物群体感应研究的一个重大突破。法尼醇是白念珠菌生物合成麦角固醇的中间产物,其通过多种信号通路影响形态相关基因的表达,最终抑制白念珠菌酵母相向菌丝相的转变[5]。法尼醇是一种具有萜类结构的挥发性成分,气相色谱或气相色谱-质谱联用是测定其含量的常用方法[6]。酪醇和3-吲哚乙醇的检测通常用液相色谱或液相色谱-质谱联用方法,对于常规生物分析来说这些方法操作烦琐或耗时较长[7]。本研究建立了同时测定法尼醇、酪醇、3-吲哚乙醇的超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UHPLC-MS/MS)方法,可用于测定白念珠菌生长各阶段QSM的含量及评价QSM浓度与白念珠菌不同阶段生长形态的相关性。采用UHPLC-MS/MS检测QSM提高了方法的速度和效率, 保证了方法的高选择性和高灵敏度。
1 材料和方法 1.1 仪器Agilent 1290 Infinity型超高效液相色谱系统,Agilent 6470型三重四极杆串联质谱仪,配有Agilent喷射流电喷雾离子源,使用MassHunter软件进行系统控制及数据处理(美国Agilent公司);FRESCO冷冻型台式离心机(美国ThermoFisher公司);METTLER AE 240型电子天平(瑞士Mettler-Toledo公司);微型涡旋混合仪(美国ThermoFisher公司);HZQ-F160恒温振荡培养箱(江苏太仓市实验设备厂);SW-CT-IF型超净化工作台(苏州安泰空气技术有限公司)。
1.2 药品与试剂法尼醇、酪醇、3-吲哚乙醇标准品(美国Sigma公司),卡马西平(内标,大连美仑生物技术有限公司),乙腈、甲醇和甲酸均为色谱纯(德国Merck公司)。
1.3 菌株与培养基白念珠菌标准株SC5314(由瑞士洛桑大学附属医院Dominique Sanglard教授惠赠)。沙氏葡萄糖琼脂(Sabouraud’s dextrose agar,SDA)培养基:大豆蛋白胨10 g,加入三蒸水900 mL搅拌混匀,然后加入D-葡萄糖40 g搅拌溶解,再用三蒸水定容至1 000 mL,搅拌均匀后加入琼脂18 g,高压灭菌,4 ℃保存。酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)琼脂培养基:酵母浸膏10 g,蛋白胨20 g,葡萄糖20 g,溶解于1 000 mL三蒸水,高压灭菌,4 ℃保存。RPMI 1640培养基:RPMI 1640培养基粉末10 g,吗啡啉丙磺酸34.5 g,碳酸氢钠2.0 g,加入三蒸水900 mL溶解,然后用氢氧化钠室温下调节pH值至7.0,最后用三蒸水定容至1 000 mL,用0.22 µm微孔滤膜过滤除菌后于4 ℃保存。
1.4 分析条件 1.4.1 液相色谱色谱柱为Agilent Poroshell 120 EC-C18色谱柱(3.0 mm×100 mm,2.7 μm)。采用梯度洗脱,流动相为0.1%甲酸水溶液(A)和乙腈(B);洗脱梯度为0~3 min 20%~40% B、3~4 min 40%~80% B、4~8 min 80% B,流速为0.5 mL/min,进样量为5 μL,柱温为25 ℃。
1.4.2 质谱采用电喷雾离子源,正离子多反应监测(multiple reaction monitoring,MRM)模式。氮气作为雾化气和干燥气;高纯氮气为碰撞气,压力为0.1 MPa;雾化器压力为40 psi(1 psi=6 894.8 Pa),干燥气温度为350 ℃,干燥气流速为11 L/min;毛细管电压为4 kV,各成分检测参数见表 1。
|
|
表 1 法尼醇、酪醇、3-吲哚乙醇及内标的质谱检测参数 Tab 1 Mass spectrum parameters of farnesol, tyrosol, 3-indoleethanol and internal standard |
1.5 溶液配制 1.5.1 对照品溶液
精密称取法尼醇、3-吲哚乙醇、酪醇适量(约10.0 mg),分别置于10 mL容量瓶中,用80%甲醇溶解,制得质量浓度约为1.0 mg/mL的对照品储备液。取对照品储备液适量,用80%甲醇逐级稀释,配成3-吲哚乙醇、酪醇质量浓度为0.5、1、2、5、10、20、50、100 µg/mL及法尼醇质量浓度为0.2、0.4、1、2、4、10、20、40 µg/mL的系列混合对照品溶液,置于4 ℃冰箱保存、备用。
1.5.2 内标储备液精密称取卡马西平标准品约10.0 mg,置于10 mL的容量瓶中,用甲醇溶解,制得质量浓度为1.0 mg/mL的内标储备液。
1.5.3 标准对照溶液及质控样品取空白RPMI 1640培养基950 μL,精密加入1.5.1节制备的系列混合对照品溶液50 μL,涡旋混匀,配成3-吲哚乙醇、酪醇质量浓度为25、50、100、250、500、1 000、2 500、5 000 ng/mL及法尼醇质量浓度为10、20、50、100、200、500、1 000、2 000 ng/mL的系列标准对照溶液,同法配制低(3-吲哚乙醇、酪醇质量浓度为50 ng/mL,法尼醇为20 ng/mL)、中(3-吲哚乙醇、酪醇质量浓度为500 ng/mL,法尼醇为200 ng/mL)、高(3-吲哚乙醇、酪醇质量浓度为2 500 ng/mL,法尼醇为1 000 ng/mL)3个浓度的质控样品待用。
1.6 样品制备 1.6.1 白念珠菌的培养将-80 ℃保存的白念珠菌标准株SC5314复苏,接种到SDA固体培养基,37 ℃培养24 h。取单克隆菌株在YPD琼脂液体培养基中200 r/min 30 ℃培养16 h,达到对数生长期后收集液体培养基中的细菌,重悬于RPMI 1640培养基中,按照实验需要制备成密度为1×105/mL的菌悬液。被膜型样品取5 mL菌液置于25 cm2的透气贴壁培养瓶中,37 ℃静置培养3 h,用PBS沿培养瓶内壁轻轻冲洗2次,加入新的RPMI 1640培养基;浮游型样品置于50 mL灭菌三角烧瓶中。2种形态的菌株都置于37 ℃、20 r/min培养箱中孵育,并分别于3、6、12、24、48 h取样测定,每组平行测定3份。
1.6.2 样品前处理将上述样品转移至10 mL离心管中,2 780×g离心5 min,取上清液1 mL,加入3 mL乙酸乙酯萃取后,氮气吹干。用1 mL 80%甲醇(含20 ng/mL内标)复溶,涡旋1 min,11 000×g高速离心3 min,取上清液5 µL进行UHPLC-MS/MS分析。
2 结果 2.1 方法学验证 2.1.1 专属性分别取空白RPMI 1640培养基、质控样品(3-吲哚乙醇、酪醇质量浓度为500 ng/mL,法尼醇质量浓度为200 ng/mL)和培养12 h的浮游型样品适量,按1.6.2节样品前处理方法操作,按1.4节液相色谱和质谱条件采集数据,获得色谱图(图 1)。结果显示,空白培养基中的成分不干扰待测物和内标出峰,专属性良好。
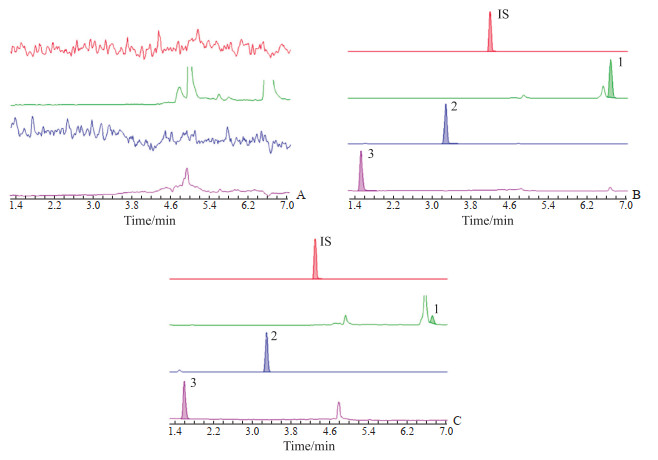
|
图 1 典型的液相色谱-串联质谱图 Fig 1 Typical chromatograms of liquid chromatography-tandem mass spectrometry A: Blank matrix; B: Blank matrix combined with standard samples; C: Actual samples. IS: Internal standard (carbamazepine) (237.0≫194.0); 1: Farnesol (205.2≫121.1); 2: 3-indoleethanol (144.1≫117.0); 3: Tyrosol (121.1≫77.0). |
2.1.2 标准曲线与定量限
取1.5.3节制备的标准对照溶液,按1.6.2节样品前处理方法操作,进样分析并记录色谱图。以待测物浓度为横坐标(x)、待测物与内标峰面积比值为纵坐标(y)进行线性回归分析。以信噪比>10确定定量限进行分析,结果如表 2所示,法尼醇、酪醇、3-吲哚乙醇线性关系良好。
|
|
表 2 酪醇、3-吲哚乙醇、法尼醇的标准曲线及定量限 Tab 2 Calibration curve and limit of quantification results of tyrosol, 3-indoleethanol and farnesol |
2.1.3 精密度和准确度
按1.5.3节制备低、中、高3个浓度的质控样品,每个浓度平行操作5份,按1.6.2节样品前处理方法操作,并于每天制备3个浓度质控样品各5份,进样分析,连续3 d,计算日内精密度、日间精密度及准确度。结果见表 3,法尼醇、酪醇、3-吲哚乙醇的日内精密度、日间精密度及准确度均良好。
|
|
表 3 酪醇、3-吲哚乙醇、法尼醇的精密度和准确度试验结果 Tab 3 Precision and accuracy results of tyrosol, 3-indoleethanol and farnesol |
2.1.4 回收率
取空白RPMI 1640培养基,分别配制低(3-吲哚乙醇、酪醇质量浓度为50 ng/mL,法尼醇为20 ng/mL)、中(3-吲哚乙醇、酪醇质量浓度为500 ng/mL,法尼醇为200 ng/mL)、高(3-吲哚乙醇、酪醇质量浓度为2 500 ng/mL,法尼醇为1 000 ng/mL)3个浓度的混合对照品溶液,按1.6.2节方法处理,每个浓度平行测定5份,计算回收率和测定的RSD。结果见表 4,不同浓度法尼醇、酪醇、3-吲哚乙醇的平均回收率在90%~115%范围内。
|
|
表 4 酪醇、3-吲哚乙醇、法尼醇的回收率试验结果 Tab 4 Recovery results of tyrosol, 3-indoleethanol and farnesol |
2.1.5 稳定性
首先取新鲜配制的对照品溶液和内标储备液,考察对照品溶液于4 ℃下放置30 d的稳定性,结果显示准确度的绝对值均<10%,说明稳定性良好。然后在质控样品的3个浓度下,分别考察3种条件(室温放置4 h、4 ℃自动进样器放置24 h及冻融3次)下的稳定性,每个浓度平行操作5份。按1.6.2节样品前处理方法操作,进样分析,将各目标化合物和内标峰面积的比值代入标准曲线方程求得实测浓度,计算相对误差及RSD,结果(表 5)表明稳定性良好。
|
|
表 5 酪醇、3-吲哚乙醇、法尼醇的稳定性试验结果 Tab 5 Stability results of tyrosol, 3-indoleethanol and farnesol |
2.2 样品测定结果
将样品按1.6.2节样品前处理方法操作,按1.4节色谱和质谱条件进行测定,代入标准曲线方程计算各目标化合物的浓度,结果如表 6所示。在浮游型样品中,3种QSM的含量随培养时间的延长而增加;而在被膜型样品中,法尼醇和酪醇在被膜成熟阶段含量降低。
|
|
表 6 白念珠菌培养基中酪醇、3-吲哚乙醇和法尼醇的含量测定结果 Tab 6 Determination of tyrosol, 3-indoleethanol and farnesol in culture medium of Candida albicans |
3 讨论
本研究运用UHPLC-MS/MS方法检测白念珠菌分泌的QSM法尼醇、酪醇、3-吲哚乙醇的含量,相关文献中质谱都采用电喷雾离子源正离子模式,在全扫描模式下这3个成分的[M+H-H2O]+离子峰稳定且响应较好[8-9],因此本实验也选择[M+H-H2O]+作为含量测定的前体离子。文献报道,采用液相色谱-质谱联用方法检测时,在流动相中加入不同比例的甲酸和乙酸能提高质谱的响应,0.1%的甲酸水溶液-乙腈体系梯度洗脱满足检测灵敏度和分离度的要求[10-11]。
本研究综合文献方法[12-13]对提取条件进行了简化和改良,采用乙酸乙酯萃取,分别考察了样品和乙酸乙酯体积比为1∶1、1∶2、1∶3和1∶4的提取效率,发现法尼醇和酪醇的提取效率随乙酸乙酯体积的增加变化不明显,3-吲哚乙醇的提取效率随乙酸乙酯体积的增加而增加,当样品与乙酸乙酯的体积比为1∶3时能够满足检测的需求,进一步提高乙酸乙酯的比例对提取效率没有显著改善。
群体感应是包括真菌在内的微生物种群内或种群间的信号传递方式,是在长期进化过程中逐步形成的。群体感应是生物膜形成的基础,它能反馈性抑制菌群的复制,使定植群落在生理上达到大小最适,从而形成成熟的生物膜。本研究测定了白念珠菌生物被膜形成阶段QSM的含量,同时比较了相同培养条件下浮游型样品中各成分的含量。结果显示,被膜型白念珠菌培养基中的QSM含量随着被膜的成熟呈升高趋势,但是法尼醇和酪醇含量在培养24 h后降低。浮游型样品中酪醇和3-吲哚乙醇含量低于被膜型样品,且随着培养时间的延长含量逐渐增加;法尼醇含量在培养前12 h几乎没有变化,在24~48 h呈现迅速增加的趋势。
法尼醇是首个被发现的真核生物QSM,它不仅可以通过多种信号通路抑制白念珠菌酵母相向菌丝相的转变,而且可以在高密度时控制细胞过量生长造成的营养竞争[14]。酪醇衍生于酪氨酸,在细胞生长过程中被持续释放到培养基中,可以促进白念珠菌的形态转变和生长。研究表明,酪醇在白念珠菌形态调节中的作用次于法尼醇,只有当环境中法尼醇含量很低或缺乏时才能发挥其调节作用[4]。随着生物被膜的形成及成熟,增多的法尼醇抑制生物被膜的形成,将生物被膜的形成维持在相对平衡状态。同时,环境中可利用营养成分的不断减少也能降低法尼醇浓度,减弱其对生物被膜的抑制作用。因此,生物被膜形成24 h后大量积累的法尼醇占据了调控主导地位,抑制细胞过度生长而导致生物被膜的形成减慢,同时也使促进生物被膜成熟的酪醇产生减少[4, 15]。
本研究建立了一种快速、灵敏、简便的UHPLC-MS/MS方法,用于测定白念珠菌培养基中法尼醇、酪醇和3-吲哚乙醇含量,样品处理采用乙酸乙酯萃取,方法简单、快速且经济;3种成分和内标通过MRM模式实现分离,其测定不受培养基中其他物质的干扰,专属性很好。方法学验证表明法尼醇、酪醇和3-吲哚乙醇的线性、精密度和稳定性均符合分析的要求,适用于白念珠菌培养基中3种成分的测定,这为迅速、准确检测真菌QSM的含量提供了参考。
| [1] |
KAUR J, NOBILE C J. Antifungal drug-resistance mechanisms in Candida biofilms[J/OL]. Curr Opin Microbiol, 2023, 71: 102237. DOI: 10.1016/j.mib.2022.102237.
|
| [2] |
ATRIWAL T, AZEEM K, HUSAIN F M, HUSSAIN A, KHAN M N, ALAJMI M F, et al. Mechanistic understanding of Candida albicans biofilm formation and approaches for its inhibition[J/OL]. Front Microbiol, 2021, 12: 638609. DOI: 10.3389/fmicb.2021.638609.
|
| [3] |
AHMAD PADDER S, PRASAD R, SHAH A H. Quorum sensing: a less known mode of communication among fungi[J]. Microbiol Res, 2018, 210: 51-58. DOI:10.1016/j.micres.2018.03.007 |
| [4] |
KRUPPA M. Quorum sensing and Candida albicans[J]. Mycoses, 2009, 52: 1-10. |
| [5] |
LEE J H, KIM Y G, KHADKE S K, LEE J. Antibiofilm and antifungal activities of medium-chain fatty acids against Candida albicans via mimicking of the quorum-sensing molecule farnesol[J]. Microb Biotechnol, 2021, 14: 1353-1366. DOI:10.1111/1751-7915.13710 |
| [6] |
BOONE C H T, GUTZMANN D J, KRAMER J J, ATKIN A L, NICKERSON K W. Quantitative assay for farnesol and the aromatic fusel alcohols from the fungus Candida albicans[J]. Appl Microbiol Biotechnol, 2022, 106: 6759-6773. DOI:10.1007/s00253-022-12165-w |
| [7] |
MATTIVI F, VRHOVSEK U, VERSINI G. Determination of indole-3-acetic acid, tryptophan and other indoles in must and wine by high-performance liquid chromatography with fluorescence detection[J]. J Chromatogr A, 1999, 855: 227-235. DOI:10.1016/S0021-9673(99)00696-2 |
| [8] |
BORDIGA M, LORENZO C, PARDO F, SALINAS M R, TRAVAGLIA F, ARLORIO M, et al. Factors influencing the formation of histaminol, hydroxytyrosol, tyrosol, and tryptophol in wine: temperature, alcoholic degree, and amino acids concentration[J]. Food Chem, 2016, 197(Pt B): 1038-1045. |
| [9] |
GREGUS P, VLCKOVÁ H, BUCHTA V, KESTRANEK J, KRIVCÍKOVÁ L, NOVÁKOVÁ L. Ultra high performance liquid chromatography tandem mass spectrometry analysis of quorum-sensing molecules of Candida albicans[J]. J Pharm Biomed Anal, 2010, 53: 674-681. DOI:10.1016/j.jpba.2010.05.029 |
| [10] |
KOSALEC I, PUEL O, DELAFORGE M, KOPJAR N, ANTOLOVIC R, JELIC D, et al. Isolation and cytotoxicity of low-molecular-weight metabolites of Candida albicans[J]. Front Biosci, 2008, 13: 6893-6904. |
| [11] |
PILAŘOVÁ V, KOČOVÁ VLČKOVÁ H, JUNG O, PROTTI M, BUCHTA V, MERCOLINI L, et al. Unambiguous determination of farnesol and tyrosol in vaginal fluid using fast and sensitive UHPLC-MS/MS method[J]. Anal Bioanal Chem, 2020, 412: 6529-6541. DOI:10.1007/s00216-020-02699-1 |
| [12] |
HORNBY J M, JENSEN E C, LISEC A D, TASTO J J, JAHNKE B, SHOEMAKER R, et al. Quorum sensing in the dimorphic fungus Candida albicans is mediated by farnesol[J]. Appl Environ Microbiol, 2001, 67: 2982-2992. DOI:10.1128/AEM.67.7.2982-2992.2001 |
| [13] |
ALEM M A S, OTEEF M D Y, FLOWERS T H, DOUGLAS L J. Production of tyrosol by Candida albicans biofilms and its role in quorum sensing and biofilm development[J]. Eukaryot Cell, 2006, 5: 1770-1779. DOI:10.1128/EC.00219-06 |
| [14] |
李婷, 刘朝晖. 真菌群体感应信号分子的研究进展[J]. 中国感染与化疗杂志, 2019, 19: 207-211. |
| [15] |
SEBAA S, BOUCHERIT-OTMANI Z, COURTOIS P. Effects of tyrosol and farnesol on Candida albicans biofilm[J]. Mol Med Rep, 2019, 19: 3201-3209. |
 2023, Vol. 44
2023, Vol. 44


