反应抑制(response inhibition)是指抑制不恰当的或不符合当前需要的行为的能力,以便人们基于环境变化做出灵活和目标指向的行为反应,是执行功能的重要组成部分[1-2]。许多日常行为中都涉及反应抑制,例如为了礼让行人,司机停止正在进行的踩油门动作;当路口的绿灯突然变成红灯,行人就停止过马路的冲动。研究表明反应抑制与右侧额叶-基底神经节网络有关,包括右侧额下回(right inferior frontal gyrus,rIFG)、右侧前辅助运动区(pre-supplementary motor area,pre-SMA)和基底神经节[3-4]。rIFG和右侧pre-SMA位于大脑皮质,受到更多的研究者关注,其中rIFG被认为是反应抑制更为关键的脑区[4],通过调节rIFG神经活动和促进神经可塑性的方法提升反应抑制能力成为新兴研究方向。
经颅直流电刺激(transcranial direct current stimulation,tDCS)是一种具有前景的调节脑区皮质活动、促进神经可塑性与提升认知能力的方法,它通过放置在头皮上的电极,以微弱直流电(一般为0.5~2 mA)作用于大脑皮质并影响大脑皮质活动,一般阳极刺激会引起皮质兴奋性增加,阴极刺激导致兴奋性降低[5]。tDCS具有非侵入、安全耐受、易于携带、操作方便等特点[6],目前已经广泛应用于认知神经科学研究领域。
研究表明阳极tDCS刺激rIFG可以提升反应抑制能力[7-9],但其皮质静息态神经机制还不清楚。静息态是大脑功能有组织的基线状态或默认模式,功能磁共振成像(functional magnetic resonance imaging,fMRI)研究表明tDCS可以调节静息态功能连接[9-10]。静息态功能连接指大脑解剖分离区域低频自发神经活动的时间同步性,反映了不同神经群体之间的信息交互,可以通过计算功能连接性和图论分析脑网络指标等衡量,对阐明大脑功能的机制十分重要,可以为洞悉大脑如何发挥功能提供有价值的信息[11-12]。静息态功能性近红外光谱成像(functional near-infrared spectroscopy,fNIRS)作为一种研究静息态脑功能的新型成像工具,避免了任务态研究因任务设计和被试执行情况差异所导致的异质性和结果难以比较等缺陷,操作过程方便,在表征功能连接性和网络拓扑属性时有较高的可行性、可靠性和可重复性[13]。已有研究者使用静息态fNIRS评估tDCS刺激对前额叶和运动相关皮质功能连接的效应[14-15],但tDCS刺激rIFG后反应抑制相关皮质(包括rIFG和右侧pre-SMA)静息态功能连接的相应变化还未见报道。
本研究利用静息态fNIRS测量阳极高精度tDCS(high definition tDCS,HD-tDCS)刺激rIFG对反应抑制相关皮质功能连接的影响,观察阳极HD-tDCS刺激rIFG(相较于假刺激)能否使rIFG和右侧pre-SMA静息态功能连接增强、脑网络效率相关指标增加,为更好地理解tDCS促进反应抑制能力提升提供基于静息态功能连接的依据。
1 对象和方法 1.1 研究对象使用G*Power 3.1.9.6软件估计样本量,设置中等效应量为0.25,统计检验力为0.9,显著性水平为0.05[16-17],计算所需样本量为46。考虑到可能有数据剔除,本研究共纳入48名健康在校大学生,其中男22人、女26人,年龄为18~24(20.54±1.47)岁。将被试随机分成两组:rIFG刺激组和假刺激组,每组24人。所有被试均视力或矫正视力正常、右利手;分别使用成人注意缺陷多动障碍(attention deficit hyperactivity disorder,ADHD)自评量表的注意缺陷分量表、多动/冲动分量表评估被试的注意缺陷和多动/冲动,只有2个分量表得分同时≤17分者被纳入,任何1个分量表得分 > 17分即可能患有ADHD[18]。所有被试均无神经精神疾病,无癫痫病史或癫痫家族史,无tDCS禁忌证(如头部金属植入、头部外伤等),无精神活性药物使用史,近2个月内未参加过类似试验。本研究通过空军军医大学西京医院伦理委员会审批(KY20202063-F-2号),被试在试验前均签署研究知情同意书,试验结束后给予被试一定劳务费。
1.2 试验设计与试验过程本试验为单盲、随机、假刺激对照研究,采用2(刺激类型:rIFG刺激vs假刺激)×2(检测时间:刺激前测vs刺激后测)的两因素混合试验设计,刺激类型为被试间因素,检测时间为被试内因素。为确保fNIRS信号的完整性和血氧信息的丰富性,将3种类型的血红蛋白信号全部纳入考虑,因变量为氧合血红蛋白(oxyhemoglobin,HbO)、去氧血红蛋白(deoxyhemoglobin,HbR)和总血红蛋白(total hemoglobin,HbT)相对浓度变化量在时间序列上的Pearson相关系数。开始收集fNIRS静息态数据前,要求被试于舒适坐位休息3 min恢复平静,然后佩戴头帽;试验过程中要求被试放松静坐,尽量保持静止,避免有规律的思考,注视前方屏幕上的“+”注视点,避免睡着[15],同时采集7 min静息态数据[19]。随后进行20 min的HD-tDCS刺激,刺激结束后研究者帮助被试仔细清理头发,再次收集7 min静息态数据,操作步骤和要求与刺激前测一致。
1.3 HD-tDCS采用M×N-9型高精度经颅电刺激仪(美国Soterix Medical公司),使用环形电极(直径1.2 cm)按照4×1排布刺激rIFG,根据国际脑电10-10系统放置电极[20],刺激方案(包括电极位置和电流强度)通过HD-Targets软件(美国Soterix Medical公司)确定,使用HD-Explore软件(美国Soterix Medical公司)进一步优化调整刺激方案及模拟相应的电场强度和电流方向(图 1),该方法已在既往研究[21]中得到应用。最终本研究的刺激方案为中心电极为阳极,放置在FT8,电流为1.25 mA,该电流强度对人体是安全的[22];4个返回电极分别放置在FC4、C4、FT10和TP8,电流分别为-0.32、-0.31、-0.31和-0.31 mA,刺激时间共20 min。rIFG刺激组电流在开始30 s内逐渐上升至1.25 mA并保持,于最后30 s逐渐下降至0 mA。假刺激组采用与rIFG刺激组同样的刺激方案,但仅在开始30 s内电流上升至设定值,随后30 s内下降至接近0 mA并保持,刺激最后1 min内前30 s电流又开始上升至设定值并于随后30 s下降至0 mA,这种方式可以产生类似真刺激的感觉以确保盲法,但并无实际刺激效果[23]。HD-tDCS所有操作步骤参照文献[22]。刺激结束后,研究者询问被试其认为自己接受的是哪种刺激类型(真、假刺激)及其对自己猜测结果的确信程度(以0~10分表示,0分表示完全是猜测,10分表示绝对确信);要求被试给刺激时的感觉(痒感、刺痛感、烧灼感、金属味等)及感觉强度打分(以0~10分表示,0分表示无感觉,10分表示能想象到的最强感觉)[24]。
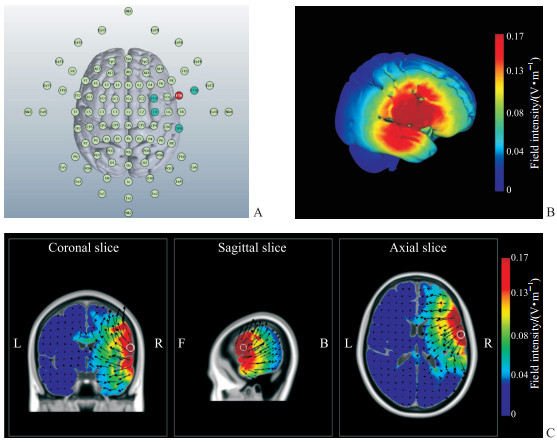
|
图 1 HD-tDCS示意图 Fig 1 Schematic illustration of HD-tDCS A: Electrode arrangement. Red (FT8) is the central electrode and cyan (FC4, C4, FT10, and TP8) is the return electrode. B: A 3D view of simulated electric field. C: The section view of simulated electric field and current direction. The arrows point in the direction of current flow. HD-tDCS: High definition transcranial direct current stimulation; L: Left; R: Right; F: Front; B: Back. |
1.4 近红外数据采集及通道定位
使用LABNIRS功能性近红外光谱成像系统(日本Shimadzu公司),根据修正的Lambert-Beer定律采集被试右侧脑区(覆盖rIFG与右侧pre-SMA)静息态7 min血氧浓度(包括HbO、HbR、HbT)的相对变化。使用11个发射光极(发射三波长近红外光,波长分别为780、805、830 nm)和11个接收光极,发射光极和接收光极之间共形成34个通道(图 2A),采样率为27.78 Hz。使用光纤帽确保光极间的距离为3 cm,为确保光极放置位置的一致性,使通道1位于国际脑电10-10系统的中线中点(central zero)[20],并且光极排布的最上端与中线中点-枕点(occipital zero)连线重合(图 2A)。通过Fastrak 3D定位仪(美国Polhemus公司)记录参考点鼻根点(nasion)、中线中点、左耳前点(left preauricular point)、右耳前点(right preauricular point)及光极和通道的坐标,通过基于MATLAB的NIRS-SPM工具包与蒙特利尔神经研究所坐标进行空间配准(图 2B、2C),使用Brodmann Talairach模板与LPBA40模板得到通道与大脑解剖结构的对应关系和概率[25]。本研究事先规定重叠概率超过50%时通道可以代表相应感兴趣区(region of interest,ROI),因此有9个通道代表右侧pre-SMA(通道1、2、5、6、8、9、12、19、26),2个通道代表rIFG(通道24、27)。
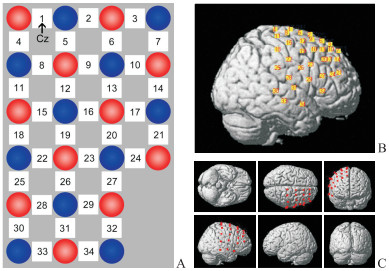
|
图 2 fNIRS光极和通道布局 Fig 2 Layout of fNIRS optrodes and channels A: Optrode arrangement. Red circles are source, blue circles are detectors, and white squares are channels. Channel 1 is located at Cz. B: Spatial registration of channels (1-34) on a rendered brain. C: Different views of optrode locations (red dots). Cz: Central zero. |
1.5 近红外数据分析
使用基于MATLAB R2021b的NIRS-KIT工具包进行数据预处理[26]。(1)数据经质量检查后去除最初30 s和最后1 min的数据,保留较稳定的信号。(2)进行去漂移处理,使用多项式回归模型估计线性或非线性趋势并从原始光谱中去除。(3)进行运动校正和滤波,运动校正选择基于时间导数分布修复方法,带通滤波使用无限脉冲响应滤波器,频率为0.01~0.08 Hz[26]。最后得到预处理后的静息态HbO、HbR和HbT相对浓度。
个体水平分析先使用NIRS-KIT工具包相应模块进行功能连接分析[26],包括感兴趣区到感兴趣区(ROI2ROI)功能连接分析和功能连接矩阵分析。ROI2ROI功能连接分析过程如下:将通道1、2、5、6、8、9、12、19、26定义为右侧pre-SMA ROI,通道24、27定义为rIFG ROI,依据时间序列上的HbO、HbR和HbT相对浓度变化,先计算每个ROI的平均时间序列,再计算2个ROI时间序列上的Pearson相关系数,并进行Fisher-Z变换,将变换后的Z值定义为ROI2ROI功能连接强度。功能连接矩阵分析过程如下:选择感兴趣通道1、2、5、6、8、9、12、19、24、26、27,提取每个通道时间序列上的血红蛋白相对浓度变化,通过每对通道时间序列之间的Pearson相关分析计算功能连接性,将得到的Pearson相关系数进行Fisher-Z变换,将变换后的Z值定义为通道对的功能连接强度。然后将NIRS-KIT工具包产生的功能连接矩阵导入到Gretna工具包,通过图论分析计算脑网络效率指标[27]。效率用来表征大脑网络中并行处理信息的能力,是脑网络研究中非常重要的指标,本研究关注的效率相关指标包括网络全局效率(network global efficiency)、网络局部效率(network local efficiency)和节点效率(nodal efficiency)[13],其中网络全局效率衡量整个网络并行信息传输的效率,网络局部效率表征给定节点的相邻节点的沟通效率,节点效率是指该节点在网络中传递信息的效率。使用Gretna工具包得到个体指标后,提取各项指标进行组水平分析。
1.6 统计学处理使用SPSS 26.0软件进行统计学分析。除有特别说明,描述性统计量以x±s表示。正态性检验采用Shapiro-Wilk检验,方差齐性检验采用Levene检验。对每个功能连接分析和脑网络指标进行2(刺激类型:rIFG刺激vs假刺激)×2(检测时间:刺激前测vs刺激后测)重复测量方差分析,对被试内因素只有两水平的不需要进行球形检验,采用Bonferroni法进行事后多重比较校正;本研究因更关注刺激类型和时间的交互效应,因此只报告交互效应结果。个别比较采用协方差分析会特别说明。基于HbT的节点效率指标由于基线不一且经检验不适用协方差分析,采用delta值(刺激后测减去刺激前测)作为节点效率统计值进行独立样本t检验。多次比较时对P值进行错误发现率(false discovery rate,FDR)校正以降低假阳性率。方差分析报告偏η2效应量[28],独立样本t检验报告Cohen’s d效应量[16]。检验水准(α)为0.05。
2 结果 2.1 被试基本特点rIFG刺激组和假刺激组性别构成一致(两组均有11名男性和13名女性),并且两组间年龄、受教育年限、ADHD自评量表注意缺陷分量表得分、ADHD自评量表多动/冲动分量表得分、ADHD自评量表总分、每晚睡眠时长差异均无统计学意义(P均 > 0.05)。见表 1。
|
|
表 1 两组被试基本特点 Tab 1 Basic characteristics of participants in 2 groups |
2.2 基于HbO信号的静息态功能连接变化
ROI2ROI功能连接分析结果显示,刺激类型与时间交互效应无统计意义[F(1,46) < 0.01,P=0.992]。两组被试功能连接矩阵见图 3,rIFG刺激组功能连接矩阵刺激前测平均强度为0.32±0.13,刺激后测为0.34±0.18;假刺激组功能连接矩阵刺激前测平均强度为0.34±0.20,刺激后测为0.30±0.19。
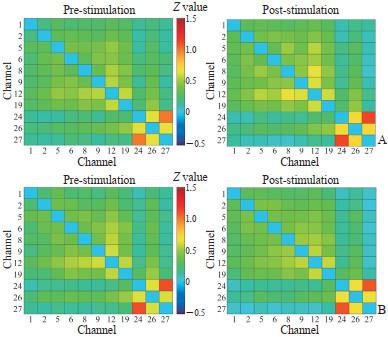
|
图 3 两组被试基于氧合血红蛋白信号的功能连接矩阵 Fig 3 Functional connectivity matrices based on oxyhemoglobin signals in subjects of 2 groups A: rIFG stimulation group; B: Sham stimulation group. The redder the color, the stronger the functional connectivity. rIFG: Right inferior frontal gyrus. |
重复测量方差分析结果显示,仅通道5-通道8[F(1,46)=4.44,P=0.041,偏η2=0.088]和通道12-通道27[F(1,46)=4.95,P=0.031,偏η2=0.097]交互效应有统计学意义,但经FDR校正后均无统计学意义(校正P均 > 0.05)。图论分析结果显示,网络全局效率交互效应无统计学意义[F(1,46)=1.09,P=0.302],网络局部效率交互效应无统计学意义[F(1,46)=0.24,P=0.629],节点效率分析显示仅节点9(即通道9)交互效应有统计学意义[F(1,46)=5.79,P=0.020,偏η2=0.112],但经FDR校正后无统计学意义(校正P > 0.05),其余节点交互效应均无统计学意义(P均 > 0.05)。
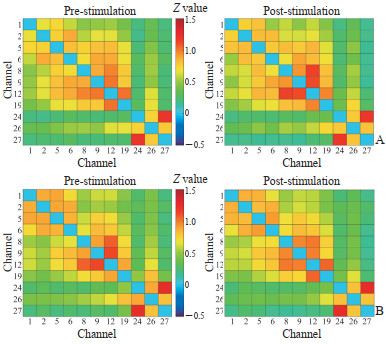
2.3 基于HbR信号的静息态功能连接变化ROI2ROI功能连接分析显示交互效应有边缘统计学意义[F(1,46)=3.73,P=0.060,偏η2=0.075],简单效应分析显示刺激前测rIFG刺激组与假刺激组的ROI2ROI功能连接强度差异无统计学意义(0.07±0.25 vs 0.09±0.29,P=0.840),刺激后测rIFG刺激组功能连接强度高于假刺激组(0.20±0.30 vs 0.01±0.21,P=0.011)。两组被试功能连接矩阵见图 4A、4B,重复测量方差分析显示通道6-通道12功能连接交互效应有统计学意义[F(1,46)=5.10,P=0.029,偏η2=0.100],但经FDR校正后无统计学意义(校正P > 0.05);协方差分析结果显示通道1-通道2组别效应有统计学意义[F(1,45)=4.22,P=0.046,偏η2=0.086],但经校正后无统计学意义(校正P > 0.05),通道2-通道24组别效应有统计学意义[F(1,45)=18.03,P < 0.001,偏η2=0.286],经FDR校正后仍有统计学意义(校正P < 0.05)。方差分析结果见图 4C、4D,经过基线调整后,rIFG刺激组通道2-通道24刺激后测功能连接强度为0.10±0.03(x±s),假刺激组则为-0.08±0.03(x±s),差异有统计学意义(P < 0.001),表明rIFG刺激组通道2-通道24刺激后测功能连接强度大于假刺激组,其余通道功能连接交互效应均无统计学意义(P均 > 0.05)。图论分析结果显示,网络全局效率交互效应无统计学意义[F(1,46)=0.49,P=0.485],网络局部效率交互效应无统计学意义[F(1,46)=0.08,P=0.785],节点效率交互效应均无统计学意义(P均 > 0.05)。

|
图 4 两组被试基于去氧血红蛋白信号的功能连接矩阵及功能连接方差分析结果 Fig 4 Functional connectivity matrices based on deoxyhemoglobin signals and analysis of variance results in subjects of 2 groups A, B: Functional connectivity matrices of rIFG stimulation group (A) and sham stimulation group (B). The redder the color, the stronger the functional connectivity. C: F value matrix. The redder the color, the higher the F value. D: Results after false discovery rate correction. The white color represents the significant result, while the black color represents the insignificant result in the binary matrix. rIFG: Right inferior frontal gyrus. |
2.4 基于HbT信号的静息态功能连接变化
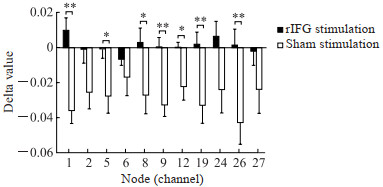
ROI2ROI功能连接分析显示交互效应无统计学意义[F(1,46)=0.17,P=0.681]。基于HbT的功能连接矩阵见图 5,rIFG刺激组功能连接矩阵刺激前测平均强度为0.57±0.20,刺激后测为0.57±0.21;假刺激组功能连接矩阵刺激前测平均强度为0.57±0.27,刺激后测为0.55±0.21,重复测量方差分析结果显示仅通道9-通道12功能连接交互效应有统计学意义[F(1,46)=4.62,P=0.037,偏η2=0.091],但经FDR校正后无统计学意义(校正P > 0.05)。图论分析结果显示,网络全局效率交互效应无统计学意义[F(1,46)=0.10,P=0.755],网络局部效率交互效应无统计学意义[F(1,46)=2.43,P=0.126]。独立样本t检验结果显示,rIFG刺激组通道1、5、8、9、12、19、26的节点效率delta值均大于假刺激组(校正P均 < 0.05,图 6);rIFG刺激组平均节点效率delta值为0.001±0.013,假刺激组为-0.028±0.020,差异有统计学意义[t(38.16)=6.05,P < 0.001,Cohen’s d=1.747]。
|
图 5 两组被试基于总血红蛋白信号的功能连接矩阵 Fig 5 Functional connectivity matrices based on total hemoglobin signals in subjects of 2 groups A: rIFG stimulation group; B: Sham stimulation group. The redder the color, the stronger the functional connectivity. rIFG: Right inferior frontal gyrus. |
|
图 6 两组被试基于总血红蛋白信号的功能连接节点效率 Fig 6 Nodal efficiency of functional connectivity based on total hemoglobin signals in subjects of 2 groups *P < 0.05, **P < 0.01 vs sham stimulation group (P values were corrected by false discovery rate). n=24, x±sx. rIFG: Right inferior frontal gyrus. |
2.5 不良反应和盲法效果
所有被试都完成刺激过程并耐受良好,没有被试报告严重不良反应,仅报告痒感、刺痛、烧灼感等常见应用tDCS产生的感觉,且rIFG刺激组与假刺激组被试的感觉强度评分差异无统计学意义[(4.13±2.23)分vs(3.96±2.66)分,t(46)=0.24,P=0.815]。对于盲法效果,rIFG刺激组有23人认为自己受到的是真刺激,1人认为是假刺激;假刺激组有22人认为自己受到的是真刺激,仅有2人认为自己受到假刺激。经连续性校正χ2检验分析,两组被试在猜测自己受到的刺激类型方面差异无统计学意义[χ2(1) < 0.01,P > 0.999],且rIFG刺激组与假刺激组被试的确信程度评分差异无统计学意义[(7.46±2.36)分vs(6.67±2.46)分,t(46)=1.14,P=0.261]。
3 讨论本研究通过静息态fNIRS观察HD-tDCS刺激rIFG前后被试反应抑制相关皮质——rIFG和右侧pre-SMA的功能连接变化,发现两组被试基本特点差异无统计学意义,具有可比性;依据被试试验后的主观报告可以认为盲法有效。基于HbO的静息态数据分析均没有统计学意义或未通过FDR校正。基于HbR信号的ROI2ROI分析结果显示刺激rIFG后rIFG与右侧pre-SMA之间功能连接强度相较于假刺激组增加,rIFG刺激组功能连接矩阵中通道2-通道24之间的功能连接强度相较于假刺激组在刺激后也增加,通道2代表右侧pre-SMA的ROI,通道24对应于rIFG的ROI,也证明rIFG与右侧pre-SMA之间功能连接增强。基于HbT信号的分析结果表明rIFG刺激组通道1、5、8、9、12、19、26的节点效率delta值大于假刺激组,且rIFG刺激组平均节点效率也大于对照组。
本研究结果显示,HD-tDCS刺激rIFG后可以使rIFG与右侧pre-SMA之间的功能连接增强,不论是ROI2ROI功能连接分析还是功能连接矩阵分析结果都支持该结果,证明阳极HD-tDCS刺激rIFG能使rIFG和右侧pre-SMA静息态功能连接增强。该结果与既往研究结果[9]一致,Sandrini等[9]在阳极tDCS(1.5 mA,20 min)刺激rIFG前后收集5 min的静息态fMRI特征,发现与假刺激相比真刺激使rIFG与尾状核之间的功能连接增强。值得注意的是尾状核属于纹状体,是基底神经节的一部分,这说明tDCS确实可以使反应抑制神经网络中不同ROI之间的静息态功能连接增强。本研究进一步阐明了tDCS刺激rIFG对反应抑制皮质静息态功能连接的影响,即rIFG与右侧pre-SMA之间的静息态功能连接增强。以往研究指出反应抑制的神经基础是额叶-基底神经节网络[3, 29],rIFG与右侧pre-SMA是反应抑制网络的重要皮质脑区,这2个脑区的功能连接增强可能对反应抑制功能的提升有极为重要的意义。
本研究还发现,基于功能连接矩阵的图论分析结果显示rIFG刺激组多数节点的节点效率delta值大于假刺激组,且平均节点效率delta值大于假刺激组,进一步表明刺激rIFG可以增加反应抑制皮质网络的节点效率,该发现与以往研究报道阳极HD-tDCS刺激右侧前额叶可以提升前额叶的静息态网络节点效率[15]一致。该结果说明,刺激后反应抑制皮质网络中的节点对停止命令或停止信息的传递效率增加,从新的角度解释了tDCS作用于rIFG使反应抑制能力提高的可能机制。但本研究没有发现网络全局效率和网络局部效率的改变,与以往研究[30]不同,该研究使用阳极tDCS(2 mA,20 min)治疗酒精使用障碍患者,通过刺激右侧背外侧前额叶考察其对静息态fMRI的影响,结果显示相较于假刺激组真刺激组脑网络全局效率增加。这可能是2项研究使用的电流强度不同导致的,本研究使用1.25 mA,而Holla等[30]使用的是2 mA。尽管电流强度与产生的效应大小之间不总是线性关系,但在一定范围内电流强度越大产生的tDCS效应更大,如Iyer等[31]使用低电流强度tDCS(1 mA,20 min)研究时被试表现差异无统计学意义,但受到更大电流强度(2 mA,20 min)刺激时被试表现提升,表现出剂量效应。在本研究中,网络全局效率和网络局部效率没有改变可能是因为电流强度较低,还不足够引发它们的改变。另一个可能的原因是被试神经网络功能基线差异,Holla等[30]选择的酒精使用障碍患者可能存在反应抑制缺陷,其相关神经网络功能更易受tDCS影响而表现出改善;Weidler等[32]也报告了使用tDCS(1.5 mA,20 min)刺激后正常对照组反应抑制并没有提高,但酒精依赖患者出现反应抑制提升。本研究受试对象是健康大学生,其神经网络功能相较于缺陷患者更难被改变和提高,可能因此没有得到网络全局效率和网络局部效率提高的结果。
以往的研究认为tDCS刺激rIFG可以提升反应抑制能力[7-9, 33],但目前还未有研究涉及tDCS刺激rIFG后rIFG和右侧pre-SMA这2个重要的反应抑制皮质的静息态脑网络的变化,本研究证明了相较于假刺激,阳极HD-tDCS能够使rIFG与右侧pre-SMA的功能连接增强、节点效率增加,对通过tDCS刺激rIFG提升反应抑制能力的可能的静息态神经机制提出了创新性见解。
本研究仍存在一些不足。首先,本研究采用刺激类型被试间设计,不能完全排除被试个体差异的影响,虽然控制了一些基本特点,但仍有可能存在没有考虑到的混杂因素,未来研究可以考虑完全被试内设计,以减少个体和组间差异的影响。其次,本研究缺少短距离参考通道,短距离参考通道可以记录头皮血流等浅层噪声,可通过从fNIRS信号中去除这些噪声,使fNIRS信号更加纯净,未来研究应考虑在设计光极排布时整合短距离参考通道[15]。另外,本研究只使用了静息态fNIRS测量方法,未结合行为学研究测量被试反应抑制能力的提升情况。最后,本研究招募的被试局限在健康大学生,在将结果推广到其他年龄人群或非健康人群时应持谨慎态度。
综上所述,本研究采用静息态fNIRS测量HD-tDCS刺激rIFG前后反应抑制皮质网络的变化,结果表明相较于假刺激对照,HD-tDCS刺激可以使rIFG和右侧pre-SMA之间功能连接增强,并且使反应抑制皮质网络中的节点效率增加。本研究为理解tDCS促进反应抑制提升提供了基于反应抑制皮质静息态网络的新思路。
| [1] |
VERBRUGGEN F, LOGAN G D. Models of response inhibition in the stop-signal and stop-change paradigms[J]. Neurosci Biobehav Rev, 2009, 33: 647-661. DOI:10.1016/j.neubiorev.2008.08.014 |
| [2] |
DIAMOND A. Executive functions[J]. Annu Rev Psychol, 2013, 64: 135-168. DOI:10.1146/annurev-psych-113011-143750 |
| [3] |
HANNAH R, ARON A R. Towards real-world generalizability of a circuit for action-stopping[J]. Nat Rev Neurosci, 2021, 22: 538-552. DOI:10.1038/s41583-021-00485-1 |
| [4] |
ARON A R, ROBBINS T W, POLDRACK R A. Inhibition and the right inferior frontal cortex: one decade on[J]. Trends Cogn Sci, 2014, 18: 177-185. DOI:10.1016/j.tics.2013.12.003 |
| [5] |
NITSCHE M A, PAULUS W. Sustained excitability elevations induced by transcranial DC motor cortex stimulation in humans[J]. Neurology, 2001, 57: 1899-1901. DOI:10.1212/WNL.57.10.1899 |
| [6] |
BIKSON M, GROSSMAN P, THOMAS C, ZANNOU A L, JIANG J, ADNAN T, et al. Safety of transcranial direct current stimulation: evidence based update 2016[J]. Brain Stimul, 2016, 9: 641-661. DOI:10.1016/j.brs.2016.06.004 |
| [7] |
JACOBSON L, JAVITT D C, LAVIDOR M. Activation of inhibition: diminishing impulsive behavior by direct current stimulation over the inferior frontal gyrus[J]. J Cogn Neurosci, 2011, 23: 3380-3387. DOI:10.1162/jocn_a_00020 |
| [8] |
CHEN S Y, JACKSON T, DONG D B, ZHANG X M, CHEN H. Exploring effects of single-session anodal tDCS over the inferior frontal gyrus on responses to food cues and food cravings among highly disinhibited restrained eaters: a preliminary study[J]. Neurosci Lett, 2019, 706: 211-216. DOI:10.1016/j.neulet.2019.05.035 |
| [9] |
SANDRINI M, XU B, VOLOCHAYEV R, AWOSIKA O, WANG W T, BUTMAN J A, et al. Transcranial direct current stimulation facilitates response inhibition through dynamic modulation of the fronto-basal ganglia network[J]. Brain Stimul, 2020, 13: 96-104. DOI:10.1016/j.brs.2019.08.004 |
| [10] |
VELICIA B, JAMIE N, HEIDI J B, STAGG CHARLOTTE J. Modulation of GABA and resting state functional connectivity by transcranial direct current stimulation[J/OL]. eLife, 2015, 4: e08789. DOI: 10.7554/eLife.08789.
|
| [11] |
NIU H J, HE Y. Resting-state functional brain connectivity: lessons from functional near-infrared spectroscopy[J]. Neuroscientist, 2014, 20: 173-188. DOI:10.1177/1073858413502707 |
| [12] |
ZHANG Y J, ZHU C Z. Assessing brain networks by resting-state dynamic functional connectivity: an fNIRS-EEG study[J/OL]. Front Neurosci, 2019, 13: 1430. DOI: 10.3389/fnins.2019.01430.
|
| [13] |
WANG M J, HU Z S, LIU L, LI H M, QIAN Q J, NIU H J. Disrupted functional brain connectivity networks in children with attention-deficit/hyperactivity disorder: evidence from resting-state functional near-infrared spectroscopy[J/OL]. Neurophotonics, 2020, 7: 015012. DOI: 10.1117/1.NPh.7.1.015012.
|
| [14] |
YAN J Q, WEI Y, WANG Y H, XU G, LI Z, LI X L. Use of functional near-infrared spectroscopy to evaluate the effects of anodal transcranial direct current stimulation on brain connectivity in motor-related cortex[J/OL]. J Biomed Opt, 2015, 20: 46007. DOI: 10.1117/1.Jbo.20.4.046007.
|
| [15] |
YAQUB M A, WOO S W, HONG K S. Effects of HD-tDCS on resting-state functional connectivity in the prefrontal cortex: an fNIRS study[J/OL]. Complex, 2018, 2018: 1613402. DOI: 10.1155/2018/1613402.
|
| [16] |
COHEN J. A power primer[J]. Psychol Bull, 1992, 112: 155-159. DOI:10.1037/0033-2909.112.1.155 |
| [17] |
FAUL F, ERDFELDER E, LANG A G, BUCHNER A. G*Power 3:a flexible statistical power analysis program for the social, behavioral, and biomedical sciences[J]. Behav Res Methods, 2007, 39: 175-191. DOI:10.3758/BF03193146 |
| [18] |
YEH C B, GAU S S F, KESSLER R C, WU Y Y. Psychometric properties of the Chinese version of the adult ADHD self-report scale[J]. Int J Methods Psychiatr Res, 2008, 17: 45-54. DOI:10.1002/mpr.241 |
| [19] |
DUAN L, VAN DAM N T, AI H, XU P F. Intrinsic organization of cortical networks predicts state anxiety: an functional near-infrared spectroscopy (fNIRS) study[J/OL]. Transl Psychiatry, 2020, 10: 402. DOI: 10.1038/s41398-020-01088-7.
|
| [20] |
JURCAK V, TSUZUKI D, DAN I. 10/20, 10/10, and 10/5 systems revisited: their validity as relative head-surface-based positioning systems[J]. NeuroImage, 2007, 34: 1600-1611. DOI:10.1016/j.neuroimage.2006.09.024 |
| [21] |
NIKOLIN S, LOO C K, BAI S, DOKOS S, MARTIN D M. Focalised stimulation using high definition transcranial direct current stimulation (HD-tDCS) to investigate declarative verbal learning and memory functioning[J]. Neuroimage, 2015, 117: 11-19. DOI:10.1016/j.neuroimage.2015.05.019 |
| [22] |
VILLAMAR M F, VOLZ M S, BIKSON M, DATTA A, DASILVA A F, FREGNI F. Technique and considerations in the use of 4×1 ring high-definition transcranial direct current stimulation (HD-tDCS)[J/OL]. J Vis Exp, 2013: e50309. DOI: 10.3791/50309.
|
| [23] |
DI ROSA E, BRIGADOIS, CUTINI S, TARANTINO V, DELL'ACQUA R, MAPELLI D, et al. Reward motivation and neurostimulation interact to improve working memory performance in healthy older adults: a simultaneous tDCS-fNIRS study[J/OL]. Neuroimage, 2019, 202: 116062. DOI: 10.1016/j.neuroimage.2019.116062.
|
| [24] |
HILL A T, ROGASCH N C, FITZGERALD P B, HOY K E. Effects of prefrontal bipolar and high-definition transcranial direct current stimulation on cortical reactivity and working memory in healthy adults[J]. NeuroImage, 2017, 152: 142-157. DOI:10.1016/j.neuroimage.2017.03.001 |
| [25] |
YE J C, TAK S, JANG K E, JUNG J, JANG J. NIRS-SPM: statistical parametric mapping for near-infrared spectroscopy[J]. NeuroImage, 2009, 44: 428-447. DOI:10.1016/j.neuroimage.2008.08.036 |
| [26] |
HOU X, ZHANG Z, ZHAO C, DUAN L, GONG Y L, LI Z, et al. NIRS-KIT: a MATLAB toolbox for both resting-state and task fNIRS data analysis[J/OL]. Neurophotonics, 2021, 8: 010802. DOI: 10.1117/1.NPh.8.1.010802.
|
| [27] |
WANG J H, WANG X D, XIA M R, LIAO X H, EVANS A, HE Y. GRETNA: a graph theoretical network analysis toolbox for imaging connectomics[J/OL]. Front Hum Neurosci, 2015, 9: 386. DOI: 10.3389/fnhum.2015.00386.
|
| [28] |
COHEN J. Statistical power analysis for the behavioral sciences[M]. 2nd ed. Hillsdale: Lawrence Erlbaum Associates, 1988: 281.
|
| [29] |
XU B, SANDRINI M, WANG W T, SMITH J F, SARLLS J E, AWOSIKA O, et al. PreSMA stimulation changes task-free functional connectivity in the fronto-basal-ganglia that correlates with response inhibition efficiency[J]. Hum Brain Mapp, 2016, 37: 3236-3249. DOI:10.1002/hbm.23236 |
| [30] |
HOLLA B, BISWAL J, RAMESH V, SHIVAKUMAR V, BHARATH R D, BENEGAL V, et al. Effect of prefrontal tDCS on resting brain fMRI graph measures in alcohol use disorders: a randomized, double-blind, sham-controlled study[J/OL]. Prog Neuropsychopharmacol Biol Psychiatry, 2020, 102: 109950. DOI: 10.1016/j.pnpbp.2020.109950.
|
| [31] |
IYER M B, MATTU U, GRAFMAN J, LOMAREV M, SATO S, WASSERMANN E M. Safety and cognitive effect of frontal DC brain polarization in healthy individuals[J]. Neurology, 2005, 64: 872-875. DOI:10.1212/01.WNL.0000152986.07469.E9 |
| [32] |
WEIDLER C, HABEL U, WALLHEINKE P, WAGELS L, HOFHANSEL L, LING S C, et al. Consequences of prefrontal tDCS on inhibitory control and reactive aggression[J]. Soc Cogn Affect Neurosci, 2022, 17: 120-130. DOI:10.1093/scan/nsaa158 |
| [33] |
LI L M, VIOLANTE I R, LEECH R, HAMPSHIRE A, OPITZ A, MCARTHUR D, et al. Cognitive enhancement with salience network electrical stimulation is influenced by network structural connectivity[J]. Neuroimage, 2019, 185: 425-433. DOI:10.1016/j.neuroimage.2018.10.069 |
 2023, Vol. 44
2023, Vol. 44


