2. 山西医科大学基础医学院药理学教研室, 太原 030000;
3. 四川禾亿制药有限公司, 成都 610000;
4. 山西省眼科医院眼视光科, 太原 030000
2. Department of Pharmacology, School of Basic Medicine, Shanxi Medical University, Taiyuan 030000, Shanxi, China;
3. Sichuan Herbease Pharmaceutical Co., Ltd, Chengdu 610000, Sichuan, China;
4. Department of Optometry, Shanxi Eye Hospital, Taiyuan 030000, Shanxi, China
长期以来高眼压被认为是青光眼的主要危险因素[1-2],降低眼压是预防和治疗青光眼、使眼压维持在可接受范围内的有效方法,而眼压的高低受眼血流量、血压和颅内压等血管因素的影响[3-4]。研究表明,青光眼与包括眼动脉在内的眼球后主要血管的循环异常有关[5-6]。Pinto等[7]研究发现,青光眼患者的眼动脉血流速度在整个心动周期中似乎是变化的。Kocaturk等[8]发现,假剥脱性青光眼患者眼动脉血管阻力增加,眼动脉电阻率指数可用于评估血管治疗药物的效果。因此,在降低眼压的基础上改善包括眼动脉在内的眼球后血管灌注对治疗青光眼具有重要的临床意义。
C57BL/6J小鼠眼动脉与人眼动脉在形态和功能上相似,都起源于颈内动脉。在药物筛选、毒性试验和安全性评价等方面,C57BL/6J小鼠可作为研究眼动脉的理想动物模型。在动物眼动脉的研究中,许多实验需要通过分离眼动脉来评价血管反应性及其机制[9-12]。由于眼动脉为微血管(内径80~150 μm),分离且保持其活性具有一定的困难。眼动脉平滑肌细胞(ophthalmic artery smooth muscle cell,OASMC)可介导眼动脉血管收缩,对维持眼动脉血管弹性及调节血流运动具有重要作用[13],目前尚未见原代小鼠OASMC的分离和培养方法。原代细胞的分离和培养方法主要有组织块贴壁法和酶消化法,前者操作简易、成本较低,但生长周期长,容易受杂细胞影响,且大多数细胞生长在组织块附近;后者可获得纯度较高的细胞,但过程烦琐且成本较高[14-16]。
本课题组前期通过上述2种方法获得了OASMC,但其数量及活性尚不理想,影响后续实验的开展。本研究在传统细胞培养方法的基础上结合酶消化法和组织块贴壁法的优点,优化和完善磁性分离法,将分离得到的C57BL/6J小鼠眼动脉进行细胞原代培养,构建一种原代培养OASMC的新方法,为青光眼等眼动脉相关疾病的药物研发和治疗研究奠定基础。
1 材料和方法 1.1 实验动物5周龄的健康雄性C57BL/6J小鼠20只,购自山西医科大学实验动物中心[动物生产许可证号:SCXK(晋)2019-0004]。饲养条件:光照/黑暗周期为12 h/12 h,环境温度为(24±1)℃,普通饲料和饮用水。本研究动物实验方法符合医学伦理学要求,经山西医科大学动物伦理委员会审批(SYDL2022003)。
1.2 主要仪器和试剂解剖显微镜(苏州神鹰光学有限公司),眼科器械(含眼科镊、眼科剪,南京精弓医疗科技有限公司),二氧化碳培养箱(香港力康生物医疗科技控股有限公司),IX53P1F荧光倒置显微镜(日本Olympus公司),Dynal MPC-1磁力分离器(美国Invitrogen公司)。
M199培养基、FBS(美国Gibco公司),0.25%胰蛋白酶-EDTA、PBS、DAPI溶液(Minibio科技公司),琼脂糖A9539、氧化铁(Ⅱ,Ⅲ)磁性纳米粉末(以下简称铁粉)、胶原蛋白酶Ⅳ(美国Sigma公司),青霉素-链霉素溶液、Triton X-100(北京索莱宝科技有限公司),小鼠抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)多克隆抗体、FITC标记的山羊抗小鼠IgG(北京博奥森生物技术有限公司),山羊血清(北京兰杰柯科技有限公司),多聚甲醛(上海阿拉丁生化科技股份有限公司)。
琼脂糖铁粉混悬液配制:称取一定质量的铁粉和琼脂糖溶解于12 mL普通M199培养基中,煮沸后温度维持在37 ℃。胶原酶溶液配制:称取一定质量的胶原蛋白酶溶解于6 mL普通M199培养基中。
1.3 优化磁性分离法培养原代小鼠OASMC通过优化胶原蛋白酶配方、琼脂糖铁粉配方和铁粉粒径等关键实验环节,经不同组合实验确定最佳的实验条件。
1.3.1 分离小鼠眼动脉C57BL/6J小鼠经戊巴比妥钠(50 mg/kg)腹腔麻醉后,用胶带固定四肢。在无菌条件下,沿腹中线逐层解剖打开胸腹腔,切断肾动脉使血液排出,向小鼠左心室注入5 mL无菌4 ℃ PBS除血至血管透明;立即在同一位置注入琼脂糖铁粉混悬液,至其从肾动脉流出后夹闭肾动脉,继续注射3 mL琼脂糖铁粉混悬液。快速去除小鼠头面部皮肤,沿矢状面将小鼠头部对称分开并去除脑组织,用无菌4 ℃ PBS冲洗2~3次后立即放入凝胶板中,并用固定针固定。在解剖显微镜下,缓慢分离耳部下缘组织,寻找末端游离的颈内动脉,不断剥离周围组织至眼球内部,将供养眼球的血管(富含琼脂糖铁粉混悬液)保留,并留存较少组织以保持血管活性,获得用于细胞培养的眼动脉。
1.3.2 OASMC原代培养将眼动脉转移至超净工作台,在磁力分离器上使含铁血管吸附在靠近磁铁一侧的50 mL灭菌离心管管壁上,用无菌4 ℃ PBS冲洗2~3次后,用刀片将其划至长为1.0~1.5 mm大小的组织块。将组织块转移至37 ℃、5%二氧化碳培养箱中,用过滤除菌的胶原蛋白酶消化45 min。消化完成后,连接磁力分离器去除胶原蛋白酶,用不含FBS的M199培养基清洗2~3次,均匀接种于培养皿中,添加2~3 mL含20% FBS的M199培养基,以覆盖组织块为宜,平稳转移至37 ℃、5%二氧化碳培养箱中静置培养。3 d后全量更换新鲜培养基,其后每隔2~3 d半量换液,培养细胞约7 d传代。
1.3.3 细胞纯化与传代待细胞生长融合至85%~90%时,弃去原培养基,用37 ℃预热的PBS清洗2~3次,加入0.25%胰蛋白酶-EDTA 1.0~1.5 mL室温下消化2~3 min,待镜下观察细胞变圆后立即加入5 mL完全培养基终止消化。反复用培养基冲淋培养皿四周并混匀,获得细胞悬液。将细胞悬液以1∶2的比例传代,将细胞“十”字混匀,均匀铺在培养瓶中,平稳转移至37 ℃、5%二氧化碳培养箱中培养,每隔2~3 d全量换液。
1.3.4 细胞鉴定选取纯化后细胞,经胰酶消化后制备成单细胞混悬液,接种于无菌细胞培养皿,置于37 ℃、5% CO2培养箱中培养。待细胞融合至80%~90%时,弃去原培养基,用PBS反复清洗2~3次,加入4%多聚甲醛溶液室温固定15 min;用PBS清洗2~3次,加入0.2% Triton X-100常温透化15 min。弃去液体后,加入10%山羊血清室温封闭1 h;滴加1∶500稀释的小鼠抗α-SMA多克隆抗体,置于湿盒中4 ℃孵育过夜。次日用PBS冲洗2~3次后,加入1∶500稀释的FITC标记的山羊抗小鼠IgG,室温避光孵育1 h;PBS清洗2~3次后,加入DAPI室温避光孵育10 min染核;PBS清洗后,于荧光倒置显微镜下观察拍照。
1.4 细胞培养效率比较采用组织块贴壁法、酶消化法和优化磁性分离法分离和培养小鼠原代OASMC,通过形态学和免疫荧光染色法比较细胞生长情况和所获细胞的纯度。
2 结果 2.1 磁性分离法的优化条件不同实验条件下细胞培养情况见表 1。确定的最佳实验条件为:胶原蛋白酶与M199培养基比例为0.001 5 g∶6 mL,胶原蛋白酶消化时间为45 min,铁粉粒径为5 μm,琼脂糖与铁粉的质量比为1∶1(0.05 g∶0.05 g);琼脂糖铁粉混悬液的温度为37 ℃,注射器型号为0.6 mm×25 mm TWLB。
|
|
表 1 不同实验条件下细胞培养情况 Tab 1 Cell culture under different experimental conditions |
2.2 小鼠眼动脉的分离过程
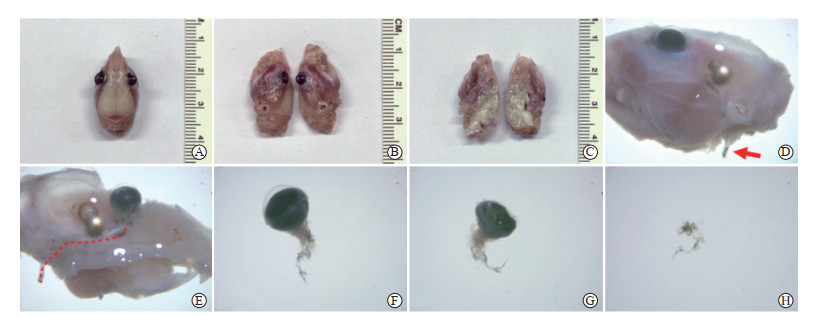
将C57BL/6J小鼠头部暴露后,根据琼脂糖铁粉混悬液所示血管走行,由颈内动脉延伸至眼球截取供养眼球的血管,从而得到眼动脉。见图 1。
|
图 1 C57BL/6J小鼠眼动脉分离 Fig 1 Ophthalmic artery isolation of C57BL/6J mice A: The mouse head; B: The outer side of the mouse head; C: The inner side of the mouse head; D: Internal carotid artery (red arrow); E: Ophthalmic artery is branch of internal carotid artery (red dashed line); F: Free eyeball and ophthalmic artery containing suspension of iron agarose powder; G: Intraocular vascular isolation; H: Ophthalmic artery. |
2.3 小鼠原代OASMC的生长和形态
结合组织块贴壁法和酶消化法的优点,优化完善磁性分离法,本研究成功高效、快速培养出原代小鼠OASMC。将分离得到的眼动脉经磁性分离法处理后培养,2 d后细胞从血管组织边缘爬出并逐渐向外生长延伸,呈放射状分布;5 d后细胞增殖和迁移速度加快,细胞逐渐融合;7 d时细胞生长至85%~90%且呈典型长梭形,可进行传代。见图 2。

|
图 2 C57BL/6J小鼠OASMC原代培养 Fig 2 Primary culture of OASMCs of C57BL/6J mice A: Vascular tissue blocks; B, C: OASMCs; D: OASMCs crawled out around the tissue blocks on day 2; E: The growth of OASMCs accelerated and fused with each other on day 5; F: OASMCs could be prepared for passage on day 7. OASMC: Ophthalmic artery smooth muscle cell. |
2.4 小鼠原代OASMC的鉴定
在荧光倒置显微镜下观察,绿色荧光显示α-SMA表达阳性,蓝色荧光为细胞核,阳性细胞率达98%以上,满足后续眼动脉相关疾病的药物活性筛选的要求。见图 3。

|
图 3 C57BL/6J小鼠原代OASMC免疫荧光鉴定 Fig 3 Immunofluorescence identification of primary OASMCs of C57BL/6J mice A: Nucleus staining; B: α-SMA staining; C: A superimposition of A and B. OASMC: Ophthalmic artery smooth muscle cell; α-SMA: α-smooth muscle actin. |
2.5 3种小鼠原代OASMC培养法的比较
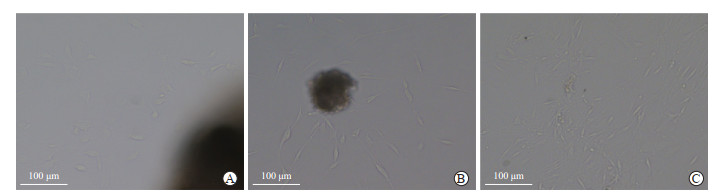
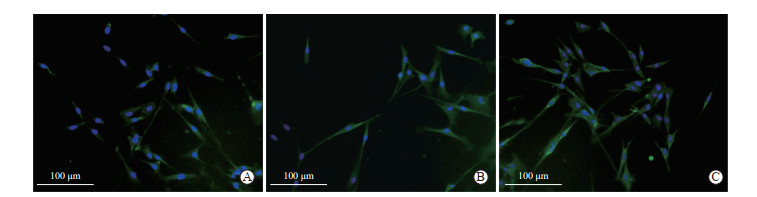
3种方法培养3 d后组织周围均有细胞爬出,但不同方法培养的细胞形态及其生长状态不同。组织块贴壁法:组织块接种3 d后细胞从组织爬出较慢,形态不佳,少见典型长梭形形态,可能为杂质细胞(图 4A),6 d左右出现典型长梭形平滑肌细胞,生长缓慢,约14 d可传代。酶消化法:组织块接种3 d后细胞从组织边缘爬出,形态呈典型长梭形,生长速度介于组织贴壁法和磁性分离法之间(图 4B)。磁性分离法:2 d后可见细胞从组织边缘爬出,细胞形态佳且呈典型长梭形,生长速度较快,3 d时生长情况见图 4C,7 d左右即可传代。α-SMA免疫荧光染色结果显示,磁性分离法培养的原代OASMC纯度最高,酶消化法次之,组织块贴壁法最低(图 5)。
|
图 4 3种方法原代培养第3天C57BL/6J小鼠OASMC的生长状态 Fig 4 Growth state of primary OASMCs of C57BL/6J mice cultured by 3 methods on day 3 A: Tissue block adhesion method; B: Enzyme digestion method; C: Magnetic separation method. OASMC: Ophthalmic artery smooth muscle cell. |
|
图 5 3种方法原代培养第3天C57BL/6J小鼠OASMC的免疫荧光鉴定 Fig 5 Immunofluorescence identification of primary OASMCs of C57BL/6J mice cultured by 3 methods on day 3 A: Tissue block adhesion method; B: Enzyme digestion method; C: Magnetic separation method. OASMC: Ophthalmic artery smooth muscle cell. |
3 讨论
本研究综合组织块贴壁法和酶消化法,通过优化关键实验环节构建了一种培养原代C57BL/6J小鼠OASMC的磁性分离法,该方法具有快速、高效、简便、细胞获得率高等特点。
组织块贴壁法操作简单,但培养周期较长,且组织贴壁率低,细胞获得率低。酶消化法培养效率高,但对细胞有一定毒性,且细胞与酶接触时间较长,死亡率较高[17]。本研究综合以上2种方法,利用胶原蛋白酶有效解离组织块,使细胞能较快爬出,细胞获得率高,且消化过程短,细胞活性较强。廖洪跃等[18]利用组织块结合酶消化法培养婴幼儿血管瘤内皮细胞。Lin等[19]利用免疫磁性分离等快速评估靶向治疗中的肿瘤细胞表面标志物。Liao等[20]通过抗体修饰的具有不同磁敏感性的仿生磁性荧光探针,与模型肿瘤细胞结合从而对其进行分离。蒋蕊等[21]通过磁性分离法培养C57BL/6J小鼠原代肺动脉平滑肌细胞。在此基础上,本研究通过调整胶原蛋白酶、琼脂糖铁粉配方和铁粉粒径等6个实验环节得到最优实验条件:胶原蛋白酶与M199培养基的比例为0.001 5 g∶6 mL,胶原蛋白酶消化时间为45 min,铁粉粒径为5 μm,琼脂糖与铁粉的比例为0.05 g∶0.05 g,琼脂糖铁粉混悬液的温度为37 ℃等。本方法中,琼脂糖铁粉混悬液可进入眼动脉远端血管,为OASMC培养提供理想组织,且由于琼脂糖铁粉混悬液的注入更易辨别供养眼球的血管,使得血管分离速度更快,有利于保持良好的血管活性。此外,经过磁性分离处理能够最大程度保留眼动脉组织,保证后续细胞培养质量。在OASMC培养过程中,琼脂糖铁粉混悬液凝固在眼动脉血管组织中,在磁性分离过程中被吸附在具有磁性的侧壁上,最大程度地减少了眼动脉血管组织的损失,且能有效去除其他杂质,减少细胞培养的影响因素。需要注意的是,在分离含有铁粉的琼脂糖液体的眼动脉时,为保持血管活性需迅速剥离周围组织,同时避免拉扯血管,并且保持在4 ℃ PBS中进行操作。
综上所述,本研究集合了组织块贴壁法和酶消化法的优势,同时弥补了这2种方法的不足,在磁性分离基础上进行条件改良,建立了一种简便、高效、细胞纯度高的方法,成功原代培养出C57BL/6J小鼠OASMC。本研究为眼动脉血管形态和反应性的研究奠定了基础,为相关药物筛选提供了技术支持,对青光眼等眼动脉相关疾病的研究和药物开发具有重要意义。
| [1] |
ACOTT T S, KELLEY M J, KELLER K E, VRANKA J A, ABU-HASSAN D W, LI X, et al. Intraocular pressure homeostasis: maintaining balance in a high-pressure environment[J]. J Ocul Pharmacol Ther, 2014, 30(2/3): 94-101. |
| [2] |
STAMPER R L. A history of intraocular pressure and its measurement[J/OL]. OptomVis Sci, 2011, 88: E16-E28. DOI: 10.1097/OPX.0b013e318205a4e7.
|
| [3] |
LIU J H K, WEINREB R N. Monitoring intraocular pressure for 24 h[J]. Br J Ophthalmol, 2011, 95: 599-600. DOI:10.1136/bjo.2010.199737 |
| [4] |
冉光耀, 孙安琪, 李木, 偰薇, 张虹. POAG患者Schlemm管功能与选择性激光小梁成形术疗效的关系[J]. 中华实验眼科杂志, 2021, 39: 892-897. DOI:10.3760/cma.j.cn115989-20190716-00314 |
| [5] |
PERUMAL N, STRAßBURGER L, HERZOG D P, MÜLLER M B, PFEIFFER N, GRUS F H, et al. Bioenergetic shift and actin cytoskeleton remodelling as acute vascular adaptive mechanisms to angiotensin Ⅱ in murine retina and ophthalmic artery[J/OL]. Redox Biol, 2020, 34: 101597. DOI: 10.1016/j.redox.2020.101597.
|
| [6] |
MODRZEJEWSKA M, GRZESIAK W, ZABORSKI D, MODRZEJEWSKA A. The role of lipid dysregulation and vascular risk factors in glaucomatous retrobulbar circulation[J]. Bosn J Basic Med Sci, 2015, 15: 50-56. |
| [7] |
PINTO L A, VANDEWALLE E, CLERCK E D, MARQUES-NEVES C, STALMANS I. Ophthalmic artery doppler waveform changes associated with increased damage in glaucoma patients[J]. Invest Ophthalmol Vis Sci, 2012, 53: 2448-2453. DOI:10.1167/iovs.11-9388 |
| [8] |
KOCATURK T, ISIKLIGIL I, UZ B, DAYANIR V, DAYANIR Y O. Ophthalmic artery blood flow parameters in pseudoexfoliation glaucoma[J]. Eur J Ophthalmol, 2016, 26: 124-127. DOI:10.5301/ejo.5000671 |
| [9] |
MENTEK M, MORAND J, BALDAZZA M, FAURY G, APTEL F, PEPIN J L, et al. Chronic intermittent hypoxia alters rat ophthalmic artery reactivity through oxidative stress, endothelin and endothelium-derived hyperpolarizing pathways[J]. Invest Ophthalmol Vis Sci, 2018, 59: 5256-5265. DOI:10.1167/iovs.18-25151 |
| [10] |
BLIXT F W, HAANES K A, OHLSSON L, CHRISTIANSEN A T, WARFVINGE K, EDVINSSON L. Increased endothelin-1-mediated vasoconstriction after organ culture in rat and pig ocular arteries can be suppressed with MEK/ERK1/2 inhibitors[J/OL]. Acta Ophthalmol, 2018, 96: e619-e625. DOI: 10.1111/aos.13651.
|
| [11] |
MANICAM C, GINTER N, LI H, XIA N, GOLOBORODKO E, ZADEH J K, et al. Compensatory vasodilator mechanisms in the ophthalmic artery of endothelial nitric oxide synthase gene knockout mice[J/OL]. Sci Rep, 2017, 7: 7111. DOI: 10.1038/s41598-017-07768-7.
|
| [12] |
DELGADO E, MARQUES-NEVES C, ROCHA I, SALES-LUÍS J, SILVA-CARVALHO L. Intrinsic vasomotricity and adrenergic effects in a model of isolated rabbit eye[J]. Acta Ophthalmol, 2009, 87: 443-449. DOI:10.1111/j.1755-3768.2008.01285.x |
| [13] |
HU J, SISIGNANO M, BRECHT R, PERUMAL N, ANGIONI C, BIBLI I S, et al. Cyp2c44 epoxygenase-derived epoxyeicosatrienoic acids in vascular smooth muscle cells elicit vasoconstriction of the murine ophthalmic artery[J/OL]. Sci Rep, 2021, 11: 18764. DOI: 10.1038/s41598-021-98236-w.
|
| [14] |
BRUN P, AKBARALI H I. Culture of neurons and smooth muscle cells from the myenteric plexus of adult mice[J]. Methods Mol Biol, 2018, 1727: 119-125. |
| [15] |
ZHANG C, ZHU L, LIU X, JIANG M, TANG Q, XU F, et al. Establishment of a human meibomian gland carcinoma cell model and analysis of differently expressed genes[J/OL]. Exp Eye Res, 2022, 219: 108983. DOI: 10.1016/j.exer.2022.108983.
|
| [16] |
ZHAO J, OUYANG Q, H UZ, HUANG Q, WU J, WANG R. A protocol for the culture and isolation of murine synovial fibroblasts[J]. Biomed Rep, 2016, 5: 171-175. DOI:10.3892/br.2016.708 |
| [17] |
王佃亮. 脐带间充质干细胞的发现研究及规模化生产——《脐带间充质干细胞》连载之一[J]. 中国生物工程杂志, 2018, 38: 108-112. |
| [18] |
廖洪跃, 邢新, 欧阳天祥, 郭伶俐, 李军辉, 薛春雨, 等. 组织块结合酶消化法培养婴幼儿血管瘤内皮细胞[J]. 第二军医大学学报, 2009, 30: 147-150. LIAO H Y, XING X, OUYANG T X, GUO L L, LI J H, XUE C Y, et al. Explant combined with trypsin-digestion for culture of endothelial cells from infantile hemangiomas[J]. Acad J Sec Mil Med Univ, 2009, 30: 147-150. |
| [19] |
LIN Z, LIN S Y, XIE P, LIN C Y, RATHER G M, BERTINO J R. Rapid assessment of surface markers on cancer cells using immuno-magnetic separation and multi-frequency impedance cytometry for targeted therapy[J/OL]. Sci Rep, 2020, 10: 3015. DOI: 10.1038/s41598-020-57540-7.
|
| [20] |
LIAO Z, HAN L, LI Q, LI L, LIU Y, SONG Y, et al. Gradient magnetic separation and fluorescent imaging-based heterogeneous circulating tumor cell subpopulations assay with biomimetic multifunctional nanoprobesp[J/OL]. Adv Funct Mater, 2021, 31: 2009937. DOI: 10.1002/adfm.202009937.
|
| [21] |
蒋蕊, 曾超, 杜永成, 张爱珍, 施熠炜. 磁性分离法培养小鼠肺动脉平滑肌细胞[J]. 中华生物医学工程杂志, 2016, 22: 384-387. DOI:10.3760/cma.j.issn.1674-1927.2016.05.007 |
 2023, Vol. 44
2023, Vol. 44


