2. 海军军医大学(第二军医大学)第三附属医院生物信号转导实验室, 上海 200438;
3. 海军军医大学(第二军医大学)第一附属医院内分泌科, 上海 200433
2. Laboratory of Biological Signal Transduction, The Third Affiliated Hospital of Naval Medical University(Second Military Medical University), Shanghai 200438, China;
3. Department of Endocrinology, The First Affiliated Hospital of Naval Medical University(Second Military Medical University), Shanghai 200433, China
肝细胞癌(hepatocellular carcinoma,HCC)是世界第六大最常见的恶性肿瘤,也是癌症相关死亡的第二大原因[1]。流行病学研究表明2型糖尿病是肝癌的危险因素[2]。肥胖和高BMI与肿瘤之间的关系较为复杂[3]。肥胖和高BMI与一些肿瘤发生率升高、疾病进展加速和治疗后复发等相关[4]。但有研究表明,高BMI与较低的肺癌发病率和较低的癌症特异性死亡率相关;在接受手术治疗的早期非小细胞肺癌或接受紫杉醇加卡铂化学治疗的晚期患者中,高BMI是预后的独立保护因素[5]。在HCC患者中,有研究表明高BMI影响HCC肝切除术后的并发症发病率[6]。然而,在合并2型糖尿病的肝癌患者中,根治性切除术后生存的影响因素及术前不同BMI患者的临床病理特征尚不清楚。本研究通过对海军军医大学(第二军医大学)第三附属医院140例接受了肝癌根治性切除术的HCC合并2型糖尿病患者的临床资料进行回顾性分析,探究术前BMI与患者预后和临床病理特征的关系。
1 资料和方法 1.1 病例资料回顾性选择2013年1月至2014年12月在海军军医大学(第二军医大学)第三附属医院行肝癌根治性切除术的140例HCC合并2型糖尿病患者。纳入标准:(1)肝癌的首次治疗方式为根治性切除术;(2)术前Child-Pugh评分为A级或B级;(3)术后病理诊断为HCC。排除标准:(1)年龄<18岁;(2)合并门静脉主干及一级分支、总肝管及一级分支、肝静脉主干及下腔静脉癌栓;(3)术前接受过射频消融、经导管动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)或其他抗肿瘤治疗;(4)肝外转移;(5)肝癌破裂出血;(6)同期罹患其他器官恶性肿瘤或其他严重疾病。所有纳入患者病例信息均匿名分析。本研究通过海军军医大学(第二军医大学)第三附属医院伦理委员会审批,患者均同意将诊治期间的临床病例资料用于医学研究。
1.2 观察指标与临床随访收集患者的临床资料,包括性别、年龄、BMI、血红蛋白、血小板计数、空腹血糖、白蛋白、总胆红素、丙氨酸转氨酶、天冬氨酸转氨酶、乙型肝炎表面抗原、HBV DNA水平、肝癌病理类型、肝癌病理分级、肿瘤最大直径、肿瘤数量、肿瘤包膜是否完整、镜下癌栓、肝硬化等。肝癌手术后,患者在第1年每1~3个月随访1次,此后每半年随访1次。无复发生存期为从手术日到肿瘤复发或末次随访的时间,总生存期为从手术日到因任何原因死亡或末次随访的时间。
1.3 统计学处理应用SPSS 25.0软件进行统计学分析。计量资料以x±s表示,两组间比较采用独立样本t检验;计数资料以例数和百分数表示,两组间比较采用χ2检验。使用Kaplan-Meier法评估累积生存率,并使用log-rank检验分析组间生存曲线的差异。采用Cox比例风险回归模型进行单因素和多因素分析。检验水准(α)为0.05。
2 结果 2.1 患者基本特征140例HCC合并2型糖尿病患者中男122例(87.1%)、女18例(12.9%),男女比为6.8∶1。患者的年龄为23~80岁,平均年龄为(58.3±9.57)岁,其中106例(75.7%)患者的年龄>50岁。95例(67.9%)患者有慢性HBV感染,4例(2.9%)患者有慢性丙型肝炎病毒感染,仅23例(16.4%)接受过抗病毒治疗。66例患者(47.1%)伴有肝硬化。
2.2 两组患者临床特征比较患者BMI在术前1周内测定,140例患者的BMI为18.8~31.8 kg/m2,中位数为23.9 kg/m2。94例(67.1%)患者BMI正常(BMI为18.8~24.9 kg/m2),43例(30.7%)患者超重(BMI为25.0~29.9 kg/m2),3例(2.1%)患者轻度肥胖(BMI为30.0~31.8 kg/m2)。将超重和肥胖患者合并为较高BMI(25.0~31.8 kg/m2)组。正常BMI组患者和较高BMI组患者在年龄、性别、实验室检查指标、病理学参数、抗病毒治疗、糖尿病治疗方式、术后预防性TACE治疗等方面差异均无统计学意义(P均>0.05)。见表 1。
|
|
表 1 正常BMI组与较高BMI组HCC合并2型糖尿病患者的一般资料 Tab 1 General data of HCC patients with type 2 diabetes mellitus between normal- and high-BMI groups |
2.3 术前BMI对患者生存期的影响
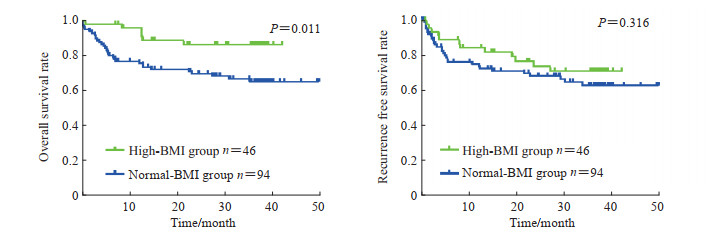
如图 1所示,较高BMI组患者的总生存期长于正常BMI组患者(P=0.011),较高BMI组的3年总生存率为86.0%,而正常BMI组的3年总生存率为64.8%;两组无复发生存期差异无统计学意义(P=0.316)。
|
图 1 HCC合并2型糖尿病患者术后总生存期和无复发生存期的Kaplan-Meier生存曲线 Fig 1 Kaplan-Meier survival curves of overall survival and recurrence free survival of HCC patients with type 2 diabetes mellitus after surgery Normal-BMI group: BMI was 18.8-24.9 kg/m2; High-BMI group: BMI was 25.0-31.8 kg/m2. HCC: Hepatocellular carcinoma; BMI: Body mass index. |
2.4 预后影响因素分析
单因素Cox比例风险回归分析显示,天冬氨酸转氨酶>40 U/L、甲胎蛋白>20 μg/L、最大肿瘤直径>5 cm、包膜不完整是HCC合并2型糖尿病患者根治性切除术后总生存期的危险因素,而较高BMI和术后预防性TACE治疗对患者总生存期有保护作用。进一步多因素Cox比例风险回归分析显示,甲胎蛋白>20 μg/L是HCC合并2型糖尿病患者根治性切除术后总生存期的独立危险因素,较高BMI和术后预防性TACE治疗是患者总生存期的独立保护因素。见表 2。
|
|
表 2 影响HCC合并2型糖尿病患者总生存期的单因素和多因素Cox比例风险回归分析 Tab 2 Univariate and multivariate Cox proportional hazard regression analyses of overall survival in HCC patients with type 2 diabetes mellitus |
3 讨论
代谢综合征尤其是肥胖、糖尿病和血脂异常等与多种实体肿瘤的高发病率联系密切[7]。BMI是评估人体肥胖程度的简捷指标。前瞻性临床试验表明,高BMI(≥25 kg/m2)与癌症发展风险(包括食管癌、结肠癌、胰腺癌、子宫内膜癌、肾癌及绝经后女性乳腺癌等)升高相关[8]。全球大约9%和7%的HCC可分别归因于肥胖和糖尿病[9]。新近一项针对1 430万韩国人的前瞻性队列研究发现,超重和肥胖明显增加了韩国人患HCC的风险[10]。但目前合并2型糖尿病的HCC患者临床预后与患者术前基线BMI的相关性尚不清楚,对合并2型糖尿病的HCC人群尚缺乏体重管理的依据。
糖尿病与HCC均可能引起患者BMI降低,因此,合并2型糖尿病的HCC患者BMI可能较单纯2型糖尿病患者偏低更明显。本研究140例合并2型糖尿病的HCC患者中,仅有30.7%、2.1%的患者BMI分别属于超重和轻度肥胖范畴。与BMI正常的HCC合并2型糖尿病患者相比,较高BMI患者的实验室检查指标、病理指标等临床特征均无显著性差异,表明BMI所反映的术前机体肥胖程度与患者长期形成的肿瘤特征之间并无相关性。因此,本研究着重分析了不同BMI状态对于HCC合并2型糖尿病患者术后预后的影响。
有关BMI与HCC患者预后的报道存在较大争议。来自日本的一项研究报道,肥胖(BMI≥25 kg/m2)对原发性肝癌患者行根治性肝切除术治疗后的结果(包括术后并发症和长期预后)没有不利影响[11]。Liu等[6]的研究则表明,高BMI患者术后并发症发生率、术中输血率、术后住院时间均明显高于正常BMI患者。Tateishi等[12]在非乙型肝炎和丙型肝炎相关HCC中发现BMI为22.1~25 kg/m2的患者预后最好,而BMI过高或过低的患者预后均较差。从本研究的分析结果来看,具有较高BMI的HCC合并2型糖尿病患者总生存期好于正常BMI患者,而两组间无复发生存期差异无统计学意义。此外,较高的BMI是改善患者总生存期的独立保护因素。以上结果提示,对于HCC合并2型糖尿病人群,其术后体重管理的目标可能与其他人群存在差异,尚需进一步的前瞻性研究来获得明确的结论。
BMI增加和生存率提高之间的联系已在多种肿瘤中引起了广泛关注,并被称为“肥胖悖论”。一方面,与高BMI相关的脂肪变性、糖尿病和非酒精性脂肪性肝炎等被证明与肝切除术后并发症的发生率增加有关[13]。这可能与高BMI(肥胖或超重)患者术中通气压力较高,增加肝静脉压力,影响肝静脉流出有关[14]。另一方面,较高BMI的保护作用则可能与患者具有较强的免疫和炎症反应有关。在包括非小细胞肺癌在内的多种恶性肿瘤患者中,均发现高BMI与更好的免疫检查点抑制剂治疗效果相关[15-17]。在本研究合并2型糖尿病的HCC患者中,较高的BMI与患者肝癌切除术后的总生存期改善相关,但患者的无复发生存期并无差异,这进一步表明较高的BMI可能影响了患者对根治性切除术后其他治疗措施的反应性。
由于肥胖或糖尿病本身会影响多种免疫治疗的疗效,而治疗糖尿病的药物也会对多种治疗方法的疗效产生重要影响。本研究结果显示,胰岛素治疗对合并2型糖尿病的HCC患者术后总生存期无显著影响,而口服二甲双胍有改善患者术后总生存期的趋势(P=0.059)。尽管肝癌术后预防性TACE能否提高肝癌患者术后生存尚存在争议,但本研究结果显示在合并2型糖尿病的HCC患者中,术后预防性TACE可显著改善HCC患者总生存期,是独立保护因素。因此,阐明术后预防性TACE改善HCC合并2型糖尿病患者术后生存的具体机制、为合并2型糖尿病的HCC患者制订最佳的治疗干预策略至关重要,亟须开展更深入的临床试验和相关的基础研究。
脂肪组织所参与的炎症反应对机体的免疫功能具有重要调控作用[18]。由于BMI并不能区分肌肉质量和不同部位(如腹部、臀部、内脏等)脂肪组织的分布情况,BMI并非衡量肥胖的最佳指标。此外,肝癌患者肝硬化腹水、水肿等因素也可能对体重产生影响。为排除这些因素的作用,本研究统计了患者白蛋白水平和腹水情况,观察到两组之间差异无统计学意义(未展示数据)。BMI与患者预后之间存在的复杂联系尚需更加系统的研究进一步阐明。
综上所述,在合并2型糖尿病的HCC患者中,BMI较高的患者总生存期更好,其中涉及的影响因素及机制尚需进一步探索。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, LAVERSANNE M, SOERJOMATARAM I, JEMAL A, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71: 209-249. DOI:10.3322/caac.21660 |
| [2] |
ZHANG X, WONG G L, YIP T C, CHEUNG J T K, TSE Y K, HUI V W, et al. Risk of liver-related events by age and diabetes duration in patients with diabetes and nonalcoholic fatty liver disease[J]. Hepatology, 2022, 76: 1409-1422. DOI:10.1002/hep.32476 |
| [3] |
LAIRD B J A, SKIPWORTH R J E. The obesity paradox in cancer: is bigger better?[J]. J Cachexia Sarcopenia Muscle, 2022, 13: 1440-1441. DOI:10.1002/jcsm.13007 |
| [4] |
LENNON H, SPERRIN M, BADRICK E, RENEHAN A G. The obesity paradox in cancer: a review[J/OL]. Curr Oncol Rep, 2016, 18: 56. DOI: 10.1007/s11912-016-0539-4.
|
| [5] |
MOREL H, RAYNARD B, D'ARLHAC M, HAUSS P A, LECUYER E, OLIVIERO G, et al. Prediagnosis weight loss, a stronger factor than BMI, to predict survival in patients with lung cancer[J]. Lung Cancer, 2018, 126: 55-63. DOI:10.1016/j.lungcan.2018.07.005 |
| [6] |
LIU Z P, YAO L Q, DIAO Y K, CHEN Z X, FENG Z H, GU W M, et al. Association of preoperative body mass index with surgical textbook outcomes following hepatectomy for hepatocellular carcinoma: a multicenter study of 1 206 patients[J]. Ann Surg Oncol, 2022, 29: 4278-4286. DOI:10.1245/s10434-022-11721-y |
| [7] |
WANG Y C, MCPHERSON K, MARSH T, GORTMAKER S L, BROWN M. Health and economic burden of the projected obesity trends in the USA and the UK[J]. Lancet, 2011, 378: 815-825. DOI:10.1016/S0140-6736(11)60814-3 |
| [8] |
SCHOEMAKER M J, NICHOLS H B, WRIGHT L B, BROOK M N, JONES M E, O'BRIEN K M, et al. Association of body mass index and age with subsequent breast cancer risk in premenopausal women[J/OL]. JAMA Oncol, 2018, 4: e181771. DOI: 10.1001/jamaoncol.2018.1771.
|
| [9] |
BAECKER A, LIU X, LA VECCHIA C, ZHANG Z F. Worldwide incidence of hepatocellular carcinoma cases attributable to major risk factors[J]. Eur J Cancer Prev, 2018, 27: 205-212. DOI:10.1097/CEJ.0000000000000428 |
| [10] |
JUN B G, KIM M, SHIN H S, YI J J, YI S W. Impact of overweight and obesity on the risk of hepatocellular carcinoma: a prospective cohort study in 14.3 million Koreans[J]. Br J Cancer, 2022, 127: 109-115. DOI:10.1038/s41416-022-01771-0 |
| [11] |
UTSUNOMIYA T, OKAMOTO M, KAMEYAMA T, MATSUYAMA A, YAMAMOTO M, FUJIWARA M, et al. Impact of obesity on the surgical outcome following repeat hepatic resection in Japanese patients with recurrent hepatocellular carcinoma[J]. World J Gastroenterol, 2008, 14: 1553-1558. DOI:10.3748/wjg.14.1553 |
| [12] |
TATEISHI R, OKANOUE T, FUJIWARA N, OKITA K, KIYOSAWA K, OMATA M, et al. Clinical characteristics, treatment, and prognosis of non-B, non-C hepatocellular carcinoma: a large retrospective multicenter cohort study[J]. J Gastroenterol, 2015, 50: 350-360. DOI:10.1007/s00535-014-0973-8 |
| [13] |
MCCORMACK L, PETROWSKY H, JOCHUM W, FURRER K, CLAVIEN P A. Hepatic steatosis is a risk factor for postoperative complications after major hepatectomy: a matched case-control study[J]. Ann Surg, 2007, 245: 923-930. DOI:10.1097/01.sla.0000251747.80025.b7 |
| [14] |
JONES R M, MOULTON C E, HARDY K J. Central venous pressure and its effect on blood loss during liver resection[J]. Br J Surg, 2003, 85: 1058-1060. DOI:10.1046/j.1365-2168.1998.00795.x |
| [15] |
YOU Y F, JIANG C, PENG K W, HE W Z, WANG L, JIN Y N, et al. The predictive value of body mass index on prognosis and adverse events of cancers treated with immunotherapy: a systematic review and meta-analysis[J]. Cancer Immunol Immunother, 2021, 70: 2323-2335. DOI:10.1007/s00262-021-02858-y |
| [16] |
KICHENADASSE G, MINERS J O, MANGONI A A, ROWLAND A, HOPKINS A M, SORICH M J. Association between body mass index and overall survival with immune checkpoint inhibitor therapy for advanced non-small cell lung cancer[J]. JAMA Oncol, 2020, 6: 512-518. DOI:10.1001/jamaoncol.2019.5241 |
| [17] |
LEE J H, HYUNG S, LEE J, CHOI S H. Visceral adiposity and systemic inflammation in the obesity paradox in patients with unresectable or metastatic melanoma undergoing immune checkpoint inhibitor therapy: a retrospective cohort study[J/OL]. J Immunother Cancer, 2022, 10: e005226. DOI: 10.1136/jitc-2022-005226.
|
| [18] |
AZVOLINSKY A. Cancer prognosis: role of BMI and fat tissue[J/OL]. J Natl Cancer Inst, 2014, 106: dju177. DOI: 10.1093/jnci/dju177.
|
 2023, Vol. 44
2023, Vol. 44


