肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌的主要组织学亚型,占原发性肝癌的90%,是全球最常见的癌症之一,也是癌症相关死亡的第三大原因[1]。HCC最常用的生物学标志物是血清甲胎蛋白(α-fetoprotein,AFP)[2],然而AFP在某些特定情形中的使用一直存在争议,特别是在治疗反应监测和诊断方面[3]。建立一种有效且可靠的肝癌诊断方法将在改善肝癌患者预后方面发挥关键作用。
miRNA与肿瘤发生和转移相关[4]。研究表明,HCC和非肿瘤组织中的miRNA表达谱有显著差异。《原发性肝癌诊疗指南(2022年版)》指出,血浆游离miRNA可以作为肝癌早期诊断标志物,特别是对于血清AFP阴性人群[5]。有研究者构建了联合检测7种miRNA(miRNA-122、miRNA-192、miRNA-21、miRNA-223、miRNA-26a、miRNA-27a和miRNA-801)表达的logistic回归模型(7miRNAs),并通过ROC曲线分析得出7miRNAs对于肝癌的早期诊断有较好的临床价值[6]。之后,有生物公司制作了7miRNAs的HCC诊断试剂盒,方便了它在临床中应用。然而,目前尚缺乏临床应用的数据分析,也缺乏与AFP的对比研究。我院尝试将7miRNAs检测试剂盒用于HCC诊断,本研究对血清7miRNAs和AFP进行联合检测,探讨7miRNAs在HCC临床诊断中的应用价值,从而为HCC的诊断提供更多依据。
1 资料和方法 1.1 研究对象选择2021年1月至2021年6月在我院就诊的HCC和非HCC患者为研究对象,对其病例资料进行回顾性分析。HCC组纳入标准:(1)肝穿刺活检或切除术后病理检查诊断为HCC;(2)同期CT或MRI动态增强检查显示肝脏占位性病变在动脉期有快速不均质血管强化,静脉期或延迟期快速消退;(3)乙型肝炎或丙型肝炎相关性肝癌。非HCC组纳入标准:临床诊断或病理诊断为HBV携带者、肝硬化、胆结石、肝囊肿、肝脓肿、肝血管瘤、肝局灶结节增生或其他肿瘤性病变的非HCC患者。排除标准:(1)婴幼儿患者;(2)妊娠期及哺乳期患者;(3)生殖腺胚胎源性肿瘤患者。共纳入符合条件的249例患者,所有患者均有明确的诊断结果。本研究通过我院医学伦理委员会审批。
1.2 研究方法与观察指标所有入组病例均在评估入院后次日空腹采集静脉血,室温静置15~30 min,以3 000 r/min(离心半径为10 cm)离心10 min,分离血清,保存于-20℃冰箱待测。采用骏实生物科技(上海)有限公司生产的7种miRNA检测试剂盒(PCR荧光探针法)于体外半定量检测人血浆中7种miRNA(miRNA-21、miRNA-26a、miRNA-27a、miRNA-122、miRNA-192、miRNA-223、miRNA-801)。首先使用纳米磁珠的特异捕获和qPCR技术完成7种miRNA的量化检测,然后利用logistic回归模型,通过非参数检验对7种miRNA的检测结果进行综合分析得出联合检测结果(7miRNAs)。采用瑞士罗氏公司生产的Cobase601全自动电化学发光免疫分析仪检测AFP水平,所用校准品、质控品、试剂均由瑞士罗氏公司提供。检测过程中严格按照说明书操作,质控品的测定值均在要求范围内。遵从临床工作中的检验标准,分别以7miRNAs≥-0.5和AFP≥20 ng/mL为阳性。联合诊断HCC时,7miRNAs和AFP中任意1个指标阳性即判断为阳性,两者皆为阴性即判断为阴性。
1.3 统计学处理应用SPSS 20.1软件进行统计学分析。呈正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验;呈偏态分布的计量资料以中位数(极差)表示,两组间比较采用Mann-Whitney U检验;计数资料以例数和百分数表示,两组间比较采用χ2检验。以临床诊断结果或病理结果为金标准,计算7miRNAs、AFP及两者联合检测诊断HCC的灵敏度、特异度、阳性预测值、阴性预测值。绘制7miRNAs、AFP及两者联合检测诊断HCC的ROC曲线,计算AUC。在AUC>0.5的情况下,AUC越接近于1说明诊断效果越好。所有检验均为双侧检验,检验水准(α)为0.05。
2 结果 2.1 两组患者基本资料249例患者中HCC组163例,男139例、女24例,年龄为33~87(57.68±10.91)岁;非HCC组86例,男47例、女39例,年龄为20~87(57.33±12.35)岁。两组患者年龄差异无统计学意义(t=0.23,P=0.26);HCC组女性患者比例低于非HCC组,差异有统计学意义(χ2=27.94,P<0.01)。
2.2 两组患者血清7miRNAs和AFP水平HCC组患者的7miRNAs高于非HCC组[-0.18(3.12)vs -0.31(3.01)],差异有统计学意义(U=11 035.50,P<0.01)。HCC组AFP水平高于非HCC组[(398.36±40.17)ng/mL vs(10.62±4.18)ng/mL],差异有统计学意义(t=6.99,P<0.01)。
2.3 血清7miRNAs和AFP在HCC与非HCC患者中的分布HCC患者中123例7miRNAs阳性、40例7miRNAs阴性,93例AFP阳性、70例AFP阴性;非HCC患者中22例7miRNAs阳性、64例7miRNAs阴性,5例AFP阳性、81例AFP阴性。按照联合诊断标准,HCC患者中,有142例联合诊断为阳性,21例联合诊断为阴性;非HCC患者中,有26例联合诊断为阳性,60例联合诊断为阴性。AFP检测阴性的70例HCC患者中49例(70.00%)7miRNAs阳性。
2.4 血清7miRNAs、AFP单独及联合检测对HCC的诊断价值7miRNAs、AFP和两者联合检测的灵敏度分别为75.46%(123/163)、57.06%(93/163)和87.12%(142/163),特异度分别为74.42%(64/86)、94.19%(81/86)和69.77%(60/86),阳性预测值分别为84.83%(123/145)、94.90%(93/98)和84.52%(142/168),阴性预测值分别为61.54%(64/104)、53.64%(81/151)和74.07%(60/81)。
ROC曲线分析(图 1)显示,7miRNAs、AFP单独检测和两者联合检测诊断HCC的AUC分别为0.787、0.819和0.864。结果说明7miRNAs和AFP联合检测的诊断效能最高,7miRNAs对HCC的诊断效能略逊于AFP,但AUC>0.7,对HCC诊断仍有一定的临床价值。
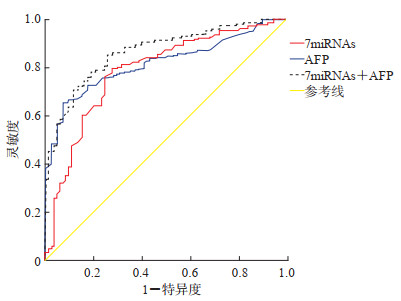
|
图 1 7miRNAs、AFP和两者联合检测诊断肝细胞癌的接受者操作特征曲线 7miRNAs为7种miRNA (miRNA-122、miRNA-192、miRNA-21、miRNA-223、miRNA-26a、miRNA-27a、miRNA-801)联合检测模型.miRNA:微RNA;AFP:甲胎蛋白. |
3 讨论
CT或MRI检查对肝癌的诊断较为准确,但费用相对较高,而肝穿刺活检有创且有一定的手术风险,均不适合HCC的普遍性筛查。血液肿瘤标志物的检测简单、便捷,成为肿瘤筛查的首选方法之一,AFP就是HCC筛查、诊断最重要的肿瘤标志物之一。但是,对于有HCC高危因素的患者,AFP检测的判断效果不够理想,有30%~40%的HCC患者AFP水平正常;同时AFP也可能因非肿瘤相关因素如慢性病毒性肝炎、肝硬化、转移性肝癌等而升高,导致AFP(临界值为20 ng/mL)诊断HCC的灵敏度仅为58%~68%[7-8]。此外,AFP对于小肝癌(直径<5 cm)的诊断特别不灵敏,其在小肝癌中的阳性率仅为25%[9]。AFP单项检测已无法满足HCC的诊断需求[10],因此需要寻找新的血液肿瘤标志物,以提高HCC的诊断效率。
血清中存在大量稳定表达的miRNA[11],研究报道血清miRNA-16、miRNA-122、miRNA-21、miRNA-223、miRNA-25、miRNA-375和let-7f等miRNA在肝癌患者、乙型肝炎患者和健康人中存在差异表达[12-14]。但这些报道都有其局限性,如筛选的miRNA数量有限、样本量小、无法区分HCC和乙型肝炎、缺乏独立验证等。Zhou等[6]的研究报道弥补了以往研究的不足,科学地鉴定了7miRNAs对HCC的诊断准确度。7miRNAs联合诊断HCC的灵敏度和特异度分别为86.1%和76.8%,对AFP阴性HCC的灵敏度和特异度分别为77.7%和84.5%。此外,无论HCC疾病状态如何,7miRNAs的诊断性能均能令人满意(巴塞罗那临床肝癌分期0、A、B和C期的AUC分别为0.888、0.888、0.901和0.881),还可以很好地区分HCC患者与健康人、慢性乙型肝炎患者和肝硬化患者(AUC分别为0.941、0.842、0.884)。
研究表明,AFP和其他肿瘤标志物联合检测对原发性肝癌的检出率常高于AFP单独检测,并且单指标检测对疾病的诊断和鉴别诊断仍存在很大的缺陷,因此联合检测可作为提高诊断效能的重要手段[15]。本研究结果显示,HCC组患者的血清7miRNAs和AFP水平均高于非HCC组患者。在249例患者中,7miRNAs诊断HCC的灵敏度为75.46%,高于AFP(57.06%);7miRNAs的特异度为74.42%,低于AFP(94.19%)。ROC曲线分析显示,7miRNAs和AFP诊断HCC的AUC分别为0.787和0.819,两者联合检测的AUC为0.864,提示2项指标单独和联合分析对HCC的诊断均有一定的临床价值,且两者联合检测的诊断效能更高。
综上所述,血清7miRNAs和AFP联合检测对HCC的诊断效能优于AFP单独检测,对HCC具有更高的诊断价值。
| [1] |
NAULT J C, GALLE P R, MARQUARDT J U. The role of molecular enrichment on future therapies in hepatocellular carcinoma[J]. J Hepatol, 2018, 69: 237-247. DOI:10.1016/j.jhep.2018.02.016 |
| [2] |
FORCE M, PARK G, CHALIKONDA D, ROTH C, COHEN M, HALEGOUA-DEMARZIO D, et al. Alpha-fetoprotein (AFP) and AFP-L3 is most useful in detection of recurrence of hepatocellular carcinoma in patients after tumor ablation and with low AFP level[J/OL]. Viruses, 2022, 14: 775. DOI: 10.3390/v14040775.
|
| [3] |
GALLE P R, FOERSTER F, KUDO M, CHAN S L, LLOVET J M, QIN S K, et al. Biology and significance of alpha-fetoprotein in hepatocellular carcinoma[J]. Liver Int, 2019, 39: 2214-2229. DOI:10.1111/liv.14223 |
| [4] |
GARZON R, FABBRI M, CIMMINO A, CALIN G A, CROCE C M. microRNA expression and function in cancer[J]. Trends Mol Med, 2006, 12: 580-587. DOI:10.1016/j.molmed.2006.10.006 |
| [5] |
国家卫生健康委办公厅. 原发性肝癌诊疗指南(2022年版)[J]. 临床肝胆病杂志, 2022, 38: 288-303. |
| [6] |
ZHOU J, YU L, GAO X, HU J, WANG J P, DAI Z, et al. Plasma microRNA panel to diagnose hepatitis B virus-related hepatocellular carcinoma[J]. J Clin Oncol, 2011, 29: 4781-4788. DOI:10.1200/JCO.2011.38.2697 |
| [7] |
MARRERO J A, FENG Z D, WANG Y H, NGUYEN M H, BEFELER A S, ROBERTS L R, et al. Alpha-fetoprotein, des-gamma carboxyprothrombin, and lectin-bound alpha-fetoprotein in early hepatocellular carcinoma[J]. Gastroenterology, 2009, 137: 110-118. DOI:10.1053/j.gastro.2009.04.005 |
| [8] |
LOK A S, STERLING R K, EVERHART J E, WRIGHT E C, HOEFS J C, DI BISCEGLIE A M, et al. Des-gamma-carboxy prothrombin and alpha-fetoprotein as biomarkers for the early detection of hepatocellular carcinoma[J]. Gastroenterology, 2010, 138: 493-502. DOI:10.1053/j.gastro.2009.10.031 |
| [9] |
孙明辉, 刘龙, 杨瑞萍, 雷旭, 刘艳清, 陈泽芳, 等. 异常凝血酶原联合甲胎蛋白检测在HBV相关肝细胞癌中的诊断价值[J/CD]. 中国肝脏病杂志(电子版), 2018, 10: 1-6.
|
| [10] |
TSUCHIYA N, SAWADA Y, ENDO I, SAITO K, UEMURA Y, NAKATSURA T. Biomarkers for the early diagnosis of hepatocellular carcinoma[J]. World J Gastroenterol, 2015, 21: 10573-10583. DOI:10.3748/wjg.v21.i37.10573 |
| [11] |
MITCHELL P S, PARKIN R K, KROH E M, FRITZ B R, WYMAN S K, POGOSOVA-AGADJANYAN E L, et al. Circulating microRNAs as stable blood-based markers for cancer detection[J]. Proc Natl Acad Sci USA, 2008, 105: 10513-10518. DOI:10.1073/pnas.0804549105 |
| [12] |
LI L M, HU Z B, ZHOU Z X, CHEN X, LIU F Y, ZHANG J F, et al. Serum microRNA profiles serve as novel biomarkers for HBV infection and diagnosis of HBV-positive hepatocarcinoma[J]. Cancer Res, 2010, 70: 9798-9807. DOI:10.1158/0008-5472.CAN-10-1001 |
| [13] |
QU K Z, ZHANG K, LI H R, AFDHAL N H, ALBITAR M. Circulating microRNAs as biomarkers for hepatocellular carcinoma[J]. J Clin Gastroenterol, 2011, 45: 355-360. DOI:10.1097/MCG.0b013e3181f18ac2 |
| [14] |
XU J, WU C, CHE X, WANG L, YU D K, ZHANG T W, et al. Circulating microRNAs, miR-21, miR-122, and miR-223, in patients with hepatocellular carcinoma or chronic hepatitis[J]. Mol Carcinog, 2011, 50: 136-142. DOI:10.1002/mc.20712 |
| [15] |
邹珍珍, 王坤, 何璐, 严敬宇, 高致远. 异常凝血酶原和甲胎蛋白联合检测在原发性肝癌中的临床价值[J]. 检验医学与临床, 2019, 16: 1771-1773. |
 2023, Vol. 44
2023, Vol. 44


