2. 河北大学附属医院急诊医学科, 保定 071000;
3. 华北理工大学附属医院急诊科, 唐山 063000
2. Department of Emergency Medicine, Affiliated Hospital of Hebei University, Baoding 071000, Hebei, China;
3. Department of Emergency, North China University of Science and Technology Affiliated Hospital, Tangshan 063000, Hebei, China
急性一氧化碳中毒(acute carbon monoxide poisoning,ACOP)是最常见的中毒性疾病之一[1],以脑组织损伤为主。急诊科医师往往将神经精神症状的改变和迟发性脑病作为ACOP诊疗的重点,较少关注和深入研究心肌损伤的早期评估,导致患者病情恶化、病死率高。心肌肌钙蛋白(cardiac troponin,cTn)是心肌损伤的传统检测指标,但是其升高出现在心肌损伤4~6 h,且不具有急性心肌梗死后血清标志物变化特点,因此其用于心肌损伤诊断往往会延误治疗,影响预后。ACOP致心肌损伤的发病机制尚无定论,炎症损伤是目前研究较多且较为认可的机制之一[2]。系统性免疫炎症指数(systemic immune-inflammation index,SII)反映了全身免疫炎症反应的状态,其升高是冠心病、慢性心力衰竭患者急性发作期院内死亡的独立危险因素[3-4]。单核细胞与高密度脂蛋白胆固醇比值(monocyte to high density lipoprotein-cholesterol ratio,MHR)与各种心血管病的发生及预后有关,活化的单核细胞可调节机体的炎症细胞因子,高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)可抑制机体氧化应激和炎症反应,是一种新型的机体炎症反应指标[5]。本研究通过观察ACOP早期患者SII和MHR的变化,评估SII和MHR对ACOP并发心肌损伤的早期预测价值。
1 资料和方法 1.1 病例资料选择2020年1月至2022年3月河北医科大学哈励逊国际和平医院急救医学部、河北大学附属医院急诊医学科和华北理工大学附属医院急诊科收治的113例ACOP患者为研究对象,所有患者均给予心电监护、吸氧、高压氧、防治脑水肿、营养脑细胞及对症支持等治疗。纳入标准:(1)ACOP诊断符合《内科学》(第9版)ACOP诊断标准[6];(2)年龄≥18岁;(3)有明确的高浓度一氧化碳(carbon monoxide,CO)吸入史;(4)无其他系统严重疾病。排除标准:(1)入院时即出现新发的心源性休克、心房颤动、阵发性室上性或室性心动过速、房室传导阻滞、心室颤动等主要不良心脏事件;(2)合并急性冠状动脉综合征、先天性心脏病、心肌病、瓣膜性心脏病;(3)有脑血管意外或其他中毒性疾病、血液系统疾病、恶性肿瘤、自身免疫病;(4)入院时合并严重感染;(5)住院时间<12 h。参照《职业性急性化学物中毒性心脏病诊断标准》(GBZ 74-2009)[7],出现如下情况之一即诊断为心肌损伤:(1)心电图出现缺血性或心肌梗死样改变;(2)肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)≥正常参考值上限的2倍;(3)cTnI阳性;(4)出现新发心律失常;(5)心力衰竭或心源性休克;(6)心脏性猝死。根据是否合并心肌损伤将患者分为心肌损伤组(30例)和非心肌损伤组(83例)。本研究符合医学伦理学标准,获得河北医科大学哈励逊国际和平医院伦理委员会审批(2021-1-032)。
1.2 观察指标收集患者的一般资料,主要包括性别、年龄、既往病史、中毒至就诊时间、昏迷时间及病情严重程度;记录入院时患者的心率和平均动脉压。入院时和入院后12 h抽取患者静脉血,使用日本希森美康公司生产的XN2800型全自动血细胞分析仪检测中性粒细胞、淋巴细胞、血小板、单核细胞计数,使用日本日立公司生产的7600型全自动生化分析仪检测HDL-C、CRP、cTnI和CK-MB,并计算SII和MHR:SII=血小板计数(×109/L)×中性粒细胞计数(×109/L)/淋巴细胞计数(×109/L),MHR=单核细胞计数(×109/L)/HDL-C(mmol/L)。
1.3 统计学处理应用SPSS 23.0软件进行统计学分析。呈正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验;计数资料以例数和百分数表示,两组间比较采用χ2检验。采用logistic回归方法分析ACOP患者发生心肌损伤的独立危险因素,通过ROC曲线分析入院时SII、MHR、CRP单独及SII与MHR联合检测对ACOP患者发生心肌损伤的预测价值。检验水准(α)为0.05。
2 结果 2.1 两组患者临床资料的比较113例ACOP患者中男58例、女55例,年龄为18~80岁,平均年龄为(47.1±16.5)岁。心肌损伤组患者的病情严重程度高于非心肌损伤组患者(P<0.001),心肌损伤组与非心肌损伤组患者的年龄、性别、心率、平均动脉压、中毒至就诊时间、昏迷时间、高血压病史、糖尿病史等比较差异均无统计学意义(P均>0.05)。见表 1。
|
|
表 1 两组急性一氧化碳中毒患者临床资料的比较 |
2.2 两组患者不同时刻SII、MHR、CRP、cTnI和CK-MB的比较
入院时心肌损伤组患者的SII、MHR、CRP均高于非心肌损伤组(P均<0.001),入院后12 h心肌损伤组患者的SII、MHR、CRP、cTnI和CK-MB均高于非心肌损伤组(P均<0.001)。见表 2。
|
|
表 2 两组急性一氧化碳中毒患者SII、MHR、CRP、cTnI和CK-MB的比较 |
2.3 ACOP患者心肌损伤的危险因素
以心肌损伤是否发生为因变量,将单因素分析中P<0.05的指标纳入logistic回归模型,校正混杂因素后,结果显示入院时SII、MHR和CRP水平升高是ACOP患者发生心肌损伤的危险因素(OR=7.248,95% CI 2.861~18.358,P<0.001;OR=5.733,95% CI 2.154~15.264,P<0.001;OR=2.496,95% CI 1.124~5.541,P=0.025)。
2.4 ACOP患者入院时SII、MHR、CRP及SII与MHR联合检测对心肌损伤的预测能力ROC曲线分析显示,入院时SII、MHR、CRP及SII与MHR联合检测预测ACOP患者发生心肌损伤的AUC分别为0.812(95% CI 0.726~0.897)、0.837(95% CI 0.764~0.910)、0.720(95% CI 0.608~0.833)、0.876(95% CI 0.811~0.940),灵敏度分别为0.806、0.823、0.667、0.867,特异度分别为0.747、0.783、0.689、0.766。SII、MHR、CRP的临界诊断值分别为2 235.8×109/L、0.44×109/mmol、38.86 mg/L。见图 1。
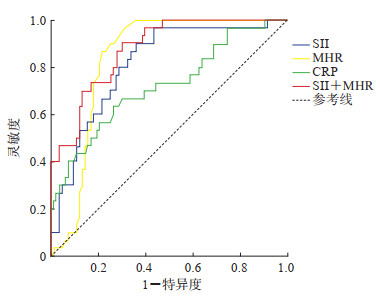
|
图 1 入院时SII、MHR、CRP单独及SII与MHR联合检测预测急性一氧化碳中毒患者心肌损伤的ROC曲线 SII:系统性免疫炎症指数;MHR:单核细胞与高密度脂蛋白胆固醇比值;CRP:C反应蛋白;ROC:接受者操作特征. |
3 讨论
ACOP是常见的缺氧性疾病,CO与体内血红蛋白紧密结合形成碳氧血红蛋白,使血红蛋白失去携氧能力,导致组织缺氧,同时CO可导致氧离曲线向左平移,进一步降低了组织动脉血氧分压,因此碳氧血红蛋白的形成及其导致的组织缺氧被认为是CO中毒的主要机制[2]。心肌对缺氧很敏感,但由于次于脑组织,轻症患者可自觉有胸闷、胸痛、心悸、憋气等症状,而多数心肌损伤患者无自觉症状或因意识障碍不能感受和描述症状,往往被忽视而导致病情延误,错过最佳治疗时机,给患者和家属增加负担。
CO中毒引起心脏损伤的机制主要有以下几个方面:(1)组织供氧减少导致心肌细胞缺氧,同时碳氧血红蛋白影响了氧的释放与传递。(2)多种因素促使炎症级联反应发生,造成血管内皮功能障碍致心脏损伤。(3)CO影响氧的利用,损害线粒体功能,抑制细胞色素氧化酶的活性,阻碍组织细胞对氧的利用,导致缺氧、乳酸酸中毒及细胞凋亡致心肌损伤。(4)由于线粒体功能障碍及脂质过氧化,产生过多的自由基导致内皮损伤;同时CO亦可以与肌红蛋白结合引起氧化应激反应,导致心肌受损。缺氧和炎症级联反应被认为是ACOP心肌损伤的主要机制[8]。CRP作为一种经典的急性炎症反应蛋白,在CO中毒患者中普遍升高,CRP水平与中毒程度及组织的病理损伤程度呈正相关[9]。然而CRP和IL-18等炎症指标因检测过程复杂或价格昂贵等原因未作为入院常规检查项目,特别是在很多基层医院的应用受到较多限制。
SII是近年发现的新型炎症指标,综合了外周血血小板、中性粒细胞、淋巴细胞计数,能更好地反映炎症与免疫之间的平衡。中性粒细胞是炎症过程中抵抗感染的第一道防线;淋巴细胞减少可使自身免疫反应能力降低、免疫调节功能紊乱,容易引起血管内皮细胞功能障碍,导致血小板活化聚集及血栓形成。多项研究表明,SII与急性冠状动脉综合征、ST段抬高和非ST段抬高心肌梗死等多种心血管疾病的不良临床结局相关;较高的SII与冠状动脉疾病患者发生心源性死亡、非致死性心肌梗死或因心力衰竭住院的风险独立相关[10-12]。同时SII是评估宿主全身炎症和免疫应答之间平衡状态的客观标志,比其他炎症生物标志物能更好地反映机体的炎症状态[13]。因此,本研究将SII引入ACOP患者心肌损伤的研究中,探讨其在ACOP患者中的早期变化,结果显示心肌损伤组患者入院时SII高于非心肌损伤组患者,早于cTnI和CK-MB的升高,进一步logistic回归分析显示入院时SII是ACOP患者发生心肌损伤的独立危险因素,表明SII检测有助于早期预测ACOP患者是否发生心肌损伤。此外,ROC曲线分析结果显示SII预测心肌损伤发生的AUC为0.812,灵敏度和特异度分别为0.806、0.747,均优于CRP(分别为0.720、0.667、0.689),提示SII对ACOP患者发生心肌损伤有较高的预测价值。
MHR也是反映炎症和氧化应激的一个新型标志物,它是促炎指标单核细胞计数与抗炎指标HDL-C的比值,是心血管事件的独立预测因子,可作为心血管疾病中炎症反应趋势的指标[14]。单核细胞的激活是炎症过程中非常重要的一步,HDL-C具有抗炎、抗氧化应激和抗血栓形成等作用,还可直接作用于单核细胞预防炎症。MHR结合了损伤机制与保护机制的特性,较单一指标更有优势[15],但MHR与ACOP患者心肌损伤相关性的研究甚少。本研究结果表明,入院时心肌损伤组MHR高于非心肌损伤组,早于cTnI和CK-MB的升高,logistic回归分析显示MHR是ACOP患者发生心肌损伤的危险因素;ROC曲线分析显示,MHR预测心肌损伤发生的AUC、灵敏度和特异度分别为0.837、0.823、0.783,也优于CRP。临床上多采取多指标联合检测以提高诊断效力,本研究中SII和MHR联合预测心肌损伤发生的AUC为0.876,灵敏度和特异度分别为0.867、0.766,与SII和MHR单独检测相比,联合检测诊断价值更高。
ACOP尤其是合并心肌损伤的ACOP患者由于病情危重、变化迅速,其诊断往往需要早期、灵敏度高、数据收集快捷、简单易得的检测指标。SII和MHR的检测可为ACOP患者的诊治提供临床指导,且价格低廉、易于获取,便于在急诊科开展,适用于ACOP后心肌损伤的早期预测及筛查,值得临床推广。今后仍需增加样本量及联合更多中心开展研究,进一步明确SII和MHR在ACOP心肌损伤患者中的应用价值及对治疗效果的评价能力,还需要动态检测以探讨更多时间段SII和MHR的变化,从而更好地指导临床诊治。
| [1] |
王维展, 高珣, 肖青勉, 刘倩, 王璞. 两指标在一氧化碳中毒性心脏病评估中的应用[J]. 中华急诊医学杂志, 2021, 30: 1007-1012. |
| [2] |
李耀宗, 刘思达, 胡潇, 胡光荣. 急性一氧化碳中毒对心脏损伤的研究进展[J]. 临床急诊杂志, 2020, 21: 913-918. |
| [3] |
范文俊, 刘静怡, 史菲, 张爱文, 司月乔, 高秀鑫, 等. 新型炎性指标对冠状动脉疾病的诊断预测价值[J]. 医学研究杂志, 2021, 50: 80-85. |
| [4] |
黎晨辉, 杨少芬, 卢庆莉, 张彤, 苏华. 系统免疫炎症指数与慢性心力衰竭急性发作患者院内死亡的相关性研究[J]. 心肺血管病杂志, 2021, 40: 658-662. |
| [5] |
桑婉玥, 李红建. 单核细胞/高密度脂蛋白胆固醇比值在心血管疾病中的研究进展[J]. 海南医学院学报, 2021, 27: 797-800. |
| [6] |
葛均波, 徐永健, 王辰. 内科学[M]. 9版. 北京: 人民卫生出版社, 2018: 905-907.
|
| [7] |
中华人民共和国卫生部. 职业性急性化学物中毒性心脏病诊断标准: GBZ 74-2009[S]. 北京: 人民卫生出版社, 2009.
|
| [8] |
WEAVER L K. Carbon monoxide poisoning[J]. Undersea Hyperb Med, 2020, 47: 151-169. |
| [9] |
李小梅, 龚洵虎, 王道良. 急性一氧化碳中毒患者C反应蛋白和白细胞水平的变化[J]. 检验医学与临床, 2009, 6: 1262-1263. |
| [10] |
ZHANG Y, LIU W Z, YU H T, CHEN Z, ZHANG C M, TI Y, et al. Value of the systemic immune-inflammatory index (SII) in predicting the prognosis of patients with peripartum cardiomyopathy[J/OL]. Front Cardiovasc Med, 2022, 9: 811079. DOI: 10.3389/fcvm.2022.811079.
|
| [11] |
YANG Y L, WU C H, HSU P F, CHEN S C, HUANG S S, CHAN W L, et al. Systemic immune-inflammation index (SII) predicted clinical outcome in patients with coronary artery disease[J/OL]. Eur J Clin Invest, 2020, 50: e13230. DOI: 10.1111/eci.13230.
|
| [12] |
XU M, CHEN R L, LIU L, LIU X Z, HOU J, LIAO J Q, et al. Systemic immune-inflammation index and incident cardiovascular diseases among middle-aged and elderly Chinese adults: the Dongfeng-Tongji cohort study[J]. Atherosclerosis, 2021, 323: 20-29. |
| [13] |
HUANG H P, LIU Q, ZHU L X, ZHANG Y, LU X J, WU Y W, et al. Prognostic value of preoperative systemic immune-inflammation index in patients with cervical cancer[J/OL]. Sci Rep, 2019, 9: 3284. DOI: 10.1038/s41598-019-39150-0.
|
| [14] |
郝素芝, 来春林. 单核细胞计数/高密度脂蛋白与心血管疾病相关性研究进展[J]. 中国心血管病研究, 2019, 17: 390-394. |
| [15] |
刘晓腾, 张英, 金凤表, 刘慧卿, 李青联, 高宇, 等. GPR、MHR与老年原发性高血压合并不稳定型心绞痛的相关性[J]. 中南大学学报(医学版), 2021, 46: 373-378. |
 2023, Vol. 44
2023, Vol. 44


