早发性卵巢功能不全(premature ovarian insufficiency,POI)是妇科内分泌领域的常见疾病,在一般人群中的发病率为1%~3%,且近年来呈逐渐上升趋势[1]。根据欧洲人类生殖与胚胎学会(European Society for Human Reproduction and Embryology,ESHRE)的标准,当年龄<40岁的女性闭经或月经稀发至少4个月且间隔4周以上检测的2次促卵泡激素(follicle-stimulating hormone,FSH)水平升高(FSH>25 IU/L)可诊断为POI[2]。POI临床表现为女性在40岁之前出现闭经、不孕、性欲下降、潮热等一系列卵巢功能衰竭症状,其激素水平表现为低雌激素和高促性腺激素等[3]。研究发现POI由多种病因及复杂机制引起,包括特发性、遗传性、自身免疫性、医源性及环境性等因素,其中免疫性因素占5%~30%[4],且约20%的POI患者伴随其他自身免疫病,如自身免疫性甲状腺炎、肾上腺自身免疫病、自身免疫性多腺综合征等[5]。
自身免疫性POI与T淋巴细胞调节的细胞免疫异常密切相关[6],而T淋巴细胞亚群失衡是其免疫异常及激素减退症状的主要原因,其中具有免疫抑制功能的调节性T细胞(regulatory T cell,Treg细胞)在促进免疫耐受及维持免疫稳态中起至关重要的作用。研究表明,自身免疫性POI中Treg细胞及其分泌的细胞因子IL-10、TGF-β水平降低[7],提示Treg细胞可能在自身免疫性POI的发生、发展中发挥重要作用。目前Treg细胞疗法被认为是自身免疫病的潜在治疗方法,过继转移CD4+CD25+Treg细胞可部分修复胸腺切除术诱导的POI小鼠的卵巢损伤[8]。但单纯的Treg细胞疗法可能不足以诱导免疫耐受而无法作为单一的治疗剂。基因编辑技术可快速有效地产生遗传改变,从而改善Treg细胞的稳定性及增殖能力,故有必要进一步探索Treg细胞具体的治疗靶点以指导POI的治疗。本课题组发现了1个与Treg细胞免疫抑制功能密切相关的基因,即Pellino-1(Peli1)基因,它是一种免疫耐受中关键的E3泛素化连接酶,在调控细胞坏死、细胞凋亡、免疫细胞的激活与分化等方面发挥着重要作用。此外,Peli1在自身免疫性POI小鼠模型和患者中低表达,其可能与自身免疫性POI的发病有关[9]。
Peli1可介导靶蛋白泛素化,而泛素化是调节Treg细胞活化的重要机制[10]。研究发现,缺失Peli1的小鼠胸腺和外周血中Treg细胞数量减少,TGF-β表达降低,其T淋巴细胞免疫抑制功能减弱[11],这表明Peli1可能通过调控Treg细胞的生物学特性发挥免疫抑制功能,两者在发挥免疫抑制功能方面具有协同作用。透明带3多肽(zona pellucida 3 peptide,pZP3)是卵巢特异性糖蛋白抗原,与卵巢功能改变及卵泡耗竭相关,可导致卵巢自身免疫病。本实验采用pZP3构建自身免疫性POI小鼠模型,考察Peli1是否对自身免疫性POI有调节功能,探讨过继转移过表达Peli1的Treg细胞对自身免疫性POI的卵巢内分泌功能是否具有修复作用及对其免疫功能是否具有调控作用,以期为POI治疗提供更多理论依据。
1 材料和方法 1.1 动物清洁级雌性BALB/c小鼠,7~8周龄,体重18~22 g,购自南方医科大学实验动物中心,实验动物生产许可证号为SCXK(粤)2018-0034。所有动物均在标准条件下饲养,即温度(24±1)℃,湿度45%~55%,光照12 h,自由摄食、饮水。每天早上8:00-9:00进行阴道涂片,实验前均经阴道脱落细胞涂片筛查提示动情周期正常。本研究获得南方医科大学珠江医院实验动物伦理委员会批准(2020A1515010205)。
1.2 试剂及仪器pZP3(中国广州杰特伟生物科技有限公司);小鼠CD3e、CD28抗体(美国eBioscience公司);过表达Peli1的慢病毒(lentiviral,LV)载体(LV-Peli1)、空载对照LV、聚凝胺(苏州吉玛基因股份有限公司);Peli1抗体(英国Abcam公司);小鼠FSH、雌二醇(estradial,E2)、IL-10、TGF-β ELISA检测试剂盒(杭州联科生物技术股份有限公司);Treg细胞分选试剂盒、EasySep缓冲液(德国Miltenyi Biotec公司);荧光倒置显微镜(德国Zeiss公司);β-巯基乙醇(美国Gibco公司);MEM-非必需氨基酸(江苏恩莫阿赛生物技术有限公司);IL-2(美国PeproTech公司);完全弗式佐剂(complete Freund’s adjuvant,CFA)及不完全弗式佐剂(incomplete Freund’s adjuvant,IFA)(美国Sigma公司);柠檬酸盐缓冲液、3% H2O2(山东永进生物科技有限公司);兔源Ki-67多克隆抗体、CD3多克隆抗体及山羊抗兔IgG(江苏碧云天生物技术研究所);Leica DM2500明场正置显微镜和成像系统(德国Lecia公司);TUNEL细胞凋亡检测试剂盒(武汉伊莱瑞特生物科技股份有限公司);DAPI及抗荧光衰减密封剂(北京索莱宝科技有限公司);Ti2-E尼康高内涵荧光显微镜(日本Nikon公司)。
1.3 自身免疫性POI小鼠模型的构建与分组pZP3(氨基酸序列NSSSSQFIHGPR)以1 mg/mL的质量浓度溶解于蒸馏水,经超滤除菌后,将pZP3溶液乳化成等体积的CFA和IFA。在小鼠后足和腹部皮下注射含0.5 mg/mL pZP3的CFA乳剂0.15 mL,2周后在相同部位第2次皮下注射含0.5 mg/mL pZP3的IFA乳剂0.15 mL。第2次免疫开始后每天进行阴道涂片以监测小鼠动情周期的变化,6周后大多数POI小鼠出现动情周期不规则或延长,表明POI小鼠模型建立成功。
将POI模型小鼠分为4组(n=5),分别为LV-Peli1-POI组(过继转移过表达Peli1的Treg细胞)、LV-POI组(过继转移转染慢病毒空载体的Treg细胞)、Treg-POI组(过继转移未经任何处理的Treg细胞)、POI模型组(经尾静脉注射等体积PBS)。
1.4 小鼠脾脏Treg细胞的分选及扩增将小鼠放入清洁的容器内,缓慢注入二氧化碳,以二氧化碳吸入窒息法处死小鼠。在无菌条件下摘取正常小鼠的脾脏,用PBS冲洗,在EasySep缓冲液中研磨制备脾细胞悬液,悬液经小鼠CD4+CD25+ Treg细胞分选试剂盒分选后获得Treg细胞,加入5 µg/mLCD3e抗体、4 µg/mL CD28抗体及100 IU/mL IL-2,于37 ℃孵育培养72 h。
1.5 LV-Peli1转染Treg细胞并过继转移至POI模型小鼠LV- 由苏州吉玛基因股份有限公司采用分子生物学方法完成LV-Peli1的体外构建。Treg细胞接种至24孔板,计算并加入感染复数(multiplicity of infection,MOI)为100的病毒液,再加入4 μg/mL聚凝胺,置于37 ℃培养箱中孵育;24 h后更换为不含病毒液的完全培养基,继续培养;转染96 h后于荧光倒置显微镜下观察荧光蛋白表达情况。根据1.3节分组,将Treg细胞或等体积PBS经尾静脉注射到POI模型小鼠体内。
1.6 H-E 染色观察各组小鼠卵巢结构并进行卵泡计数H- 取小鼠卵巢,用4%多聚甲醛溶液固定24 h后进行石蜡包埋,连续切片,厚度为4 μm;每隔10张片子选取1张,每组选择5张,用H-E法染色后在光学显微镜下观察卵巢结构并进行各级卵泡(始基卵泡、初级卵泡、次级卵泡、成熟卵泡)计数。
1.7 TUNEL 实验检测小鼠卵巢组织颗粒细胞凋亡情况将卵巢组织石蜡切片进行二甲苯脱蜡、梯度乙醇水化,按TUNEL细胞凋亡检测试剂盒说明书操作,首先配制蛋白酶K工作液覆盖各组切片组织进行反应,然后制备末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase,TdT)反应液进行标记及复染。用PBS洗涤3次,用DAPI复染细胞核5 min,然后再用含抗荧光淬灭剂的封片剂进行封片。在荧光显微镜下观察,其中绿色荧光代表阳性染色,为凋亡信号。
1.8 ELISA 法检测小鼠血清FSH、E2、IL-10及TGF-β的表达水平收集各组小鼠血样,900×g离心15 min获取血清,用ELISA检测试剂盒检测血清卵巢激素FSH、E2以及炎症因子IL-10、TGF-β的表达水平,绘制标准曲线。
1.9 免疫组织化学染色检测小鼠卵巢组织增殖蛋白Ki-67表达及CD3+ T淋巴细胞水平经石蜡包埋的卵巢组织切片进行二甲苯脱蜡、浓度梯度乙醇水化和柠檬酸钠缓冲液抗原修复,用3% H2O2阻断内源性过氧化物酶活性,后用5%牛血清白蛋白(bovine serum albumin,BSA)封闭剂进行封闭,兔源Ki-67多克隆抗体和山羊血清按1∶1 000配液后于4 ℃湿盒孵育过夜。加入用山羊血清以1∶500配制的HRP标记的山羊抗兔IgG溶液,37 ℃孵育1 h。现配现用DAB显色液,观察免疫反应及组织着色情况,苏木精复染组织后用中性树胶封片。用Leica DM2500明场正置显微镜和成像系统进行阅片,观察Ki-67表达水平。免疫组织化学染色检测CD3+ T淋巴细胞步骤同前述。
1.10 统计学处理应用SPSS 20.0软件进行统计学分析,GraphPad Prism 8.4软件绘制统计图表。计量资料以x±s表示,多组间比较用单因素方差分析。若方差齐性,组间两两比较采用SNK检验;若方差不齐,组间两两比较采用Dunnett ’s T3检验。检验水准(α)为0.05。
2 结果 2.1 Treg细胞体外扩增、转染情况经Treg细胞分选试剂盒分选获得Treg细胞,光镜下原代Treg细胞呈均质、透亮、小圆形细胞,边缘清晰。扩增培养72 h及LV-Peli1转染96 h后采用荧光倒置显微镜在明视野下观察Treg细胞,其细胞形态无明显变化。暗视野观察Treg细胞蛋白荧光表达情况并计算不同MOI下慢病毒载体转染率,确定最佳MOI为100,转染率为89%。
2.2 过继转移过表达Peli1的Treg细胞可有效修复自身免疫性POI小鼠的卵巢功能 2.2.1 各组卵巢组织结构及各级卵泡计数对各组卵巢组织进行H-E染色,显微镜下观察、比较各组卵巢组织结构并行各级卵泡计数。POI模型组小鼠可见卵巢结构紊乱,体积缩小,总卵泡数量减少;LV-Peli1-POI组小鼠卵巢体积及总卵泡数量(P<0.01)均较POI模型组增加(图 1A、1B);LV-POI组及Treg-POI组情况介于上述两组之间。LV-Peli1-POI组的始基卵泡数、初级卵泡数均较其他3组增加(P<0.05,P<0.01;图 1C、1D),LV-Peli1-POI组的次级卵泡数多于LV-POI组、POI模型组(P<0.05,P<0.01;图 1E),LV-Peli1-POI组的成熟卵泡数多于Treg-POI组和POI模型组(P<0.05,P<0.01;图 1F)。结果表明,过继转移过表达Peli1的Treg细胞可一定程度上促进自身免疫性POI小鼠卵巢结构的恢复。
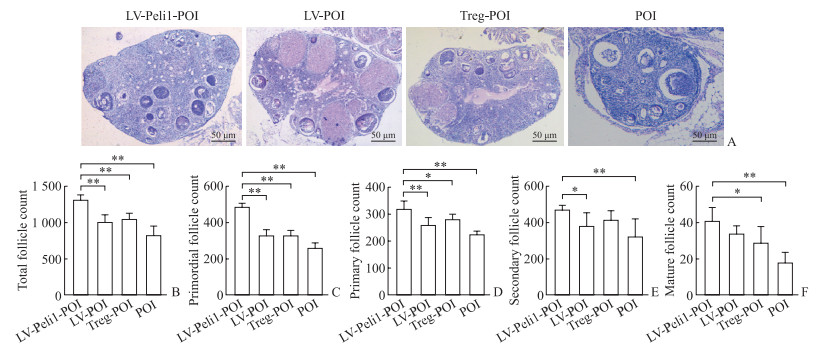
|
图 1 各组小鼠卵巢结构及各级卵泡计数 Fig 1 Ovarian structure and follicle counts at various stages of mice in each group A: Histology images of ovarian tissue sections in each group following hematoxylin-eosin staining; B-F: The counts of follicles per section at various stages in the ovaries. LV-Peli1-POI group: Regulatory T (Treg) cells overexpressing Pellino-1 (Peli1) were adoptively transferred to premature ovarian insufficiency (POI) mice; LV-POI group: Treg cells transfected with empty-vector lentivirus (LV) were adoptively transferred to POI mice; Treg-POI group: Treg cells without any treatment were adoptively transferred to POI mice; POI group: An equal volume of phosphate-buffered saline was injected into POI mice via the tail vein. *P < 0.05, **P < 0.01. n=5, x±s. |
2.2.2 卵巢组织颗粒细胞增殖及凋亡情况
免疫组织化学染色结果显示,与LV-POI组、Treg-POI组和POI模型组比较,LV-Peli1-POI组中Ki-67的表达增加(图 2A)。TUNEL实验结果显示,LV-Peli1-POI组中绿色荧光减少,即颗粒细胞凋亡减少(图 2B)。结果表明,过继转移过表达Peli1的Treg细胞可促进自身免疫性POI小鼠的卵巢颗粒细胞增殖,抑制其凋亡。
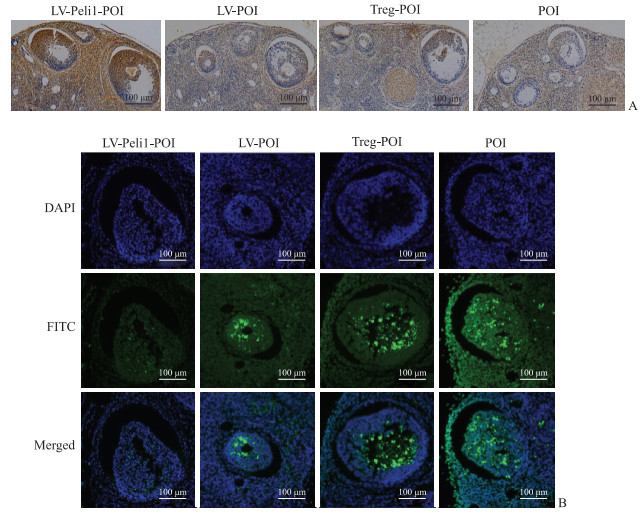
|
图 2 小鼠卵巢组织中颗粒细胞的增殖及凋亡情况 Fig 2 Proliferation and apoptosis of granulosa cells in ovarian tissue of mice A: Immunohistochemical staining of the expression levels of Ki-67 in granulosa cells, expressed by the number and depth of brown granules; B: Terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling analysis of apoptosis levels of ovarian granulosa cells, expressed by the intensity of green fluorescence. LV-Peli1-POI group: Regulatory T (Treg) cells overexpressing Pellino-1 (Peli1) were adoptively transferred to premature ovarian insufficiency (POI) mice; LV-POI group: Treg cells transfected with empty-vector lentivirus (LV) were adoptively transferred to POI mice; Treg-POI group: Treg cells without any treatment were adoptively transferred to POI mice; POI group: An equal volume of phosphate-buffered saline was injected into POI mice via the tail vein. DAPI: 4', 6-diamidino-2-phenylindole; FITC: Fluorescein isothiocyanate. |
2.2.3 ELISA法检测各组小鼠血清中FSH和E2表达水平
ELISA结果显示,LV-Peli1-POI组卵巢激素FSH的表达水平为(4.07±0.87)ng/mL,低于LV-POI组[(7.57±1.76)ng/mL]、Treg-POI组[(6.98±1.34)ng/mL]和POI模型组[(11.33±2.16)ng/mL](P<0.05,P<0.01);LV-Peli1-POI组E2的表达水平为(78.44±9.23) pmol/L,高于LV-POI组[(67.75±5.62)pmol/L]、Treg-POI组[(62.84±6.86)pmol/L]和POI模型组[(47.05±4.09)pmol/L](P<0.05,P<0.01)。结果表明,过继转移过表达Peli1的Treg细胞可改善自身免疫POI小鼠的内分泌功能。
2.3 过继转移过表达Peli1的Treg细胞可抑制自身免疫性POI小鼠的自身免疫性炎症反应 2.3.1 各组小鼠血清IL-10及TGF-β的表达水平ELISA检测结果显示,LV-Peli1-POI组的IL-10表达水平为(0.89±0.09)ng/mL,高于LV-POI组[(0.72±0.04)ng/mL]、Treg-POI组[(0.72±0.05)ng/mL]和POI模型组[(0.61±0.05)ng/mL](P<0.05,P<0.01);LV-Peli1-POI组的TGF-β表达水平为(2.13±0.13)ng/mL,高于LV-POI组[(1.76±0.10)ng/mL]、Treg-POI组[(1.85±0.09)ng/mL]和POI模型组[(1.23±0.14)ng/mL](P均<0.01)。结果表明过继转移过表达Peli1的Treg细胞后小鼠血清中细胞因子IL-10、TGF-β水平也随之增加,从而调控Treg细胞的功能,增强Treg细胞的免疫抑制功能。
2.3.2 各组小鼠卵巢组织中CD3+ T淋巴细胞的水平免疫组织化学染色检测结果显示,与LV-POI组、Treg-POI组和POI模型组相比,LV-Peli1-POI组小鼠卵巢组织中CD3+ T淋巴细胞数量减少,表明POI小鼠自身免疫性卵巢炎症减轻(图 3)。

|
图 3 免疫组织化学染色检测小鼠卵巢组织中CD3+ T淋巴细胞的水平 Fig 3 Levels of CD3+ T lymphocytes in mice ovarian tissue detected by immunohistochemical staining A: Immunohistochemical staining of the expression levels of Ki-67 in granulosa cells, expressed by the number and depth of brown granules; B: Terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling analysis of apoptosis levels of ovarian granulosa cells, expressed by the intensity of green fluorescence. LV-Peli1-POI group: Regulatory T (Treg) cells overexpressing Pellino-1 (Peli1) were adoptively transferred to premature ovarian insufficiency (POI) mice; LV-POI group: Treg cells transfected with empty-vector lentivirus (LV) were adoptively transferred to POI mice; Treg-POI group: Treg cells without any treatment were adoptively transferred to POI mice; POI group: An equal volume of phosphate-buffered saline was injected into POI mice via the tail vein. DAPI: 4', 6-diamidino-2-phenylindole; FITC: Fluorescein isothiocyanate. |
3 讨论
POI最大的危害是会导致育龄妇女丧失生育能力,影响生殖健康。此外,POI还可增加患心血管疾病、自身免疫病、骨质疏松等的风险,并可引发认知功能障碍、情绪障碍、抑郁、焦虑等一系列心理和社会问题[12]。自身免疫性POI的治疗可应用激素替代治疗缓解激素缺乏导致的围绝经期症状,但该疗法无法逆转卵巢结构和功能的损伤,因而不能从根本上解决POI患者的生育问题[13]。免疫治疗可能对于自身免疫性POI有一定效果,但目前尚不成熟,不能逆转疾病的进展,且可能导致库欣综合征、膝关节坏死等一系列严重并发症[14]。目前,辅助生殖技术是解决POI患者生育问题的主要方法,包括体外受精-胚胎移植、卵子捐赠等。然而受多种因素的影响,胚胎移植的成功率并不高,卵子捐赠在我国法律上也不允许,存在伦理学问题。因此,辅助生殖技术也不能从根本上解决POI患者的生育问题,仍需深入探讨自身免疫性POI的具体机制、寻找新的治疗靶点,提高其治疗有效性,改善女性生殖健康。本研究结果发现,过继转移过表达Peli1的Treg细胞可有效促进POI小鼠卵巢组织颗粒细胞增殖并抑制其凋亡,同时改善卵巢内分泌功能和调节免疫功能,从而对自身免疫性POI产生一定的修复及治疗作用。
自身免疫性POI存在细胞免疫及体液免疫反应受损,与自身免疫系统失调有着密切联系,但其发病机制尚未明确。自身免疫攻击的主要靶点是类固醇生成细胞,而自身免疫性POI患者体内可检测出抗卵巢抗体、抗透明带抗体、抗促性腺激素抗体等自身抗体[4]。此外,淋巴细胞性卵巢炎是自身免疫性POI的病理生理学基础之一,免疫组织化学染色主要检测T淋巴细胞浸润,也包括B淋巴细胞、自然杀伤细胞、巨噬细胞和浆细胞等[15]。T淋巴细胞亚群改变和T淋巴细胞介导的损伤可能是自身免疫性POI的发生机制。T淋巴细胞亚群包括细胞毒性T淋巴细胞、Treg细胞及辅助性T细胞等,其中Treg细胞具有免疫抑制功能,能促进人体对自身免疫系统的免疫耐受,在限制过度免疫反应和维持免疫系统稳态的过程中起至关重要的作用[16]。研究发现,Treg细胞免疫抑制功能的丧失会引起效应性T细胞(effector T cell,Teff细胞)对自身抗原的反应增强并异常增殖活化,导致免疫耐受破坏、过度自身免疫应答,引发自身免疫病[17],故Treg细胞与许多自身免疫病的发生、发展相关。
IL-10和TGF-β是Treg细胞发挥免疫抑制功能的主要细胞因子。叉头框蛋白P3(forkhead box protein P3,Foxp3)作为CD4+CD25+Treg细胞的特异性转录因子,可沉默Teff细胞的基因和激活编码免疫抑制功能分子的基因,发挥免疫抑制功能[18]。TGF-β是影响CD4+CD25+Foxp3+Treg细胞发育的关键因素,可激活Smad3信号分子,从而诱导Foxp3表达,进而调节Treg细胞分化、促进Treg细胞增殖及减少凋亡[19]。IL-10既可上调血清中TGF-β水平、促进Treg细胞增殖,还可下调Treg细胞膜上TGF-β表达水平,促进Treg细胞介导的细胞-细胞接触免疫抑制[20]。有研究表明,自身免疫性POI小鼠模型中IL-10、TGF-β表达水平降低[7],提示Treg细胞及其分泌的细胞因子IL-10、TGF-β可能在自身免疫性POI的发生、发展中发挥重要作用。近年来,免疫细胞疗法在自身免疫病中逐渐发挥优势,其中Treg细胞疗法有明确的免疫学治疗原理并在部分研究中得以验证[8],被认为是自身免疫病的潜在疗法。然而,由于体内Treg细胞数量自我调控、Treg细胞分离及扩增方法、细胞最佳治疗剂量及输注方式等多方面因素影响,单纯应用过继性Treg细胞治疗自身免疫性POI的疗效有限,且技术有一定限制,难以应用于临床[21]。因此,本研究从具体发挥作用的基因及蛋白入手,进一步探索Treg细胞的治疗靶点以提高自身免疫性POI的疗效。
Peli1基因位于2号染色体2p13.3区域,长度为3 780 bp,其编码的蛋白质是一种高度保守的环指(RING)类E3泛素化连接酶[22],依赖其C端环域可催化赖氨酸(lysine,Lys)第48个位点及第63个位点形成,从而介导Lys48或Lys63连接的多聚泛素链形成。研究发现,Peli1可介导NF-κB诱导激酶(NF-κB-inducing kinase,NIK)的Lys48泛素化及降解,负向调节非经典NF-κB信号激活以抑制系统性红斑狼疮[23]。Peli1参与调节T淋巴细胞的增殖和活化,可抑制滤泡辅助性T细胞增殖及淋巴细胞的过度活化,与多种自身免疫病(如多发性硬化症、系统性红斑狼疮和类风湿性关节炎等)密切相关[24]。相关研究表明,Peli1可在T淋巴细胞中高度表达,是调控T淋巴细胞内稳态和外周耐受的关键因素[25]。Peli1可介导结节性硬化症复合物1(tuberous sclerosis complex 1,TSC1)泛素化,负性调节雷帕霉素靶蛋白复合物1(mechanistic target of rapamycin complex 1,mTORC1)机制靶点的信号通路活化,抑制T淋巴细胞的糖酵解代谢和抗肿瘤免疫反应,起到免疫抑制的作用[26]。由于Peli1可负性调节T淋巴细胞活化,故Peli1缺失的T淋巴细胞对T淋巴细胞受体(T cell receptor,TCR)-CD28刺激反应过度,能够抑制Treg细胞增殖和抑制性细胞因子TGF-β表达,表现为自身免疫耐受缺失和T淋巴细胞免疫抑制功能减弱,从而导致多种自身免疫病的发生、发展[27]。有研究证明,过继转移Treg细胞疗法能通过多种机制控制自身免疫炎症、调控Teff细胞功能、促进组织修复,有效改善自身免疫病[28],因此过继转移Treg细胞疗法可能在一定程度上缓解小鼠卵巢早衰的发生、发展。本课题组前期通过细胞实验已证实,Peli1能促进自身免疫性POI小鼠脾脏Treg细胞的增殖、抑制凋亡,增强免疫抑制功能[29]。本实验通过分子生物学方法构建LV-Peli1并转染至Treg细胞,将稳定过表达Peli1的Treg细胞过继转移到POI模型小鼠体内,结果表明过继转移过表达Peli1的Treg细胞比单纯Treg细胞具有更加明显的治疗效果,能够更好地修复自身免疫性POI。
本研究结果显示与过继转移慢病毒空载体Treg细胞、未经处理Treg细胞的POI小鼠及单纯POI模型小鼠相比,自身免疫性POI小鼠过继转移过表达Peli1的Treg细胞后可调节卵泡发育,主要表现为总卵泡数及各级卵泡数增加、卵巢体积增大、淋巴细胞浸润减少,说明过表达Peli1可一定程度上促进自身免疫性POI小鼠卵巢结构的修复。卵巢颗粒细胞可调控相关信号通路、合成并分泌雌激素和细胞因子,在调节卵巢功能中起关键作用,卵巢颗粒细胞的凋亡是滤泡闭锁的核心环节[30]。增殖蛋白Ki-67的免疫组织化学染色及TUNEL实验结果表明,过继转移过表达Peli1的Treg细胞可促进卵巢颗粒细胞Ki-67表达、减小细胞凋亡。此外,过表达Peli1可一定程度上恢复POI小鼠的血清激素水平。血清学检查结果显示,LV-Peli1-POI组的FSH水平降低、E2水平升高,表明过继转移过表达Peli1的Treg细胞对卵巢内分泌功能有更好的疗效,也说明Peli1可能通过促进卵巢颗粒细胞功能的恢复调控卵巢内分泌功能。在免疫功能方面,TGF-β在小鼠卵巢血管、卵泡发育和窦卵泡形成中起重要作用,且在窦前卵泡和卵巢颗粒细胞中高表达,可恢复受损的卵巢功能[31]。本实验研究结果也表明过继转移过表达Peli1的Treg细胞干预后,POI小鼠血清炎症抑制因子TGF-β和IL-10的分泌增加,同时卵泡中CD3+T淋巴细胞的数量减少,表明过继转移过表达Peli1的Treg细胞可改变免疫炎症因子的水平,促进Treg细胞的免疫调节功能,缓解自身免疫性卵巢炎症损伤。
综上所述,过继转移过表达Peli1的Treg细胞可改善卵巢结构、促进卵巢颗粒细胞增殖且抑制其凋亡,在一定程度上恢复自身免疫性POI小鼠的卵巢内分泌功能,同时减轻了全身和局部的卵巢免疫性炎症反应,部分修复了自身免疫性POI小鼠的卵巢损伤,表明过表达Peli1后的Treg细胞对于自身免疫性POI的治疗效果显著。这一结果为自身免疫性POI的治疗提供了新思路,为其发病机制的深入探讨提供了新方向,也为POI患者的有效治疗和生育力保护奠定了基础。
| [1] |
CHAE-KIM J J, GAVRILOVA-JORDAN L. Premature ovarian insufficiency: procreative management and preventive strategies[J/OL]. Biomedicines, 2018, 7: 2.
10.3390/biomedicines7010002.
|
| [2] |
European Society for Human Reproduction and Embryology (ESHRE) Guideline Group on POI; WEBBER L, DAVIES M, ANDERSON R, BARTLETT J, BRAAT D, et al. ESHRE guideline: management of women with premature ovarian insufficiency[J]. Hum Reprod, 2016, 31: 926-937. DOI:10.1093/humrep/dew027 |
| [3] |
JIAO X, KE H N, QIN Y Y, CHEN Z J. Molecular genetics of premature ovarian insufficiency[J]. Trends Endocrinol Metab, 2018, 29: 795-807. DOI:10.1016/j.tem.2018.07.002 |
| [4] |
DOMNIZ N, MEIROW D. Premature ovarian insufficiency and autoimmune diseases[J]. Best Pract Res Clin Obstet Gynaecol, 2019, 60: 42-55. DOI:10.1016/j.bpobgyn.2019.07.008 |
| [5] |
KIRSHENBAUM M, ORVIETO R. Premature ovarian insufficiency (POI) and autoimmunity-an update appraisal[J]. J Assist Reprod Genet, 2019, 36: 2207-2215. DOI:10.1007/s10815-019-01572-0 |
| [6] |
KOMOROWSKA B. Autoimmune premature ovarian failure[J]. Prz Menopauzalny, 2016, 15: 210-214. |
| [7] |
蔡慧华. 间充质干细胞诱导调节性T细胞治疗卵巢早衰的实验研究[D]. 广州: 南方医科大学, 2017.
|
| [8] |
DONG Y J, LI H M, LI Y Y, LIU Y G, CHEN H L, XU P P, et al. The role of regulatory T cells in thymectomy-induced autoimmune ovarian disease[J/OL]. Am J Reprod Immunol, 2017, 78(4).
10.1111/aji.12683.
|
| [9] |
LI X R, XIE J X, WANG Q R, CAI H H, XIE C H, FU X F. miR-21 and Pellino-1 expression profiling in autoimmune premature ovarian insufficiency[J/OL]. J Immunol Res, 2020, 2020: 3582648.
10.1155/2020/3582648.
|
| [10] |
OVERACRE-DELGOFFE A E, VIGNALI D A A. Treg fragility: a prerequisite for effective antitumor immunity?[J]. Cancer Immunol Res, 2018, 6: 882-887. DOI:10.1158/2326-6066.CIR-18-0066 |
| [11] |
LIU M, LI S, LI M O. TGF-β control of adaptive immune tolerance: a break from Treg cells[J/OL]. Bioessays, 2018, 40: e1800063.
10.1002/bies.201800063.
|
| [12] |
JANKOWSKA K. Premature ovarian failure[J]. Prz Menopauzalny, 2017, 16: 51-56. |
| [13] |
HICKS B M, KRISTENSEN K B, PEDERSEN S A, HÖLMICH L R, POTTEGÅRD A. Hormone replacement therapy and the risk of melanoma in post-menopausal women[J]. Hum Reprod, 2019, 34: 2418-2429. DOI:10.1093/humrep/dez222 |
| [14] |
SHARIF K, WATAD A, BRIDGEWOOD C, KANDUC D, AMITAL H, SHOENFELD Y. Insights into the autoimmune aspect of premature ovarian insufficiency[J/OL]. Best Pract Res Clin Endocrinol Metab, 2019, 33: 101323.
10.1016/j.beem.2019.101323.
|
| [15] |
SZELIGA A, CALIK-KSEPKA A, MACIEJEWSKA-JESKE M, GRYMOWICZ M, SMOLARCZYK K, KOSTRZAK A, et al. Autoimmune diseases in patients with premature ovarian insufficiency-our current state of knowledge[J/OL]. Int J Mol Sci, 2021, 22: 2594.
10.3390/ijms22052594.
|
| [16] |
G SCHL L, SCHEINECKER C, BONELLI M. Treg cells in autoimmunity: from identification to Treg-based therapies[J]. Semin Immunopathol, 2019, 41: 301-314. DOI:10.1007/s00281-019-00741-8 |
| [17] |
KUMAR P, BHATTACHARYA P, PRABHAKAR B S. A comprehensive review on the role of co-signaling receptors and Treg homeostasis in autoimmunity and tumor immunity[J]. J Autoimmun, 2018, 95: 77-99. DOI:10.1016/j.jaut.2018.08.007 |
| [18] |
LU L, BARBI J, PAN F. The regulation of immune tolerance by FOXP3[J]. Nat Rev Immunol, 2017, 17: 703-717. DOI:10.1038/nri.2017.75 |
| [19] |
ZHAO M D, ZHANG H X, LIU X B, JIANG Y Z, REN L Q, HU X M. The effect of TGF-β on Treg cells in adverse pregnancy outcome upon Toxoplasma gondii infection[J/OL]. Front Microbiol, 2017, 8: 901.
10.3389/fmicb.2017.00901.
|
| [20] |
LI S F, WAN J L, ANDERSON W, SUN H Q, ZHANG H, PENG X B, et al. Downregulation of IL-10 secretion by Treg cells in osteoarthritis is associated with a reduction in Tim-3 expression[J]. Biomed Pharmacother, 2016, 79: 159-165. DOI:10.1016/j.biopha.2016.01.036 |
| [21] |
SELCK C, DOMINGUEZ-VILLAR M. Antigen-specific regulatory T cell therapy in autoimmune diseases and transplantation[J/OL]. Front Immunol, 2021, 12: 661875.
10.3389/fimmu.2021.661875.
|
| [22] |
YU G Q, SONG Y, XIE C W, TAO L Y, WAN F, JIANG L, et al. miR-142a-3p and miR-155-5p reduce methamphetamine-induced inflammation: role of the target protein Peli1[J]. Toxicol Appl Pharmacol, 2019, 370: 145-153. DOI:10.1016/j.taap.2019.03.019 |
| [23] |
LIU J L, HUANG X F, HAO S M, WANG Y, LIU M M, XU J, et al. Peli1 negatively regulates noncanonical NF-κB signaling to restrain systemic lupus erythematosus[J/OL]. Nat Commun, 2018, 9: 1136.
10.1038/s41467-018-03530-3.
|
| [24] |
HUANG X P, PENG J H, PANG J W, TIAN X C, LI X S, WU Y, et al. Peli1 contributions in microglial activation, neuroinflammatory responses and neurological deficits following experimental subarachnoid hemorrhage[J/OL]. Front Mol Neurosci, 2017, 10: 398.
10.3389/fnmol.2017.00398.
|
| [25] |
CHANG M, JIN W, CHANG J H, XIAO Y, BRITTAIN G C, YU J, et al. The ubiquitin ligase Peli1 negatively regulates T cell activation and prevents autoimmunity[J]. Nat Immunol, 2011, 12: 1002-1009. DOI:10.1038/ni.2090 |
| [26] |
KO C J, ZHANG L Y, JIE Z L, ZHU L L, ZHOU X F, XIE X P, et al. The E3 ubiquitin ligase Peli1 regulates the metabolic actions of mTORC1 to suppress antitumor T cell responses[J/OL]. EMBO J, 2021, 40: e104532.
10.15252/embj.2020104532.
|
| [27] |
DAI D F, YUAN J, WANG Y, XU J, MAO C M, XIAO Y C. Peli1 controls the survival of dopaminergic neurons through modulating microglia-mediated neuroinflammation[J/OL]. Sci Rep, 2019, 9: 8034.
10.1038/s41598-019-44573-w.
|
| [27] |
EGGENHUIZEN P J, NG B H, OOI J D. Treg enhancing therapies to treat autoimmune diseases[J/OL]. Int J Mol Sci, 2020, 21: 7015.
10.3390/ijms21197015.
|
| [29] |
杨雨涛, 汪庆如, 李欣然, 王袁, 卓爱萍, 谢嘉欣, 等. Peli1对免疫性早发性卵巢功能不全小鼠调节性T细胞生物学特性的影响[J]. 医学研究生学报, 2022, 35: 1150-1155. |
| [30] |
LIU Z T, LI F H, XUE J W, WANG M M, LAI S C, BAO H C, et al. Esculentoside A rescues granulosa cell apoptosis and folliculogenesis in mice with premature ovarian failure[J]. Aging, 2020, 12: 16951-16962. DOI:10.18632/aging.103609 |
| [31] |
ATRETKHANY K S N, MUFAZALOV I A, DUNST J, KUCHMIY A, GOGOLEVA V S, ANDRUSZEWSKI D, et al. Intrinsic TNFR2 signaling in T regulatory cells provides protection in CNS autoimmunity[J]. Proc Natl Acad Sci USA, 2018, 115: 13051-13056. DOI:10.1073/pnas.1807499115 |
 2023, Vol. 44
2023, Vol. 44


