2. 海军军医大学(第二军医大学)基础医学院细胞生物学教研室, 上海 200433;
3. *Corresponding authors
2. Department of Cell Biology, College of Basic Medical Sciences, Naval Medical University (Second Military Medical University), Shanghai 200433, China
胆管组织是一个复杂的三维网络系统,包括肝内胆管和肝外胆管。胆汁由肝脏分泌,而后经胆管系统的运输储存在胆囊中,最终进入十二指肠消化食物。胆管细胞不仅在运输胆汁方面起着重要作用,也参与调控胆管结构和免疫应答。胆管细胞异常会引发胆道系统疾病,此类疾病兼具高发病率和高死亡率,也是肝移植的主要因素之一。据统计,成年患者中胆管系统疾病导致的肝移植占比约为1/3[1]。此外,胆管并发症也是肝移植失败的主要原因[2]。供体资源的严重匮乏一直是此类疾病治疗面临的一大困境[3-4]。实现胆管细胞的体外扩增,并利用胆管细胞重建和替换病变胆管有望解决这个难题。
肝外胆管组织包括胆囊、囊管、肝管和胆总管等。不同位置的细胞呈现出的特征基因和功能特性有所区别,表现为胆汁酸在不同区域的化学修饰以及肝内胆管、肝外胆管和胆囊之间疾病易感性的变化。有研究表明,胆囊颈部和底部都存在具有前体/干细胞特性的胆管上皮细胞群[5]。胆囊组织可由胆囊切除术获得,在体外实现源于胆囊的胆管细胞培养,可为胆管修复提供候选细胞。胆囊源的上皮细胞在体外较难生长,而日渐成熟的类器官培养模式提供了新的策略[6]。
类器官是在体外生长的干细胞或器官祖细胞,具有自我更新和形成三维结构的能力,有着与细胞起始器官相似的形态和功能[7]。在类器官培养过程中,通过调整多种信号通路能够控制细胞命运。本研究提供了人胆囊类器官的培养方法,证实了胆囊类器官具有胆管上皮细胞特性,且发现在人胆囊类器官培养过程中加入小分子CHIR-99021和blebbistatin能够增强人胆囊类器官的增殖能力。人胆囊类器官培养体系的建立为胆管疾病的治疗与建模提供了新思路。
1 材料和方法 1.1 材料来源人正常胆囊组织来自肝脏移植手术中切除的胆囊,由海军军医大学(第二军医大学)第二附属医院提供。本研究的供体为35岁的女性和52岁的男性各1例,供体组织的使用均通过海军军医大学(第二军医大学)第二附属医院伦理委员会批准。所有供体均通过实验室检查,无肝脏疾病、遗传性疾病以及包括人类免疫缺陷病毒在内的传染性疾病。
基质胶(美国Corning公司,货号354234);牛血清白蛋白(bovine serum albumin,BSA;美国Invitrogen公司,货号15260-037);Advanced DMEM/F12培养基(美国Life Technologies公司,货号12634-010);B27添加剂(无维生素A,50×;美国Life Technologies公司,货号12587-010);N2添加剂(100×,美国Life Technologies公司,货号17502-048);尼克酰胺(美国Sigma-Aldrich公司,货号N0636);N-乙酰半胱氨酸(美国Sigma-Aldrich公司,货号A0737-5MG);重组人R-Spondin-1(美国PeproTech公司,货号120-38);重组人胃泌素(美国Sigma-Aldrich公司,货号G9145);重组人表皮生长因子(epithelial growth factor,EGF;美国PeproTech公司,货号AF-100-15);重组人肝细胞生长因子(hepatocyte growth factor,HGF;美国PeproTech公司,货号100-39);毛喉素(forskolin,FSK;美国Sigma-Aldrich公司,货号66575-29-9);TrypLE酶(TrypLETM Express,美国Gibco公司,货号12604013);糖原合酶激酶3(glycogen synthase kinase 3,GSK 3)抑制剂CHIR-99021[拉度格塞(laduviglusib),美国MedChemExpress公司,货号252917-06-9];非肌球蛋白Ⅱ重链ATP酶抑制剂blebbistatin(美国MedChemExpress公司,货号674289-55-5);Rho激酶抑制剂Y27632(美国Sigma-Aldrich公司,货号Y0503);荧光免疫试剂盒(美国ThermoFisher公司,货号A10170);CD133抗体(货号SAB5701045)、富含亮氨酸重复序列的G蛋白偶联受体5(leucine rich repeat containing G protein coupled receptor 5,LGR5)抗体(货号SAB1302821)、肝细胞核因子1β(hepatocyte nuclear factor 1β,HNF1β)抗体(货号HPA002083)、细胞角蛋白(cytokeratin,CK)7抗体(货号AMAB91530)均购自美国Sigma-Aldrich公司;上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)抗体(英国Abcam公司,货号Ab32392);CK19抗体(美国AbboMax公司,货号A3190);性别决定区Y框9(sex determiningregion Y box 9,SOX9)抗体(美国Millipore公司,货号Ab5355)。
1.2 胆囊类器官的培养 1.2.1 原代培养提前备好高压灭菌过的镊子和剪刀、预冷的PBS和所需培养基,24孔培养板放入细胞培养箱预温30 min以上。用镊子夹取胆囊,用剪刀沿胆囊颈至胆囊底的方向剪开胆囊,用PBS多次清洗胆囊组织。将清洗好的胆囊组织置于新的培养皿中,加入适量基本培养基使组织完全浸没于培养基中,将胆囊平铺开。用镊子夹持手术刀片反复刮取胆囊上皮,使上皮完全脱落,转移至15 mL离心管中,放入离心机内4 ℃下300×g离心5 min。弃去上清,加入适量体积的基质胶,重悬底部沉淀,轻柔吹打混匀,以50 μL/孔的量接种于24孔培养板。将培养板置于细胞培养箱10~15 min,使基质胶固化。加入人原代胆囊类器官培养基,每孔500 μL,每隔2 d换液1次。培养基配方:Advanced DMEM/F12+B27+N2+尼克酰胺+N-乙酰半胱氨酸+R-Spondin-1+重组人胃泌素+EGF+HGF+FSK+Y27632。
1.2.2 传代培养将培养有细胞的培养板置于4 ℃冰箱降温30 min,利用基质胶的温敏特性使基质胶在低温条件下发生解体,以方便收集细胞。取一新的培养板置于细胞培养箱预热30 min。原培养板降温后弃去上清,每3~4孔加入1 mL预冷的PBS,将细胞连同基质胶转移至15 mL离心管中。补足预冷的PBS至15 mL,用吸管轻柔吹打细胞。置于离心机4 ℃下300×g离心5 min。去除上清,再次补足培养基并以相同条件离心。完全弃去上清,加入500 μL TrypLE酶,用吸管吹打混匀后置于37 ℃恒温水浴锅中消化3 min取出,吹打后接着消化3 min。消化完成后用吸管吹打细胞至单细胞状态,完全弃去上清后接种至新的培养板。根据细胞生长状态和密度进行传代。
1.2.3 小分子诱导类器官生长7 d后,换成小分子诱导培养基(配方:人原代胆囊类器官培养基+CHIR-99021+blebbistatin),每孔500 μL,每天换液。
1.2.4 冻存将上述步骤消化后得到的细胞沉淀按照每孔500 μL的体积重悬于细胞冻存液中,并以每管1 mL的量转移至细胞冻存管中,做好标记。将标记好的冻存管放入降温冻存盒中,置于-80 ℃冰箱24 h,然后转移至液氮中长期保存。
1.2.5 复苏取出冻存在液氮中的细胞冻存管,置于37 ℃水浴锅中不断晃动使其融化。将完全解冻的细胞取出置于离心机内,4 ℃下300×g离心5 min。弃去上清,加入适量含有基质胶的培养基重悬细胞沉淀,以50 μL/孔的量接种在预热的24孔培养板中。
1.3 细胞免疫荧光染色胆囊类器官石蜡切片经抗原修复后冷却至室温,用含0.05% Tween-20的PBS(PBST)洗3次。用1% BSA室温孵育20 min,弃去封闭液,加入一抗4 ℃孵育过夜。第2天复温至室温,弃去一抗,PBST洗3次。加入二抗,37 ℃孵育30 min。DAPI染核后封片,置于荧光显微镜下观察。
1.4 细胞增殖实验将5-溴脱氧尿嘧啶核苷(5-bromodeoxyuridinc,BrdU)以1 mg/mL加入类器官培养基,对类器官标记48 h。收取细胞,固定后制作石蜡切片,使用Click-iT细胞缓冲液试剂盒(美国Invitrogen公司)对石蜡切片进行染色,避光室温孵育30 min。用含3% BSA的PBS洗3次。DAPI染核后封片,置于荧光显微镜下观察。
1.5 胆囊类器官成像与形态分析每2 d用倒置显微镜拍摄在6孔板中生长的胆囊类器官1次,每个时间点至少拍摄100张类器官图像。使用ImageJ软件进行图像分析,测量类器官的面积和周长。形状因子的计算公式:形状因子=4πS/L2,式中S为类器官的面积,L为周长。
1.6 统计学处理应用SPSS 17.0和GraphPad Prism 5软件进行统计学分析。计量资料以中位数(下四分位数,上四分位数)表示,两样本间比较采用Wilcoxon秩和检验。检验水准(α)为0.05。
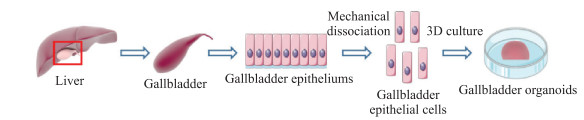
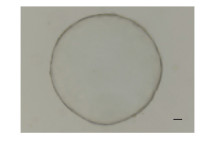
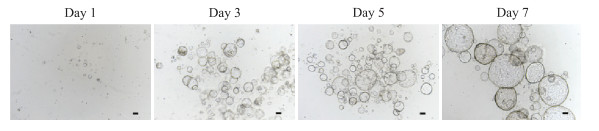
2 结果 2.1 胆囊类器官的形成如图 1所示,利用三维悬浮培养体系对分离的人胆囊细胞进行培养。24 h后能观察到明显的球形结构,并随着时间推移不断扩大,在7 d左右能形成较大的球形克隆,如图 2、3所示。
|
图 1 胆囊类器官的获取示意图 Fig 1 Schematic diagram of acquisition of gallbladder organoids |
|
图 2 胆囊类器官球形结构(标尺=50 μm) Fig 2 Spherical structure of gallbladder organoids (bar = 50 μm) |
|
图 3 胆囊类器官生长过程(标尺=100 μm) Fig 3 Growth process of gallbladder organoids (bar=100 μm) |
在胆囊类器官的制备过程中,平均每7~10 d可以进行传代,传代比例为1∶3~1∶5。在传代时,球状的类器官结构经过消化吹打成单细胞后,可以重新生长扩增出新的球状结构,且冻存后复苏的胆囊类器官依然具有良好的增殖能力。胆囊类器官可以连续传代10代以上,并始终保持稳定的球形结构。以上结果说明胆囊类器官可以在体外实现稳定扩增。
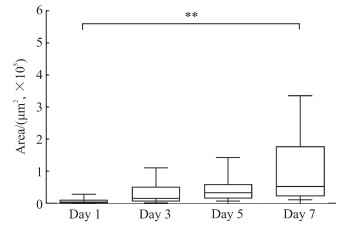
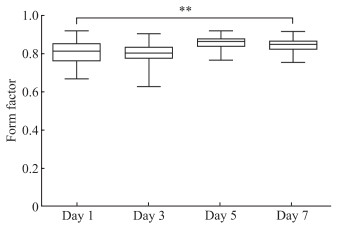
2.2 胆囊类器官的形态学分析如图 4所示,在体外培养过程中,胆囊类器官面积逐渐增大,第7天的类器官面积与第1天比较差异有统计学意义(P<0.01)。如图 5所示,在培养过程中,第7天的类器官形状因子[0.83(0.81,0.85)]与第1天[0.80(0.75,0.84)]比较差异有统计学意义(P<0.01),表明在胆囊类器官前7 d的生长过程中其形态趋于一个完美的圆。
|
图 4 胆囊类器官面积 Fig 4 Area of gallbladder organoids **P < 0.01. n=106, median (lower quartile, upper quartile). |
|
图 5 胆囊类器官形状因子 Fig 5 Form factor of gallbladder organoids **P < 0.01. n=106, median (lower quartile, upper quartile). |
2.3 胆囊类器官具有干性特征
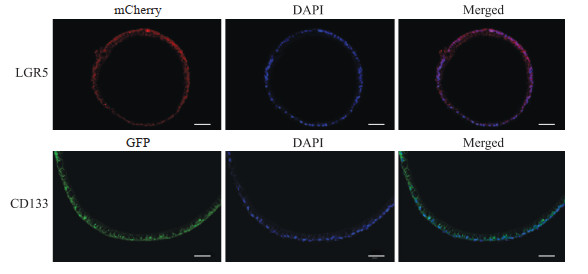
胆囊类器官石蜡切片的免疫荧光染色结果如图 6所示,胆囊类器官表达干细胞相关的表面标志物CD133和LGR5,说明胆囊类器具有干性特征。
|
图 6 胆囊类器官表达干细胞相关的表面标志物 Fig 6 Gallbladder organoids express stem cell surface markers Immunofluorescence staining (bar=50 μm). LGR5: Leucine rich repeat containing G protein coupled receptor 5; DAPI: 4', 6-diamidino-2-phenylindole; GFP: Green fluorescence protein. |
2.4 胆囊类器官具有胆管上皮细胞特性
免疫荧光染色(图 7)结果显示,胆囊类器官表达胆管祖细胞标志物HNF1β。同时,胆囊类器官标本中可以观察到胆管上皮细胞标志物的表达,如EpCAM、CK7、CK19和SOX9。以上结果提示胆囊类器官具备胆管上皮细胞特性,具有分化为成熟胆管细胞的潜能。

|
图 7 胆囊类器官表达胆管祖细胞标志物和胆管上皮细胞标志物 Fig 7 Gallbladder organoids express bile duct progenitor markers and bile duct epithelial cell markers Immunofluorescence staining (bar=50 μm). EpCAM: Epithelial cell adhesion molecule; CK: Cytokeratin; SOX9: Sex determining region Y box 9; HNF1β: Hepatocyte nuclear factor 1β; DAPI: 4', 6-diamidino-2-phenylindole; GFP: Green fluorescence protein. |
2.5 CHIR-99021和blebbistatin诱导胆囊类器官增殖
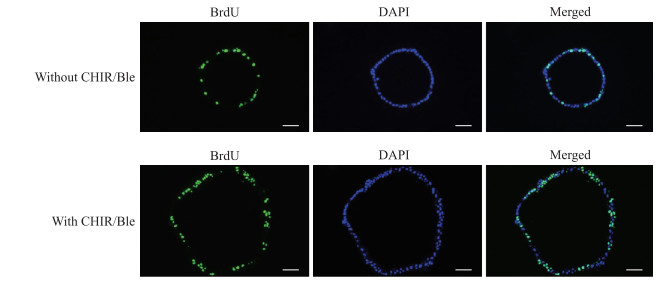
在胆囊类器官培养基中同时添加小分子CHIR-99021和blebbistatin后,BrdU摄入实验结果(图 8)显示,未添加小分子的类器官增殖比例为(21.48±2.06)%,添加小分子后增殖比例提高到(65.19±3.12)%,差异具有统计学意义(P<0.01),表明CHIR-99021和blebbistatin能够增强胆囊类器官增殖能力。
|
图 8 CHIR-99021(CHIR)和blebbistatin(Ble)诱导胆囊类器官增殖 Fig 8 CHIR-99021 (CHIR) and blebbistatin (Ble) induce proliferation of gallbladder organoids Fluorescence staining (bar=50 μm). BrdU: 5-bromodeoxyuridinc; DAPI: 4', 6-diamidino-2-phenylindole. |
3 讨论
类器官具有组织修复的潜力,因为它们保留了来源组织的关键功能和特征。本研究选取人胆囊作为细胞来源培养类器官。胆囊作为浓缩和贮存胆汁的场所,它的摘除不会对机体造成重大的生理影响,且在肝移植手术中胆囊也会被常规摘除丢弃,相较于其他胆管组织,胆囊的获取更为容易且获得的细胞量更大,是类器官的良好研究材料。
本研究的胆囊来源为无肝脏疾病、遗传性疾病和传染性疾病的男性、女性供体各1例,两者都成功培养出了能够稳定传代的胆囊类器官,表明本培养体系可靠。人胆管中的多能细胞主要存在于胆管周围腺体内,但是胆囊中腺体较少,这可能是体外细胞较难扩增的原因。在胆囊颈部和底部的上皮细胞能检测到干性细胞标志物的表达[8],本研究培养所得的胆囊类器官也证明了这群细胞的存在。
在培养胆囊类器官时,本研究参考了肝癌类器官的基本培养基,另外又添加了多种小分子。例如FSK是细胞腺苷酸环化酶的激活剂,可以促进细胞的生长,它也是囊性纤维化跨膜电导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)的激活剂,可以促进细胞分泌。Y27632是一种小分子Rho激酶抑制剂,可以抑制细胞凋亡,使细胞生长状态更好。
对于胆囊类器官形态来说,本研究参考了Huang等[9]分析腺泡类器官和导管类器官的方法。运用图形分析软件批量统计类器官的面积与周长,在生长初期的7 d内类器官面积增长了约20倍。形状因子可用来描述目标边界的复杂程度,其取值范围是(0,1],当取值为1时表示目标是一个完美的圆。通过计算发现类器官在传代后的第1天就接近圆形[形状因子为0.80(0.75,0.84)],并在7 d内逐渐趋于一个完美的圆。此方法还可以用于类器官后续分化中形态变化的分析。
在探究胆囊类器官特性的过程中,已知胆囊和胆管在空间、功能和发育上都具有连续性。胆管上皮由具有不同转录谱的胆管细胞组成,这些转录谱由其局部环境决定[10]。已有研究从肝外胆管上皮分离和培养人原代胆管细胞,由此产生的肝外胆管类器官在转录组学特征和功能特性方面与原代胆管细胞非常相似[11]。无论是在体外还是移植后,胆管区域的类器官都能适应局部环境并表达区域特异性标志物。因此,理论上单一区域的胆囊类器官可能有修复整个胆管的潜能[12]。本实验结果证明胆囊类器官不仅具有干性,而且具有胆管上皮细胞的特性,为胆管修复提供了新的来源。
胆管细胞增殖与维持需要以下信号通路的参与:胆管细胞的分化与维持需要Notch信号通路[13-14];TGF-β信号通路介导胆管细胞特异性和胆管形态发生[15];Hippo信号通路有助于肝再生的导管反应[16-17];蛋白激酶A(protein kinase A,PKA)信号通路通过激活ERK和β-联蛋白促进胆管细胞增殖[18-19]。经过筛选,我们选择了2种小分子CHIR-99021和blebbistatin对类器官进行诱导。CHIR-99021是GSK3抑制剂,能激活经典Wnt信号通路,而blebbistatin是一种非肌球蛋白Ⅱ重链ATP酶抑制剂,用于肝类器官培养[20]。BrdU摄取实验结果证明,在基本培养基中加入CHIR-99021和blebbistatin后胆囊类器官的增殖能力增强。
类器官技术在再生医学中有着巨大的前景,但尚未应用于人类相关疾病的治疗。下一步,我们将探索胆囊类器官在体内的再生与胆管修复潜力,将人胆囊类器官移植到胆管损伤小鼠模型体内,鉴定其是否有修复胆管上皮的能力,为肝脏疾病的细胞治疗提供候选细胞。此外,在胆囊类器官修复损伤、分化为其他成体细胞的过程中可能存在致瘤性、免疫排斥等关键问题,这些还需进一步探索。
综上所述,本研究结果提供了胆囊类器官培养方法并对其特性和增殖能力进行了探究,实现了胆囊类器官的获取与稳定培养,为胆管疾病建模和再生医学的应用提供了新思路。
| [1] |
ENESTVEDT C K, MALIK S, REESE P P, MASKIN A, YOO P S, FAYEK S A, et al. Biliary complications adversely affect patient and graft survival after liver retransplantation[J]. Liver Transplant, 2013, 19: 965-972. DOI:10.1002/lt.23696 |
| [2] |
SKARO A I, JAY C L, BAKER T B, WANG E, PASRICHA S, LYUKSEMBURG V, et al. The impact of ischemic cholangiopathy in liver transplantation using donors after cardiac death: the untold story[J]. Surgery, 2009, 146: 543-553. DOI:10.1016/j.surg.2009.06.052 |
| [3] |
GALLO A, ESQUIVEL C O. Current options for management of biliary atresia[J]. Pediatr Transplant, 2013, 17: 95-98. DOI:10.1111/petr.12040 |
| [4] |
FELDER S I, MENON V G, NISSEN N N, MARGULIES D R, LO S, COLQUHOUN S D. Hepaticojejunostomy using short-limb Roux-en-Y reconstruction[J]. JAMA Surg, 2013, 148: 253-257. DOI:10.1001/jamasurg.2013.601 |
| [5] |
CARPINO G, CARDINALE V, RENZI A, HOV J R, BERLOCO P B, ROSSI M, et al. Activation of biliary tree stem cells within peribiliary glands in primary sclerosing cholangitis[J]. J Hepatol, 2015, 63: 1220-1228. DOI:10.1016/j.jhep.2015.06.018 |
| [6] |
TAKEBE T, WELLS J M. Organoids by design[J]. Science, 2019, 364: 956-959. DOI:10.1126/science.aaw7567 |
| [7] |
LANCASTER M A, KNOBLICH J A. Organogenesis in a dish: modeling development and disease using organoid technologies[J/OL]. Science, 2014, 345: 1247125. DOI: 10.1126/science.1247125.
|
| [8] |
IGARASHI S, SATO Y, REN X S, HARADA K, SASAKI M, NAKANUMA Y. Participation of peribiliary glands in biliary tract pathophysiologies[J]. World J Hepatol, 2013, 5: 425-432. DOI:10.4254/wjh.v5.i8.425 |
| [9] |
HUANG L, DESAI R, CONRAD D N, LEITE N C, AKSHINTHALA D, LIM C M, et al. Commitment and oncogene-induced plasticity of human stem cell-derived pancreatic acinar and ductal organoids[J/OL]. Cell Stem Cell, 2021, 28: 1090-1104. e6. DOI: 10.1016/j.stem.2021.03.022.
|
| [10] |
SINGH V K, KUMAR N, KALSAN M, SAINI A, CHANDRA R. Mechanism of induction: induced pluripotent stem cells (iPSCs)[J]. J Stem Cells, 2015, 10: 43-62. |
| [11] |
LANZONI G, CARDINALE V, CARPINO G. The hepatic, biliary, and pancreatic network of stem/progenitor cell niches in humans: a new reference frame for disease and regeneration[J]. Hepatology, 2016, 64: 277-286. DOI:10.1002/hep.28326 |
| [12] |
SAMPAZIOTIS F, MURARO D, TYSOE O C, SAWIAK S, BEACH T E, GODFREY E M, et al. Cholangiocyte organoids can repair bile ducts after transplantation in the human liver[J]. Science, 2021, 371: 839-846. DOI:10.1126/science.aaz6964 |
| [13] |
TCHORZ J S, KINTER J, MÜLLER M, TORNILLO L, HEIM M H, BETTLER B. Notch2 signaling promotes biliary epithelial cell fate specification and tubulogenesis during bile duct development in mice[J]. Hepatology, 2009, 50: 871-879. DOI:10.1002/hep.23048 |
| [14] |
ZONG Y W, PANIKKAR A, XU J, ANTONIOU A, RAYNAUD P, LEMAIGRE F, et al. Notch signaling controls liver development by regulating biliary differentiation[J]. Development, 2009, 136: 1727-1739. DOI:10.1242/dev.029140 |
| [15] |
SCHAUB J R, HUPPERT K A, KURIAL S N T, HSU B Y, CAST A E, DONNELLY B, et al. De novo formation of the biliary system by TGFβ-mediated hepatocyte transdifferentiation[J]. Nature, 2018, 557: 247-251. DOI:10.1038/s41586-018-0075-5 |
| [16] |
PLANAS-PAZ L, SUN T L, PIKIOLEK M, COCHRAN N R, BERGLING S, ORSINI V, et al. YAP, but not RSPO-LGR4/5, signaling in biliary epithelial cells promotes a ductular reaction in response to liver injury[J/OL]. Cell Stem Cell, 2019, 25: 39-53. e10. DOI: 10.1016/j.stem.2019.04.005.
|
| [17] |
PEPE-MOONEY B J, DILL M T, ALEMANY A, ORDOVAS-MONTANES J, MATSUSHITA Y, RAO A, et al. Single-cell analysis of the liver epithelium reveals dynamic heterogeneity and an essential role for YAP in homeostasis and regeneration[J/OL]. Cell Stem Cell, 2019, 25: 23-38. e8. DOI: 10.1016/j.stem.2019.04.004.
|
| [18] |
FANTI M, SINGH S, LEDDA-COLUMBANO G M, COLUMBANO A, MONGA S P. Tri-iodothyronine induces hepatocyte proliferation by protein kinase A-dependent β-catenin activation in rodents[J]. Hepatology, 2014, 59: 2309-2320. DOI:10.1002/hep.26775 |
| [19] |
FRANCIS H, GLASER S, UENO Y, LESAGE G, MARUCCI L, BENEDETTI A, et al. cAMP stimulates the secretory and proliferative capacity of the rat intrahepatic biliary epithelium through changes in the PKA/Src/MEK/ERK1/2 pathway[J]. J Hepatol, 2004, 41: 528-537. DOI:10.1016/j.jhep.2004.06.009 |
| [20] |
WANG X, NI C, JIANG N, WEI J S, LIANG J Q, ZHAO B, et al. Generation of liver bipotential organoids with a small-molecule cocktail[J]. J Mol Cell Biol, 2020, 12: 618-629. DOI:10.1093/jmcb/mjaa010 |
 2023, Vol. 44
2023, Vol. 44


