2. 温州医科大学口腔医学院, 温州 325027
2. School of Stomatology, Wenzhou Medical University, Wenzhou 325027, Zhejiang, China
锌指和BTB结构域蛋白20(zinc finger and BTB domain containing 20,ZBTB20)又称树突细胞来源的POZ锌指蛋白(dendritic cell-derived POZ zinc finger protein,DPZF),是转录因子家族成员,在各个组织器官广泛表达。其氨基端为BTB/POZ结构域,可介导蛋白间的相互作用;羧基端有5个C2H2锌指结构域,可介导DNA的结合。该基因在种属间高度保守,主要有2个转录本,分别编码741个氨基酸的长型异构体或668个氨基酸的短型异构体。短型异构体在氨基端缺少73个氨基酸,羧基端与长型异构体相同[1]。ZBTB20在个体发育[2]、物质代谢[3-5]、神经分化调控[6-9]和免疫应答[10]等方面有重要的生理功能。有文献报道,人类ZBTB20基因突变可导致Primrose综合征,该疾病有智力低下、特殊面部特征、骨骼异常、进行性肌无力、听觉丧失、成年后糖尿病等症状[11-12],进一步证明了ZBTB20在个体发育和代谢中的重要作用。为进一步研究ZBTB20的生物学功能及作用机制,本研究制备了靶向人和小鼠ZBTB20基因的干扰腺病毒,并分别在Huh7细胞和小鼠体内验证其干扰效率,为研究ZBTB20生物学功能提供有效手段。
1 材料和方法 1.1 主要试剂干扰腺病毒穿梭质粒pShuttle-U6-GFP购自美国Vigene Biosciences公司;转染有pAdEasy-1腺病毒骨架质粒的大肠杆菌BJ5183由海军军医大学(第二军医大学)基础医学院病理生理学教研室自行构建保种,对照干扰腺病毒Ad-U6-GFP购自和元生物技术(上海)股份有限公司。HEK-293细胞购自美国模式培养物集存库,Huh7细胞购自中国科学院细胞库/干细胞库;高糖DMEM细胞培养基、FBS、生理盐水购自美国Hyclone公司;转染试剂Lipofectamine 3000购自美国Gibco BRL公司;限制性内切酶和T4 DNA连接酶购自日本TaKaRa公司、质粒抽提试剂盒购自美国Omega公司;DNA凝胶回收试剂盒购自美国Axygen公司;双萤光素酶检测试剂盒购自美国Promega公司;ZBTB20单克隆抗体9A10为海军军医大学(第二军医大学)基础医学院病理生理学教研室自行制备[6],β-肌动蛋白抗体购自美国Proteintech公司。人、鼠通用ZBTB20基因干扰引物(ZBTB20 shRNA)由上海杰李生物技术有限公司合成,靶向序列为5'-GCATGTGTCTGACGGATAA-3'。
1.2 pAd-shZBTB20重组腺病毒载体的构建ZBTB20干扰腺病毒穿梭质粒的构建:合成靶向干扰ZBTB20的2条5'端分别带有BamHⅠ或HindⅢ酶切位点的互补寡核苷酸片段,退火形成双链后与经BamHⅠ和HindⅢ双酶切的pShuttle-U6-GFP穿梭质粒连接。将连接产物转化进TOP10感受态细胞,37 ℃培养过夜后挑菌抽提质粒,将测序验证正确的质粒命名为pShuttle-shZBTB20。
ZBTB20干扰腺病毒质粒的构建:pShuttle-shZBTB20A穿梭质粒用PmeⅠ酶切充分线性化,再用小牛肠碱性磷酸酶(calf intestine alkaline phosphatase,CIAP)去磷酸化,经琼脂糖凝胶回收后溶于20 μL去离子水中。将回收的线性化质粒1 µL(100 ng/µL)转化含有腺病毒载体(pAdEasy-1质粒)的感受态细胞BJ5183,涂于卡那霉素抗性的LB平板,置于37 ℃培养箱内培养16~20 h。挑菌提取质粒,选择30 kb左右的质粒转化感受态细胞TOP10,再涂板挑菌抽提质粒,PacⅠ酶切鉴定,重组成功的ZBTB20干扰腺病毒质粒命名为pAd-shZBTB20。
1.3 ZBTB20干扰腺病毒的包装、扩增、浓缩纯化及滴度测定包装:取10 μg pAd-shZBTB20重组质粒用PacⅠ充分酶切线性化,经50%异丙醇沉淀及75%乙醇洗涤沉淀后,溶于无菌双蒸水中,利用脂质体转染HEK-293细胞。致细胞病变效应(cytopathic effect,CPE)达到70%,收集细胞,于干冰和37 ℃水浴反复冻融3次以释放出病毒。所得的重组病毒命名为Ad-shZBTB20。
扩增和纯化:腺病毒Ad-shZBTB20在HEK-293细胞中大量扩增后得到总量约1×1012 IU/mL的病毒颗粒,加入0.5倍体积的20% 聚乙二醇8000/2.5 mol/L NaCl溶液沉淀48 h以富集病毒。500×g 4 ℃离心15 min得到病毒沉淀,重悬于PBS中,用CsCl粉末调整比重为1.34~1.36 g/mL,转移至12 mL薄壁超速离心管,并覆盖以1 mL石蜡油,10 ℃ 176 000×g超速离心20 h后可见白垩色条带,即为浓缩的病毒。用2 mL注射器从侧壁穿刺吸出约1 mL浓缩的病毒并过柱纯化。
滴度测定:(1)利用比色皿检测260 nm处光密度(D260),根据D260=1相当于1.1×1012/mL计算病毒颗粒数。(2)利用半数组织培养物感染量(tissue culture infectious dose 50,TCID50)检测腺病毒滴度。于96孔板中接种HEK-293细胞(含2% 胎牛血清的DMEM培养基),密度为每孔2×104/100 µL。梯度稀释法配制10-6~10-13/mL的病毒感染液,每孔100 µL,每个稀释度设10个复孔;另设不加病毒的阴性对照。置于5% CO2、37 ℃培养10 d,显微镜下观察每个稀释度细胞出现CPE的情况,发生CPE即为阳性。按下列公式计算滴度(T):T=101+d(S-0.5)IU/mL, 其中d为稀释倍数的常用对数,S为从第1个稀释度起的阳性比率之和。
1.4 腺病毒的离体和在体感染离体感染:接种人肝癌细胞株Huh7于6孔板,密度为2.5×1012/孔。培养过夜后更换为含腺病毒Ad-shZBTB20或对照腺病毒Ad-Con的无血清DMEM培养基,总体积为1.5 mL。腺病毒感染复数(multiplicity of infection,MOI)为50和100,即病毒数∶细胞数=50∶1或100∶1。用含腺病毒培养基孵育8 h后,更换为含10% FBS的完全培养基继续培养72~96 h,收获细胞进行mRNA和蛋白检测。
在体感染:以4个月龄的C57BL/6小鼠[购自江苏集萃药康生物科技股份有限公司,动物生产许可证号:SCXK(苏)2018-0008]为模型,经尾静脉注射1×1010 VG/只重组腺病毒或对照腺病毒,以PBS稀释,注射总体积为200 µL。7 d后麻醉处死小鼠,取肝脏组织液氮速冻后保存于-80 ℃,以备mRNA和蛋白检测。
1.5 qPCR使用美国Applied Biosystems公司的PowerUPTM SYBR Green Master Mix试剂进行qPCR检测。反应体系包含SYBR Green Master Mix 5 μL、cDNA模板10 ng、正向和反向引物(10 pmol/μL)各0.5 μL,双蒸水补足10 μL。扩增条件为95 ℃ 5 min;95 ℃ 15 s,59 ℃ 30 s,72 ℃ 30 s,40个循环。采用2-ΔΔCt法计算目的基因的相对表达量。ZBTB20正向引物5'-GCAGC-CGGCAGCCCCTTCTTC-3',反向引物5'-CGCTC-GCCGCTGCCATTCTG-3';甲胎蛋白正向引物5'-TCTGCTGGCACGCAAGAAG-3',反向引物5'-TC-GGCAGGTTCTGGAAACTG-3'。内参基因GAPDH正向引物5'-AGCAGTCCCGTACACTGGCAAAC-3',反向引物5'-TCTGTGGTGATGTAAATGTCCT-CT-3'。
1.6 蛋白质印迹法细胞蛋白样品:人肝癌Huh7细胞感染Ad-shZBTB20腺病毒和对照干扰腺病毒72 h或96 h后,用预冷的PBS清洗2次,加入300 μL蛋白裂解缓冲液(50 mmol/L Tris-HCl、1 mmol/L EDTA、150 mmol/L NaCl、1% Triton X-100、1 mg/L抑蛋白酶肽aprotinin及100 mg/L PMSF制备蛋白样品。
组织蛋白样品:称量50 mg液氮冻存的肝脏组织,加入0.5 mL RIPA蛋白裂解液,冰上匀浆后常规制备蛋白样品。样品经10% SDS-PAGE后转膜,用5%脱脂奶粉封闭1 h后与ZBTB20单克隆抗体9A10(5%脱脂奶粉1∶2 000稀释)4 ℃孵育过夜,次日用HRP标记的抗小鼠β-肌动蛋白二抗(5%脱脂奶粉1∶5 000稀释)室温孵育1 h,TBST洗膜后用ECL检测蛋白表达水平。
1.7 统计学处理应用GraphPad Prism 9.0软件进行数据分析并制图。数据以x±s表示,采用独立样本t检验比较组间的差异。检验水准(α)为0.05。
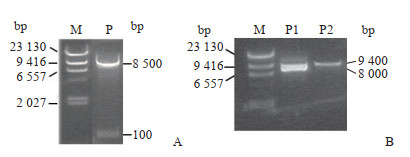
2 结果 2.1 干扰腺病毒载体pAd-shZBTB20的构建和鉴定将ZBTB20干扰序列退火后与经BamHⅠ和HindⅢ双酶切后的穿梭质粒pShuttle-U6-GFP连接,得到重组穿梭质粒pShuttle-shZBTB20。重组穿梭质粒经BamHⅠ和HindⅢ双酶切验证确有干扰片段插入(图 1A),再经测序验证重组穿梭载体构建成功。将重组穿梭质粒经PmeⅠ酶切线性化(图 1B),回收线性化片段用电穿孔法转染进含有腺病毒基因骨架质粒pAdEasy-1的细菌BJ5183,进行同源重组以获得重组腺病毒质粒。挑选阳性菌落,质粒抽提后经PacⅠ酶切鉴定,可见30 kb和4.5 kb条带(图 2),提示重组腺病毒质粒pAd-shZBTB20构建成功。
|
图 1 穿梭质粒pShuttle-shZBTB20的酶切鉴定 Fig 1 Enzymatic identification of shuttle plasmid pShuttle-shZBTB20 A: Identify the insertion of interference fragment; B: Identify the linearization of recombinant shuttle plasmid. M: Marker; P: pShuttle-shZBTB20 digested by BamHⅠand HindⅢ; P1: pShuttle-shZBTB20; P2: pShuttle-shZBTB20 digested by PmeⅠ. |

|
图 2 重组腺病毒质粒pAd-shZBTB20的酶切鉴定 Fig 2 Enzymatic identification of recombinant adenovirus plasmid pAd-shZBTB20 M: Marker; P1-P3: pAd-shZBTB20 digested by PacⅠ. |
2.2 重组腺病毒Ad-shZBTB20的包装和滴度检测
用Lipofectamine 3000转染试剂将PacⅠ线性化后的重组腺病毒载体pAd-shZBTB20转染HEK-293细胞,转染72 h时可见散在绿色荧光,至第17天可见明显的CPE,大多数细胞变圆漂起。收集细胞,经干冰和37 ℃水浴反复冻融并剧烈震荡3次,收集含病毒的细胞裂解液上清。反复感染HEK-293细胞3次以大量扩增病毒,CsCl超速离心后用比色皿检测D260确定病毒颗粒数。依照TCID50法,在感染后第10天观察CPE,计数每个稀释度产生的CPE的孔数,根据公式计算得到腺病毒的滴度为3.2×1010 IU/mL。
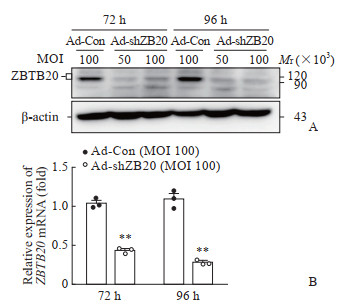
2.3 重组腺病毒Ad-shZBTB20的干扰效果蛋白质印迹法检测结果显示,Ad-shZBTB20(MOI为50或100)感染72 h即可明显下调人肝癌细胞株Huh7细胞内源性ZBTB20蛋白的表达,感染96 h时内源性ZBTB20蛋白表达水平进一步降低(图 3A)。qPCR结果显示,Ad-shZBTB20(MOI为100)感染Huh7细胞96 h时,ZBTB20 mRNA表达约为感染对照腺病毒的20%(图 3B)。该结果提示重组的ZBTB20干扰腺病毒能有效降低体外培养细胞株内源性ZBTB20的表达。
|
图 3 ZBTB20干扰腺病毒对Huh7细胞内源性ZBTB20表达的影响 Fig 3 Effect of ZBTB20-interfering adenovirus on endogenous ZBTB20 expression in Huh7 cells A: ZBTB20 protein expression in Huh7 cells detected by Western blotting; B: ZBTB20 mRNA level in Huh7 cells detected by quantitative polymerase chain reaction. **P < 0.01 vs Ad-Con group. n=3, x±s. ZBTB20: Zinc finger and BTB domain containing 20; Ad-Con: Control interfering adenovirus; Ad-shZB20: ZBTB20 interfering adenovirus; MOI: Multiplicity of infection. |
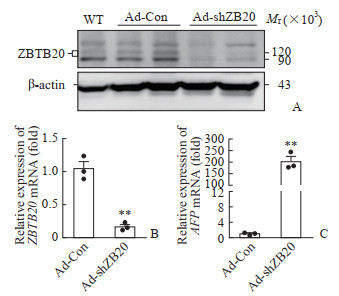
进一步观察该重组腺病毒在小鼠体内干扰ZBTB20蛋白的表达,蛋白质印迹法检测结果显示尾静脉注射1×1010 VG/只的重组腺病毒Ad-shZBTB20能下调小鼠肝脏组织内源性ZBTB20蛋白的表达(图 4A);qPCR结果显示ZBTB20 mRNA下调约80%(图 4B),ZBTB20的靶基因甲胎蛋白mRNA表达上调约203倍(图 4C)。
|
图 4 ZBTB20干扰腺病毒对小鼠肝脏内源性ZBTB20表达的影响 Fig 4 Effect of ZBTB20-interfering adenovirus on endogenous ZBTB20 expression in mouse liver A: ZBTB20 protein expression in the liver of mouse detected by Western blotting; B, C: ZBTB20 (B) and AFP (C) mRNA levels in the mouse liver detected by quantitative polymerase chain reaction. **P < 0.01 vs Ad-Con group. n=3, x±s. ZBTB20: Zinc finger and BTB domain containing 20; WT: C57BL/6 mice without adenovirus; Ad-Con: C57BL/6 mice with control interfering adenovirus (1×1010 VG/mouse); Ad-shZB20: ZBTB20 interfering adenovirus (1×1010 VG/mouse); AFP: α-fetoprotein. |
3 讨论
转录因子ZBTB20最初是从人树突状细胞中克隆的含BTB/POZ结构域的锌指蛋白家族成员。本课题组近年来利用ZBTB20全身和组织特异性敲除小鼠模型,发现ZBTB20参与了包括大脑皮质发育[6]、痛觉感受[7-8]、垂体发育分化[13-14]、肝脏再生[15]、心肌收缩[16]、糖脂代谢[2-5]等的调节作用。ZBTB20是出生后肝脏甲胎蛋白水平迅速下调的关键性转录抑制因子[1, 17],其表达水平是肝癌预后的一个独立预警因素。与正常肝脏组织及癌旁组织相比,肝癌组织中ZBTB20 mRNA和蛋白水平明显增高,并与静脉侵袭、转移等密切相关,ZBTB20高表达的肝癌患者无瘤生存期和总生存期明显低于低表达者[18]。有报道指出,ZBTB20通过抑制过氧化物酶体增殖物激活受体γ转录表达而激活Wnt/连环蛋白β-1信号通路,从而促进肝癌细胞增殖[19]。此外,本课题组近期实验结果提示ZBTB20与饮食诱导的肝脏糖脂代谢紊乱有关[4-5]。ZBTB20结合于脂质代谢关键基因碳水化合物反应元件结合蛋白α的启动子区,抑制脂质合成代谢相关基因的表达。肝脏特异性ZBTB20敲除小鼠在饥饿状态下,肝脏脂质的从头合成及甘油三酯的分泌受到抑制,血浆甘油三酯、胆固醇和游离脂肪酸水平远低于同窝对照。在高碳水化合物饮食下,抑制ZBTB20表达可改善肝细胞的脂质沉积及增强胰岛素敏感性[4-5]。ZBTB20在肝脏再生发育和糖脂代谢中发挥重要作用,提示干扰ZBTB20的表达具有潜在的防治肝癌和改善代谢的价值。
重组腺病毒血清型5是非整合型双链DNA病毒,具有易构建、易浓缩和纯化、出毒率高、无致癌性、适用性广等特点。重组腺病毒经腹腔或尾静脉注射后具有肝脏组织聚集性,因而成为研究肝脏生物学的重要病毒载体[20]。AdEasy腺病毒系统是目前应用最广泛的病毒表达载体,通过克隆含外源目的基因的腺病毒穿梭质粒(pShuttle-U6-GFP)与携带有腺病毒大部分基因组的质粒(pAdEasy)共转化至大肠杆菌BJ5183,在重组酶的作用下经抗性筛选获得重组腺病毒基因组质粒,线性化后转染HEK-293细胞获得重组腺病毒。本课题组的前期研究提示ZBTB20在肝脏糖脂代谢、肝癌发展中发挥重要作用[4-5],因而具有肝脏靶向性的腺病毒表达载体无疑是进一步研究肝脏中ZBTB20生物学功能及作用机制的首选工具。ZBTB20基因种属保守性很高,人鼠间基因同源性达92.91%,蛋白同源性高达97.71%。而且ZBTB20蛋白的2个亚型在羧基端完全一致。鉴于此,我们设计的ZBTB20基因的干扰序列靶向蛋白羧基端的高度保守区,可以同时敲减人和小鼠的ZBTB20的2个蛋白亚型,以实现最优干扰效果。本课题组前期实验表明,在常用的人和小鼠肝癌细胞株中,Huh7细胞株内源性ZBTB20蛋白表达丰度最高,是验证腺病毒干扰效率的理想模型(未发表结果)。另外,腺病毒感染宿主细胞时不整合入宿主基因组中,因此适用于外源基因的瞬时表达,表达高峰期在1周左右,其后表达量逐渐降低。本实验以人肝癌Huh7细胞为模型的离体实验证明ZBTB20基因干扰腺病毒感染细胞3~4 d可获得明显的干扰效率,小鼠在体实验也证明感染1周时肝脏组织依然能实现80%的敲减效率,这表明所构建的ZBTB20干扰腺病毒活力可以满足实验需要。
总之,我们利用AdEasy系统成功制备了ZBTB20基因干扰腺病毒,在离体细胞中及小鼠在体注射后均能成功抑制ZBTB20蛋白的表达和功能。ZBTB20基因干扰腺病毒的成功制备为深入研究ZBTB20在肝脏的生理和病理作用及筛选肝癌和代谢性疾病的治疗靶点提供了有效的工具。
| [1] |
XIE Z F, ZHANG H, TSAI W, ZHANG Y, DU Y, ZHONG J G, et al. Zinc finger protein ZBTB20 is a key repressor of α-fetoprotein gene transcription in liver[J]. Proc Natl Acad Sci U S A, 2008, 105: 10859-10864. DOI:10.1073/pnas.0800647105 |
| [2] |
SUTHERLAND A P, ZHANG H, ZHANG Y, MICHAUD M, XIE Z F, PATTI M E, et al. Zinc finger protein Zbtb20 is essential for postnatal survival and glucose homeostasis[J]. Mol Cell Biol, 2009, 29: 2804-2815. DOI:10.1128/MCB.01667-08 |
| [3] |
ZHANG Y, XIE Z F, ZHOU L T, LI L, ZHANG H, ZHOU G D, et al. The zinc finger protein ZBTB20 regulates transcription of fructose-1, 6-bisphosphatase 1 and β cell function in mice[J]. Gastroenterology, 2012, 142: 1571-1580. DOI:10.1053/j.gastro.2012.02.043 |
| [4] |
LIU G, ZHOU L T, ZHANG H, CHEN R, ZHANG Y, LI L, et al. Regulation of hepatic lipogenesis by the zinc finger protein Zbtb20[J/OL]. Nat Commun, 2017, 8: 14824. DOI: 10.1038/ncomms14824
|
| [5] |
LI H, LIU G, WAN X Q, ZHOU L T, QIN Z B, MA X H, et al. The zinc finger and BTB domain containing protein ZBTB20 regulates plasma triglyceride metabolism by repressing lipoprotein lipase gene transcription in hepatocytes[J]. Hepatology, 2022, 75: 1169-1180. DOI:10.1002/hep.32176 |
| [6] |
XIE Z F, MA X H, JI W L, ZHOU G D, LU Y Z, XIANG Z H, et al. Zbtb20 is essential for the specification of CA1 field identity in the developing hippocampus[J]. Proc Natl Acad Sci U S A, 2010, 107: 6510-6515. DOI:10.1073/pnas.0912315107 |
| [7] |
REN A J, WANG K, ZHANG H, LIU A J, MA X H, LIANG Q, et al. ZBTB20 regulates nociception and pain sensation by modulating TRP channel expression in nociceptive sensory neurons[J/OL]. Nat Commun, 2014, 5: 4984. DOI: 10.1038/ncomms5984.
|
| [8] |
JIA X, DAI M H, REN A J, WANG T T, ZHANG W J, ZHANG L. ZBTB20 in nociceptive neurons of the trigeminal ganglia regulates pruritus[J/OL]. Front Med (Lausanne), 2021, 8: 626554. DOI: 10.3389/fmed.2021.626554.
|
| [9] |
MEDEIROS DE ARAÚJO J A, BARÃO S, MATEOS-WHITE I, ESPINOSA A, COSTA M R, GIL-SANZ C, et al. ZBTB20 is crucial for the specification of a subset of callosal projection neurons and astrocytes in the mammalian neocortex[J/OL]. Development, 2021, 148: dev196642. DOI: 10.1242/dev.196642.
|
| [10] |
KRZYZANOWSKA A K, HAYNES Ⅱ R A H, KOVALOVSKY D, LIN H C, OSORIO L, EDELBLUM K L, et al. Zbtb20 identifies and controls a thymus-derived population of regulatory T cells that play a role in intestinal homeostasis[J/OL]. Sci Immunol, 2022, 7: eabf3717. DOI: 10.1126/sciimmunol.abf3717.
|
| [11] |
MELIS D, CARVALHO D, BARBARO-DIEBER T, ESPAY A J, GAMBELLO M J, GENER B, et al. Primrose syndrome: characterization of the phenotype in 42 patients[J]. Clin Genet, 2020, 97: 890-901. DOI:10.1111/cge.13749 |
| [12] |
JUVEN A, NAMBOT S, PITON A, JEAN-MARÇAIS N, MASUREL A, CALLIER P, et al. Primrose syndrome: a phenotypic comparison of patients with a ZBTB20 missense variant versus a 3q13.31 microdeletion including ZBTB20[J]. Eur J Hum Genet, 2020, 28: 1044-1055. DOI:10.1038/s41431-020-0582-3 |
| [13] |
CAO D M, MA X H, CAI J, LUAN J, LIU A J, YANG R, et al. ZBTB20 is required for anterior pituitary development and lactotrope specification[J/OL]. Nat Commun, 2016, 7: 11121. DOI: 10.1038/ncomms11121.
|
| [14] |
HAN Q, YAN X D, YE Y F, HAN L H, MA X H, WANG T, et al. ZBTB20 regulates prolactin expression and lactotrope function in adult mice[J/OL]. Endocrinology, 2022, 163: bqac181. DOI: 10.1210/endocr/bqac181.
|
| [15] |
ZHANG H, SHI J H, JIANG H, WANG K J, LU J Y, JIANG X C, et al. ZBTB20 regulates EGFR expression and hepatocyte proliferation in mouse liver regeneration[J/OL]. Cell Death Dis, 2018, 9: 462. DOI: 10.1038/s41419-018-0514-0.
|
| [16] |
REN A J, CHEN C, ZHANG S, LIU M N, WEI C C, WANG K, et al. Zbtb20 deficiency causes cardiac contractile dysfunction in mice[J]. FASEB J, 2020, 34: 13862-13876. DOI:10.1096/fj.202000160RR |
| [17] |
ZHANG H, CAO D M, ZHOU L T, ZHANG Y, GUO X Q, LI H, et al. ZBTB20 is a sequence-specific transcriptional repressor of alpha-fetoprotein gene[J/OL]. Sci Rep, 2015, 5: 11979. DOI: 10.1038/srep11979.
|
| [18] |
WANG Q, TAN Y X, REN Y B, DONG L W, XIE Z F, TANG L, et al. Zinc finger protein ZBTB20 expression is increased in hepatocellular carcinoma and associated with poor prognosis[J/OL]. BMC Cancer, 2011, 11: 271. DOI: 10.1186/1471-2407-11-271.
|
| [19] |
TO J C, CHIU A P, TSCHIDA B R, LO L H, CHIU C H, LI X X, et al. ZBTB20 regulates WNT/CTNNB1 signalling pathway by suppressing PPARG during hepatocellular carcinoma tumourigenesis[J/OL]. JHEP Rep, 2020, 3: 100223. DOI: 10.1016/j.jhepr.2020.100223.
|
| [20] |
LUO J Y, DENG Z L, LUO X J, TANG N, SONG W X, CHEN J, et al. A protocol for rapid generation of recombinant adenoviruses using the AdEasy system[J]. Nat Protoc, 2007, 2: 1236-1247. DOI:10.1038/nprot.2007.135 |
 2023, Vol. 44
2023, Vol. 44


