2. 海军军医大学(第二军医大学)第一附属医院泌尿外科, 上海 200433;
3. 海军军医大学(第二军医大学)第三附属医院泌尿外科, 上海 201800
2. Department of Urology, The First Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200433, China;
3. Department of Urology, The Third Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 201800, China
肾细胞癌是一种发病率较高的泌尿系统恶性肿瘤,占成人恶性肿瘤新发病例的2%以上[1],且预后较差,约16%的患者在初次就诊时就已出现局部或远处转移,有近30%的患者在随访中发现有转移,晚期肾细胞癌患者的5年生存率约为11.6%[2-3]。随着抗血管生成药物和免疫检查点抑制剂的发展,晚期肾细胞癌的药物治疗发生了重大变化,以程序性死亡蛋白1(programmed death 1,PD-1)/程序性死亡蛋白配体1(programmed death-ligand 1,PD-L1)单抗为代表的免疫治疗在晚期肾细胞癌治疗中的地位越来越突出,该疗法下患者总生存期及无进展生存期均较靶向治疗有所提高[4]。特瑞普利单抗是我国自主研发的一种针对PD-1的免疫治疗药物[5]。目前国内尚缺乏特瑞普利单抗在晚期肾细胞癌治疗中的有效性及安全性评估。本研究分析了海军军医大学(第二军医大学)第二附属医院应用特瑞普利单抗联合舒尼替尼治疗晚期肾细胞癌的疗效与安全性,现将初步结果报道如下。
1 资料和方法 1.1 研究对象收集2020年1月至2022年3月于海军军医大学(第二军医大学)第二附属医院接受特瑞普利单抗联合舒尼替尼治疗的25例晚期肾细胞癌患者的临床资料。纳入标准:(1)手术切除或穿刺病理证实为肾细胞癌;(2)影像学检查或术中证实存在局部进展(如腔静脉癌栓、局部淋巴结转移)或远处转移;(3)既往未曾接受PD-1/PD-L1抑制剂治疗;(4)预计生存期≥3个月;(5)依据实体瘤疗效评价标准1.1版,具有可测量的实体病灶;(6)体力状态良好,治疗前美国东部肿瘤合作组体力状态评分为0~2分;(7)患者临床资料完整。如果患者肿瘤病灶进展或因不良反应不能耐受则退出治疗。本研究通过海军军医大学(第二军医大学)第二附属医院伦理委员会审批(2020YLCYJ-Y13),所有患者在接受治疗前均签署知情同意书。
1.2 研究方法 1.2.1 治疗方案所有患者均给予特瑞普利单抗(240 mg静脉注射,每3周1次)联合舒尼替尼(50 mg口服,每日1次)治疗,每3周为1个治疗周期。根据患者耐受性调整药物剂量(减量、暂缓服药或停药)。
1.2.2 疗效和不良反应评价采用CT或MRI于治疗前和治疗2个周期后进行影像学检查,并在之后每隔3个月进行随访监测,根据实体瘤疗效评定标准1.1版进行疗效评价,其中完全缓解(complete response,CR)指所有靶病灶消失,无新病灶出现,且肿瘤标志物正常,维持至少4周;部分缓解(partial response,PR)指所有靶病灶最大径之和减少≥30%,维持至少4周;疾病进展(progressive disease,PD)指所有靶病灶最大径之和至少增加≥20%,或出现新病灶;疾病稳定(stable disease,SD)指所有靶病灶最大径之和缩小未达PR,或增大未达PD。根据美国国家癌症研究所不良事件通用术语标准5.0版对不良事件进行评估和分级。
1.3 统计学处理应用SPSS 26.0软件对数据进行统计学分析。计数资料以例数和百分数表示,计量资料以中位数(95% CI)表示。采用Kaplan-Meier生存分析法估计总生存期和无进展生存期。
2 结果 2.1 一般临床资料共纳入晚期肾细胞癌患者25例,其中男21例(84.0%)、女4例(16.0%),中位年龄为59(95% CI 33~80)岁。接受联合治疗前,按照国际转移性肾细胞癌数据库联盟(International Metastatic Renal Cell Carcinoma Database Consortium,IMDC)风险分级,低危4例、中危18例、高危3例。6例患者既往未行任何全身抗肿瘤治疗;19例患者曾接受过血管内皮生长因子受体酪氨酸激酶抑制剂一线抗肿瘤治疗(舒尼替尼12例、培唑帕尼6例、索拉非尼1例)。21例患者经原发肿瘤切除术后病理确诊,4例经穿刺活检病理确诊,病理类型包括23例肾透明细胞癌和2例转录因子3(transcription factor 3,TFE3)基因融合相关性肾细胞癌,其中1例肾透明细胞癌伴部分肉瘤样变。7例(28.0%)患者转移部位数量仅有1处,18例(72.0%)患者转移部位≥2处,最常见的转移部位为肺(10例,40.0%)、骨(9例,36.0%)、淋巴结(6例,24.0%)、肝(3例,12.0%),其他转移部位包括脑、腰大肌、结肠、胸膜(各1例)等。
2.2 疗效评价随访至2022年3月1日,25例患者均未达到CR,其中9例PR,12例SD,4例出现PD。25例患者的总体客观缓解率(objective response rate,ORR)为36.0%(9/25),疾病控制率(disease control rate,DCR)为84.0%(21/25)。其中接受特瑞普利单抗联合舒尼替尼作为一线治疗的6例患者ORR为50.0%(3/6),DCR为83.3%(5/6);接受特瑞普利单抗联合舒尼替尼作为二线治疗的19例患者ORR为31.6%(6/19),DCR为84.2%(16/19)。至随访截止日期,13例(52.0%)患者停止了特瑞普利单抗治疗,停药的原因包括PD(4例)、不良反应不耐受(5例)、经济困难(4例)。
2.3 生存分析本研究随访至2022年3月1日,中位随访时间为11.0(95% CI 2.5~24.0)个月。3例患者因出现PD而死亡,中位无进展生存期为12.7(95% CI 10.7~14.7)个月(图 1A),因随访时间较短,中位总生存期未达到(图 1B)。19例接受特瑞普利单抗联合舒尼替尼作为二线治疗的患者中位无进展生存期为13.0(95% CI 10.1~15.9)个月。
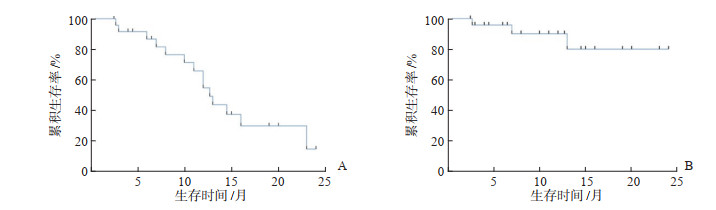
|
图 1 特瑞普利单抗联合舒尼替尼治疗晚期肾细胞癌患者的无进展生存(A)及总生存(B)曲线 |
2.4 不良反应
共计22例患者(50例次)发生不良反应,总体不良反应发生率为88.0%(22/25),多数不良反应(90.0%,45/50)为1~2级(表 1),发生率较高的不良反应有皮疹(32.0%,8/25)、腹泻(24.0%,6/25)、手足皮肤反应(20.0%,5/25)、高血压(16.0,4/25)。有5例患者发生3级及以上不良反应,其中高血压1例,血压持续高于170/90 mmHg(1 mmHg=0.133 kPa),需服用2种降压药控制血压;下颌骨坏死1例,行手术治疗,术后病理结果排除肿瘤转移;肾功能损伤1例,行透析治疗;胸腔积液1例,住院后行胸腔积液引流并予糖皮质激素治疗;腹水1例,住院后行腹腔引流。5例患者因不耐受不良反应而停止特瑞普利单抗联合舒尼替尼治疗,其中包括发生3级及以上不良反应的患者3例(肾功能损伤、胸腔积液、腹水各1例),反复发热患者1例,反复呕吐患者1例。另有2例患者因皮疹、手足皮肤反应不耐受调整舒尼替尼剂量为37.5 mg(每日1次)。所有患者不良反应经对症治疗或调整用药后均好转。
|
|
表 1 特瑞普利单抗联合舒尼替尼治疗晚期肾细胞癌患者的不良反应 |
3 讨论
中国临床肿瘤学会肾癌诊疗指南、美国国家综合癌症网络和欧洲泌尿外科学会均将免疫治疗联合靶向药物作为晚期肾细胞癌的推荐治疗方案。研究表明,约30%的转移性肾细胞癌患者存在PD-1/PD-L1的高表达[6-7]。2019年,国内一项特瑞普利单抗治疗晚期黑色素瘤或泌尿系统肿瘤的Ⅰ期临床试验中纳入的6例晚期肾细胞癌患者ORR为33.3%,DCR为50.0%,中位无进展生存期和总生存期长于黑色素瘤和尿路上皮癌患者[5],显示该药对晚期肾细胞癌患者有效。多项临床试验显示,以PD-1/PD-L1单抗为主的免疫治疗药物联合靶向药物在晚期肾细胞癌的治疗中具有比传统靶向药物或免疫组合治疗更佳的疗效[8-10]。
本研究回顾性分析了海军军医大学(第二军医大学)第二附属医院采用特瑞普利单抗联合靶向药物舒尼替尼治疗晚期肾细胞癌的生存获益和安全性,结果显示ORR为36.0%,DCR为84.0%,中位无进展生存期为12.7(95% CI 10.7~14.7)个月,初步疗效可观,多数不良反应可控。本研究中二线方案治疗的19例晚期肾细胞癌患者ORR为31.6%,DCR为84.2%;一线方案治疗的6例患者中50.0%病情缓解。在JAVELIN Renal 101、Keynote-426两项免疫制剂联合阿西替尼对比舒尼替尼的研究中,舒尼替尼单药治疗组分别纳入444例和429例晚期肾细胞癌患者,中位无进展生存期分别为8.4个月和11.1个月[8, 11]。本研究中72.0%(18/25)的患者转移部位≥2处,19例为二线治疗,中高危患者占比84.0%(21/25),特瑞普利单抗联合舒尼替尼对这些患者的治疗效果可能低于上述国外临床试验中选定人群的治疗效果,但与上述研究结果中舒尼替尼单药治疗相比,本研究获得了较长的中位无进展生存期,结果显示特瑞普利单抗联合靶向药物治疗在晚期肾细胞癌一线及二线治疗中取得了较好的初步疗效。但本组患者中也存在接受联合治疗方案后短期内出现PD的情况,提示并非所有晚期肾细胞癌患者均能从中获益。
临床上伴肉瘤样分化的肾细胞癌患者的治疗难度较大,但越来越多的研究提示免疫治疗对这部分患者具有疗效上的优势[11-13]。本研究纳入1例晚期肾透明细胞癌伴部分肉瘤样变的患者,该患者因既往行脑肿瘤手术病理回报为肾透明细胞癌转移而确诊左侧肾细胞癌,伴肺、腹腔、腹膜后淋巴结多发转移,行左侧肾脏切除术后予舒尼替尼37.5 mg(每日1次)作为一线治疗,4.5年后发生PD,术后5年开始行特瑞普利单抗联合舒尼替尼(50 mg,每日1次)二线治疗,取得了持续PR的可观疗效。有研究证实伴有肉瘤样分化的肾细胞癌患者中存在的PD-L1结构性高表达与免疫治疗疗效相关[11, 14]。
在安全性方面,本组患者总体不良反应发生率为88.0%,多见不良反应包括皮疹(32.0%)、腹泻(24.0%)、手足皮肤反应(20.0%)、高血压(16.0%)等,90.0%的不良反应为1~2级,经对症治疗或调整用药后均缓解。参照美国临床肿瘤学会的免疫相关不良事件管理指南[15],本组患者的免疫相关不良反应主要包括皮疹(32.0%,8/25)、疲劳(8.0%,2/25)、肾功能损伤(8.0%,2/25)、甲状腺功能异常(4.0%,1/25)、胸腔积液(4.0%,1/25)、下颌骨坏死(4.0%,1/25)等。本组样本量较小,部分不良反应尚未监测到,仍需更广泛、更长时间的随访。在CheckMate 016研究中,33例舒尼替尼联合纳武利尤单抗(nivolumab)治疗的晚期肾细胞癌患者均发生了不同级别的不良反应,80.0%以上的患者经历过3级或4级不良反应,最常见的为疲劳(84.8%)、腹泻(63.6%)、味觉障碍(63.6%)和恶心(57.6%),3级以上治疗相关不良反应常见为高血压(18.2%)、丙氨酸转氨酶升高(18.2%)、天冬氨酸转氨酶升高(9.1%)、腹泻(9.1%)和疲劳(9.1%),39.4%的患者因不良反应而停药[16]。本研究总的不良反应发生率较上述研究低,且实际治疗整体可控,因不良反应停药患者占比25.0%(5/25),有2例患者减少了舒尼替尼的使用剂量,提示在密切关注患者治疗中出现的不良反应的前提下,及时采取干预措施对症治疗或调整药物剂量可能对提高患者生存获益有帮助。本研究二线治疗的19例患者中有12例既往行舒尼替尼单药一线治疗,2例因不良反应调整舒尼替尼剂量的患者中作为一线、二线治疗的各1例,既往对舒尼替尼良好的耐受性可能是此类患者治疗效果较好的原因之一。但由于本研究样本量小,且为资料性研究,难免会发生病例选择导致的偏倚。总体而言,本研究采用特瑞普利单抗联合舒尼替尼治疗晚期肾细胞癌的安全性数据与国外研究报道相似。
综上所述,特瑞普利单抗联合舒尼替尼在晚期肾细胞癌的治疗中初步疗效可观,ORR和DCR均较高,且安全性方面与既往研究报道类似,不良反应可控。但因样本量小、随访时间短,该方法的疗效和安全性尚需在更广泛人群中进行前瞻性随机对照临床研究进一步验证。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, LAVERSANNE M, SOERJOMATARAM I, JEMAL A, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71: 209-249. DOI:10.3322/caac.21660 |
| [2] |
GARJE R, AN J, GRECO A, VADDEPALLY R K, ZAKHARIA Y. The future of immunotherapy-based combination therapy in metastatic renal cell carcinoma[J/OL]. Cancers (Basel), 2020, 12: 143. DOI: 10.3390/cancers12010143.
|
| [3] |
PATEL H D, GUPTA M, JOICE G A, SRIVASTAVA A, ALAM R, ALLAF M E, et al. Clinical stage migration and survival for renal cell carcinoma in the United States[J]. Eur Urol Oncol, 2019, 2: 343-348. DOI:10.1016/j.euo.2018.08.023 |
| [4] |
DELEUZE A, SAOUT J, DUGAY F, PEYRONNET B, MATHIEU R, VERHOEST G, et al. Immunotherapy in renal cell carcinoma: the future is now[J/OL]. Int J Mol Sci, 2020, 21: 2532. DOI: 10.3390/ijms21072532.
|
| [5] |
TANG B X, YAN X Q, SHENG X N, SI L, CUI C L, KONG Y, et al. Safety and clinical activity with an anti-PD-1 antibody JS001 in advanced melanoma or urologic cancer patients[J/OL]. J Hematol Oncol, 2019, 12: 7. DOI: 10.1186/s13045-018-0693-2.
|
| [6] |
CHOUEIRI T K, FIGUEROA D J, FAY A P, SIGNORETTI S, LIU Y, GAGNON R, et al. Correlation of PD-L1 tumor expression and treatment outcomes in patients with renal cell carcinoma receiving sunitinib or pazopanib: results from COMPARZ, a randomized controlled trial[J]. Clin Cancer Res, 2015, 21: 1071-1077. DOI:10.1158/1078-0432.CCR-14-1993 |
| [7] |
JILAVEANU L B, SHUCH B, ZITO C R, PARISI F, BARR M, KLUGER Y, et al. PD-L1 expression in clear cell renal cell carcinoma: an analysis of nephrectomy and sites of metastases[J]. J Cancer, 2014, 5: 166-172. DOI:10.7150/jca.8167 |
| [8] |
MOTZER R J, PENKOV K, HAANEN J, RINI B, ALBIGES L, CAMPBELL M T, et al. Avelumab plus axitinib versus sunitinib for advanced renal-cell carcinoma[J]. N Engl J Med, 2019, 380: 1103-1115. DOI:10.1056/NEJMoa1816047 |
| [9] |
CICCARESE C, IACOVELLI R, PORTA C, PROCOPIO G, BRIA E, ASTORE S, et al. Efficacy of VEGFR-TKIs plus immune checkpoint inhibitors in metastatic renal cell carcinoma patients with favorable IMDC prognosis[J/OL]. Cancer Treat Rev, 2021, 100: 102295. DOI: 10.1016/j.ctrv.2021.102295.
|
| [10] |
QUHAL F, MORI K, BRUCHBACHER A, RESCH I, MOSTAFAEI H, PRADERE B, et al. First-line immunotherapy-based combinations for metastatic renal cell carcinoma: a systematic review and network meta-analysis[J]. Eur Urol Oncol, 2021, 4: 755-765. DOI:10.1016/j.euo.2021.03.001 |
| [11] |
RINI B I, PLIMACK E R, STUS V, GAFANOV R, HAWKINS R, NOSOV D, et al. Pembrolizumab plus axitinib versus sunitinib for advanced renal-cell carcinoma[J]. N Engl J Med, 2019, 380: 1116-1127. DOI:10.1056/NEJMoa1816714 |
| [12] |
MCDERMOTT D F, HUSENI M A, ATKINS M B, MOTZER R J, RINI B I, ESCUDIER B, et al. Clinical activity and molecular correlates of response to atezolizumab alone or in combination with bevacizumab versus sunitinib in renal cell carcinoma[J]. Nat Med, 2018, 24: 749-757. DOI:10.1038/s41591-018-0053-3 |
| [13] |
MCGREGOR B A, MCKAY R R, BRAUN D A, WERNER L, GRAY K, FLAIFEL A, et al. Results of a multicenter phaseⅡstudy of atezolizumab and bevacizumab for patients with metastatic renal cell carcinoma with variant histology and/or sarcomatoid features[J]. J Clin Oncol, 2020, 38: 63-70. |
| [14] |
GUPTA S, CHEVILLE J C, JUNGBLUTH A A, ZHANG Y M, ZHANG L, CHEN Y B, et al. JAK2/PD-L1/PD-L2 (9p24.1) amplifications in renal cell carcinomas with sarcomatoid transformation: implications for clinical management[J]. Mod Pathol, 2019, 32: 1344-1358. DOI:10.1038/s41379-019-0269-x |
| [15] |
SCHNEIDER B J, NAIDOO J, SANTOMASSO B D, LACCHETTI C, ADKINS S, ANADKAT M, et al. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: ASCO guideline update[J]. J Clin Oncol, 2021, 39: 4073-4126. DOI:10.1200/JCO.21.01440 |
| [16] |
AMIN A, PLIMACK E R, ERNSTOFF M S, LEWIS L D, BAUER T M, MCDERMOTT D F, et al. Safety and efficacy of nivolumab in combination with sunitinib or pazopanib in advanced or metastatic renal cell carcinoma: the CheckMate 016 study[J/OL]. J Immunother Cancer, 2018, 6: 109. DOI: 10.1186/s40425-018-0420-0.
|
 2023, Vol. 44
2023, Vol. 44


