2. 中国融通医疗健康集团有限公司上海四一一医院口腔科, 上海 200081
2. Department of Stomatology, Shanghai 411 Hospital, China Rongtong Medical Healthcare Group Co. Ltd, Shanghai 200081, China
牙槽骨吸收是牙周炎常见的并发症,会导致牙齿松动脱落并影响义齿修复效果,传统的牙槽手术因为创伤大且预后效果不佳,患者接受程度普遍不高[1]。以人牙周膜干细胞(human periodontal ligament stem cell,hPDLSC)作为种子细胞的组织工程技术,为牙槽骨再生提供了新的治疗思路,具有较大的临床应用潜力[2]。
生物电磁场作为一种经济、安全、有效的物理辅助疗法,能显著促进骨组织的愈合。研究表明脉冲电磁场(pulsed electromagnetic field,PEMF)可以促进干细胞的增殖和成骨分化,从而促进骨组织的产生和骨折愈合[3-4]。尽管PEMF应用于临床已有相当长时间,但是关于PEMF诱导成骨的具体生理机制尚不明确。研究表明PEMF刺激可能通过激活Ca2+离子通道、cAMP、骨形态发生蛋白(bone morphogenetic protein,BMP)等信号通路刺激成骨细胞的成熟和矿化[5-7]。新近研究发现PEMF和MAPK信号通路可能存在密切关系[5, 8-9]。JNK通路属于MAPK通路家族,主要被细胞因子、紫外辐照、γ射线、氧化损伤、电离辐射等激活,参与细胞增殖、分化、衰亡、应激等细胞行为[10]。有研究证实JNK通路除了参与细胞应激、凋亡等生物学行为外,在成骨分化方面也发挥重要作用[11-12]。在电磁场刺激诱导成骨分化的过程中干细胞的JNK通路是否被激活,目前尚缺乏相关研究。
本研究选择hPDLSC作为种子细胞,建立低频PEMF促进hPDLSC成骨分化体外模型,通过检测该过程中Runt相关转录因子2(Runt-related transcription factor 2,Runx2)、碱性磷酸酶(alkaline phosphatase,ALP)、骨桥蛋白(osteopontin,OPN)、骨钙蛋白(osteocalcin,OCN)等成骨相关基因的表达和ALP活性,筛选适宜的PEMF磁场强度参数;再通过检测JNK和磷酸化JNK(phosphorylated-JNK,p-JNK)蛋白的表达情况判断JNK通路是否参与PEMF促进hPDLSC成骨分化,以及选择JNK特异性抑制剂SP600125[13]干预JNK信号通路,探究JNK通路在PEMF促进hPDLSC成骨分化中的作用。
1 材料和方法 1.1 主要实验仪器与试剂CO2培养箱、超速离心机、荧光定量PCR仪(美国ThermoFisher公司),倒置荧光显微镜(日本Olympus公司),流式细胞仪、磁珠分选架、CD146免疫磁珠(德国Miltenyi Biotec公司),FBS(美国Gibco公司),PBS、DMSO(美国Corning公司),成骨诱导液(美国Hyclone公司),SP600125、青霉素-链霉素双抗(美国Sigma公司),反转录试剂盒(日本TaKaRa公司),山羊抗鼠二抗、蛋白分子量标记和蛋白质印迹法相关试剂、多聚甲醛、ALP活性检测试剂盒(上海碧云天生物技术有限公司),鼠抗人角蛋白抗体、鼠抗人波形蛋白抗体、JNK抗体和p-JNK抗体(英国Abcam公司),基因引物序列由生工生物工程(上海)股份有限公司设计合成。
1.2 hPDLSC体外培养本研究经海军军医大学(第二军医大学)第一附属医院医学伦理委员会审批。在口腔正畸治疗患者(年龄为11~13岁)监护人签署知情同意书后,收集因正畸治疗拔除的健康前磨牙,刮取牙根中1/3牙周膜组织,用含体积分数1%双抗的PBS反复冲洗,小心转移牙周膜组织至培养皿中,去除杂质后置于CO2培养箱孵育。待组织块呈现半干涸状态时加入完全培养基,根据细胞生长情况每3~5 d换液,当细胞汇合至70%~80%时传代。取第3代牙周膜细胞,调整细胞密度,在避光条件下,每107个细胞加20 μL CD146免疫磁珠和20 μL分选用封闭液等试剂,充分吹打均匀后4 ℃避光孵育20 min;将细胞悬液转移至分选柱内,推动活塞于分选柱下方收集未接合CD146免疫磁珠的细胞悬液;取下分选柱并远离磁场,推动活塞收集经过分选的细胞,清洗后转移至培养皿。
1.3 hPDLSC表面标志物鉴定取第3代经分选后的细胞,调整细胞密度;在避光条件下用封闭液(含2% FBS的PBS)封闭30 min,离心获得细胞沉淀。添加别藻蓝蛋白(allophycocyanin,APC)标记的CD146流式抗体和FITC标记的STRO1流式抗体,避光孵育20 min,清洗细胞并重悬。将细胞悬液置于流式细胞仪检测,以空白组中无APC、FITC通道区作标记,检测该区域CD146和STRO1双阳性的细胞比例。
1.4 hPDLSC组织来源鉴定取第3代经分选后的细胞爬至玻片上生长,待细胞汇合至70%左右时,使用4%多聚甲醛溶液固定细胞30 min。加入破膜工作液孵育10 min,再分别添加鼠抗人波形蛋白抗体和鼠抗人角蛋白抗体孵育过夜,然后加入山羊抗鼠二抗孵育50 min。添加DAPI染色细胞核,避光孵育10 min后封片,在荧光显微镜下观察并采集图像。
1.5 PEMF辐照hPDLSCPEMF细胞干预系统由空军军医大学军事生物医学工程系提供技术支持(ZL02224739.4)[14],整个系统包括PEMF发生器、赫姆霍兹线圈、示波器、CO2培养箱、连接线路等。实验时将严格消毒后的赫姆霍兹线圈置于CO2培养箱中,将培养皿置于线圈中,通过赫姆霍兹线圈产生脉冲频率15 Hz、脉冲宽度0.2 ms、脉冲间隔0.02 ms、脉冲群宽度5 ms、脉冲群间隔60 ms、磁场强度为0~3.0 mT的均匀磁场,对细胞进行辐照干预(图 1)。
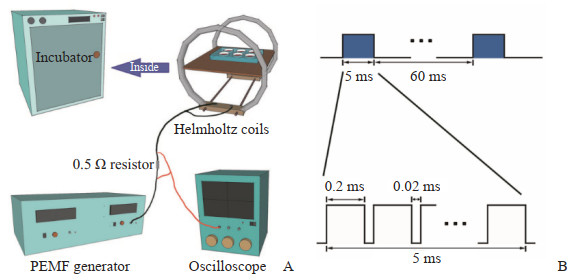
|
图 1 PEMF发生器体外辐照细胞示意图 Fig 1 Schematic diagram of PEMF exposure of cells in vitro A: PEMF exposure system comprises a pulsed signal generator and Helmholtz coil pair assembly with two-coil array. An oscilloscope was used to monitor waveform and amplitude of current. B: PEMF generator produced an open-circuit PEMF waveform (burst width 5 ms, pulse width 0.2 ms, pulse wait 0.02 ms, burst wait 60 ms, pulse rise 0.3 ms, pulse fall 2.0 ms). PEMF: Pulsed electromagnetic field. |
1.6 筛选适宜场强的PEMF实验分组
取第3代hPDLSC添加成骨培养液培养,自第1天起每间隔12 h辐照细胞1 h,设置对照组、0.5 mT PEMF干预组、1.0 mT PEMF干预组、1.5 mT PEMF干预组、2.0 mT PEMF干预组、2.5 mT PEMF干预组、3.0 mT PEMF干预组,分别给予15 Hz频率的0、0.5、1.0、1.5、2.0、2.5、3.0 mT PEMF进行干预。
1.7 JNK通路在PEMF促进hPDLSC成骨分化中作用的实验分组辐照条件为15 Hz频率2.5 mT PEMF自第1天起每间隔12 h辐照细胞1 h,使用DMSO稀释SP600125,设置以下分组:对照组(含DMSO无PEMF辐照),2.5 mT PEMF干预组(含DMSO以2.5 mT PEMF辐照),10 μmol/L SP600125组(添加10 μmol/L SP600125以2.5 mT PEMF辐照),20 μmol/L SP600125组(添加20 μmol/L SP600125以2.5 mT PEMF辐照),30 μmol/L SP600125组(添加30 μmol/L SP600125以2.5 mT PEMF辐照)。
1.8 ALP活性检测按照说明书要求先绘制ALP活性标准曲线。收集细胞并添加0.2% Triton X-100裂解细胞,添加ALP检测试剂,待反应完成后通过酶标仪在405 nm处检测光密度(D)值,根据标准曲线计算ALP活性。
1.9 成骨相关基因表达检测使用0.2% Triton X-100裂解收集的细胞,提取总RNA并测定浓度和纯度,通过试剂盒反转录为cDNA,反应条件为37 ℃ 15 min、85 ℃ 5 s。通过qPCR检测ALP、Runx2、OPN、OCN基因表达,引物序列见表 1,反应条件为95 ℃ 5 s、60 ℃ 15 s、72 ℃ 15 s,共45个循环。结果采用2-ΔΔCt法进行定量。
|
|
表 1 基因引物序列 Tab 1 Sequences of gene primers |
1.10 蛋白表达检测
收集细胞加入RIPA裂解液,冰上裂解30 min,离心收集上清液。按说明书要求配制BCA工作液并测定蛋白浓度。分别配制分离胶和浓缩胶,进行凝胶电泳。转膜封闭后加入一抗和内参(GAPDH)抗体,4 ℃孵育过夜,清洗膜,孵育二抗1 h后清洗,发光剂显色,胶片曝光并采集图像,使用ImageJ软件分析蛋白条带。
1.11 统计学处理应用SPSS 19.0软件进行统计学分析,应用GraphPad Prism 8.0软件绘图。计量资料以x±s表示,组间比较采用单因素方差分析,两两比较采用Tukey’s检验。检验水准(α)为0.05。
2 结果 2.1 hPDLSC鉴定结果经CD146免疫磁珠分选获得的细胞形态学呈锥形、椭圆形、三角形或不规则形,细胞小且胞质内细胞器较少,细胞核呈卵圆形且占细胞内体积的比例较大(图 2 A),经流式细胞术鉴定STRO1和CD146双阳性细胞的比例约为55.3%(图 2 B)。免疫荧光染色结果显示角蛋白是阴性表达且波形蛋白呈阳性表达(图 2C),说明分选获得的细胞为中胚层来源间充质细胞,且无外胚层来源细胞污染。
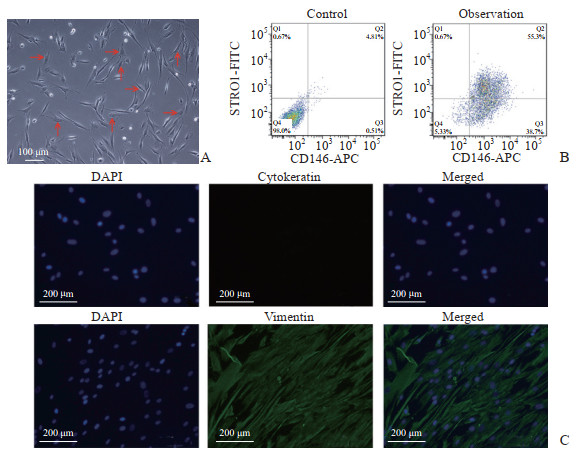
|
图 2 hPDLSC鉴定 Fig 2 Identification of hPDLSCs A: Isolated CD146+ hPDLSCs were round, fusiform, and small (arrows). The cells had less cytoplasm and a large nucleus. B: Flow cytometry showed that the double-positive rate of CD146 and STRO1 in cells obtained by immunomagnetic beads was 55.3%. C: Immunofluorescence staining showed that isolated hPDLSCs were vimentin-positive, but were cytokeratin-negative. hPDLSC: Human periodontal ligament stem cell; APC: Allophycocyanin; FITC: Fluoresceine isothiocyanate; DAPI: 4', 6-diamidino-2-phenylindole. |
2.2 PEMF对hPDLSC成骨分化的影响
实验第7天,ALP活性检测结果显示,与对照组相比,1.5、2.0、2.5、3.0 mT磁场强度的PEMF均促进了ALP蛋白活性表达(P均<0.05);其中2.5 mT PEMF干预组ALP活性高于其他分组(P均<0.05,图 3A)。第7天基因检测结果显示,与对照组相比,1.0、1.5、2.0、2.5、3.0 mT磁场强度的PEMF均上调了ALP基因表达(P均<0.05),其中2.5 mT PEMF干预组ALP基因表达水平高于其他分组(P均<0.05,图 3B);与对照组相比,1.5、2.0、2.5、3.0 mT磁场强度的PEMF上调了Runx2基因表达(P均<0.05),其中2.5 mT组Runx2基因表达水平高于其他分组(P均<0.05,图 3C)。第14天基因检测结果显示,与对照组相比,1.5、2.0、2.5、3.0 mT磁场强度的PEMF上调了OPN基因表达(P均<0.05),其中2.5 mT PEMF干预组OPN基因表达水平高于其他分组(P均<0.05,图 3D);与对照组相比,1.0、1.5、2.0、2.5、3.0 mT磁场强度的PEMF上调了OCN基因表达(P均<0.05),其中2.5 mT PEMF干预组OCN基因表达水平高于其他分组(P均<0.05,图 3E)。
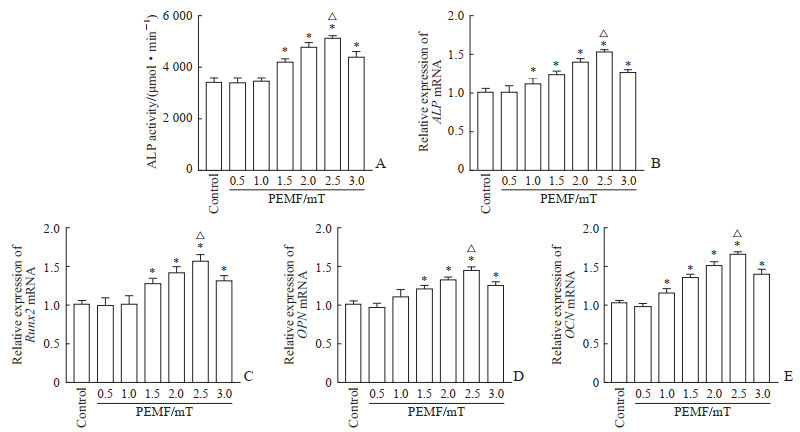
|
图 3 不同磁场强度的PEMF刺激对hPDLSC内ALP活性及成骨相关基因表达的影响 Fig 3 Effect of PEMF stimulation of different intensities on expression of osteogenesis-related genes in hPDLSCs A: ALP activity in hPDLSCs exposed to PEMF stimulation of different intensities was measured via a quantitative kit on day 7; B, C: mRNA expression of ALP (B) and Runx2 (C) in hPDLSCs exposed to PEMF stimulation of different intensities was detected by qPCR on day 7; D, E: mRNA expression of OPN (D) and OCN (E) in hPDLSCs exposed to PEMF stimulation of different intensities detected by qPCR on day 14. *P < 0.05 vs conrtol group; △P < 0.05 vs other intensity groups. n=4, x±s. PEMF: Pulsed electromagnetic field; hPDLSC: Human periodontal ligament stem cell; ALP: Alkaline phosphatase; Runx2: Runt-related transcription factor 2; OPN: Osteopontin; OCN: Osteoclain; qPCR: Quantitative polymerase chain reaction. |
2.3 PEMF辐照后hPDLSC内JNK蛋白磷酸化水平改变及SP600125的抑制作用
实验第7天,蛋白质印迹法检测结果显示15 Hz、2.5 mT PEMF明显促进了hPDLSC内JNK、p-JNK蛋白的表达,与对照组相比差异均有统计学意义(P均<0.05)。与2.5 mT PEMF干预组相比,添加不同浓度SP600125后,hPDLSC内JNK蛋白表达变化不明显(P均>0.05),而p-JNK蛋白表达水平明显下降(P均<0.05)。见图 4。
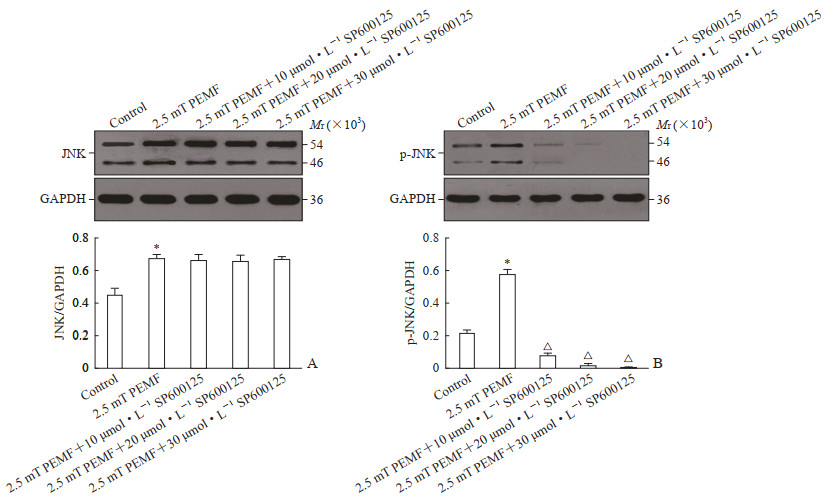
|
图 4 不同浓度SP600125对PEMF刺激下hPDLSC内JNK(A)、p-JNK(B)蛋白表达的影响 Fig 4 Effects of SP600125 on protein expression of JNK (A) and p-JNK (B) in hPDLSCs stimulated by PEMF *P < 0.05 vs control group; △P < 0.05 vs 2.5 mT PEMF group. n=4, x±s. PEMF: Pulsed electromagnetic field; hPDLSC: Human periodontal ligament stem cell; JNK: c-Jun N-terminal kinase; p-JNK: Phosphorylated-JNK; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
2.4 SP600125抑制剂对PEMF促hPDLSC成骨分化能力的影响
实验第7天,ALP活性检测结果显示,经不同浓度SP600125作用后15 Hz、2.5 mT PEMF刺激下hPDLSC的ALP活性水平均高于对照组(P均<0.05),均较单纯2.5 mT PEMF干预组下降(P均<0.05),且20 μmol/L SP600125组和30 μmol/L SP600125组ALP活性水平低于10 μmol/L SP600125组(P均<0.05),但20 μmol/L SP600125组与30 μmol/L SP600125组之间ALP活性水平差异无统计学意义(P>0.05,图 5A)。第7天qPCR检测结果显示,不同浓度SP600125作用后15 Hz、2.5 mT PEMF刺激下hPDLSC成骨分化早期相关基因ALP、Runx2的表达水平均高于对照组(P均<0.05),但均低于单纯2.5 mT PEMF干预组(P均<0.05),且20 μmol/L SP600125组和30 μmol/L SP600125组ALP、Runx2基因表达水平均低于10 μmol/L SP600125组(P均<0.05),但20 μmol/L SP600125组与30 μmol/L SP600125组之间的差异无统计学意义(P>0.05,图 5B、5C)。第14天qPCR检测结果显示,不同浓度SP600125作用后15 Hz、2.5 mT PEMF刺激下hPDLSC成骨分化中晚期相关基因OPN、OCN的表达水平均高于对照组(P均<0.05),但均低于单纯2.5 mT PEMF干预组(P均<0.05),且20 μmol/L SP600125组和30 μmol/L SP600125组OPN、OCN基因表达水平均低于10 μmol/L SP600125组(P均<0.05),但20 μmol/L SP600125组与30 μmol/L SP600125组之间的差异无统计学意义(P>0.05,图 5D、5E)。
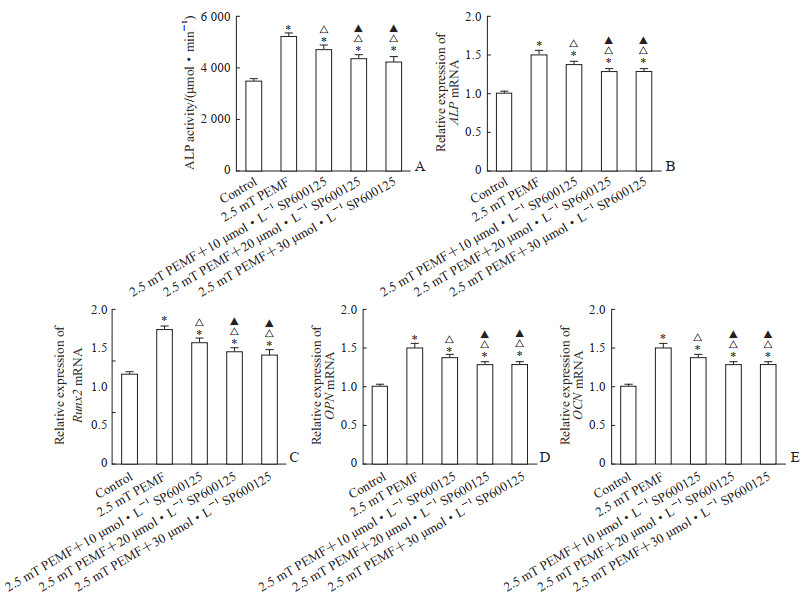
|
图 5 SP600125对PEMF促hPDLSC成骨分化能力的影响 Fig 5 Effect of SP600125 on osteogenic differentiation ability in hPDLSCs stimulated by PEMF A: The ALP activity in hPDLSCs stimulated by PEMF was assessed by a quantitative assay after treatment with SP600125 of different concentrations on day 7; B, C: The ALP (B) and Runx2 (C) mRNA expression in hPDLSC stimulated by PEMF was assessed by qPCR after treatment with SP600125 on day 7; D, E: The OPN (D) and OCN (E) mRNA expression was assessed by qPCR after treatment with SP600125 of different concentrations on day 14. *P < 0.05 vs control group; △P < 0.05 vs 2.5 mT PEMF group; ▲P < 0.05 vs 2.5 mT PEMF+10 μmol/L SP600125 group. n=4, x±s. PEMF: Pulsed electromagnetic field; hPDLSC: Human periodontal ligament stem cell; ALP: Alkaline phosphatase; Runx2: Runt-related transcription factor 2; qPCR: Quantitative polymerase chain reaction; OPN: Osteopontin; OCN: Osteoclain. |
3 讨论
牙周膜干细胞是牙周韧带组织中具有成骨样、成脂肪样、成软骨样等多向分化潜能的细胞,是口腔生物工程和牙周组织再生领域较为理想的种子细胞[2]。干细胞的成骨分化会受到生物、物理、化学等诸多因素的影响,越来越多的文献证实了低频电磁场可以促进干细胞成骨分化。PEMF作为一种生物物理刺激能够在组织中诱导生物电流而发挥作用,另外其物理特性具有“窗口效应”,不同频率、波形、强度的电磁场对特定的细胞产生不同的生物效应[3-4, 15],目前认为有效的电磁场频率应接近正常机体活动频率[4, 16]。本研究发现15 Hz的PEMF在1.0~2.5 mT磁场强度区间,随着磁场强度的增强,hPDLSC内成骨标志物ALP活性及ALP、Runx2、OPN、OCN等基因表达增强,然而强度高于2.5 mT以后,成骨分化相关基因表达明显减弱,提示磁场强度窗口可能在2.5 mT附近。
目前为止关于PEMF促进骨形成的具体机制已做了大量研究,但仍未明确。有研究发现PEMF可能影响细胞内Ca2+的移动和细胞膜电位变化进而促进成骨作用[6, 17],还能通过上调与成骨相关的多种生长因子如骨形态发生蛋白(bone morphogenetic protein,BMP)2、TGF-β、骨保护素、OPN、Runx2、ALP、基质金属蛋白酶(matrix metalloproteinase,MMP)1、MMP3、一氧化氮的合成[9],下调与骨基质吸收相关的细胞因子如前列腺素E2、IL-6的表达分泌,从而促进骨组织的形成[18]。Wang等[19]发现PEMF可能通过初级纤毛介导,直接或间接激活可溶性腺苷酸环化酶(soluble adenylyl cyclase,sAC)-cAMP-蛋白激酶A(protein kinase A,PKA)-cAMP反应元件结合蛋白(cAMP response element-binding protein,CREB)信号通路,增高细胞内cAMP水平,促进PKA和CREB的磷酸化,并诱导磷酸化CREB的核转位,从而促进成骨分化。Cheng等[20]学者认为PEMF还可以通过一氧化氮-环岛苷酸-蛋白激酶G途径刺激大鼠成骨细胞促进成骨分化和矿化。PEMF通过激活Wnt/β-联蛋白信号通路,促进Wnt1、Wnt3a、Wnt10b等蛋白表达,从而促进成骨分化[14-21]。PEMF还可能通过激活TGF-β/Smad 1/5/8、BMP/Smad 1/5/8信号转导途径,上调转录因子Runx2和Osterix的表达,促进间充质干细胞成骨分化[7]。
新近研究发现PEMF与MAPK家族成员关系密切,MAPK作为普遍存在于哺乳动物细胞中的一条高度保守的信号通路,在调控细胞增殖、分化及对外界环境的应激反应过程中起着重要作用[22],其家族成员包括细胞外信号调节激酶(extracellular signal-regulated kinases,ERK)、JNK及p38激酶[12, 22]。Caliogna等[5]认为MAPK途径在PEMF诱导的成骨分化中起着关键作用。Ehnert等[23]研究表明低频PEMF通过触发ERK1/2信号通路,可显著提高成骨细胞内线粒体和ALP活性,并促进矿化基质的形成。另一项研究也证实了电磁场可引起PKA途径的激活和ERK1/2磷酸化的增加,ALP活性、Runx2、BMP2和OCN的表达水平升高,诱导骨髓间充质干细胞成骨分化[24]。Peluso等[25]发现电磁场能够促进成纤维细胞生长因子激活ERK1/2蛋白的磷酸化,上调ALP基因表达,诱导hPDLSC早期成骨分化。Poh等[26]研究发现,26 Hz PEMF通过激活ERK1/2信号通路,促进脂肪来源间充质干细胞增殖、防止细胞死亡、协助翻译成骨蛋白等重要作用。Soda等[27]认为60 Hz、3 mT的PEMF通过激活p38信号通路促进MC3T3-E1细胞成骨分化。Hong等[28]则发现7.5 Hz的PEMF可以通过p38信号通路促进脂肪来源干细胞向成骨细胞分化,而45 Hz的PEMF则抑制成骨分化。这些研究表明不同参数的PEMF诱导干细胞成骨分化过程中,能否激活MAPK信号通路以及产生的生物效应不尽相同。
JNK通路主要被各种细胞因子(TNF-α、IL-1等)、应激(紫外线、电离辐射、氧化损伤等)等外界刺激活化,激活的JNK蛋白通过c-Jun促进激活蛋白-1(activator protein -1,AP-1)复合物的形成,调控与JNK相关的基因表达,从而发挥生物学效应[10]。Wang等[12]研究发现JNK信号通路参与BMP9诱导的hPDLSC成骨分化,在此过程中p-JNK1/2可能与Smad2/3蛋白发生相互作用。Song等[29]证实淫羊藿苷导致ERK1/2和JNK蛋白的磷酸化增加,促进了MC3T3-E1细胞成骨分化和基质矿化。本研究中蛋白质印迹法检测结果显示,相比对照组,15 HZ、2.5 mT的PEMF明显促进了hPDLSC内p-JNK蛋白表达,且在SP600125抑制剂作用下,p-JNK蛋白水平降低,同时ALP、OPN、OCN等成骨标志物表达均有不同程度的下降,表明PEMF通过激活JNK通路参与诱导hPDLSC内成骨相关基因的表达;但在添加高浓度SP600125抑制剂,JNK通路近乎被阻断的情况下,PEMF仍能促进PDLSC成骨分化,说明JNK通路不是唯一路径。现有研究表明JNK主要通过激活c-Jun并提高AP-1的转录活性传递信号,活化的AP-1能调控转录激活因子2(activating transcription factor 2,ATF2)、TNF-α、IL、干扰素、环氧合酶-2等表达,但这些底物均与骨生长发育没有直接关联,并且JNK通路的下游也不包含成骨相关转录因子,猜测JNK通路可能通过串话(crosstalk)其他成骨通路参与成骨分化过程。
综上所述,适宜参数的PEMF(15 Hz,2.5 mT)可以较好地促进hPDLSC成骨分化,并在该条件下JNK通路是其功能机制之一。本实验研究进一步探索了PEMF诱导成骨的功能机制,这将为低频PEMF应用于临床修复牙槽骨的缺损提供理论依据。
| [1] |
TELES F, COLLMAN R G, MOMINKHAN D, WANG Y. Viruses, periodontitis, and comorbidities[J]. Periodontol 2000, 2022, 89: 190-206. DOI:10.1111/prd.12435 |
| [2] |
TOMOKIYO A, WADA N, MAEDA H. Periodontal ligament stem cells: regenerative potency in periodontium[J]. Stem Cells Dev, 2019, 28: 974-985. DOI:10.1089/scd.2019.0031 |
| [3] |
UMIATIN U, HADISOEBROTO DILOGO I, SARI, KUSUMA WIJAYA S. Histological analysis of bone callus in delayed union model fracture healing stimulated with pulsed electromagnetic fields (PEMF)[J/OL]. Scientifica (Cairo), 2021, 2021: 4791172. DOI: 10.1155/2021/4791172.
|
| [4] |
WANG T T, WANG P, CAO Z Z, WANG X X, WANG D L, SHEN Y X, et al. Effects of BMP9 and pulsed electromagnetic fields on the proliferation and osteogenic differentiation of human periodontal ligament stem cells[J]. Bioelectromagnetics, 2017, 38: 63-77. DOI:10.1002/bem.22018 |
| [5] |
CALIOGNA L, MEDETTI M, BINA V, BRANCATO A M, CASTELLI A, JANNELLI E, et al. Pulsed electromagnetic fields in bone healing: molecular pathways and clinical applications[J/OL]. Int J Mol Sci, 2021, 22: 7403. DOI: 10.3390/ijms22147403.
|
| [6] |
PETECCHIA L, SBRANA F, UTZERI R, VERCELLINO M, USAI C, VISAI L, et al. Electro-magnetic field promotes osteogenic differentiation of BM-hMSCs through a selective action on Ca2+-related mechanisms[J/OL]. Sci Rep, 2015, 5: 13856. DOI: 10.1038/srep13856.
|
| [7] |
MARTINI F, PELLATI A, MAZZONI E, SALATI S, CARUSO G, CONTARTESE D, et al. Bone morphogenetic protein-2 signaling in the osteogenic differentiation of human bone marrow mesenchymal stem cells induced by pulsed electromagnetic fields[J/OL]. Int J Mol Sci, 2020, 21: 2104. DOI: 10.1038/srep13856.
|
| [8] |
XU H, ZHANG J, LEI Y, HAN Z, RONG D, YU Q, et al. Low frequency pulsed electromagnetic field promotes C2C12 myoblasts proliferation via activation of MAPK/ERK pathway[J]. Biochem Biophys Res Commun, 2016, 479: 97-102. DOI:10.1016/j.bbrc.2016.09.044 |
| [9] |
YUAN J, XIN F, JIANG W X. Underlying signaling pathways and therapeutic applications of pulsed electromagnetic fields in bone repair[J]. Cell Physiol Biochem, 2018, 46: 1581-1594. DOI:10.1159/000489206 |
| [10] |
WESTON C R, DAVIS R J. The JNK signal transduction pathway[J]. Curr Opin Cell Biol, 2007, 19: 142-149. DOI:10.1016/j.ceb.2007.02.001 |
| [11] |
ZHENG W W, CHEN Q, ZHANG Y, XIA R, GU X P, HAO Y F, et al. BMP9 promotes osteogenic differentiation of SMSCs by activating the JNK/Smad2/3 signaling pathway[J]. J Cell Biochem, 2020, 121: 2851-2863. DOI:10.1002/jcb.29519 |
| [12] |
WANG P, WANG Y N, TANG W Z, WANG X X, PANG Y N, YANG S, et al. Bone morphogenetic protein-9 enhances osteogenic differentiation of human periodontal ligament stem cells via the JNK pathway[J/OL]. PLoS One, 2017, 12: e0169123. DOI: 10.1371/journal.pone.0169123.
|
| [13] |
LI G, QI W Q, LI X X, ZHAO J W, LUO M H, CHEN J J. Recent advances in c-Jun N-terminal kinase (JNK) inhibitors[J]. Curr Med Chem, 2021, 28: 607-627. DOI:10.2174/0929867327666200210144114 |
| [14] |
SHAO X, YAN Z D, WANG D, YANG Y Q, DING Y J, LUO E P, et al. Pulsed electromagnetic fields ameliorate skeletal deterioration in bone mass, microarchitecture, and strength by enhancing canonical Wnt signaling-mediated bone formation in rats with spinal cord injury[J]. J Neurotrauma, 2021, 38: 765-776. DOI:10.1089/neu.2020.7296 |
| [15] |
DAISH C, BLANCHARD R, FOX K, PIVONKA P, PIROGOVA E. The application of pulsed electromagnetic fields (PEMFs) for bone fracture repair: past and perspective findings[J]. Ann Biomed Eng, 2018, 46: 525-542. DOI:10.1007/s10439-018-1982-1 |
| [16] |
GALLI C, PEDRAZZI G, GUIZZARDI S. The cellular effects of pulsed electromagnetic fields on osteoblasts: a review[J]. Bioelectromagnetics, 2019, 40: 211-233. DOI:10.1002/bem.22187 |
| [17] |
TONG J, SUN L J, ZHU B, FAN Y, MA X F, YU L Y, et al. Pulsed electromagnetic fields promote the proliferation and differentiation of osteoblasts by reinforcing intracellular calcium transients[J]. Bioelectromagnetics, 2017, 38: 541-549. DOI:10.1002/bem.22076 |
| [18] |
SHEN W W, ZHAO J H. Pulsed electromagnetic fields stimulation affects BMD and local factor production of rats with disuse osteoporosis[J]. Bioelectromagnetics, 2010, 31: 113-119. |
| [19] |
WANG Y Y, PU X Y, SHI W G, FANG Q Q, CHEN X R, XI H R, et al. Pulsed electromagnetic fields promote bone formation by activating the sAC-cAMP-PKA-CREB signaling pathway[J]. J Cell Physiol, 2019, 234: 2807-2821. DOI:10.1002/jcp.27098 |
| [20] |
CHENG G, ZHAI Y, CHEN K, ZHOU J, HAN G, ZHU R, et al. Sinusoidal electromagnetic field stimulates rat osteoblast differentiation and maturation via activation of NO-cGMP-PKG pathway[J]. Nitric Oxide, 2011, 25: 316-325. DOI:10.1016/j.niox.2011.05.009 |
| [21] |
ZHAI M M, JING D, TONG S C, WU Y, WANG P, ZENG Z B, et al. Pulsed electromagnetic fields promote in vitro osteoblastogenesis through a Wnt/β-catenin signaling-associated mechanism[J]. Bioelectromagnetics, 2016, 37: 152-162. DOI:10.1002/bem.21961 |
| [22] |
ZHANG B, XIE Y L, NI Z H, CHEN L. Effects and mechanisms of exogenous electromagnetic field on bone cells: a review[J]. Bioelectromagnetics, 2020, 41: 263-278. DOI:10.1002/bem.22258 |
| [23] |
EHNERT S, FALLDORF K, FENTZ A K, ZIEGLER P, SCHRÖTER S, FREUDE T, et al. Primary human osteoblasts with reduced alkaline phosphatase and matrix mineralization baseline capacity are responsive to extremely low frequency pulsed electromagnetic field exposure-clinical implication possible[J]. Bone Rep, 2015, 3: 48-56. DOI:10.1016/j.bonr.2015.08.002 |
| [24] |
YONG Y, MING Z D, FENG L, CHUN Z W, HUA W. Electromagnetic fields promote osteogenesis of rat mesenchymal stem cells through the PKA and ERK1/2 pathways[J/OL]. J Tissue Eng Regen Med, 2016, 10: E537-E545. DOI: 10.1002/term.1864.
|
| [25] |
PELUSO V, RINALDI L, RUSSO T, OLIVIERO O, DI VITO A, GARBI C, et al. Impact of magnetic stimulation on periodontal ligament stem cells[J/OL]. Int J Mol Sci, 2021, 23: 188. DOI: 10.3390/ijms23010188.
|
| [26] |
POH P S P, SEELIGER C, UNGER M, FALLDORF K, BALMAYOR E R, VAN GRIENSVEN M. Osteogenic effect and cell signaling activation of extremely low-frequency pulsed electromagnetic fields in adipose-derived mesenchymal stromal cells[J/OL]. Stem Cells Int, 2018, 2018: 5402853. DOI: 10.1155/2018/5402853.
|
| [27] |
SODA A, IKEHARA T, KINOUCHI Y, YOSHIZAKI K. Effect of exposure to an extremely low frequency-electromagnetic field on the cellular collagen with respect to signaling pathways in osteoblast-like cells[J]. J Med Invest, 2008, 55(3/4): 267-278. |
| [28] |
HONG J M, KANG K S, YI H G, KIM S Y, CHO D W. Electromagnetically controllable osteoclast activity[J]. Bone, 2014, 62: 99-107. DOI:10.1016/j.bone.2014.02.005 |
| [29] |
SONG L, ZHAO J, ZHANG X, LI H, ZHOU Y. Icariin induces osteoblast proliferation, differentiation and mineralization through estrogen receptor-mediated ERK and JNK signal activation[J]. Eur J Pharmacol, 2013, 714: 15-22. DOI:10.1016/j.ejphar.2013.05.039 |
 2023, Vol. 44
2023, Vol. 44


