中医脾虚证患者可见胃肠黏膜损伤的临床表现[1-2],益气健脾是脾虚证的主要治则,益气健脾方药有胃肠黏膜保护作用。黄芪是常用的益气健脾中药,含有黄芪的方剂用于治疗胃肠黏膜损伤病变也取得良好疗效,黄芪建中汤联合西药(奥美拉唑、阿莫西林、克拉霉素、枸橼酸铋钾)治疗脾胃虚寒型胃溃疡,可促进胃溃疡愈合,改善消化功能[3];白术黄芪汤加味联合西药柳氮磺胺吡啶治疗溃疡性结肠炎能改善患者临床症状、缓解炎症反应,且疗效优于单用西药柳氮磺胺吡啶[4];以黄芪+四君子汤为基础方协助治疗克罗恩病能有效缓解及改善患者生活质量,对活动期有协助缓解作用[5-6]。这些研究成果为开展黄芪对胃肠黏膜保护机制的研究提供了临床疗效基础。
胃肠黏膜损伤修复包括上皮细胞迁移、增殖、分化、黏膜重建等,多胺在胃肠黏膜损伤修复中起重要作用[7]。本课题组前期动物实验结果显示,黄芪、白术、党参、甘草及四君子汤的水提物或多糖提取物有防治大鼠应激性胃溃疡的作用,其机制与其提高胃黏膜多胺含量有关[8-10];四君子汤水提物和多糖提取物对吲哚美辛所致大鼠胃或小肠黏膜损伤有防治作用,可提高胃和小肠黏膜多胺水平,提高胃和小肠黏膜紧密连接和黏附连接蛋白表达,对肠通透性指标(血浆D-乳酸)增高和黏膜Ca2+含量降低有改善作用[11-12];上述结果表明益气健脾中药多糖提取物的胃肠黏膜保护作用与传统剂型水提物的药效相似,多糖是其有效组分之一。细胞水平的研究显示,黄芪、白术、党参、甘草及四君子汤的提取物(多糖或黄酮或皂苷等)可通过作用于多胺及其调控通路促进大鼠小肠隐窝上皮IEC-6细胞的增殖、迁移、分化、细胞连接及上皮屏障完整性,表明益气健脾中药胃肠黏膜损伤修复作用与其影响多胺及其调控有关,其中对Ca2+的调节作用是关键环节之一[13-23]。
本课题组前期研究表明,黄芪多糖提取物可防治大鼠应激性胃溃疡,机制与其提高胃黏膜多胺有关[10];黄芪水提物能防治吲哚美辛所致大鼠小肠黏膜损伤并降低模型动物死亡率[24];黄芪总皂苷能促进IEC-6细胞增殖,使G0/G1期细胞百分比下降而G2/M+S期细胞百分比上升,提高多胺调控的细胞增殖调节因子c-Myc、RhoA和细胞周期蛋白依赖性激酶2(cyclin-dependent kinase 2,Cdk2)蛋白表达,逆转多胺合成抑制剂二氟甲基鸟氨酸(difluoromethylornithine,DFMO)对上述指标的抑制作用[15, 24]。黄芪多糖能促进IEC-6细胞迁移,提高钾通道蛋白Kv1.1表达,促进细胞膜电位超极化,提高细胞Ca2+水平,提高Rho-GTP蛋白(Cdc42、Rac1、RhoA)表达,逆转DFMO对上述指标的抑制作用[18]。本研究在此基础上提取分离黄芪多糖,观察其对钙通道蛋白瞬时受体电位通道1(transient receptor potential channel 1,TRPC1)、Ca2+感受器正负向调节蛋白基质交感分子(stromal interaction molecule,STIM)1和STIM2、Ca2+调节蛋白复合体STIM1/TRPC1和STIM1/STIM2等的影响,并研究黄芪多糖促进IEC-6细胞迁移的作用机制,为探讨黄芪的胃肠黏膜保护作用机制提供参考。
1 材料和方法 1.1 药材豆科植物蒙古黄芪[Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.)Hsiao]的干燥根(批号201506,产地为甘肃)购于广州同康药业有限公司,经广州中医药大学中药鉴定教研室童家赟副教授鉴定符合《中华人民共和国药典》规定。
1.2 细胞株IEC-6细胞(货号CRL-1592,批号58541019),由美国菌种保藏中心提供,取22~28代细胞用于实验。
1.3 试剂DMEM高糖培养基(货号12800-058)、FBS(货号10099-141)、青霉素-链霉素双抗(货号15140-122)、0.25%胰蛋白酶-EDTA(货号25200-056)购自美国Gibco公司;胰蛋白酶1∶250(货号T810)、Triton X-100(货号0694)、Tris(货号0497)、甘氨酸(货号0167)购自美国Amresco公司;亚精胺(spermidine,SPD;货号C10010500BT)购自美国HyClone公司;SPD(货号124-20-9)购自德国Sigma公司;DFMO(货号288500-25MG)购自德国Calbiochem公司;RNA提取试剂盒(货号9767)、PrimeScriptTM反转录试剂盒(货号RR036)、SYBR® Premix Ex TaqTM Ⅱ(Tli RNaseHPlus,货号RR820A)购自日本TaKaRa公司;DEPC水(货号RT121)购自天根生化科技(北京)有限公司;山羊血清封闭液(货号C-0005)购自北京博奥森生物技术公司;4% 多聚甲醛(货号DF0135)、DAPI染色封片剂(货号DZ0125-10 mL)、聚乙烯醇荧光封片剂(货号IH0258)购自北京雷根生物技术有限公司;牛血清白蛋白Ⅴ(货号735094)购自瑞士Roche公司;STIM1(货号5668S)、抗兔IgG Fab2 AlexaFluor® 488分子探针(货号4412S)购自美国CST公司;兔STIM1单抗(货号ab108994)、兔TRPC1单抗(货号ab51255)购自英国Abcam公司;脱脂奶粉(货号BS102-100 g)购自广州硕谱生物科技有限公司;蛋白A+G琼脂糖(货号P2012)、蛋白质印迹法及免疫沉淀法细胞裂解液(货号P0013K)、PMSF(货号ST5062)、SDS-PAGE凝胶配制试剂盒(货号P0012A、P0012B)、5×SDS-PAGE蛋白上样缓冲液(货号P0015)购自上海碧云天生物技术有限公司;Precision Plus ProteinTM Standards(货号161-0374)、ECL化学发光液(货号170-5060)购自美国Bio-Rad公司;PierceTM BCA蛋白检测试剂盒(货号23227)购自美国ThermoFisher Scientific公司;氯化钠、苯酚、硫酸、三氯甲烷、正丁醇、无水乙醇购自广州东巨玻璃仪器有限公司(均为分析纯)。
1.4 仪器AUW120D电子分析天平及Uvmini-1240紫外分光光度计购自日本Shimadzu公司;E2695型高效液相色谱仪、G 4000 PWXL色谱柱(7.8 mm×300 mm)、2414示差检测器购自美国Waters公司;IX-71型荧光倒置相差显微镜购自日本Olympus公司;3111型CO2培养箱、MULTFUGE X1R型离心机、NanoDrop 2000紫外微量分光光度计购自美国ThermoFisher Scientific公司;CFX-96荧光定量PCR仪、iMarkTM酶标仪、ChemiDoxTM XRS+成像仪购自美国Bio-Rad公司;Mastercycler nexus X1 PCR仪购自德国Eppendorf公司;SPE型激光共聚焦显微镜购自德国Leica公司。
1.5 黄芪多糖受试药的制备取黄芪500 g,打粉,加入蒸馏水(2.5 L)后通过超声提取(35 kHz,60 ℃,1 h)3次,合并水提液,浓缩至适量,加入95%乙醇至含二醇量达80%,静置过夜,取沉淀,浓缩成干浸膏,得到水提醇沉物,即“黄芪多糖1”。再以Sevage法去蛋白,得到“黄芪多糖2”。取“黄芪多糖2”样品,经DEAE-纤维素柱(3.0 cm×35 cm)层析初步分离;用蒸馏水洗脱,流速3 mL/min,收集洗脱液,减压浓缩,真空干燥得到“黄芪多糖3”,即为本实验受试药(以下统称黄芪多糖,得率1.50%,苯酚-硫酸法测得糖含量为66.3%)。实验剂量以黄芪多糖提取物重量计算。实验时黄芪多糖样品以PBS配成所需浓度,0.22 μm滤膜过滤,-20 ℃保存备用。
1.6 HPLC检测黄芪多糖黄芪多糖配成1 mg/mL,过0.45 μm滤膜,进行HPLC检测并记录图谱。HPLC条件:柱温为30 ℃,示差折光检测器温度为30 ℃;检测灵敏度为4;流动相为超纯水;流速为0.6 mL/min;进样量为20 μL。
1.7 细胞迁移实验(无钙培养)无Ca2+的DMEM高糖培养基配制:100 mL不含Ca2+的DMEM高糖培养基加11 mg丙酮酸钠和58.6 mgL-谷氨酰胺,用0.22 μm微孔滤膜过滤后,加入5%血清和1%双抗,4 ℃保存。
细胞迁移实验及给药方法:按文献[25-26]方法进行细胞培养和划痕,细胞划痕后迅速加入含各种药物的培养基2.5 mL[有钙对照组加入含Ca2+的高糖DMEM培养基2.5 mL;无钙对照组、阳性对照药(SPD 5 μmol/L)组、受试药(黄芪多糖20、40、80、160 mg/L)组均加入无Ca2+的高糖DMEM培养基2.5 mL]。37 ℃、5% CO2、饱和湿度条件下培养24 h。在荧光倒置相差显微镜下观察细胞迁移情况并拍照,每组3个复孔,每孔拍8个视野,用Image-Pro Plus软件统计细胞迁移数。
1.8 免疫荧光法检测STIM1蛋白移位及表达细胞爬片放入24孔培养板,加1 mL培养基在培养箱,预平衡15 min,吸弃培养基。细胞以4×104/mL接种于爬片,每孔1 mL,37 ℃、5% CO2、饱和湿度培养24 h,以200 μL移液器吸头做一划痕,PBS冲洗。空白组加完全培养基1 mL;DFMO模型组加含2.5 mmol/L DFMO的完全培养基1 mL;阳性对照药组加含5 μmol/L SPD的完全培养基1 mL(负荷实验同时加入DFMO);受试药组分别加入含40、80 mg/L黄芪多糖的完全培养基1 mL(负荷实验同时加入DFMO),每组6个复孔,37 ℃、5% CO2、饱和湿度下分别培养0 min、10 min、30 min、1 h、3 h、6 h。取出24孔板,吸弃培养基,PBS冲洗,预冷4%多聚甲醛固定15 min,吸弃固定液,PBS冲洗,用PBS配制的含5%山羊血清、0.3% Triton X-100的封闭液室温封闭1 h;加入一抗(用PBS配制的含1%牛血清白蛋白Ⅴ、0.3% Triton X-100的抗体稀释液稀释,稀释比例1∶250)置于湿盒,4 ℃孵育过夜,回收一抗,PBS冲洗;加入荧光探针(PBS配制含1%牛血清白蛋白Ⅴ、0.3% Triton X-100的抗体稀释液稀释,稀释比例1∶250)室温避光孵育1 h,吸弃二抗,PBS冲洗;加入DAPI染色封片剂,孵育5 min,吸弃封片剂,PBS冲洗;载玻片上加入聚乙烯醇荧光封片剂14 μL,将细胞爬片盖在载玻片上,指甲油封片一圈,通风橱内吹1~2 h,立即采用激光共聚焦显微镜检测。采用ImageJ1.53e软件对各组细胞荧光强度进行分析。
1.9 qPCR法检测TRPC1、STIM1、STIM2mRNA表达细胞接种于6孔板,培养24 h,移液器吸头沿各孔中央做3条划痕,PBS冲洗;空白组加完全培养基2.5 mL,DFMO模型组加含2.5 mmol/L DFMO的完全培养基2.5 mL,阳性对照药组加含5 μmol/L SPD的完全培养基2.5 mL(负荷实验同时加入DFMO),受试药组分别加入含20、40、80、160 mg/L黄芪多糖的完全培养基2.5 mL(负荷实验同时加入DFMO),每组3个复孔;培养24 h,弃培养基,PBS冲洗,每孔加0.5 mL PBS,将各孔细胞刮下并转移至1.5 mL离心管,25 800×g离心5 min,弃上清液,按试剂盒方法提取细胞总RNA,紫外分光光度计检测RNA纯度。用反转录试剂盒在37 ℃ 15 min、85 ℃ 5 s反应条件下对各组RNA反转录,得cDNA。cDNA加入SYBR® Premix Ex TaqTM Ⅱ荧光物质进行qPCR反应。TRPC1上游引物5'-AGCCTCTTGACAAACGAGGA-3',下游引物5'-ACCTGACATCTGTCCGAACC-3';STIM1上游引物5'-CCACCCTATTCTGCCTACTTC-3',下游引物5'-CTTTTGGATTCTTCCCATTCTC-3';STIM2上游引物5'-AGCAAACCAACAACCTCCAAC-3',下游引物5'-CTGACACGCCCACCTCATAAT-3';β-肌动蛋白上游引物5'-GGAGATTACTGCCCTG-GCTCCTA-3',下游引物5'-GACTCATCGTACTCC-TGCTTGCTG-3'。25 μL反应体系,95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共40个循环。反应结束后,采用荧光定量PCR仪分析并计算结果。以β-肌动蛋白作为内参对各样本进行相对定量,用2-ΔΔCt法计算TRPC1、STIM1、STIM2 mRNA表达,3次独立实验进行统计学分析。
1.10 蛋白质印迹法检测TRPC1、STIM1、STIM2蛋白表达细胞划痕并给药(分组和给药方法同mRNA检测实验)培养24 h后,吸弃培养基,PBS冲洗;每孔加0.5 mL PBS,将细胞刮下收集到1.5 mL离心管,25 800×g离心5 min,弃上清液;加含PMSF的RIPA裂解液提取细胞总蛋白质,采用BCA法测蛋白浓度。各组样品调至相同蛋白量,样品与5×SDS-PAGE蛋白上样缓冲液1∶4混匀,沸水中煮5 min,冰水浴1 min,-20 ℃保存。SDS-PAGE结束,制作电转“三明治”,300 mA电转90 min,TBST洗膜3次,5%脱脂奶粉室温封闭1 h,TBST洗膜,根据相应的蛋白分子量切膜。加入稀释的一抗(TRPC1抗体稀释比例为1∶5 000,STIM1抗体、STIM2抗体稀释比例均为1∶1 000,GAPDH稀释比例为1∶10 000),室温摇床孵育20 min,4 ℃孵育过夜;次日室温孵育20 min,TBST洗膜3次,回收一抗;室温孵育二抗1 h,TBST洗膜3次,加入ECL化学发光液反应5 min,显影。采用Image Lab软件分析蛋白条带光密度比值,3次独立实验后进行统计学分析。
1.11 免疫沉淀法检测STIM1/TRPC1、STIM1/STIM2复合体蛋白表达细胞裂解及总蛋白提取后,各样品取500 μg蛋白,加入4 μg STIM1抗体,4 ℃摇床孵育过夜;加入40 μL蛋白A+G琼脂糖,4 ℃孵育3 h。4 ℃ 1 000×g离心5 min,弃上清液;PBS洗涤沉淀5次,4 ℃ 1 000×g离心5 min,弃上清液;加入50 μL SDS-PAGE蛋白上样缓冲液,沸水中煮5 min;用TRPC1或STIM2抗体(TRPC1抗体稀释比例为1∶5 000,STIM1抗体、STIM2抗体稀释比例均为1∶1 000)进行后续蛋白质印迹实验,检测TRPC1或STIM2是否被STIM1抗体沉淀下来。
1.12 统计学处理应用SPSS 21.0软件进行统计学分析。数据以x±s表示,组间比较采用单因素方差分析,多重比较采用最小显著性差异法(方差齐)或Dunnett’s T3检验(方差不齐)。检验水准α为0.05。
2 结果 2.1 HPLC检测结果见图 1,黄芪多糖有3个吸收峰,最大吸收峰保留时间为21 min,所占比例为79.7%,提示黄芪多糖样品为杂多糖。
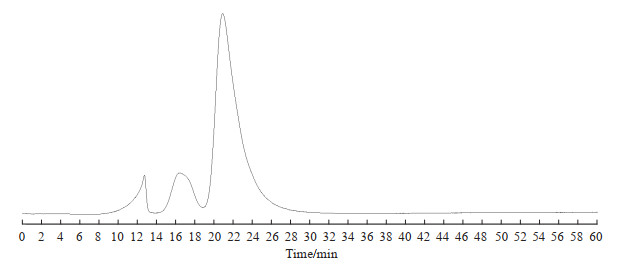
|
图 1 APS的高效液相色谱图 Fig 1 High performance liquid chromatogram of APS APS: Astragalus polysaccharide. |
2.2 黄芪多糖能提高无钙培养条件下IEC-6细胞的迁移能力
结果(图 2)显示,当去除了胞外Ca2+内流来源时细胞迁移数较有钙对照组减少[139.17±80.14 vs 488.41±42.09,P<0.01)];各剂量(20、40、80、160 mg/L)黄芪多糖均可提高无钙培养时的细胞迁移数,分别为288.94±80.14、371.27±71.74、236.63±86.04、262.75±92.71,与无钙对照组相比差异均有统计学意义(P<0.05或P<0.01),但不能使细胞迁移数恢复至有钙培养的水平(按公式“黄芪多糖各剂量组细胞迁移数均值/有钙对照组迁移数均值×100%”计算,黄芪多糖4个剂量组细胞迁移数为有钙对照组的48.5%~76.0%)。
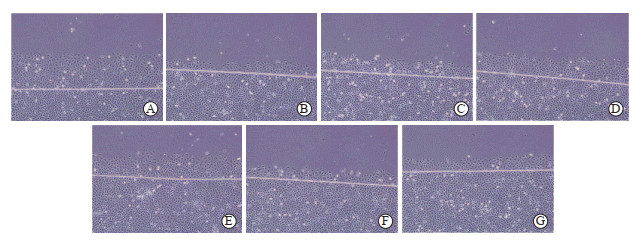
|
图 2 APS对无钙培养下IEC-6细胞迁移的影响(100×) Fig 2 Effect of APS on IEC-6 cell migration in calcium-free culture (100×) A: Ca2+(+) control group; B: Ca2+(-) control group; C: Ca2+(-)+5 μmol/L SPD; D: Ca2+(-)+20 mg/L APS; E: Ca2+(-)+40 mg/L APS; F: Ca2+(-)+80 mg/L APS; G: Ca2+(-)+160 mg/L APS. APS: Astragalus polysaccharide; SPD: Spermidine. |
2.3 黄芪多糖能促进IEC-6细胞TRPC1
mRNA及蛋白表达qRCR检测结果显示,与空白组比较,各剂量(20、40、80、160 mg/L)黄芪多糖组TRPC1 mRNA表达均增加(P<0.05或P<0.01,图 3A)。负荷实验中DFMO模型组的TRPC1 mRNA表达水平低于空白组(P<0.01),而各剂量黄芪多糖组TRPC1 mRNA表达水平均高于DFMO模型组(P均<0.01,图 3B)。结果表明黄芪多糖在正常或DFMO负荷时均可上调钙通道蛋白TRPC1 mRNA表达。
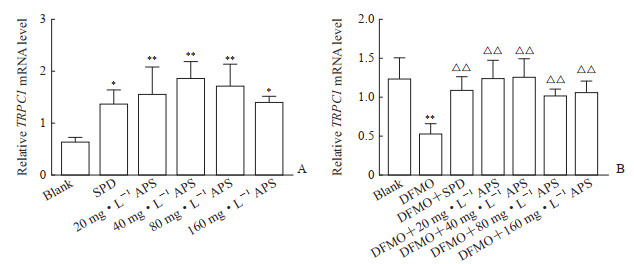
|
图 3 qPCR检测APS对IEC-6细胞TRPC1 mRNA表达的影响 Fig 3 Effect of APS on TRPC1 mRNA expression in IEC-6 cells detected by qPCR A: No load; B: Under DFMO loading. *P < 0.05, **P < 0.01 vs blank group; △△P < 0.01 vs DFMO group. n=3, x±s. qPCR: Quantitative polymerase chain reaction; APS: Astragalus polysaccharide; TRPC1: Transient receptor potential channel 1; SPD: Spermidine; DFMO: Difluoromethylornithine. |
蛋白质印迹法检测结果(图 4)显示,黄芪多糖各剂量组TRPC1蛋白表达水平均高于空白组(P<0.05或P<0.01)。负荷实验中DFMO模型组的TRPC1蛋白表达水平低于空白组(P<0.01),而各剂量黄芪多糖组TRPC1蛋白表达水平均高于DFMO模型组(P均<0.01)。结果表明黄芪多糖在正常或DFMO负荷时均可上调钙通道蛋白TRPC1蛋白表达。
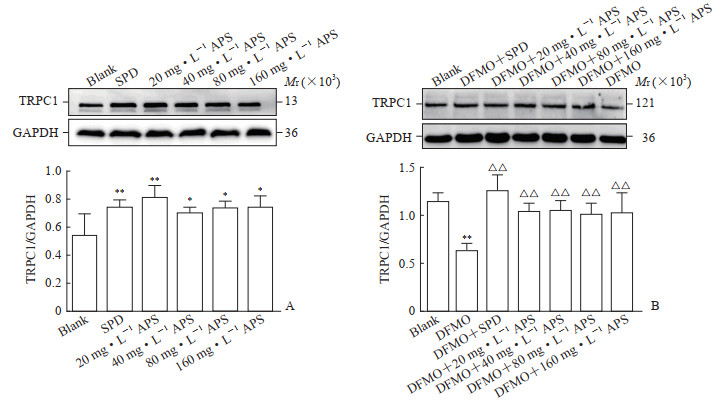
|
图 4 蛋白质印迹法检测APS对IEC-6细胞TRPC1蛋白表达的影响 Fig 4 Effect of APS on TRPC1 protein expression in IEC-6 cells detected by Western blotting A: No load; B: Under DFMO loading. *P < 0.05, **P < 0.01 vs blank group; △△P < 0.01 vs DFMO group. n=3, x±s. APS: Astragalus polysaccharide; TRPC1: Transient receptor potential channel 1; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; SPD: Spermidine; DFMO: Difluoromethylornithine. |
2.4 黄芪多糖对IEC-6细胞Ca2+感受器蛋白STIM1、STIM2的影响 2.4.1 无负荷条件下黄芪多糖对STIM1蛋白移位及表达的影响
STIM1蛋白荧光图显示,空白组STIM1蛋白在划痕后0 min主要分布在胞质内;划痕后10 min STIM1开始向胞膜移位,胞膜附近出现点状绿色荧光,胞膜的STIM1表达增加;划痕后10 min~1 h,STIM1在胞膜表达增加而在胞质表达减少;划痕后3 h STIM1在胞膜表达开始下降;划痕后6 h胞膜的STIM1表达已很弱。与空白组比较,黄芪多糖组在划痕后10 min~1 h时STIM1移位至胞膜增加且表达升高(P<0.05或P<0.01);划痕后3 h时STIM1在胞膜的表达开始减少,6 h时在胞膜上的表达下降至接近0 min时水平。另外,黄芪多糖作用后胞膜STIM1荧光强度增加的同时胞质内的荧光强度也有一定增加,提示40 mg/L和80 mg/L剂量的黄芪多糖不仅能促进STIM1移位至胞膜,还能增加细胞STIM1蛋白表达。见图 5。
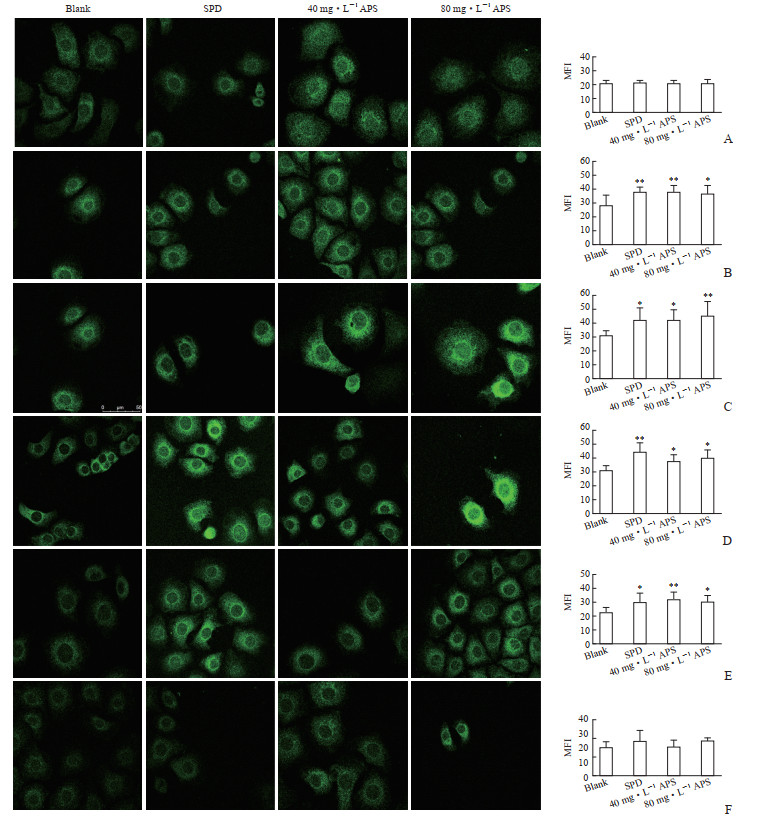
|
图 5 APS对IEC-6细胞STIM1移位至胞膜及STIM1蛋白表达的影响 Fig 5 Effects of APS on translocation of STIM1 to plasma membrane and STIM1 protein expression in IEC-6 cells A: 0 min; B: 10 min; C: 30 min; D: 1 h; E: 3 h; F: 6 h. The fluorescence graphs (600×) are the results of immunofluorescence detection and the bar graphs are the results of statistical anslysis. *P < 0.05, **P < 0.01 vs blank group. n=6, x±s. APS: Astragalus polysaccharide; STIM1: Stromal interaction molecule 1; SPD: Spermidine; MFI: Mean fluorescence intensity. |
2.4.2 DFMO负荷实验中黄芪多糖对STIM1蛋白移位及表达的影响
DFMO负荷下STIM1蛋白荧光图显示,DFMO模型组STIM1荧光主要出现在胞质内,胞核和胞膜分界不清,划痕后10 min~3 h荧光表达仍集中在胞质内,荧光强度较空白组减弱,提示DFMO负荷导致STIM1向胞膜移位延迟,STIM1蛋白表达降低,在胞膜上的表达不增加;划痕后6 h开始STIM1向胞膜移位,细胞由实心状向有清晰胞核、胞膜轮廓转变,提示DFMO负荷对STIM1移位的影响开始减弱,但对STIM1蛋白表达抑制的作用仍在。黄芪多糖组划痕后10 min时,STIM1荧光也主要分布在胞质,向胞膜移位相对空白组延迟;黄芪多糖组在30 min时STIM1开始向胞膜移位;与DFMO模型组相比,1、3 h时黄芪多糖组在胞膜的STIM1表达增加(P均<0.01),6 h时胞膜上仍有少量STIM1蛋白表达,提示40 mg/L和80 mg/L的黄芪多糖可拮抗DFMO所致的STIM1向胞膜移位延迟及蛋白表达降低。见图 6。

|
图 6 DFMO负荷下APS对IEC-6细胞STIM1分布和表达的影响 Fig 6 Effects of APS on distribution and expression of STIM1 under DFMO loading in IEC-6 cells A: 0 min; B: 10 min; C: 30 min; D: 1 h; E: 3 h; F: 6 h. The fluorescence graphs (600×) are the results of immunofluorescence detection and the bar graphs are the results of statistical anslysis. **P < 0.01 vs blank group; △△P < 0.01 vs DFMO group. n=6, x±s. DFMO: Difluoromethylornithine; APS: Astragalus polysaccharide; STIM1: Stromal interaction molecule 1; SPD: Spermidine. MFI: Mean fluorescence intensity. |
2.4.3 黄芪多糖对STIM1、STIM2 mRNA表达的影响
由图 7A可见,20、40、80 mg/L黄芪多糖能上调STIM1 mRNA表达、降低STIM2 mRNA表达,与空白组比较差异均有统计学意义(P<0.05或P<0.01)。由图 7B可见,与空白组比较,DFMO模型组STIM1 mRNA表达水平下降、STIM2 mRNA表达水平升高(P<0.05或P<0.01);DFMO负荷下20、40、80 mg/L黄芪多糖均能促进STIM1 mRNA表达、抑制STIM2 mRNA表达,与DFMO模型组比较差异均有统计学意义(P<0.05或P<0.01)。结果表明黄芪多糖在正常或DFMO负荷时均能提高STIM1 mRNA表达、降低STIM2 mRNA表达。
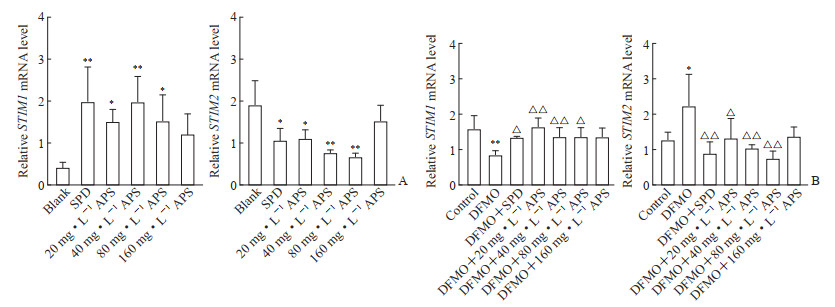
|
图 7 qPCR检测APS对IEC-6细胞STIM1、STIM2 mRNA表达的影响 Fig 7 Effects of APS on expression of STIM1 and STIM2 mRNA detected by qPCR in IEC-6 cells A: No load; B: Under DFMO loading. *P < 0.05, **P < 0.01 vs blank group; △P < 0.05, △△P < 0.01 vs DFMO group. n=3, x±s. qPCR: Quantitative polymerase chain reaction; ASP: Astragalus polysaccharide; STIM: Stromal interaction molecule; SPD: Spermidine; DFMO: Difluoromethylornithing. |
2.4.4 黄芪多糖对STIM1、STIM2蛋白表达的影响
由图 8A可见,20、40、80 mg/L黄芪多糖能促进STIM1蛋白表达、抑制STIM2蛋白表达,与空白组比较差异均有统计学意义(P<0.05或P<0.01)。由图 8B可见,DFMO抑制了STIM1蛋白表达、增加了STIM2蛋白表达,与空白组比较差异均有统计学意义(P<0.05或P<0.01);DFMO负荷下20、40、80、160 mg/L黄芪多糖可促进STIM1蛋白表达,20、40、80 mg/L黄芪多糖可抑制STIM2蛋白表达,与DFMO模型组比较差异均有统计学意义(P<0.05或P<0.01)。结果表明黄芪多糖在正常或DFMO负荷时均能促进STIM1蛋白表达、降低STIM2蛋白表达。
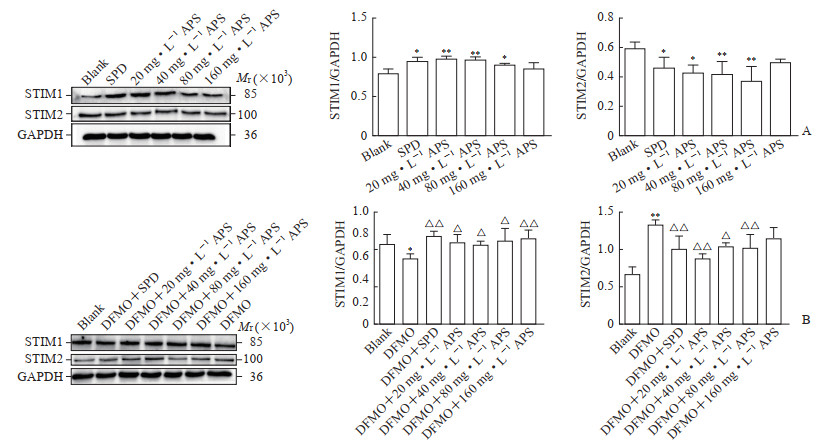
|
图 8 蛋白质印迹法检测APS对IEC-6细胞STIM1、STIM2蛋白表达的影响 Fig 8 Effects of APS on expression of STIM1 and STIM2 proteins in IEC-6 cells detected by Western blotting A: No load; B: Under DFMO loading. *P < 0.05, **P < 0.01 vs blank group; △P < 0.05, △△P < 0.01 vs DFMO group. n=3, x±s. APS: Astragalus polysaccharide; STIM: Stromal interaction molecule; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; SPD: Spermidine; DFMO: Difluoromethylornithing. |
2.5 黄芪多糖对IEC细胞Ca2+调节蛋白复合体表达的影响 2.5.1 黄芪多糖对STIM1/TRPC1蛋白复合体表达的影响
免疫沉淀法检测结果(图 9)显示,与空白组相比,40 mg/L黄芪多糖增加STIM1表达,促进STIM1/TRPC1复合体表达;与空白相比,DFMO负荷可降低复合体中STIM1和TRPC1蛋白表达,抑制了STIM1/TRPC1复合体表达;与DFMO模型组相比,DFMO负荷下40 mg/L黄芪多糖增加了复合体中STIM1和TRPC1表达。结果表明黄芪多糖在正常或DFMO负荷时均可促进STIM1/TRPC1蛋白复合体表达。

|
图 9 免疫沉淀法检测APS对IEC-6细胞STIM1/TRPC1复合体表达的影响 Fig 9 Effect of APS on expression of STIM1/TRPC1 complex in IEC-6 cells detected by immunoprecipitation A: No load; B: Under DFMO loading. APS: Astragalus polysaccharide; STIM1: Stromal interaction molecule 1; TRPC1: Transient receptor potential channel 1; SPD: Spermidine; DFMO: Difluoromethylornithine. |
2.5.2 黄芪多糖对STIM1/STIM2蛋白复合体表达的影响
免疫沉淀法检测结果(图 10)显示,40 mg/L黄芪多糖通过促进复合体中STIM1表达、降低STIM2表达而调节STIM1/STIM2复合体表达;与空白组相比,DFMO负荷对STIM1/STIM2复合体的影响表现为增加STIM2表达、降低STIM1表达;与DFMO模型组相比,DFMO负荷下40 mg/L黄芪多糖对STIM1/STIM2复合体的影响表现为降低STIM2表达、增加STIM1表达。结果提示黄芪多糖可拮抗DFMO对STIM1/STIM2复合体表达的影响,在正常或DFMO负荷均对STIM1/STIM2蛋白复合体表达有调节作用。

|
图 10 免疫沉淀法检测APS对IEC-6细胞STIM1/STIM2复合体表达的影响 Fig 10 Effect of APS on expression of STIM1/STIM2 complex in IEC-6 cells detected by immunoprecipitation A: No load; B: Under DFMO loading. APS: Astragalus polysaccharide; STIM: Stromal interaction molecule; SPD: Spermidine; DFMO: Difluoromethylornithine. |
3 讨论
黄芪性味甘、微温,归肺、脾经,功效补气升阳、固表止汗、利水消肿、生津养血、行滞通痹、托毒排脓、敛疮生肌,用于气虚乏力、食少便溏、中气下陷、久泻脱肛、表虚自汗、气虚水肿、内热消渴、血虚萎黄等病症。本研究主要针对黄芪的胃肠黏膜保护作用,从胃肠黏膜损伤修复的重要步骤——上皮细胞迁移入手,在本课题组前期工作基础上围绕多胺信号通路Ca2+调节蛋白及其蛋白复合体等探讨黄芪多糖促进小肠上皮细胞迁移的作用机制。
研究表明多胺对IEC-6细胞迁移是必需的[27];多胺通过增加钾通道蛋白Kv1.1表达、促进细胞膜电位超极化而调控Ca2+内流驱动力。细胞Ca2+升高主要有胞内钙库释放和胞外Ca2+内流2种方式;虽然胞内钙库释放可引起Ca2+瞬间升高并刺激细胞迁移,但持久的细胞迁移主要依赖胞内Ca2+耗竭而诱导的Ca2+内流。钙库操控通道(store-operated channel,SOC)是小肠上皮细胞Ca2+内流主要通道之一,TRPC1作为SOC蛋白对上皮细胞迁移过程中Ca2+内流驱动力和Ca2+的调控起重要作用[28]。STIM1是位于内质网的跨膜蛋白,作为胞内Ca2+感应器,是激活SOC的关键指标,当胞内钙库Ca2+耗竭时STIM1从内质网移位到胞膜并与TRPC1相互作用形成STIM1/TRPC1复合体,进而增强TRPC1介导的Ca2+内流而促进细胞迁移[29]。Ca2+感应器蛋白STIM2也是内质网跨膜蛋白,属于SOC的负调控蛋白,多胺通过改变ST1M1/ST1M2比值而调控TRPC1介导的Ca2+信号。多胺增加刺激STIM1表达、抑制STIM2表达,消除多胺则会减少STIM1表达、增加STIM2表达。多胺增加提高了STIM1/TRPC1复合体表达,增强了Ca2+内流,刺激了细胞迁移;消除多胺则下调STIM1/TRPC1复合体表达,减少Ca2+内流,抑制细胞迁移;消除多胺增加了ST1M1/ST1M2复合体表达,抑制ST1M1移位到细胞膜,减少Ca2+流入和细胞迁移,表明多胺通过对STIM1和STIM2的差异性调节作用调控TRPC1介导的Ca2+信号[30]。因此多胺调控的STIM1移位至胞膜并形成STIM1/TRPC1复合体是TRPC1介导的Ca2+内流的重要环节。
本研究结果显示,在缺乏胞外Ca2+内流途径时(无钙培养),黄芪多糖虽有促进细胞迁移的作用,但不能使细胞迁移恢复至正常水平(仅为有钙对照组细胞迁移数的48.5%~76.0%);与有钙培养时黄芪多糖促进细胞迁移的作用有较大差距(20、40、80、160 mg/L黄芪多糖组细胞迁移数是有钙培养对照组的133.7%~159.5%)[18],提示Ca2+是黄芪多糖促进细胞迁移作用的重要条件,黄芪多糖对Ca2+的调节是其促进细胞迁移的作用机制之一。
本研究结果显示,黄芪多糖对细胞迁移过程中Ca2+调节的影响机制包括:(1)对钙通道的作用:黄芪多糖提高钙通道蛋白TRPC1 mRNA和蛋白表达,逆转DFMO所致的TRPC1 mRNA和蛋白表达降低。(2)对Ca2+感应器正、负向调节蛋白STIM1、STIM2的作用:黄芪多糖促进STIM1向细胞膜移位并提高其表达水平,改善DFMO所致的STIM1向细胞膜移位延迟及蛋白表达抑制;提高STIM1 mRNA和蛋白表达,逆转DFMO对STIM1 mRNA和蛋白表达的抑制;降低STIM2 mRNA和蛋白表达,逆转DFMO对STIM2 mRNA和蛋白表达的提高。(3)对Ca2+调节蛋白复合体的影响:黄芪多糖提高STIM1/TRPC1复合体表达,逆转DFMO对STIM1/TRPC1复合体表达的抑制;通过提高STIM1/STIM2复合体中STIM1表达、降低STIM2表达调节该复合体表达,并能拮抗DFMO对STIM1/STIM2表达的影响。本研究结果表明黄芪多糖可通过调节TRPC1表达、STIM1移位至细胞膜、STIM1和STIM2表达、STIM1/TRPC1复合体和STIM1/ STIM2复合体表达等作用于TRPC1介导的Ca2+内流,是黄芪多糖促进细胞迁移的重要作用机制之一;若去除胞外Ca2+内流途径(无钙培养),黄芪多糖促进细胞迁移的作用明显减弱,也佐证了黄芪多糖通过增加胞外Ca2+内流促进细胞迁移的作用机制。
综上所述,黄芪多糖促进细胞迁移的作用与其影响多胺调控信号通路有关,尤其对Ca2+的调节作用是关键机制。其对细胞迁移过程中Ca2+调节的作用包括:(1)对信号通路Ca2+调节上游指标的影响。黄芪多糖可提高细胞SPD含量,提高钾通道蛋白Kv1.1 mRNA和蛋白表达促进K+外流,对DFMO或钾通道抑制剂4-AP所致的细胞迁移抑制、SPD含量降低、Kv1.1 mRNA和蛋白表达降低、K+外流抑制有逆转作用,并促进细胞膜电位超极化、逆转DFMO所致的膜电位去极化。(2)对信号通路Ca2+的影响。黄芪多糖能提高细胞Ca2+水平;通过提高TRPC1、STIM1及STIM1/TRPC1表达、促进STIM1移位至胞膜、降低STIM2表达、调节STIM1/STIM2表达而促进TRPC1介导的Ca2+内流,并逆转DFMO对上述指标的作用。(3)对信号通路Ca2+调节下游指标的影响。黄芪多糖可提高Rho-GTP酶(RhoA、Rac1、Cdc42)蛋白表达,逆转DFMO对上述蛋白表达的抑制作用[14, 18]。综合黄芪提取物在细胞水平和整体动物水平[10, 24]的实验研究结果,益气健脾中药黄芪的胃肠黏膜保护作用可能与其促进上皮细胞迁移有关,从新视角为探讨黄芪的胃肠黏膜保护作用机制提供了参考。
| [1] |
许长照, 张瑜瑶, 刘隆棣, 朱启锭, 田启鹏, 沙家豪. 脾虚证患者十二指肠的病理形态及组织化学研究[J]. 中西医结合杂志, 1987, 7: 722-725, 708. |
| [2] |
尹光耀, 张武宁, 何雪芬, 陈一, 尹玉芬, 沈小静. 脾虚证胃粘膜组织细胞病理学研究[J]. 中国中西医结合杂志, 1999, 19: 660-663. DOI:10.3321/j.issn:1003-5370.1999.11.008 |
| [3] |
闫芳. 黄芪建中汤治疗脾胃虚寒型胃溃疡60例[J]. 河南中医, 2020, 40: 1503-1506. DOI:10.16367/j.issn.1003-5028.2020.10.0382 |
| [4] |
朱超, 常凤玲. 白术黄芪汤对溃疡性结肠炎患者证候积分及炎性反应的影响[J]. 现代诊断与治疗, 2020, 31: 1190-1191. |
| [5] |
陈延, 黄智斌, 刘奇, 何家鸣, 欧阳博文, 杨弘楚, 等. 补土方案维持克罗恩病缓解期及生存质量研究[J]. 中国中西医结合消化杂志, 2015, 23: 888-890. |
| [6] |
周巧萍, 黄智斌, 陈延. 加味四君子汤对提高克罗恩病患者血红蛋白含量及降低相关炎症指标的作用[J]. 中国中西医结合消化杂志, 2019, 27: 284-288. |
| [7] |
GAO J H, GUO L J, HUANG Z Y, RAO J N, TANG C W. Roles of cellular polyamines in mucosal healing in the gastrointestinal tract[J]. J Physiol Pharmacol, 2013, 64: 681-693. |
| [8] |
赵世清. 甘草、党参对大鼠应激性溃疡及多胺影响的研究[D]. 广州: 广州中医药大学, 2012.
|
| [9] |
李茹柳, 年立全, 赵世清, 温鹏, 随晶晶, 陶玉珠, 等. 党参对应激性溃疡和细胞迁移及多胺的影响[J]. 广州中医药大学学报, 2013, 30: 519-524, 604. |
| [10] |
年立全. 益气健脾中药提取物对大鼠应激性溃疡及多胺影响的研究[D]. 广州: 广州中医药大学, 2013.
|
| [11] |
王东旭, 李茹柳, 朱易平, 时玉霞, 朱惠彬, 胡玲, 等. 从多胺及细胞连接蛋白角度探讨四君子汤防治胃黏膜损伤的作用机制[J]. 中药材, 2018, 41: 2886-2892. |
| [12] |
王东旭. 四君子汤通过影响多胺以防治胃肠黏膜损伤的实验研究[D]. 广州: 广州中医药大学, 2018.
|
| [13] |
SONG H P, LI R L, CHEN X, WANG Y Y, CAI J Z, LIU J, et al. Atractylodes macrocephala Koidz promotes intestinal epithelial restitution via the polyamine-voltage-gated K+ channel pathway[J]. J Ethnopharmacol, 2014, 152: 163-172. |
| [14] |
ZENG D, HU C, LI R L, LIN C Q, CAI J Z, WU T T, et al. Polysaccharide extracts of Astragalus membranaceus and Atractylodes macrocephala promote intestinal epithelial cell migration by activating the polyamine-mediated K+ channel[J]. Chin J Nat Med, 2018, 16: 674-682. |
| [15] |
朱易平, 李茹柳, 时玉霞, 王东旭, 梁雪丹, 胡玲, 等. 黄芪总皂苷对IEC-6细胞增殖及相关蛋白表达的影响[J]. 中药新药与临床药理, 2019, 30: 60-65. |
| [16] |
李茹柳, 陶玉珠, 曾丹, 赵世清, 林传权, 陈蔚文. 党参、甘草糖提取物对小肠上皮细胞迁移多胺信号通路的影响[J]. 中国药理学通报, 2016, 32: 245-251. |
| [17] |
涂小华, 李茹柳, 邓娇, 曾丹, 蔡佳仲, 陈蔚文. 四君子汤多糖对小肠上皮细胞迁移多胺信号通路钙离子调控的影响[J]. 中华中医药杂志, 2016, 31: 1665-1673. |
| [18] |
曾丹, 李茹柳, 伍婷婷, 王东旭, 时玉霞, 陈蔚文. 黄芪多糖对IEC-6细胞迁移多胺信号通路相关指标的影响[J]. 中华中医药杂志, 2017, 32: 3447-3452. |
| [19] |
伍婷婷, 李茹柳, 曾丹, 胡玲, 时玉霞, 王东旭, 等. 白术多糖调控钙离子以促进细胞迁移及E-钙黏蛋白表达的研究[J]. 中药新药与临床药理, 2017, 28: 145-150. |
| [20] |
SHI Y X, ZHU H B, LI R L, WANG D X, ZHU Y P, HU L, et al. Effect of polysaccharides from Sijunzi decoction on Ca2+ related regulators during intestinal mucosal restitution[J/OL]. Phytomedicine, 2019, 58: 152880. DOI: 10.1016/j.phymed.2019.152880.
|
| [21] |
王洲, 李茹柳, 徐颂芬, 陈蔚文. 白术糖复合物对IEC-6细胞分化及绒毛蛋白表达的影响[J]. 中药材, 2010, 33: 938-944. |
| [22] |
朱惠彬. 人参多糖对IEC-6细胞迁移钙离子调控相关指标影响的研究[D]. 广州: 广州中医药大学, 2020.
|
| [23] |
罗蒙, 伍婷婷, 李茹柳, 张东, 朱惠彬, 胡玲, 等. 白术多糖对小肠上皮细胞细胞屏障及黏附连接蛋白表达的影响[J]. 中药新药与临床药理, 2021, 32: 533-539. |
| [24] |
朱易平. 从细胞增殖和黏附连接角度探讨黄芪和人参胃肠黏膜损伤修复机制[D]. 广州: 广州中医药大学, 2019.
|
| [25] |
HU C, LI R L, LU W B, YANG Y Q, WANG J, CHEN W W. Studies on cell migration model in intestinal epithelial restitution for pharmacological research[J]. J Chin Med Mater, 2011, 34: 738-746. |
| [26] |
RATHOR N, CHUNG H K, SONG J L, WANG S R, WANG J Y, RAO J N. TRPC1-mediated Ca2+ signaling enhances intestinal epithelial restitution by increasing α4 association with PP2Ac after wounding[J/OL]. Physiol Rep, 2021, 9: e14864. DOI: 10.14814/phy2.14864.
|
| [27] |
RAO J N, XIAO L, WANG J Y. Polyamines in gut epithelial renewal and barrier function[J]. Physiology (Bethesda), 2020, 35: 328-337. |
| [28] |
RAO J N, PLATOSHYN O, GOLOVINA V A, LIU L, ZOU T T, MARASA B S, et al. TRPC1 functions as a store-operated Ca2+ channel in intestinal epithelial cells and regulates early mucosal restitution after wounding[J/OL]. Am J Physiol Gastrointest Liver Physiol, 2006, 290: G782-G792. DOI: 10.1152/ajpgi.00441.2005.
|
| [29] |
RAO J N, RATHOR N, ZOU T T, LIU L, XIAO L, YU T X, et al. STIM1 translocation to the plasma membrane enhances intestinal epithelial restitution by inducing TRPC1-mediated Ca2+ signaling after wounding[J/OL]. Am J Physiol Cell Physiol, 2010, 299: C579-C588. DOI: 10.1152/ajpcell.00066.2010.
|
| [30] |
RAO J N, RATHOR N, ZHUANG R, ZOU T T, LIU L, XIAO L, et al. Polyamines regulate intestinal epithelial restitution through TRPC1-mediated Ca2+ signaling by differentially modulating STIM1 and STIM2[J/OL]. Am J Physiol Cell Physiol, 2012, 303: C308-C317. DOI: 10.1152/ajpcell.00120.2012.
|
 2023, Vol. 44
2023, Vol. 44


