2. 同济大学附属上海市第四人民医院超声医学科, 上海 200434;
3. 海军军医大学(第二军医大学)第二附属医院超声诊断科, 上海 200003
2. Department of Ultrasound, Shanghai Fourth People's Hospital Affiliated to Tongji University, Shanghai 200434, China;
3. Department of Ultrasound, The Second Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200003, China
肌肉损伤在临床上较为常见,占运动相关损伤的10%~55%[1]。早期识别和正确评估肌肉损伤程度非常必要。超声因其便捷、实时、高分辨等优势,被广泛应用于肌肉损伤的评估,可准确定位损伤部位,检测肌肉水肿、肌纤维撕裂,以及确定是否有血肿等[2]。彩色多普勒血流成像(color Doppler flow imaging,CDFI)虽可清晰显示肌肉内部的血流分布情况,但难以灵敏识别与损伤炎症相关的新生微小血管。对于骨骼肌损伤后缺血缺氧的功能状态[3],常规超声难以实现对肌肉活性的可视化评估。
光声成像是近年来一种新兴的成像技术,其在生物组织内能利用内源性信号如血红蛋白和脱氧血红蛋白吸收脉冲光能,并通过热弹性膨胀转化为声能[4-5]。与纯光学成像方法相比,光声成像不仅具有超声的高分辨率,又能清晰地显示深层生物组织的光学对比度[6],特别适用于体内外组织的微观结构显像,在基础研究及临床试验中被广泛应用[7-9]。另外,光声成像结合外源显像剂进行分子成像可有效反映组织的生物化学信息等[10]。例如采用伊文思蓝作为无毒分子探针,通过光声成像能实时定量检测大鼠缺血肌肉的微循环损伤程度[11]。Smith等[12]研究发现光声成像能检出吸入氧分数变化引起的血氧饱和度改变,可用于实时检测动物缺氧性休克期间大血管和微血管的血氧饱和度。因此,光声成像有望实现骨骼肌损伤后缺血缺氧程度的可视化评估。目前对于骨骼肌损伤光声成像的研究较少,骨骼肌损伤修复过程中局部肌肉组织的血氧饱和度动态变化仍需进一步阐明。本研究以骨骼肌钝挫伤模型大鼠作为研究对象,探讨光声成像定量评估受损骨骼肌血氧变化的可行性。
1 材料和方法 1.1 动物模型的制作成年雄性SD大鼠25只(体重180~220 g)购自上海市计划生育科学研究所实验动物经营部[实验动物生产许可证号为SCXK(沪)2018-0006],适应性饲养1周,饲养温度保持在20~25 ℃,相对湿度保持为50%~65%,饲养环境保持安静,通风良好。将大鼠随机分为5组:损伤后1、2、3、7 d组和正常对照组,每组5只。动物实验操作获得海军军医大学(第二军医大学)第二附属医院实验动物伦理委员会审批(20ZR1457900),并符合国家科学技术委员会发布的《实验动物管理条例》中关于动物保护和使用的指导方针。
损伤后1、2、3、7 d组大鼠经2%戊巴比妥钠(30 mg/kg)腹腔注射麻醉后,电动剪剪除右后肢毛发,取俯卧位,于伸膝、踝背屈90°固定于实验台。采用重物打击装置[13]构建大鼠骨骼肌钝挫伤模型,模型构建成功后,将大鼠饲养于笼中,自由获得食物和水,每天观察大鼠摄食、活动和伤口情况。正常对照组大鼠不做任何处理。
1.2 基本超声检查与图像分析采用彩色多普勒超声仪(德国Siemens公司)进行超声检查,探头频率为5~14 MHz,各系统参数恒定。首先用2D超声检查右后肢股部肌肉以确定各损伤组大鼠骨骼肌损伤部位,对各损伤组肌肉损伤区域及正常对照组相同部位进行纵向和横向扫描,记录骨骼肌回声变化及有无血肿形成。然后用CDFI模式观察骨骼肌的血流分布情况,参考Alder半定量法对血流进行分级:0级为未探及血流;Ⅰ级为少量血流,可探及1或2个点状或细短棒状血管;Ⅱ级为中量血流,可探及3或4个点状血流或1支较长血管,血管长度可接近或超过病灶半径;Ⅲ级为多量血流,可探及5个以上点状或2支较长血管。为保证超声切面一致,所有大鼠超声检查时均须显示位于上方的右侧耻骨,且以股直肌长轴为观察平面,存储相应2D灰阶、CDFI图像以备脱机分析,由2名从事超声工作5年以上的主治医师进行图像分析。
1.3 光声成像与图像分析光声成像设备采用Vevo 2100成像系统(加拿大Fujifilm公司),配有LZ250高频探头,探头包含超声波和光纤晶体,采用波长750和850 nm的激光以20 Hz重复频率、6~8 ns脉冲宽度和20 mJ峰值脉冲能量传播到血管和组织后产生光声图像,保存图像以备分析。
各损伤组大鼠按照对应时间节点进行光声成像检测,正常对照组大鼠在全部实验组完成后进行检测。首先在诱导箱中用2%~3%异氟醚将大鼠麻醉,然后置于Vevo加热扫描平台(维持37 ℃),大鼠取俯卧位,于右后肢呈伸直状态后固定。光声成像探头安装在可调节的关节臂上,将高黏度超声凝胶耦合剂涂抹到大鼠右后肢皮肤表面(为了最大限度排出耦合剂内的气泡以减少成像伪影,提前将耦合剂于20 375×g离心8 s。在2D灰阶超声模式下识别大鼠股直肌长轴和短轴切面,启动光声成像模式,获得光声成像图像,并确保2D灰阶超声图像与光声图像同时显示在屏幕上。在2D灰阶超声图像上对各损伤组的挫伤部位及正常对照组相对应的部位选择1个感兴趣区域(region of interest,ROI),同步定位光声成像图像相同的ROI。采用Vevo软件(加拿大HemoMeazure & OxyZated公司)自动计算获得骨骼肌组织ROI内平均血氧饱和度和总血氧饱和度。所有测量与计算均由具备至少2年光声成像操作经验的超声科主治医师完成,图像分析由2名从事超声工作5年以上的主治医师完成。
1.4 肌肉组织的组织病理学分析光声成像检查完成后,经腹腔注射过量2%戊巴比妥钠(350 mg/kg)处死正常对照组及各损伤组大鼠,取各损伤组大鼠损伤部位及正常对照组相同部位的骨骼肌组织,放入4%多聚甲醛PBS溶液中固定24 h。然后进行石蜡包埋、5 μm厚度连续切片、常规H-E染色[苏木精,货号H9627,美国Sigma公司;伊红Y(水溶性),货号71014544,中国医药集团有限公司]和CD34免疫组织化学染色(CD34抗体EP373Y,货号ab81289,英国Abcam公司,稀释比例为1∶1 000)。每组连续取3张切片于光镜下观察染色阳性部位,染色呈黄色者为阳性,并在放大200倍视野下采用图像分析系统Vectra多色荧光系统(美国PerkinElmer公司)测定染色阳性区域的光密度值。在光镜下选择5个染色阳性视野测定CD34含量,计算微血管平均光密度值。
1.5 统计学处理应用SPSS 22.0软件进行统计学分析。呈正态分布的计量资料以x±s表示,若方差齐多组间比较采用单因素方差分析,若方差不齐则采用近似F检验,多重比较采用Bonferroni法。为确保正常对照组与各损伤组光声成像定量分析结果的一致性,使用组内相关系数(intraclass correlation coefficient,ICC)分析2名观察者间及观察者内(观察者1间隔1周再次测量)光声成像定量参数的一致性,其中ICC<0.4表示一致性较差,0.4~0.75表示一致性一般,>0.75表示一致性较好。采用Fisher确切概率法分析光声成像定量参数与CDFI血流Alder半定量分级的相关性。检验水准(α)为0.05。
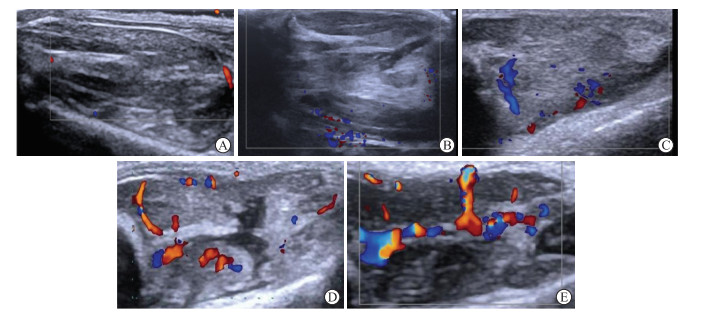
2 结果 2.1 各组大鼠骨骼肌的2D灰阶超声及CDFI声像图特征在实验过程中,成功建立SD大鼠骨骼肌钝挫伤模型,4个损伤组共20只大鼠均存活。在股直肌长轴切面上,正常对照组大鼠骨骼肌表现为低回声肌束与强回声肌束膜相间的网络样排列;CDFI显示5只大鼠骨骼肌组织内部均仅见1或2个星点状血流信号,血流Adler半定量分级为Ⅰ级。损伤后1 d组受损区肌肉肿胀、明显增厚,回声增高,肌纹理连续性中断,模糊不清;CDFI显示3只大鼠骨骼肌组织内有1个星点状血流信号,血流Adler半定量分级为Ⅰ级,2只大鼠骨骼肌组织内未见血流信号,血流Adler半定量分级为0级。损伤后2 d、3 d组,受损区肌肉厚度较前变薄,回声不均匀,肌肉纹理紊乱,可见血肿形成;CDFI显示血流信号较前增多,其中损伤后2 d组5只大鼠均可探及3或4个点状血流,损伤后3 d组3只大鼠可探及3或4个点状血流,血流Adler半定量分级为Ⅱ级;损伤后3 d组2只大鼠可探及2支较长血管的血流信号,血流Adler半定量分级为Ⅲ级。损伤后7 d组受损区肌肉厚度基本正常,回声减低,肌肉纹理逐渐清晰;CDFI显示血流信号较丰富,5只大鼠均可见2或3条较长血管,血流Adler半定量分级为Ⅲ级。见图 1。
|
图 1 各组大鼠骨骼肌的CDFI声像图特征 Fig 1 CDFI sonographic characteristics of skeletal muscle of rats in each group A: In the normal control group, the CDFI star-shaped blood flow signal was interpreted as Adler grade Ⅰ; B: 1 d after contusion, the CDFI star-shaped blood flow signal was judged as Adler grade Ⅰ; C, D: 2 d (C) and 3 d (D) after contusion, CDFI showed multiple punctate blood flow, which was judged as Adler grade Ⅱ; E: 7 d after contusion, CDFI showed rich blood flow signal, and 2-3 small blood vessels were visible, which was judged as Adler grade Ⅲ. CDFI: Color Doppler flow imaging. |
2.2 各组大鼠骨骼肌的光声成像声像图特征
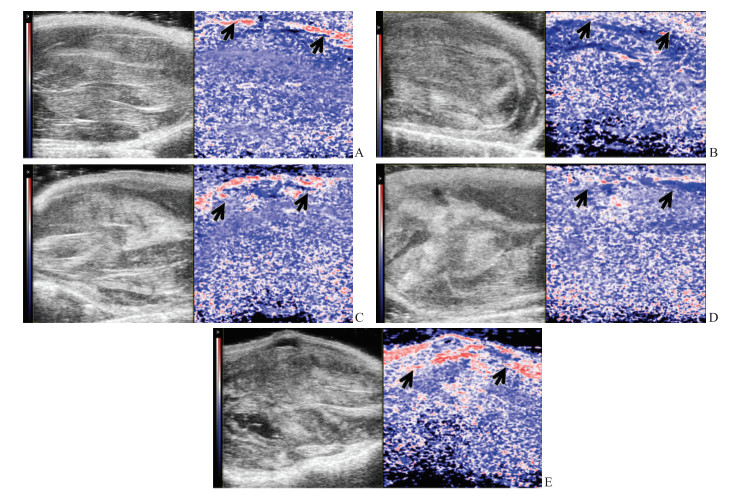
与正常对照组[(50.95±0.51)%]相比,损伤后1、2、3、7 d组大鼠骨骼肌的平均血氧饱和度均有所增加[分别为(53.41±2.05)%、(57.23±0.99)%、(58.63±2.40)%、(60.66±3.92)%],其中损伤后2、3、7 d组与正常对照组之间差异有统计学意义(P均<0.05)。与正常对照组[(50.19±0.61)%]相比,损伤后1、2、3、7 d组大鼠骨骼肌的总血氧饱和度均有所增加[分别为(52.54±2.96)%、(56.38±0.88)%、(57.40±1.49)%、(58.54±4.19)%],其中损伤后2、3、7 d组与正常对照组之间差异有统计学意义(P均<0.05)。损伤后1、2、3、7 d大鼠骨骼肌的平均血氧饱和度和总血氧饱和度均逐渐增大,损伤后2、3、7 d组与损伤后1 d组相比差异均有统计学意义(P均<0.05),损伤后7 d组与损伤后2、3 d组相比差异亦均有统计学意义(P均<0.05),而损伤后2 d组与3 d组之间差异无统计学意义(P均>0.05)。见图 2。
|
图 2 各组大鼠骨骼肌的光声成像声像图特征 Fig 2 Photoacoustic imaging characteristics of skeletal muscle of rats in each group A: The normal control group; B: The group of 1 d after contusion; C: The group of 2 d after contusion; D: The group of 3 d after contusion; E: The group of 7 d after contusion. The grayscale images showed the changes of muscle thickness and echo. There is a photoacoustic imaging color scale on the left side of the grayscale images. Both images are consistent, photoacoustic images with color scaling to show areas of high oxygen saturation in red and low saturation in blue. Black arrows indicate the skin. |
2.3 各组大鼠骨骼肌的组织病理学变化
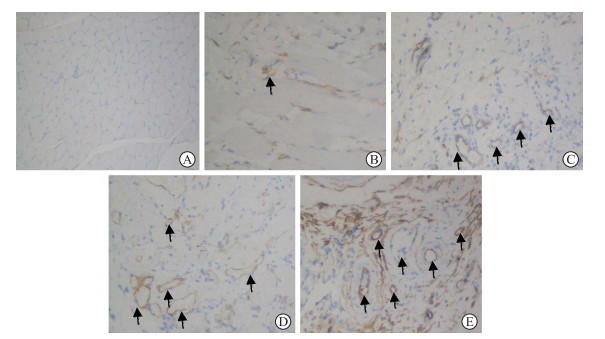
正常对照组大鼠骨骼肌肌纤维排列紧密、横纹清晰;损伤后1 d组损伤处骨骼肌水肿明显;损伤后2 d组多形核白细胞和中性粒细胞减少;损伤后3 d组白细胞急剧减少,有少量胶原纤维形成;损伤后7 d组有较多新生血管形成,肌卫星细胞大幅增加,伴有胶原沉积。免疫组织化学染色(图 3)显示CD34主要在血管内皮细胞表达,染色呈棕黄色,损伤后1 d组表达偏少,在损伤后7 d组表达最多,而正常对照组未见CD34表达。见图 3。
|
图 3 免疫组织化学染色检测各组大鼠骨骼肌CD34的表达(200×) Fig 3 CD34 expression in rat skeletal muscle detected by immunohistochemical staining (200×) A: The normal control group; B: The group of 1 d after contusion; C: The group of 2 d after contusion; D: The group of 3 d after contusion; E: The group of 7 d after contusion. Black arrows indicate blood vessels. |
2.4 观察者间及观察者内光声成像定量参数的一致性分析
正常对照组与损伤后1、2、3、7 d组大鼠骨骼肌的平均血氧饱和度和总血氧饱和度在观察者1和2之间一致性均较好,其中平均血氧饱和度的ICC值分别为0.769、0.798、0.872、0.951、0.932,总血氧饱和度的ICC值分别为0.840、0.866、0.769、0.897、0.904;在观察者1的2次测量之间一致性也均较好,其中平均血氧饱和度的ICC值分别为0.869、0.888、0.932、0.975、0.965,总血氧饱和度的ICC值分别为0.913、0.928、0.869、0.946、0.950。
2.5 CDFI血流Adler半定量分级与光声成像定量参数的相关性分析25只大鼠中CDFI血流Alder半定量分级为0~Ⅰ级10只、Ⅱ~Ⅲ级15只。以平均血氧饱和度和总血氧饱和度各自的平均值(均约为55%)将大鼠分为<55%、≥55%两组,其中平均血氧饱和度<55%的大鼠11只(CDFI血流Alder半定量分级为0~Ⅰ级8只、Ⅱ~Ⅲ级3只),≥55%的大鼠14只(CDFI血流Alder半定量分级为0~Ⅰ级者2只、Ⅱ~Ⅲ级者12只);总血氧饱和度<55%的大鼠11只(CDFI血流Alder半定量分级为0~Ⅰ级9只、Ⅱ~Ⅲ级2只),≥55%的大鼠14只(CDFI血流Alder半定量分级为0~Ⅰ级1只、Ⅱ~Ⅲ级13只)。采用Fisher确切概率法进行相关性分析,结果显示CDFI血流Alder半定量分级与平均血氧饱和度和总血氧饱和度均呈正相关(P=0.005、0.002),即CDFI显示血流丰富的肌肉组织中血氧饱和度相对较高,光声成像检测所得的平均血氧饱和度和总血氧饱和度均以≥55%为主。
3 讨论骨骼肌因各种因素导致损伤时,准确评估伤情能够指导临床实施正确的治疗方案。超声成像技术经过多年的发展,已被公认可作为骨骼肌疾病筛查的影像学手段,能对肌肉损伤后肌纤维结构、血流分布等进行实时无创评估[2]。然而还需要寻找到一种可靠的定量成像方法对肌肉损伤后局部血氧饱和度变化进行评估。
光声成像作为一种新兴的影像学技术,动物实验研究已证明其可用于评估急慢性关节炎的形态和功能变化[14-15]。随着光声成像技术逐渐成为研究热点,光声成像在肌肉骨骼系统软组织的定性识别与诊断方面表现出巨大潜力,研究者们在生物组织微血管网络、血红蛋白浓度和氧饱和度等领域进行了尝试[16-17]。Liu等[18]将光声成像应用于创伤性骨关节炎,探讨光声成像体内无创评估滑膜组织缺氧的可行性及与创伤性骨关节炎严重程度的相关性,结果显示滑膜组织缺氧与创伤性骨关节炎的严重程度相关;Chen等[19]将高分辨率光声显微镜和新型缺氧敏感探针相结合,展示了小鼠下肢缺血模型血管内氧合和组织缺氧的图像。光声成像还可用于评估急性淋巴细胞白血病小鼠骨髓腔内的血氧饱和度,能无创监测急性淋巴细胞白血病的进展[20]。基于以上研究结果,本研究尝试使用光声成像观察骨骼肌钝挫伤模型大鼠损伤后不同时间点骨骼肌内的血氧饱和度变化,初步探讨光声成像技术定量评估受损骨骼肌局部血氧变化的可行性。
受损肌肉的愈合过程包括损伤、再生和重塑[21]。本实验中大鼠损伤后1~7 d,损伤肌肉的光声成像定参数平均血氧饱和度和总血氧饱和度均高于正常对照组,CDFI血流Alder半定量分级从Ⅰ级升高为Ⅱ、Ⅲ级,组织病理学亦显示损伤肌肉经历了明显水肿、间质出血、中性粒细胞浸润、肌纤维断裂、胶原沉积、新生血管形成等过程。肌肉受损后炎症、修复过程影响肌肉组织的微血管循环,微血管密度与组织总血红蛋白之间存在正相关性[22],因此组织内微血管循环灌注与其血氧饱和度关系密切。肌肉受损后第1天是炎症反应高峰期,肌纤维坏死、水肿明显,此时肌肉微血管循环破坏明显,因此光声成像测得的肌肉血氧饱和度含量偏低,符合肌肉受损的破坏阶段;受损后第2天和第3天炎症反应虽然继续存在,但较第1天改善,组织水肿逐渐减轻,微循环灌注有所增加,肌肉血氧饱和度含量逐渐增加。本实验结果也显示损伤后2、3 d光声成像测得平均血氧饱和度和总血氧饱和度与损伤后1 d组相比均增高,差异均有统计学意义(P均<0.05),但损伤后2、3 d之间差异无统计学意义。损伤后第7天,肌肉进入再生阶段,肌肉微血管数量增多,血流量增加,因此肌肉血氧饱和度增加。本实验中大鼠骨骼肌受损后7 d,H-E染色提示受损区域有新生骨骼肌及较多新生血管形成,平均血氧饱和度和总血氧饱和度均达到高峰。因此,骨骼肌损伤后平均血氧饱和度和总血氧饱和度的变化能够反映肌肉组织的血氧变化,光声成像不仅可显示新生血管的解剖结构,还可以提供受损肌肉组织血氧变化的功能信息。
作为评估组织内血流灌注和血管内血流情况的经典检查模式,CDFI已被广泛用于临床,然而其对微血管和微循环的检测存在局限性。基于微血管内血红蛋白具有良好的光吸收性与散射性,He等[23]采用高灵敏度超声检测器、微米级分辨率对皮肤内的微脉管系统进行成像,精准辨别出黑色素瘤与良性痣,表明光声成像具备对组织血管形态及新生血管的监测能力。在外周动脉疾病中,Kirkham等[24]用光声成像评估小鼠小腿肌肉与年龄的关系,发现随着年龄的增长、骨骼肌氧合能力的下降,骨骼肌内总血氧饱和度由30.2%降至3.5%。本实验中,损伤后1 d组大鼠的CDFI血流Alder半定量分级与正常对照组相近,为0~Ⅰ级,而平均血氧饱和度和总血氧饱和度却轻微升高,考虑受损后1 d骨骼肌组织存在微循环破坏及炎症反应,代谢活性比正常对照组高,因此受损后1 d组骨骼肌内的血氧饱和度高于正常对照组,这一结果提示相较于CDFI,光声成像对微小血管更加灵敏。在损伤后2、3 d组,CDFI血流Alder半定量分级为Ⅱ~Ⅲ级,损伤后7 d组为Ⅲ级,这一变化与平均血氧饱和度和总血氧饱和度的变化相符。本实验进一步对平均血氧饱和度、总血氧饱和度与CDFI血流Alder半定量分级进行了相关性分析,结果表明CDFI显示血流丰富的肌肉组织光声成像检测的血氧饱和度较高,即肌肉组织中血红蛋白氧饱和度相对较高。因此对于肌肉损伤,光声成像能够实时反映组织早期损伤和再生修复阶段的血氧变化,且与组织病理学改变相关,对于临床预后意义重大。
本实验结果还显示,平均血氧饱和度和总血氧饱和度的动态变化与组织病理学变化、CDFI血流Alder半定量分级有较好的一致性,在肌肉损伤早期至修复期血氧饱和度逐渐增加,至受损后第7天到达高峰。这初步验证了光声成像定量分析大鼠钝挫伤模型受损骨骼肌血氧变化的可行性,为今后临床应用提供理论依据。
本研究有一定局限性:首先,肌肉损伤修复的病理生理过程涉及诸多因素,单用超声技术分析并不全面,未来可结合靶向造影剂从分子成像水平精准分析;其次,光声成像对较深的组织灵敏度较低,测得的平均血氧饱和度和总血氧饱和度可能存在观察者间主观差异,期待未来能够聚焦获取各项技术参数标准,为光声成像在肌肉骨骼系统疾病的临床诊断与评估中奠定交叉研究基础。
| [1] |
JÄRVINEN T A H, JÄRVINEN T L N, KÄÄRIÄINEN M, KALIMO H, JÄRVINEN M. Muscle injuries: biology and treatment[J]. Am J Sports Med, 2005, 33: 745-764. DOI:10.1177/0363546505274714 |
| [2] |
FODOR D, RODRIGUEZ-GARCIA S C, CANTISANI V, HAMMER H B, HARTUNG W, KLAUSER A, et al. The EFSUMB guidelines and recommendations for musculoskeletal ultrasound-part Ⅰ: extraarticular pathologies[J]. Ultraschall Med, 2022, 43: 34-57. DOI:10.1055/a-1562-1455 |
| [3] |
SABI E M, SINGH A, ALTHAFAR Z M, BEHL T, SEHGAL A, SINGH S, et al. Elucidating the role of hypoxia-inducible factor in rheumatoid arthritis[J]. Inflammopharmacology, 2022, 30: 737-748. DOI:10.1007/s10787-022-00974-4 |
| [4] |
DAS D, SHARMA A, RAJENDRAN P, PRAMANIK M. Another decade of photoacoustic imaging[J/OL]. Phys Med Biol, 2021, 66. DOI: 10.1088/1361-6560/abd669.
|
| [5] |
TAYLOR-WILLIAMS M, SPICER G, BALE G, BOHNDIEK S E. Noninvasive hemoglobin sensing and imaging: optical tools for disease diagnosis[J/OL]. J Biomed Opt, 2022, 27: 080901. DOI: 10.1117/1.JBO.27.8.080901.
|
| [6] |
MENOZZI L, YANG W, FENG W W, YAO J J. Sound out the impaired perfusion: Photoacoustic imaging in preclinical ischemic stroke[J/OL]. Front Neurosci, 2022, 16: 1055552. DOI: 10.3389/fnins.2022.1055552.
|
| [7] |
YANG W Z, ZHOU J S, SHAO W H, SEONG M, HE P B, YE Z H, et al. Photoacoustic-fluorescence microendoscopy in vivo[J]. Opt Lett, 2021, 46: 2340-2343. DOI:10.1364/OL.425753 |
| [8] |
JEONG W Y, KANG M S, LEE H, LEE J H, KIM J, HAN D W, et al. Recent trends in photoacoustic imaging techniques for 2D nanomaterial-based phototherapy[J/OL]. Biomedicines, 2021, 9: 80. DOI: 10.3390/biomedicines9010080.
|
| [9] |
STEINBERG I, HULAND D M, VERMESH O, FROSTIG H E, TUMMERS W S, GAMBHIR S S. Photoacoustic clinical imaging[J]. Photoacoustics, 2019, 14: 77-98. DOI:10.1016/j.pacs.2019.05.001 |
| [10] |
LI W C, WANG X Y, WANG J J, GUO Y, LU S Y, LI C M, et al. Enhanced photoacoustic and photothermal effect of functionalized polypyrrole nanoparticles for near-infrared theranostic treatment of tumor[J]. Biomacromolecules, 2019, 20: 401-411. DOI:10.1021/acs.biomac.8b01453 |
| [11] |
CHEN L, MA H H, LIU H, SHOU K Q, ZHENG X, FAN Q L, et al. Quantitative photoacoustic imaging for early detection of muscle ischemia injury[J]. Am J Transl Res, 2017, 9: 2255-2265. |
| [12] |
SMITH L M, VARAGIC J, YAMALEYEVA L M. Photoacoustic imaging for the detection of hypoxia in the rat femoral artery and skeletal muscle microcirculation[J]. Shock, 2016, 46: 527-530. DOI:10.1097/SHK.0000000000000644 |
| [13] |
刁宗平, 徐琪, 汤晓轶, 赵佳琦. 大鼠骨骼肌钝挫伤模型的超声造影图像特征与微血管分布的相关性分析[J]. 海军军医大学学报, 2023, 44: 161-169. DIAO Z P, XU Q, TANG X Y, ZHAO J Q. Correlation of contrast-enhanced ultrasound characteristics and microvascular distribution in a rat skeletal muscle blunt contusion model[J]. Acad J Naval Med Univ, 2023, 44: 161-169. |
| [14] |
JO J, XU G, ZHU Y H, BURTON M, SARAZIN J, SCHIOPU E, et al. Detecting joint inflammation by an LED-based photoacoustic imaging system: a feasibility study[J/OL]. J Biomed Opt, 2018, 23: 110501. DOI: 10.1117/1.JBO.23.11.110501.
|
| [15] |
NISHIYAMA M, NAMITA T, KONDO K, YAMAKAWA M, SHIINA T. Ring-array photoacoustic tomography for imaging human finger vasculature[J/OL]. J Biomed Opt, 2019, 24: 096005. DOI: 10.1117/1.JBO.24.9.096005.
|
| [16] |
ESTRADA H, REBLING J, HOFMANN U, RAZANSKY D. Discerning calvarian microvascular networks by combined optoacoustic ultrasound microscopy[J/OL]. Photoacoustics, 2020, 19: 100178. DOI: 10.1016/j.pacs.2020.100178.
|
| [17] |
MALLIDI S, WATANABE K, TIMERMAN D, SCHOENFELD D, HASAN T. Prediction of tumor recurrence and therapy monitoring using ultrasound-guided photoacoustic imaging[J]. Theranostics, 2015, 5: 289-301. DOI:10.7150/thno.10155 |
| [18] |
LIU Z Y, AU M T, WANG X, CHAN P M B, LAI P X, SUN L, et al. Photoacoustic imaging of synovial tissue hypoxia in experimental post-traumatic osteoarthritis[J]. Prog Biophys Mol Biol, 2019, 148: 12-20. DOI:10.1016/j.pbiomolbio.2018.03.009 |
| [19] |
CHEN M M, KNOX H J, TANG Y Q, LIU W, NIE L M, CHAN J, et al. Simultaneous photoacoustic imaging of intravascular and tissue oxygenation[J]. Opt Lett, 2019, 44: 3773-3776. DOI:10.1364/OL.44.003773 |
| [20] |
WOOD C, HARUTYUNYAN K, SAMPAIO D R T, KONOPLEVA M, BOUCHARD R. Photoacoustic-based oxygen saturation assessment of murine femoral bone marrow in a preclinical model of leukemia[J]. Photoacoustics, 2019, 14: 31-36. DOI:10.1016/j.pacs.2019.01.003 |
| [21] |
LIU L, BROSZCZAK D A, BROADBENT J A, SINGH D P, STECK R, PARKER T J, et al. Comparative label-free mass spectrometric analysis of temporal changes in the skeletal muscle proteome after impact trauma in rats[J/OL]. Am J Physiol Endocrinol Metab, 2020, 318: E1022-E1037. DOI: 10.1152/ajpendo.00433.
|
| [22] |
MENGER M M, KÖRBEL C, BAUER D, BLEIMEHL M, TOBIAS A L, BRAUN B J, et al. Photoacoustic imaging for the study of oxygen saturation and total hemoglobin in bone healing and non-union formation[J/OL]. Photoacoustics, 2022, 28: 100409. DOI: 10.1016/j.pacs.2022.100409.
|
| [23] |
HE H L, SCHÖNMANN C, SCHWARZ M, HINDELANG B, BEREZHNOI A, STEIMLE-GRAUER S A, et al. Fast raster-scan optoacoustic mesoscopy enables assessment of human melanoma microvasculature in vivo[J/OL]. Nat Commun, 2022, 13: 2803. DOI: 10.1038/s41467-022-30471-9.
|
| [24] |
KIRKHAM B M, SCHULTZ S M, ASHI K, SEHGAL C M. Assessment of age-related oxygenation changes in calf skeletal muscle by photoacoustic imaging: a potential tool for peripheral arterial disease[J]. Ultrason Imaging, 2019, 41: 290-300. DOI:10.1177/0161734619862287 |
 2023, Vol. 44
2023, Vol. 44


