2. 上海理工大学健康科学与工程学院生物医学工程研究所, 上海 200093
2. Institute of Biomedical Engineering, School of Health Science and Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China
周围神经损伤将直接导致运动、感觉等功能障碍,骨折合并周围神经损伤时常须进行紧急手术以避免损伤加重或遗留严重后遗症[1]。随着对骨内局部微环境关注的日益增多,周围神经对骨代谢调控作用的研究愈加深入,有学者发现周围神经广泛支配并营养骨骼,包括骨皮质、骨小梁、骨髓和骨膜,通过周围神经调节骨修复、骨重塑被认为是神经调节骨代谢的重要途径[2-5]。例如,在骨折大鼠的骨痂、增厚的骨膜和纤维软骨中可见大量神经纤维出芽并在早期血管形成前长入纤维软骨与编织骨中[6];兔下颌骨牵张成骨实验发现缺失感觉神经导致了新生骨形成异常[7]。因此,在骨愈合过程中,周围神经对骨修复有重要作用,骨折合并周围神经损伤将影响骨折愈合,甚至可能导致延迟愈合、骨不愈合或终身残疾。研究者们尝试通过外科手术、药物治疗、中医与物理疗法等手段治疗骨折合并周围神经损伤,但疗效均不理想[8-10]。
小鼠基因图谱详尽,基因编辑为研究骨折愈合的分子机制提供了潜在技术方法,并且小鼠具有饲养周期短、成本低、繁殖量大、可控性好等优势,因此以小鼠为骨折的动物模型应用较为广泛。目前已有的骨折模型包括小鼠开放性胫骨骨折模型、小鼠开放性股骨骨折模型和小鼠闭合性股骨骨折模型。本实验采用了小鼠开放性股骨骨折模型,其相较于其他2种模型可更好地控制骨折类型和骨折位置的一致,使骨折愈合方式达到标准化。此外,股骨髓腔相对较直、较粗,内径为0.6~0.7 mm,骨折髓内固定可采用轴向稳定性较好的髓内固定针(25 G,外径为0.51 mm)[11]。有学者认为当髓内钉(针)直径占髓腔内径的85%左右、弹性模量占正常股骨刚度的20%~50%时,其促进骨折愈合的效果最佳[12-13]。
坐骨神经是体内最粗大的外周神经,沿大腿后侧下行,依次发出关节支、肌支、胫神经和腓总神经,支配下肢大多数的皮肤感觉与骨关节、肌肉运动[14]。目前,坐骨神经损伤的建模方法主要为物理损伤法和化学损伤法,物理损伤法中的钳夹损伤法在保持神经干连续性及神经外膜完整性的前提下,为神经修复提供了可能,可用于周围神经再生的生物学与治疗方案研究[15-16]。有学者通过钳夹损伤法量化了小鼠在不同压力下的神经损伤程度,提出了确切的钳夹时间、损伤位置等建模参数[17]。
合并周围神经损伤的骨折愈合受诸多因素影响,寻找一种有效的方法建立骨折合并周围神经损伤动物模型是研究骨折合并周围神经损伤的关键。本实验建立了股骨骨折合并坐骨神经损伤小鼠模型,并对各时间点的骨折愈合情况进行分析。
1 材料和方法 1.1 实验动物96只SPF级6~8周龄雄性C57BL/6小鼠[上海吉辉实验动物饲养有限公司,实验动物生产许可证号为SCXK(沪)2017-0012],体重为(24±2)g,随机分为两组:股骨骨折合并坐骨神经损伤组(48只)和股骨骨折组(48只)。在实验前1周于海军军医大学(第二军医大学)SPF级动物房[实验动物使用许可证号为SYXK(沪)2020-0033]进行适应性饲养,6只/笼,12 h光照、12 h黑暗交替,自由进食饮水,室温为(22±2)℃,湿度为(45±5)%,1周更换2次垫料及笼盒。实验操作严格按照实验动物管理条例及伦理委员会相关规定执行。
1.2 实验仪器与试剂石蜡切片机(上海徕卡仪器有限公司),X线扫描仪(江苏大为医疗有限公司),Micro-CT机(美国ThermoFisher Scientific公司),正置光学显微镜(日本Nikon公司),1%戊巴比妥钠(上海新亚药业有限公司),β-Ⅲ-微管蛋白(β-Ⅲ-tubulin)抗体(货号GB15139)、H-E染液(货号G1003)、番红固绿(货号G1053,武汉赛维尔生物科技有限公司),中性PBS(货号C0221A)、4%多聚甲醛溶液(货号P0099,上海碧云天生物技术有限公司),显微手术器械(上海医疗器械有限公司)。
1.3 动物模型制备(1)股骨骨折合并坐骨神经损伤组:使用1%戊巴比妥钠(1 mL/kg)腹腔注射,待小鼠深度麻醉后,备皮、常规消毒左下肢,取右侧卧位置于固定台,于左侧坐骨切迹下约4 mm处沿坐骨神经体表投影走行,自后向前外侧做一长约1.5 cm的弧形切口。经钝性分离后暴露坐骨神经主干至其远端第一分支交叉处,自坐骨神经主干近端起用J31020有齿弯止血钳3扣的压力钳夹神经干10 s后松开。然后在远端2.0 mm处用同样钳夹压力和时间再次操作,2次间隔10 s,再向远端移动2.0 mm重复钳夹,共钳夹3次,全程50 s。于小鼠同侧股外侧肌与股二头肌间隙钝性分离软组织,暴露股骨干长度约为8.0 mm。将1个22 G、0.41 mm的注射器针头垂直股骨干并紧贴其下方穿出,然后钝性分离股骨干内侧肌肉。屈曲膝关节90°~100°,显露膝外侧副韧带,用显微手术器械钝性分离膝外侧部,并将髌骨向内侧推移。用25 G注射器针头自股骨髁间开口进入髓腔,拔除开口针头后用带刻度的25 G钝针(长约5.0 cm)插入髓腔内约3.0 mm。使用0.15 mm金属线锯于股骨干中部做横行骨折,待锯至对侧骨皮质时,完全插入髓内针(深度1.0~1.2 cm),继续锯至对侧骨皮质完全中断,稍复位骨折断端后,将股骨髁间外多余髓内针用尖嘴钳剪断。复位髌骨后,使用5-0缝合线缝合筋膜层,3-0缝合线单纯间断缝合皮肤。
(2)股骨骨折组:做弧形切口后,仅游离小鼠左侧坐骨神经,不做钳夹处理。此后采取与股骨骨折合并坐骨神经损伤组相同的操作,对小鼠左侧股骨干行骨折及髓内钉固定处理,并用同样方法缝合筋膜及皮肤。
1.4 术后小鼠行为学观察与评估术后每天观察小鼠活动能力,通过敲击震动鼠笼,对小鼠的反应能力及活动范围进行综合评估。术后将两组小鼠依次置于一安静房间的空笼中,待其适应环境1 h后,以木棒轻敲鼠笼体一侧产生震动与声响,同时运行Sound Meter APP进行声响的简易标准化限定,控制声音响度在55~70 dB。小鼠可快速完成从鼠笼一侧活动至另一侧或活动同等距离,且活动期间无跛行,左下肢无勾悬,计5分;可在较短时间内从鼠笼一侧活动至另一侧或活动同等距离,但活动期间出现跛行,左下肢无勾悬,计4分;可从鼠笼一侧活动至另一侧或活动同等距离,但所需时间较长且活动期间有左下肢勾悬,计3分;无法从鼠笼一侧活动至另一侧或活动同等距离,但可完成同等距离一半以上的活动,且活动期间有左下肢勾悬,计2分;有部分位移活动但无法完成从鼠笼一侧至另一侧一半的活动或不足同等距离的一半,计1分;无明显位移活动,计0分。以上计分由3名研究者在同一时间点独立完成,以3人计分的平均值作为分析数据。
1.5 术后小鼠影像学与组织学分析两组小鼠分别在术后第3、5、7、10、14、18天时,用1%戊巴比妥钠(1 mL/kg)腹腔注射深度麻醉,采取颈椎脱臼法处死。取小鼠左侧坐骨神经,使用4%多聚甲醛溶液固定24 h后以5 μm厚切片,进行β-Ⅲ-微管蛋白免疫组织化学染色,然后于镜下观察组织病理学改变。同时,术后第7、14、21、28天小鼠深度麻醉后进行左下肢X线片检查(球管电压为30 kV,球管电流为8 mA),然后用相同方法处死小鼠,取骨折术后股骨,使用4%多聚甲醛溶液固定24~36 h,用中性PBS冲洗3次后再用75%乙醇固定。经Micro-CT保湿扫描(球管电压为70 kV,球管电流为115 μA,功率为8 W)后利用Image-Pro Plus 6.0软件进行图像形态计量学分析,记录切片内骨折断端骨痂骨体积(mm3)及骨体积百分比(骨体积/组织体积×100%)。随后将股骨样本用15% EDTA溶液脱钙处理6~10 d,采用梯度乙醇脱水后进行石蜡包埋,约5 mm厚切片,分别行H-E及番红固绿染色,于光镜下观察骨组织病理学改变。
1.6 统计学处理应用Excel 2016软件进行统计学分析,应用ImageJ 5.0软件进行图像分析。服从正态分布且方差齐的计量资料以x±s或x表示,两组间比较采用独立样本t检验。检验水准(α)为0.05。
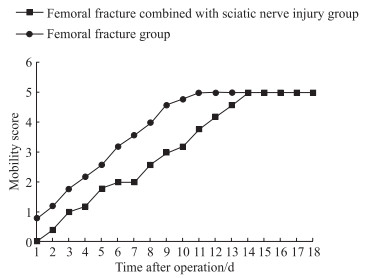
2 结果 2.1 术后小鼠行为学变化两组小鼠术后行为学改变包括舔舐术侧下肢及手术切口、术侧下肢勾悬、跛行、活动减少等,且术后的活动能力均随时间延长而增强。如图 1所示,股骨骨折合并坐骨神经损伤组小鼠的步态与活动能力于术后第14天基本恢复正常水平,股骨骨折组小鼠于术后第11天恢复正常水平。
|
图 1 两组小鼠术后活动能力评分 Fig 1 Mobility scores of mice in 2 groups after operation n=6, x. |
2.2 X线片检查与Micro-CT 3D重建分析
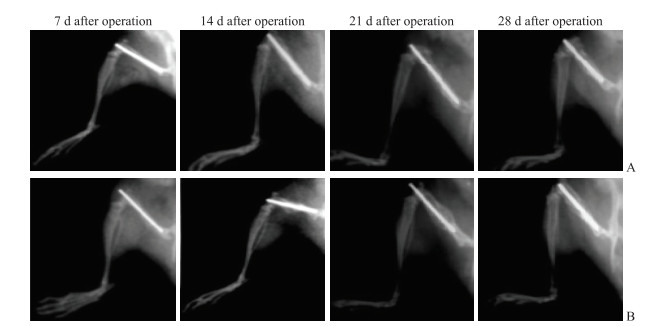
术后X线片(图 2)可见96只小鼠的骨折均为发生于左侧股骨干中段的单纯骨折,其中股骨骨折合并坐骨神经损伤组42只(87.5%)小鼠的骨折为横行骨折,6只(12.5%)为短斜行骨折;股骨骨折组43只(89.6%)小鼠为横行骨折,5只(10.4%)为短斜行骨折,两组小鼠均未见明显螺旋形骨折、粉碎性骨折及骨折不愈合。术后第7天X线片检查见两组小鼠骨折线清晰,骨折端对线对位可,未见明显旋转、分离与成角移位;髓内固定针长度及位置合适,未发现移位、断裂及弯曲变形。股骨骨折合并坐骨神经损伤组小鼠于术后第7天骨折断端几乎未见骨痂形成,至第14天出现少量骨痂;第21天于X线片可见骨痂密度增加,提示骨痂开始钙化;第28天骨折处局部膨大,呈丘状,外周骨质丰富,皮质骨形成,断端连接良好,仅存在少量钙化骨痂。股骨骨折组小鼠于术后第7天同样未见明显的骨痂形成;第14天骨折断端可见明显钙化骨痂,断端骨质部分连接,仍可见骨折线;第21天可见骨折断端明显膨大,骨折断端基本愈合,骨折线模糊。
|
图 2 两组小鼠术后左侧股骨侧位X线片 Fig 2 Postoperative lateral X-ray radiographs of left femur of mice in 2 groups A: Femoral fracture combined with sciatic nerve injury group; B: Femoral fracture group. |
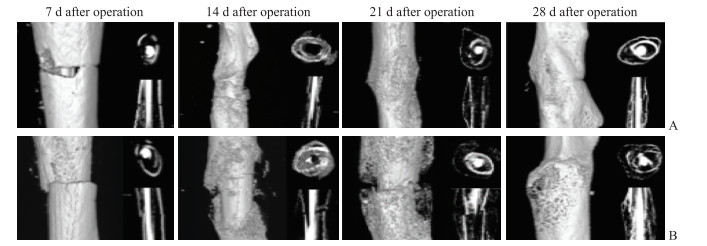
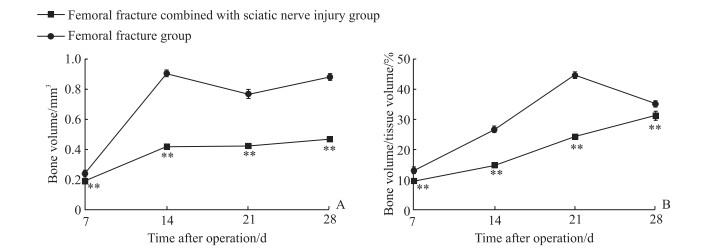
Micro-CT 3D重建图像(图 3)显示,两组小鼠于术后第7天均无明显钙化骨痂形成,骨折线清晰。术后第14天两组小鼠骨折线依旧清晰可见,其中股骨骨折组小鼠形成的钙化骨痂较股骨骨折合并坐骨神经损伤组明显,且骨折断端两侧骨质有少量连接;管状切面可见两组小鼠股骨髓腔内均存在钙化灶,且以股骨骨折组较为明显。术后第21天,股骨骨折合并坐骨神经损伤组小鼠骨折断端骨痂开始钙化,且其骨痂于管状切面与矢状面均较股骨骨折组少;股骨骨折组小鼠骨折断端周围可见明显骨痂形成,体积较大,包绕断端,外周骨质丰富,大量皮质骨形成,骨折断端已基本愈合。术后第28天,股骨骨折合并坐骨神经损伤组小鼠骨折断端稍膨大,于管状切面可见骨折已基本愈合,且股骨骨折组小鼠骨折断端骨痂仍较股骨骨折合并坐骨神经损伤组大。经Micro-CT检查后,对骨折周围骨痂骨体积与骨体积百分比进行分析,结果(图 4)显示在术后各时间点,股骨骨折合并坐骨神经损伤组的骨体积均小于股骨骨折组(P均<0.01),骨体积百分比也均低于股骨骨折组(P均<0.01);两组小鼠术后骨痂形成均随时间延长而增加,且股骨骨折合并坐骨神经损伤组形成的骨痂始终少于股骨骨折组,表明股骨骨折合并坐骨神经损伤小鼠骨痂形成缓慢,但随时间延长骨痂钙化越来越明显,骨痂改建也较单纯股骨骨折小鼠延迟。
|
图 3 两组小鼠术后左侧股骨的Micro-CT 3D重建图像 Fig 3 Postoperative micro-CT 3D reconstruction images of left femur of mice in 2 groups A: Femoral fracture combined with sciatic nerve injury group; B: Femoral fracture group. |
|
图 4 两组小鼠术后左侧股骨骨痂骨体积(A)和骨体积百分比(B)变化 Fig 4 Postoperative changes in bone volume (A) and bone volume/tissue volume (B) of left femur of mice in 2 groups **P < 0.01 vs femoral fracture group at the same time point. n=6, x±s. |
2.3 术后小鼠坐骨神经组织病理学变化
术后小鼠左侧坐骨神经β-Ⅲ-微管蛋白免疫组织化学染色(图 5)显示,术后第3天,股骨骨折合并坐骨神经损伤组小鼠坐骨神经钳夹部位神经纤维密集性下降,排列混乱,轴索水肿、部分断裂,部分髓鞘崩解,炎症细胞浸润明显;股骨骨折组小鼠坐骨神经纤维平行、整齐排列,切面形态和大小较一致,轴索连续性良好,髓鞘及神经纤维外膜保存完好。术后第14天,股骨骨折合并坐骨神经损伤组小鼠的坐骨神经纤维基本恢复连续性,排列较整齐,不存在轴索断裂及髓鞘崩解,炎症细胞浸润减少,提示受损坐骨神经结构已基本恢复。
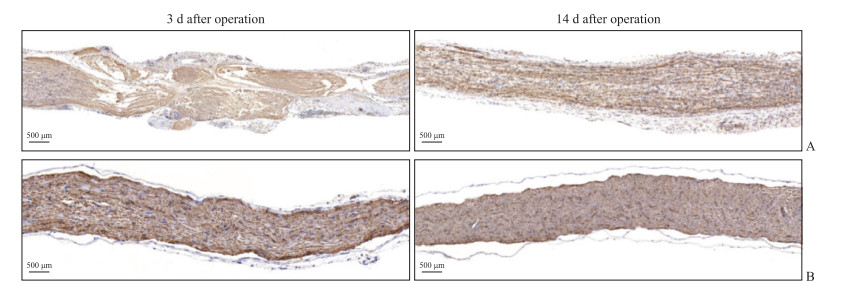
|
图 5 β-Ⅲ-微管蛋白免疫组织化学染色观察两组小鼠术后左侧坐骨神经的形态变化 Fig 5 Morphology changes of left sciatic nerve in mice after operation in 2 groups observed by β-Ⅲ-tubulin immunohistochemical staining A: Femoral fracture combined with sciatic nerve injury group; B: Femoral fracture group. |
2.4 术后小鼠股骨组织病理学变化
H-E染色(图 6)显示,股骨骨折合并坐骨神经损伤组小鼠术后第7天骨折断端几乎不存在骨痂,有大量炎症细胞浸润;术后第14天出现少量软骨痂,于断端形成内外连接的桥接骨痂,主要由未分化的间充质干细胞构成;术后第21天软骨痂开始钙化,骨痂中存在少量的软骨细胞与较多的纤维细胞;术后第28天骨折断端新生骨初步形成,含有大量肥大的软骨细胞、成骨细胞与骨细胞,骨小梁结构仍紊乱,提示骨折进入了原始骨痂形成期。股骨骨折组小鼠术后第7天于骨折断端可见少量聚集的未分化间充质干细胞;术后第14天骨折断端可见明显的软骨痂形成,主要由大量肥大的软骨细胞组成;术后第21天小鼠骨折断端软骨细胞数量减少,且形成了由大量成骨细胞及骨基质中的骨细胞组成的类骨质,提示软骨痂已进入钙化阶段,形成了硬骨痂;术后第28天,骨折断端的骨小梁结构趋向规律,提示骨痂处于吸收塑形阶段。
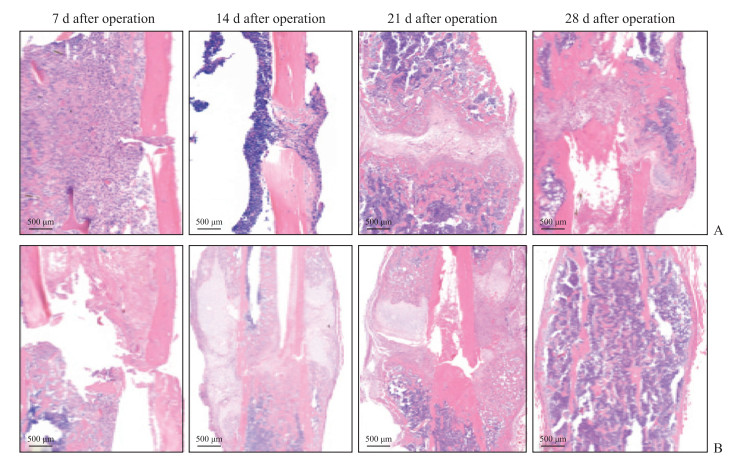
|
图 6 苏木精-伊红染色观察两组小鼠术后不同时间点左侧股骨的形态改变 Fig 6 Morphology changes of left femur in mice at different time points after operation in 2 groups observed by hematoxylin-eosin staining A: Femoral fracture combined with sciatic nerve injury group; B: Femoral fracture group. |
番红固绿染色(图 7)显示,术后第7天,股骨骨折合并坐骨神经损伤组小鼠骨折断端周围几乎无软骨基质与软骨痂;术后第14天,断端有少量软骨基质形成,仅见少量的软骨痂形成,无明显的骨痂钙化;术后第21天,断端形成少量松质小梁骨,皮质骨厚度开始增加,桥接骨痂由大量纤维细胞和少量软骨基质组成;术后第28天,断端以钙化骨痂为主,同时仍存在部分由肥大软骨细胞组成的软骨痂,断端有大量松质小梁骨,皮质骨厚度增加。术后第7天,股骨骨折组小鼠骨折断端也少见钙化骨痂形成,仅有极少的软骨基质;术后第14天,断端有大量的软骨基质形成,存在丰富的软骨痂及少量硬骨痂,松质小梁骨逐渐形成;术后第21天,断端以钙化骨痂形成为主,仅存在部分软骨基质;术后第28天,断端已形成大量松质小梁骨,皮质骨厚度增加明显,髓腔部分形成。
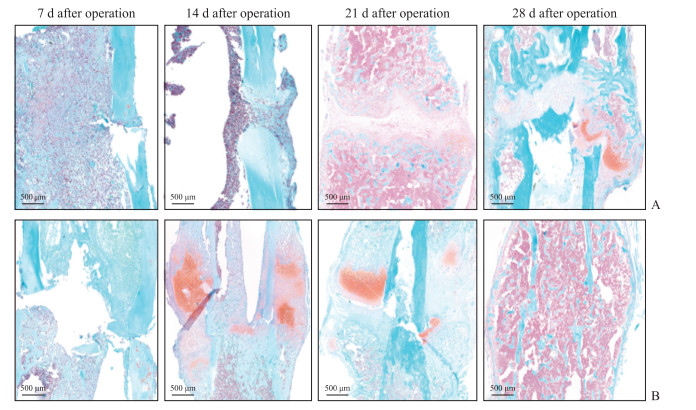
|
图 7 番红固绿染色观察两组小鼠术后不同时间点左侧股骨的形态改变 Fig 7 Morphology changes of left femur in mice at different time points after operation in 2 groups observed by safranine-fast green staining A: Femoral fracture combined with sciatic nerve injury group; B: Femoral fracture group. |
3 讨论
骨折愈合是一个复杂而连续的过程,通常需要经历撞击期、诱导期、炎症期、软骨痂期、硬骨痂期和塑形改建期[18]。根据骨折类型,骨折愈合分为一期愈合与二期愈合,即通过骨重塑实现的一期愈合(直接愈合)和通过骨痂形成实现的二期愈合(间接愈合),临床上绝大多数的骨折愈合都属于后者。在间接愈合过程中,软骨内骨化与膜内骨化交替完成骨修复与骨再生,由破骨细胞主导的骨吸收完成骨重塑,最终骨折部位恢复到与原来骨组织一样的结构,达到完全愈合。
骨折局部微环境中有多种细胞与生物活性因子直接或间接影响骨折愈合。近十几年来,越来越多学者研究了参与骨折愈合的细胞成分,包括炎症细胞、间充质干细胞、成骨细胞、破骨细胞、软骨细胞等,发现各种细胞对骨修复的作用并非单一和独立,而是相互重叠、相互协调的偶联关系,在相互偶联的过程中,许多生物活性因子发挥重要的“信使”作用。有趣的是,临床上一些合并脑外伤的骨折患者出现了骨折部位过度的骨形成,甚至异位骨化;有些骨折患者合并周围神经损伤后出现了骨折延迟愈合,甚至骨不连。这些棘手的临床问题聚焦了神经因素对骨折愈合影响的关键研究方向,神经递质、神经肽、轴突引导因子和神经营养因子等信号分子参与骨稳态的机制逐渐成为研究热点[4]。
本实验选取C57BL/6小鼠作为研究对象,通过物理钳夹法造成坐骨神经损伤,同时对以往的股骨骨折模型制作方法进行改良,通过精细线锯造成骨折并在骨髓内插入钝头空心固定针的方法制作了小鼠股骨骨折合并坐骨神经损伤模型。术后小鼠的影像学检查与组织病理学分析可见,此种方式所造成的骨折以简单骨折为主,未见粉碎性骨折等复杂骨折类型,此外股骨干破裂程度较轻,骨缺损导致骨不连的干扰因素相对较少;股骨组织切片染色显示,相较于单纯股骨骨折,合并坐骨神经损伤的股骨骨折在骨折愈合进程中软骨痂形成和向硬骨痂转化阶段表现出相对滞后的骨折愈合能力,以术后第14天与第21天较显著。既往研究报道,物理钳夹法造成的大鼠坐骨神经损伤可通过量化止血钳扣压压力大小控制神经损伤程度[17]。本实验采取统一的坐骨神经位置及钳夹压力与时间进行钳夹损伤,并通过小鼠术后行为学变化与坐骨神经的β-Ⅲ-微管蛋白免疫组织化学染色进行分析与评估,观察到坐骨神经纤维断裂,而神经外膜与束膜保持连续性、瘢痕组织形成较少,属于Sunderland Ⅲ度损伤,说明本实验构建的小鼠神经损伤模型便于短期内观察周围神经损伤的恢复过程。
尽管许多学者将神经因素作为影响骨修复、骨再生和骨代谢的一个研究热点,但缺乏一种能有效模拟骨折合并神经损伤的标准化实验动物模型。本实验提出了一种开放性股骨干骨折合并坐骨神经钳夹损伤的标准化动物模型构建方法,并通过小鼠活动度评分的行为学分析、骨组织影像学检查、组织形态学和免疫组织化学染色等对动物模型进行了评价。但该模型还需进一步完善造模方法与评价指标,如通过采用具有压力传感器的钳夹装置精准控制造成神经损伤的压力,利用联合肌电诱发电位仪测量神经电生理指标,基于数字成像技术进行步态分析,以及对骨折后骨组织的生物力学进行检测等,或许能为进一步研究骨折合并周围神经损伤的临床治疗提供新见解、新思路。
| [1] |
SINGH V K, HAQ A, TIWARI M, SAXENA A K. Approach to management of nerve gaps in peripheral nerve injuries[J]. Injury, 2022, 53: 1308-1318. DOI:10.1016/j.injury.2022.01.031 |
| [2] |
ELEFTERIOU F. Impact of the autonomic nervous system on the skeleton[J]. Physiol Rev, 2018, 98: 1083-1112. DOI:10.1152/physrev.00014.2017 |
| [3] |
SAYILEKSHMY M, HANSEN R B, DELAISSÉ J M, ROLIGHED L, LEVIN ANDERSEN T, HEEGAARD A M. Innervation is higher above bone remodeling surfaces and in cortical pores in human bone: lessons from patients with primary hyperparathyroidism[J/OL]. Sci Rep, 2019, 9: 5361. DOI: 10.1038/s41598-019-41779-w.
|
| [4] |
WAN Q Q, QIN W P, MA Y X, SHEN M J, LI J, ZHANG Z B, et al. Crosstalk between bone and nerves within bone[J/OL]. Adv Sci (Weinh), 2021, 8: 2003390. DOI: 10.1002/advs.202003390.
|
| [5] |
WANG X D, LI S Y, ZHANG S J, GUPTA A, ZHANG C P, WANG L. The neural system regulates bone homeostasis via mesenchymal stem cells: a translational approach[J]. Theranostics, 2020, 10: 4839-4850. DOI:10.7150/thno.43771 |
| [6] |
LI J, AHMAD T, SPETEA M, AHMED M, KREICBERGS A. Bone reinnervation after fracture: a study in the rat[J]. J Bone Miner Res, 2001, 16: 1505-1510. DOI:10.1359/jbmr.2001.16.8.1505 |
| [7] |
CAO J, ZHANG S J, GUPTA A, DU Z J, LEI D L, WANG L, et al. Sensory nerves affect bone regeneration in rabbit mandibular distraction osteogenesis[J]. Int J Med Sci, 2019, 16: 831-837. DOI:10.7150/ijms.31883 |
| [8] |
GARG K, SINHA S, SATYARTHEE G D, AGARWAL D, GUPTA D K, SHARMA B, et al. Microsurgical outcome of post-traumatic peripheral nerve injuries: an experience of 23 cases and review of literature[J]. Turk Neurosurg, 2016, 26: 297-301. |
| [9] |
于志华, 梁建明, 粟保元, 唐平. 补气祛瘀方联合甲钴胺治疗骨盆骨折性坐骨神经损伤[J]. 华夏医学, 2014, 27: 128-130. |
| [10] |
储淼, 周建刚. 全髋关节置换术后坐骨神经损伤的治疗及预防探讨[J]. 中外医疗, 2020, 39: 45-47, 53. |
| [11] |
MOORE E R, FEIGENSON M, MARIDAS D E. Transverse fracture of the mouse femur with stabilizing pin[J/OL]. J Vis Exp, 2021(178). DOI: 10.3791/63074.
|
| [12] |
张志平, 白晓春, 张忠民, 金大地. 髓内针固定小鼠闭合性股骨骨折模型的建立[J]. 解剖学报, 2012, 43: 135-138. |
| [13] |
GARDNER M J, PUTNAM S M, WONG A, STREUBEL P N, KOTIYA A, SILVA M J. Differential fracture healing resulting from fixation stiffness variability: a mouse model[J]. J Orthop Sci, 2011, 16: 298-303. DOI:10.1007/s00776-011-0051-5 |
| [14] |
ATONI A D, OYINBO C A, FRANCIS D A U, TABOWEI U L. Anatomic variation of the sciatic nerve: a study on the prevalence, and bifurcation loci in relation to the piriformis and popliteal fossa[J]. Acta Med Acad, 2022, 51: 52-58. DOI:10.5644/ama2006-124.370 |
| [15] |
苏静, 凌春燕, 雷龙鸣. 坐骨神经损伤实验动物的建模及评价方法与指标[J]. 中国组织工程研究, 2021, 25: 4186-4191. |
| [16] |
王启文, 宋春莉, 沈梅, 叶冬梅, 李莎, 丛林. 钳夹压力法建立大鼠坐骨神经损伤模型的研究[J]. 中国康复医学杂志, 2020, 35: 135-140. |
| [17] |
孔亚敏, 严隽陶. 坐骨神经损伤模型的量化研究[J]. 神经损伤与功能重建, 2021, 16: 249-252, 273. |
| [18] |
BAHNEY C S, ZONDERVAN R L, ALLISON P, THEOLOGIS A, ASHLEY J W, AHN J, et al. Cellular biology of fracture healing[J]. J Orthop Res, 2019, 37: 35-50. |
 2023, Vol. 44
2023, Vol. 44


