隐匿性转移瘤是低于横断面成像系统显像阈值而无法明确的转移性疾病,是胰腺导管腺癌常规分期不足的原因之一。文献报道,胰腺癌腹腔隐匿性转移(occult abdominal metastatic disease)的发生率为8%~24.4%,部分患者在剖腹探查时已经失去了根治性手术机会[1]。尽管腹腔转移是预后不良的重要因素之一,及早通过静脉或腹腔注射化学治疗药物仍能取得良好的疾病控制率,可以使胰腺癌腹腔转移患者的中位生存期延长至16.3个月,1年总生存率上升为62%,1/4的患者能够获得中转手术条件[2-3]。通常情况下胰腺癌腹腔转移的症状不典型,一般仅表现为腹痛、腹胀等,术前诊断依赖于影像学检查。增强CT和MRI由于能同时较好地显示肿瘤与血管的空间关系并相互补足,是胰腺癌诊断和分期的首要手段[4]。但目前影像学技术仍无法对转移到肝脏等部位的微小病灶做出有效诊断。研究显示,当腹膜转移病灶<1 cm时,CT的灵敏度仅为9%~28%[5],PET-CT和MRI也并不敏锐,漏诊率高达15%[6-7]。美国国立综合癌症网络临床指南指出,胰腺癌的诊断和分期原则参考基于高质量临床资料的多学科会诊评估[4]。当影像学结果不能明确转移病灶时,往往需要结合其他指标做出综合评判。
腹腔镜能发现64.4%隐匿的不可切除性病变,有效减少非必要的开腹手术[8]。因此,对腹腔隐匿性转移高危患者采用腹腔镜进行术前分期检查十分重要。但国内外对胰腺癌患者采用腹腔镜检查的最佳指征仍缺乏有力报道。本研究旨在对胰腺导管腺癌患者术前常规临床资料进行分析以找出腹腔隐匿性转移的危险因素,并建立评分模型以更高效地指导诊断性腹腔镜的使用,从而减少患者承受不必要的手术创伤。
1 资料和方法 1.1 研究对象回顾性选择2018年9月至2020年12月在我科行腹腔镜和/或开放手术治疗的1 036例胰腺癌患者。纳入标准:(1)术后病理检查确定为胰腺导管腺癌;(2)转移灶病理检查确定为转移性胰腺腺癌。排除标准:(1)胰腺部位行多次手术治疗的患者;(2)临床资料缺失严重的患者;(3)术前胰腺动脉增强CT或增强MRI检查已明确存在腹腔转移的患者。经初步筛选后,共986例胰腺导管腺癌患者在术前影像学检查中并未明确有转移病灶,在进一步排除实验室检查资料缺失严重的病例后,最终有924例患者用于模型构建,其中腹腔隐匿性转移组80例、未转移组844例。腹腔隐匿性转移的诊断标准:(1)术前胰腺动脉增强CT和增强MRI检查未发现腹腔转移,而术中意外发现转移病灶,且术后病理检查明确为胰腺导管腺癌;(2)术前影像学检查发现存在可疑病灶,术后病理检查明确为转移性胰腺导管腺癌。
我科胰腺癌病例量大,未常规开展术前诊断性腹腔镜检查。对于存在肝可疑转移瘤和腹腔不确定性病灶的患者,当现有分期诊断提示具备手术指征时,待术中或术后病理检查明确肝可疑转移瘤和腹腔不确定性病灶性质后,制定后续治疗方案。
1.2 资料收集收集患者的基本情况、病史、实验室检查、影像学检查等资料。基本资料包括性别、年龄、术前BMI、发病以来体重变化。病史资料包括有无腹痛、腹胀不适、腰背酸痛等情况,糖尿病史及血糖控制情况,吸烟史,饮酒史,高血压病史,有无乙型肝炎、甲状腺功能亢进症、慢性结肠炎等全身性疾病,以及是否有侵犯腹腔的手术史和其他恶性肿瘤病史。实验室检查资料均为术前2周内的检验结果,包括血常规、血生物化学、肿瘤标志物等指标。肿瘤标志物主要包括甲胎蛋白、癌胚抗原、糖类抗原(carbohydrate antigen,CA)125、CA19-9、CA724。影像学检查资料为术前3周内胰腺动脉增强CT检查报告结果,主要记录有无腹水、肿瘤大小、胰腺肿瘤部位、是否侵犯胰周结构、胆管是否截断、是否侵犯周围脏器、血管受侵犯的详细情况、有无可疑淋巴结转移、有无肝可疑转移瘤及腹腔其他部位不确定性病灶的个数。其中,可疑淋巴结转移仅记录在手术清扫范围内的淋巴结。
1.3 统计学处理应用SPSS 26.0软件和R 4.0.4软件进行统计学分析。呈正态分布的计量资料以x±s表示;呈偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,采用Wilcoxon秩和检验进行两组间比较。计数资料以例数和百分数表示,对于二分类资料采用χ2检验、连续校正χ2检验或Fisher确切概率法进行组间比较,对于无序多分类资料或等级资料采用Cochran-Mantel-Haenszel(CMH)检验进行组间比较。将单因素分析中P≤0.2的变量纳入多因素分析,采用二元logistic回归方法,变量筛选采用后退法,α排除取0.05。将筛选得出的独立危险因素,采用R 4.0.4软件分析计算,构建列线图模型。采用ROC曲线通过最大约登指数(灵敏度+特异度-1)确定模型的最佳临界预测分值,并计算在此分值下的灵敏度和特异度。检验水准(α)为0.05。
2 结果 2.1 患者临床资料及腹腔隐匿性转移影响因素的单因素分析在初步筛选的986例患者中腹腔隐匿性转移组83例、未转移组903例,腹腔隐匿性转移的总体发生率为8.42%;男593例(60.14%)、女393例(39.86%);年龄为26~85(62.40±9.43)岁,年龄≤60岁395例(40.06%),>60岁591例(59.94%);BMI为(22.79±2.94)kg/m2;2年内新发糖尿病或近期血糖控制不稳的患者有121例(12.27%);既往有腹腔侵犯性手术史的患者277例(28.09%),有胰腺炎病史76例(7.71%),有系统性疾病98例(9.94%);术前有新辅助化疗史的患者110例(11.16%),其中同时行放射治疗者12例(1.22%);肿瘤组织中存在其他病理类型的患者有26例(2.64%),由于病例数少,未纳入分析。
用于模型构建分析的924例患者中腹腔隐匿性转移组80例、未转移组844例。单因素分析显示,腹腔隐匿性转移组有腹痛、腹水的患者比例和腹痛时间、癌胚抗原、甲胎蛋白、CA125、CA19-9、CA724、肿瘤大小、胰体尾部肿瘤占比、腹腔干侵犯程度、肠系膜上动脉侵犯程度、脾动脉侵犯程度、脾静脉侵犯程度,以及肿瘤突破被膜、侵犯周围脏器、第9组可疑淋巴结转移、第13组可疑淋巴结转移、第14组可疑淋巴结转移、第17组可疑淋巴结转移、腹膜后可疑淋巴结转移、肝可疑转移瘤、腹腔不确定性病灶等的比例均高于未转移组(P均<0.05),而总胆红素、前白蛋白、丙氨酸转氨酶、天冬氨酸转氨酶、碱性磷酸酶、乳酸脱氢酶水平及有腹腔手术史的患者比例均低于未转移组(P均<0.05)。见表 1。
|
|
表 1 胰腺导管腺癌患者腹腔隐匿性转移组与未转移组基线资料的单因素分析 Tab 1 Univariate analysis of baseline data of pancreatic ductal adenocarcinoma patients in occult abdominal metastatic and non-metastatic groups |
2.2 腹腔隐匿性转移影响因素的多因素二元logistic回归分析
为进一步明确腹腔隐匿性转移的独立危险因素,将单因素分析中P≤0.2的变量纳入多因素分析,采用二元logistic回归模型,采用后退法进行变量筛选,α排除=0.05,筛出9个变量,对其中多分类变量“肠系膜上动脉侵犯程度”进行哑变量赋值,以“未侵犯”作为对照。多因素分析结果显示,年龄、腹水、肿瘤短径、侵犯周围脏器、肠系膜上动脉侵犯程度、第13组可疑淋巴结转移、肝可疑转移瘤、腹腔不确定性病灶、腹腔手术史等是胰腺导管腺癌患者腹腔隐匿性转移的独立预测因素(P均<0.05)。见表 2。
|
|
表 2 胰腺导管腺癌患者腹腔隐匿性转移影响因素的多因素二元logistic回归分析 Tab 2 Multivariate binary logistic regression analysis of influencing factors of occult abdominal metastasis of pancreatic ductal adenocarcinoma patients |
2.3 列线图预测模型的建立和验证
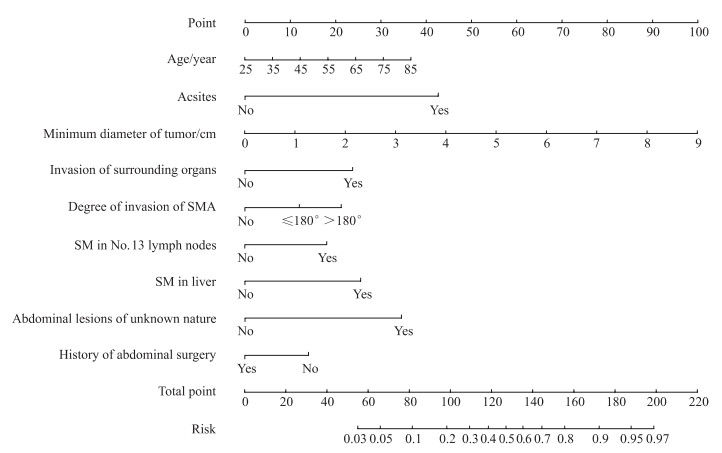
为更好地指导胰腺导管腺癌患者的手术方式选择,运用R 4.0.4软件纳入上述独立预测因素构建了胰腺导管腺癌腹腔隐匿性转移的术前列线图预测模型(图 1)。
|
图 1 胰腺导管腺癌腹腔隐匿性转移的列线图预测模型 Fig 1 Nomogram prediction model for occult abdominal metastasis of pancreatic ductal adenocarcinoma SMA: Superior mesenteric artery; SM: Suspected metastasis. |
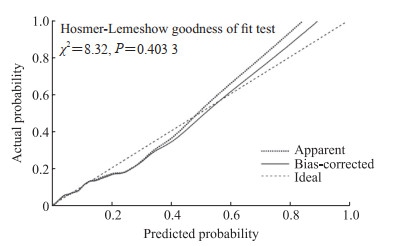
对模型进行交叉验证,绘制校准曲线,通过校准曲线可以看出模型的预估曲线及偏倚修正曲线基本上和理想的情况重叠。另外,在Hosmer-Lemeshow拟合度检验分析中,P=0.403 3,表明该模型拟合较好(图 2)。采用1 000次的Bootstrap法进行内部验证,结果显示该模型未调整的一致性指数(Concordance index,C指数)为0.783(95% CI0.726~0.840),校正后的C指数为0.767(95% CI 0.712~0.826),表明该列线图预测模型在评估胰腺导管腺癌腹腔隐匿性转移风险方面表现出了良好的准确性。
|
图 2 胰腺导管腺癌腹腔隐匿性转移列线图预测模型的校准曲线 Fig 2 Calibration curve of nomogram prediction model for occult abdominal metastasis of pancreatic ductal adenocarcinoma |
2.4 列线图预测模型的评价
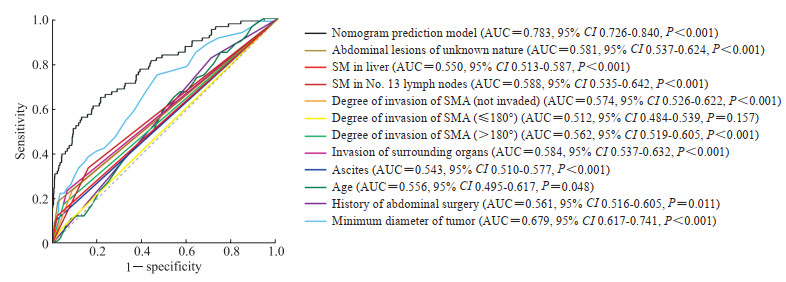
ROC曲线分析显示,各独立因素预测胰腺导管腺癌腹腔隐匿性转移均有统计学意义,其中肿瘤短径、侵犯周围脏器、第13组可疑淋巴结和腹腔不确定性病灶的预测能力相对较高,而列线图预测模型的AUC值为0.783,高于所有因素单独的预测能力(图 3)。根据最大约登指数确定最佳临界值,当列线图预测模型评分为77.68时,预测胰腺导管腺癌腹腔隐匿性转移的灵敏度为0.650,特异度为0.787。在风险评分≥77.68与<77.68的胰腺导管腺癌患者中,腹腔隐匿性转移的发生率分别为22.41%(52/232)和4.05%(28/692),差异有统计学意义(χ2=74.120,P=0.001)。
|
图 3 各因素预测胰腺导管腺癌腹腔隐匿性转移的ROC曲线 Fig 3 ROC curves of various factors for prediction of occult abdominal metastasis of pancreatic ductal adenocarcinoma ROC: Receiver operating characteristic; SM: Suspected metastasis; SMA: Superior mesenteric artery; AUC: Area under curve; CI: Confidence interval. |
3 讨论
本研究采用了单中心的大样本资料,分析发现胰腺导管腺癌腹腔隐匿性转移的术前独立预测因素包括年龄、腹水、肿瘤短径、侵犯周围脏器、肠系膜上动脉侵犯程度、第13组可疑淋巴结转移、肝可疑转移瘤、腹腔不确定性病灶、腹腔手术史,并以此建立了胰腺导管腺癌腹腔隐匿性转移的列线图预测模型。最后,通过ROC曲线评估发现AUC值为0.783,提示该模型有较好的临床预测能力。
本研究共搜集了986例患者资料,其中有腹腔隐匿性转移患者83例,发生率为8.42%,低于既往研究报道的13.1%[9]和15.0%[10]。其原因一方面可能是我科为全国少数几家大型胰腺病中心之一,就诊患者大多经过地方诊疗机构筛选;另一方面,我院影像团队的胰腺恶性肿瘤阅片经验较为丰富,诊出率相对较高;此外,本研究队列的整体时间晚于既往研究,影像技术的进步不能忽视。Gemenetzis等[1]的研究纳入了10年间共1 432例胰腺癌患者,其中腹腔隐匿性转移的发生率为8%。这可能是由于该研究剔除了手术探查为不可切除的局部晚期患者,而局部进展患者的腹腔隐匿性转移发生率可高达18.7%[11]。Oba等[12]将胰腺癌腹腔隐匿性转移定义为在术中及术后6个月内发现的转移,该研究中可切除患者的腹腔隐匿性转移发生率为28.9%。但由于胰腺癌手术创伤大,涉及血管众多,毗邻脏器结构复杂,术中肿瘤细胞极有可能播散,将腹腔隐匿性转移定义扩大至术后6个月的观点有待商榷。
血清癌胚抗原、CA19-9及CA125等肿瘤学指标常被用于筛查和反映肿瘤负荷。Gemenetzis等[1]报道CA19-9>192 U/mL是胰腺癌腹腔隐匿性转移的独立预测因素。CA19-9可由胰腺癌细胞合成并释放,在正常的胰腺和消化道上皮细胞中也有表达。因此,CA19-9具有较高的假阳性,对胰腺癌转移的灵敏度为41%~86%[13]。研究发现路易斯抗原阴性血型的患者占胰腺癌患者的3%~7%[14],此类血型的患者不能表达CA19-9,因此在整个胰腺癌患者群体中CA19-9的总体检出率仅为75%[15]。令人感兴趣的是,本研究纳入的肿瘤学指标不是腹腔隐匿性转移的独立预测因素。这可能是由于隐匿性播散的病灶体积较小,对肿瘤学指标的整体血清浓度影响较弱,需同时考虑原发灶肿瘤大小、血管侵犯程度等情况,因此,肿瘤学指标与转移灶之间的联系还需进一步研究。
肿瘤体积增大是突破脏器周围筋膜组织,使癌细胞发生播散转移的重要因素。肿瘤的长径、体积与肿瘤负荷存在一定相关性,大多数研究者用肿瘤的最大长径描述肿瘤体积大小[12, 16-19],但胰腺作为长条状腺体,恶性肿瘤也往往存在长径和短径,其中长径通常与腺体长轴伴行,这意味着垂直于被膜的短径或许与肿瘤突破能力的关系更加密切。本研究采用了最大横截面的长径和短径2个维度共同描述肿瘤形态,并对肿瘤长径、短径及两者的乘积分别进行了分析。单因素分析中,3个衡量标准在腹腔隐匿性转移组与未转移组之间差异均有统计学意义。然而,在多因素logistic回归分析中,只有肿瘤短径是腹腔隐匿性转移的独立危险因素。Suker等[11]研究发现,对于局部进展的胰腺癌患者,肿瘤的最大轴径并不能成为隐匿性转移的独立危险因素。另外,在初筛的986例患者中,腹腔隐匿性转移组肿瘤长径和短径介于2~4 cm的患者占比均为65.06%(54/83);在未转移组中,长径和短径介于2~4 cm的患者占比同样最高,分别为63.12%(570/903)和49.17%(444/903)(结果未展示)。腹腔隐匿性转移组和未转移组的胰腺肿瘤大小为2~4 cm的比例均最高,这与既往研究[17-18]相仿。以上结果提示在肿瘤大小为2~4 cm的范围内或许存在隐匿性转移发生、发展的临界值。
血管侵犯情况是胰腺癌分期的重要依据,美国癌症联合委员会第8版胰腺癌分期标准将肿瘤侵犯腹腔干、肠系膜上动脉、肝总动脉中的任一血管判定为T4,分期为Ⅲ期及以上[20]。文献报道,局部晚期胰腺癌患者腹腔隐匿性转移的检出率可达19%[11]。Mizumoto等[21]研究指出,CT检查发现有脾静脉侵犯是胰腺癌患者早期肝转移的独立危险因素;与胰头肿瘤相比,胰尾肿瘤侵袭性更强,多器官转移率和腹膜转移率相对较高。然而,也有研究者认为脾动脉受侵犯是胰体尾癌预后的重要影响因素,而脾静脉是否受到侵犯对预后无明显影响[22]。本研究纳入患者中,术前影像学检查发现受到侵犯的血管有6种动脉和3种静脉,按侵犯程度>180°、≤180°、未侵犯3类进行统计学分析,发现腹腔隐匿性转移组和未转移组在腹腔干、肠系膜上动脉、脾动脉、脾静脉侵犯程度方面差异均有统计学意义,而多因素分析中仅肠系膜上动脉侵犯是腹腔隐匿性转移的独立危险因素。
为规范临床研究和手术治疗,淋巴结通常以一定规律列组排序,现被大部分研究者认可的分组方法为日本胰腺学会的淋巴结分组方案,分为3站18组[23]。转移淋巴结的形态学改变往往不典型,本研究中有8组淋巴结被报告为可疑淋巴结。单因素分析中,第9组可疑淋巴结转移、第13组可疑淋巴结转移、第14组可疑淋巴结转移、第17组可疑淋巴结转移、腹膜后可疑淋巴结转移在腹腔隐匿性转移组和未转移组之间差异有统计学意义。经多因素分析后,第13组可疑淋巴结转移为腹腔隐匿性转移的独立危险因素。本研究中第13组淋巴结对应的是胰头背侧上缘淋巴结和胰头背侧下缘淋巴结,腹腔隐匿性转移组中33.75%(27/80)的患者存在第13组可疑淋巴结转移,未转移组为16.11%(136/844)。国内学者报道,在行手术治疗的胰头癌患者中,经病理检查证实转移共累及了9组淋巴结,有43.18%(57/132)的患者第13组淋巴结为阳性[24]。另有学者对胰头癌术中的1 550枚淋巴结行病理检查也发现第13组淋巴结阳性率最高,为39.36%(111/282)[25]。在国外一项针对胰体、胰尾恶性肿瘤的研究中,淋巴结病理阳性率依次为第9组35.3%(6/17)、第13组30.0%(3/10)、第17组30.0%(3/10)[26]。由以上结果可见无论肿瘤部位,第13组淋巴结转移检出率始终较高。继续深入研究特定分组淋巴结的转移机制,将对胰腺癌远处转移的诊断及术中淋巴结清扫范围的确定提供新的思路。
肿瘤转移往往需要脱离、转移存活和远处定植等多个步骤。当癌细胞脱落时,可能会被间质液推动,在腹膜腔内播种,同时随着腹膜液流动而加速播散。当腹腔空间存在阻隔时,播散途径被阻断,隐匿性转移的发生减少。几乎所有腹腔手术都会使内脏器官和浆膜之间发生粘连,受损的部位尤其如此,粘连一旦发生,转移路径也会随之发生阻隔。本研究结果显示,腹腔手术史是胰腺导管腺癌患者腹腔隐匿性转移的独立预测因素,与转移风险呈负相关,这一结果在先前的相关研究中鲜有报道。腹膜由间皮和间质组成。癌细胞倾向附着和侵袭腹腔内上皮下暴露的细胞外基质,而不是完整的间皮细胞[27]。研究发现,阻止间皮回缩以减少细胞外基质暴露是降低腹腔转移的有效方式[28]。腹腔粘连后瘢痕增生、浆膜层表面张力增大或许是减少间皮回缩的重要因素。
目前,胰腺癌腹腔隐匿性转移的危险因素已有较多研究,但建立一个风险量化的预测模型先前未见报道,且先前研究纳入的术前评估指标也不全面。本研究通过分析并筛选一系列独立预测因素,建立了风险预测模型。当模型提示为高风险患者时,采用腹腔镜探查能够有效提高胰腺癌腹腔隐匿性转移的诊出率,能较好地指导胰腺癌患者手术方式的选择,有助于在减少过度医疗行为的同时减少胰腺癌患者承受不必要的手术创伤。
| [1] |
GEMENETZIS G, GROOT V P, BLAIR A B, DING D, THAKKER S S, FISHMAN E K, et al. Incidence and risk factors for abdominal occult metastatic disease in patients with pancreatic adenocarcinoma[J]. J Surg Oncol, 2018, 118: 1277-1284. DOI:10.1002/jso.25288 |
| [2] |
MORIZANE C, OKUSAKA T, MORITA S, TANAKA K, UENO H, KONDO S, et al. Construction and validation of a prognostic index for patients with metastatic pancreatic adenocarcinoma[J]. Pancreas, 2011, 40: 415-421. DOI:10.1097/MPA.0b013e3182021376 |
| [3] |
SATOI S, FUJII T, YANAGIMOTO H, MOTOI F, KURATA M, TAKAHARA N, et al. Multicenter phase Ⅱ study of intravenous and intraperitoneal paclitaxel with S-1 for pancreatic ductal adenocarcinoma patients with peritoneal metastasis[J]. Ann Surg, 2017, 265: 397-401. DOI:10.1097/SLA.0000000000001705 |
| [4] |
TEMPERO M A, MALAFA M P, AL-HAWARY M, BEHRMAN S W, BENSON A B, CARDIN D B, et al. Pancreatic adenocarcinoma, version 2. 2021, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2021, 19: 439-457. DOI:10.6004/jnccn.2021.0017 |
| [5] |
BARRAL M, EVENO C, HOEFFEL C, BOUDIAF M, BAZERIES P, FOUCHER R, et al. Diffusion-weighted magnetic resonance imaging in colorectal cancer[J]. J Visc Surg, 2016, 153: 361-369. DOI:10.1016/j.jviscsurg.2016.08.004 |
| [6] |
SESHADRI R A, HEMANTH R E. Diagnostic laparoscopy in the pre-operative assessment of patients undergoing cytoreductive surgery and HIPEC for peritoneal surface malignancies[J]. Indian J Surg Oncol, 2016, 7: 230-235. DOI:10.1007/s13193-015-0486-9 |
| [7] |
朱洪权, 李琳, 徐传和, 徐嘉晨, 陶桃. 联合检测血清CA19-9、CA242、CEA对胰腺癌的诊断价值[J]. 中国实验诊断学, 2015, 19: 2060-2062. |
| [8] |
ALLEN V B, GURUSAMY K S, TAKWOINGI Y, KALIA A, DAVIDSON B R. Diagnostic accuracy of laparoscopy following computed tomography (CT) scanning for assessing the resectability with curative intent in pancreatic and periampullary cancer[J/OL]. Cochrane Database Syst Rev, 2016, 7: CD009323. DOI: 10.1002/14651858.CD009323.pub3.
|
| [9] |
INSULANDER J, SANJEEVI S, HAGHIGHI M, IVANICS T, ANALATOS A, LUNDELL L, et al. Prognosis following surgical bypass compared with laparotomy alone in unresectable pancreatic adenocarcinoma[J]. Br J Surg, 2016, 103: 1200-1208. DOI:10.1002/bjs.10190 |
| [10] |
SELL N M, FONG Z V, DEL CASTILLO C F, QADAN M, WARSHAW A L, CHANG D, et al. Staging laparoscopy not only saves patients an incision, but may also help them live longer[J]. Ann Surg Oncol, 2018, 25: 1009-1016. DOI:10.1245/s10434-017-6317-1 |
| [11] |
SUKER M, KOERKAMP B G, COENE P P, VAN DER HARST E, BONSING B A, VAHRMEIJER A L, et al. Yield of staging laparoscopy before treatment of locally advanced pancreatic cancer to detect occult metastases[J]. Eur J Surg Oncol, 2019, 45: 1906-1911. DOI:10.1016/j.ejso.2019.06.004 |
| [12] |
OBA A, INOUE Y, ONO Y, IRIE S, SATO T, MISE Y, et al. Radiologically occult metastatic pancreatic cancer: how can we avoid unbeneficial resection?[J]. Langenbecks Arch Surg, 2020, 405: 35-41. DOI:10.1007/s00423-019-01846-2 |
| [13] |
BÜNGER S, LAUBERT T, ROBLICK U J, HABERMANN J K. Serum biomarkers for improved diagnostic of pancreatic cancer: a current overview[J]. J Cancer Res Clin Oncol, 2011, 137: 375-389. DOI:10.1007/s00432-010-0965-x |
| [14] |
杨尹默, 田孝东. 中国胰腺癌诊治指南(2021)[J]. 中国实用外科杂志, 2021, 41: 725-738. |
| [15] |
ENGLE D D, TIRIAC H, RIVERA K D, POMMIER A, WHALEN S, ONI T E, et al. The glycan CA19-9 promotes pancreatitis and pancreatic cancer in mice[J]. Science, 2019, 364: 1156-1162. DOI:10.1126/science.aaw3145 |
| [16] |
UM Y J, KIM H W, JUNG D H, KIM J H, PARK J J, YOUN Y H, et al. The longest diameter of tumor as a parameter of endoscopic resection in early gastric cancer: in comparison with tumor area[J/OL]. PLoS One, 2017, 12: e0189649. DOI: 10.1371/journal.pone.0189649.
|
| [17] |
MACKAY T M, VAN ERNING F N, VAN DER GEEST L G M, DE GROOT J W B, HAJ MOHAMMAD N, LEMMENS V E, et al. Association between primary origin (head, body and tail) of metastasised pancreatic ductal adenocarcinoma and oncologic outcome: a population-based analysis[J]. Eur J Cancer, 2019, 106: 99-105. DOI:10.1016/j.ejca.2018.10.008 |
| [18] |
LOU X, LI J, WEI Y Q, JIANG Z J, CHEN M, SUN J J. Comparable prevalence of distant metastasis and survival of different primary site for LN+ pancreatic tumor[J/OL]. J Transl Med, 2020, 18: 266. DOI: 10.1186/s12967-020-02438-1.
|
| [19] |
DE ROSA A, CAMERON I C, GOMEZ D. Indications for staging laparoscopy in pancreatic cancer[J]. HPB (Oxford), 2016, 18: 13-20. DOI:10.1016/j.hpb.2015.10.004 |
| [20] |
SHI S, HUA J, LIANG C, MENG Q C, LIANG D K, XU J, et al. Proposed modification of the 8th edition of the AJCC staging system for pancreatic ductal adenocarcinoma[J]. Ann Surg, 2019, 269: 944-950. DOI:10.1097/SLA.0000000000002668 |
| [21] |
MIZUMOTO T, TOYAMA H, ASARI S, TERAI S, MUKUBO H, YAMASHITA H, et al. Pathological and radiological splenic vein involvement are predictors of poor prognosis and early liver metastasis after surgery in patients with pancreatic adenocarcinoma of the body and tail[J]. Ann Surg Oncol, 2018, 25: 638-646. |
| [22] |
KANDA M, FUJII T, SAHIN T T, KANZAKI A, NAGAI S J, YAMADA S, et al. Invasion of the splenic artery is a crucial prognostic factor in carcinoma of the body and tail of the pancreas[J]. Ann Surg, 2010, 251: 483-487. DOI:10.1097/SLA.0b013e3181cf9171 |
| [23] |
ISAJI S, MURATA Y, KISHIWADA M. New Japanese classification of pancreatic cancer[M]//NEOPTOLEMOS J, URRUTIA R, ABBRUZZESE J, BÜCHLER M. Pancreatic cancer. New York: Springer, 2016: 1-17.
|
| [24] |
刘辰, 许文彦, 龙江, 虞先濬, 傅德良, 倪泉兴. 胰头癌淋巴结转移的特性及其相关影响因素的研究[J]. 中国癌症杂志, 2012, 22: 583-588. |
| [25] |
周扬, 汪洪骏. 胰头癌淋巴结微转移的发生规律及其与患者预后的关系[J]. 中华肿瘤杂志, 2017, 39: 664-667. DOI:10.3760/cma.j.issn.0253-3766.2017.09.005 |
| [26] |
SAHIN T T, FUJII T, KANDA M, NAGAI, KODERA Y, KANZAKI A, et al. Prognostic implications of lymph node metastases in carcinoma of the body and tail of the pancreas[J]. Pancreas, 2011, 40: 1029-1033. DOI:10.1097/MPA.0b013e3182207893 |
| [27] |
SODEK K L, BROWN T J, RINGUETTE M J. Cell-cell and cell-matrix dynamics in intraperitoneal cancer metastasis[J]. Cancer Metastasis Rev, 2012, 31: 397-414. DOI:10.1007/s10555-012-9351-2 |
| [28] |
OGURA T, KOBAYASHI H, UEOKA Y, OKUGAWA K, KATO K, HIRAKAWA T, et al. Adenovirus-mediated calponin h1 gene therapy directed against peritoneal dissemination of ovarian cancer: bifunctional therapeutic effects on peritoneal cell layer and cancer cells[J]. Clin Cancer Res, 2006, 12: 5216-5223. DOI:10.1158/1078-0432.CCR-06-0674 |
 2023, Vol. 44
2023, Vol. 44


